目的:报道一例支气管扩张合并显微镜下血管炎的诊治经过并进行文献复习,提高临床医生对此类疾病的认识及诊治水平。
方法:报道 1 例支气管扩张合并显微镜下血管炎的病史、临床表现及诊治经过,并复习国内外相关文献报道。
结果:患者女性,68 岁,因「间断咯血 10 余年,乏力 1 个月,发热 3 d」入院,胸部 CT 示支气管扩张合并感染,ANCA 过筛试验阳性(1∶320),抗髓过氧化物酶抗体阳性(++),肾穿刺病理符合显微镜下血管炎。入院后病情进展,出现严重的弥漫性肺泡出血,经气管插管机械通气、糖皮质激素冲击联合环磷酰胺、血浆置换、丙种球蛋白及抗感染等治疗,病情好转出院,随访 1 年病情稳定。国内外文献显示,支气管扩张是显微镜下血管炎患者肺部累及的常见表现,部分患者在血管炎发病之前存在多年的支气管扩张病史,慢性气道感染可能与血管炎的发病有关,合并支气管扩张的血管炎患者出现弥漫性肺出血风险较高。
结论:支气管扩张与显微镜下血管炎可能存在一定的内在关系。
抗中性粒细胞胞质抗体相关性血管炎(AAV)是一种主要累及小血管的以血管炎症及坏死为特征的自身免疫性疾病,包括显微镜下多血管炎(MPA)、肉芽肿性多血管炎(GPA)及嗜酸性肉芽肿性血管炎(EGPA)[1]。支气管扩张大多是由于气道慢性炎症引起支气管壁结构破坏而导致的支气管不可逆性扩张,这两种疾病的病因和发病机制不同。当这两种疾病发生于同一患者,二者之间是否有一定的关系,目前国内此方面研究报道较少。本文报道 1 例有 10 余年支气管扩张病史患者发生 MPA 并出现严重弥漫性肺泡出血(DAH)的诊治过程,复习国内外相关文献,探讨这两种疾病的内在联系,以提高临床医生对于此类疾病的认识及诊治水平。
临床资料
患者女性,68 岁,务农。因「间断咯血 10 余年,乏力 1 个月,发热 3 d」于 2018 年 11 月 13 日入我院。患者 10 余年前出现间断咯血,在当地医院肺 CT 检查诊断为「支气管扩张」,予抗感染、止血治疗后可好转。入院前 1 个月无明显诱因出现全身乏力,3 d 前出现发热,体温 38 ℃,伴咳嗽,痰中带少量血丝,无胸痛及呼吸困难,自服头孢地尼片、感康胶囊效果不佳,就诊解放军总医院,胸部 CT 示右肺中叶及下叶基底段支气管扩张并感染,血肌酐 145 µmol/L,为进一步诊治入我院。既往史:患者自诉幼年起既有反复发作咳嗽、咳痰,未予正规诊治。查体:贫血貌,双肺呼吸音稍粗,右下肺可闻及细湿啰音,余无明显阳性体征。实验室检查:血常规:白细胞计数 12.4×109/L、血红蛋白 81 g/L,C 反应蛋白 147 mg/L,降钙素原 0.437 ng/mL。
初步诊断:肺部感染,急性肾功能不全。予以头孢唑肟抗感染及海昆肾喜保肾等对症治疗。其他辅助检查:真菌 G 试验、GM 试验、肺炎支原体抗体、军团菌抗体、巨细胞病毒、EB 病毒均阴性,血沉 77 mm/1 h,D-二聚体定量 2317 ng/mL,血肌酐 170 µmol/L,β2 微球蛋白 9.8 mg/L,血白蛋白 26.3 g/L,免疫球蛋白 G 18.6 g/L,补体 C3 0.717 g/L,ANCA 过筛试验阳性,滴度 1∶320,髓过氧化物酶抗体抗体(MPO-ANCA)阳性(++)、蛋白酶(PR3-ANCA)阴性,抗核抗体阳性 1∶100,尿常规:红细胞镜检满视野/HP,白细胞镜检 3~5/HP,尿微量白蛋白 39.6 mg/L,24 h 尿蛋白定量 931.6 mg/24 h;心电图:窦性心律,室性早搏,T 波改变,Q-Tc 间期延长。11 月 15 日行肾穿刺活检,术后病理:肾小管萎缩,肾间质内多灶性急慢性炎症细胞浸润伴结缔组织增生(图 1)。免疫荧光:IgG、IgA、IgM、C3 及 FRA 均阴性。结合临床及化验,明确诊断为 MPA。
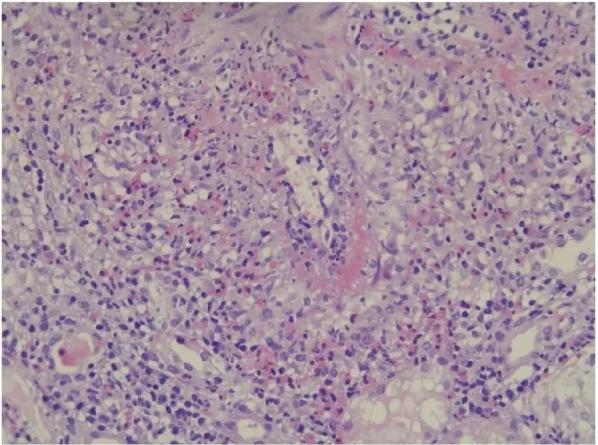
图1:肾组织病理检查像(苏木精–伊红×400)
间质内可见多灶性急慢性炎症细胞浸润伴结缔组织增生
11 月 18 日起予以甲泼尼龙 80 mg 静脉滴注 1 次/d(qd)5 d 及环磷酰胺 0.6 g 静脉滴注治疗,5 d 后甲泼尼龙减量至 40 mg qd,患者体温降至正常,四肢乏力缓解,复查血肌酐升高至 213 µmol/L。11 月 20 日出现咳嗽,咳鲜红色泡沫血痰,痰培养为铜绿假单胞菌,根据药敏结果给予哌拉西林他唑巴坦抗感染,并给予垂体后叶素及卡络磺钠止血,效果不佳。11 月 24 日复查胸部 CT 示:双肺片状渗出影,右肺中叶及下叶基底段支气管扩张并感染,较入院加重(图 2a)。
11 月 25 日抗生素升级为美罗培南联合左氧氟沙星,11 月 29 日晚 12 时患者突然喘憋加重,呼吸困难,氧饱和度下降至 50%,血气分析示氧分压 30 mm Hg(1 mm Hg=0.133 kPa),急查床旁胸部 X 线检查示双肺大片渗出影,考虑 DAH(图 2b),立即予以气管插管,插管中出现呼吸、心跳停止,心肺复苏成功后予以机械通气,床旁气管镜检查镜下见双肺支气管腔内弥漫性出血,共吸出鲜血约 400 mL,予输注红细胞悬液补充血红蛋白,500 mg 甲泼尼龙冲击治疗 qd 连续 3 d,80 mg qd 连续 5 d,后减至 40 mg qd,并给予血浆置换及丙种球蛋白,间断气管镜清除积血及痰液,美罗培南联合卡泊芬净抗感染,促红细胞生成素纠正肾性贫血等综合救治。患者病情逐渐稳定,复查胸部 X 线检查示渗出逐渐好转。12 月 5 日后拔出气管插管撤机,序贯高流量湿化给氧。12 月 20 日复查白细胞计数 8.6×10^9/L、血红蛋白 102 g/L、血肌酐 86 µmol/L,2018 年 12 月 24 日复查胸部 CT 检查示肺部弥漫性出血已基本吸收(图 2c),甲泼尼龙减量至 32 mg qd,12 月 25 日出院。
出院后 2016 年 1 月 16 日复查血肌酐升至 162 µmol/L,予环磷酰胺 50 mg qd 口服,甲泼尼龙逐渐减量,2019 年 6 月停用环磷酰胺,改硫唑嘌呤 50 mg qd 口服,甲泼尼龙减量至 8 mg qd 维持。目前随访 1 年余患者病情稳定。
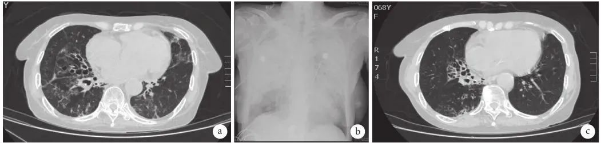
图2:胸部影像检查像
a. 2018-11-24 CT 检查像:双肺片状渗出影,右肺中叶及下叶基底段支气管扩张并感染;b. 2018-11-29 X 线检查像:双肺大片渗出影,考虑 DAH;c. 2018-12-24 CT 检查像:右肺中叶及下叶基底段支气管扩张并感染较前明显好转
讨论
亚洲人罹患血管炎大多是 MPO-ANCA 阳性的 MPA[2],MPA 特点是肺部受累率较高,可表现为肺泡出血,肺纤维化及胸膜病变等,既往普遍认为 MPA 肺累及以肺间质病变多见[3],肺间质病变可致继发性牵拉性支气管扩张。而我们报道的这例老年女性患者诊断支气管扩张 10 年余,因「乏力,发热」入院,入院后经各项化验及肾穿刺明确诊断为 MPA,病情进展出现严重的 DAH,经糖皮质激素联合环磷酰胺、血浆置换及抗感染等积极救治后好转,复查肺 CT 恢复至入院前。
国内 2018 年也曾报道 1 例支气管扩张合并血管炎的病例[4],此患者亦有支气管扩张病史多年,因「咯血」入院,入院后查血 MPO-ANCA 阳性,肾穿刺病理符合 AAV 肾损伤,作者认为此前支气管扩张诊断系误诊,原发病系 MPA。而有学者认为该病例 P-ANCA 及抗 MPO 抗体阳性不能排除支气管扩张合并感染导致的假阳性,诊断 MPA 证据不足[5]。何权瀛[6]认为该患者先有支气管扩张,MPA 是后来发病,两种疾病分别独立存在。国内也曾有报道 3 例有明显呼吸道症状的支气管扩张诊断多年后发生血管炎的病例,但缺乏病理诊断[7]。当支气管扩张与 MPA 发生于同一患者,是两种分别存在的独立疾病,还是两者之间有一定的内在联系,对此目前尚不明确。我们查阅国内外相关文献发现,支气管扩张在 MPA 有较高的发生率[8],近年有日本研究报道支气管扩张是 MPA 最常见的肺部异常表现,PR3 阳性的血管炎也可见支气管扩张,但发生率远小于 MPA[9]。国外文献报道 MPA 患者肺 CT 发现支气管扩张的比例为 26%~56%[10-11],远高于一般人群发病率[12]。国内文献报道 MPA 患者肺部 CT 发现支气管扩张也较常见,但多考虑为牵拉性支气管扩张未引起重视[13-14]。MPA 除了可以导致牵拉性支气管扩张,还可能通过免疫损伤直接导致支气管扩张。法国学者曾报道 1 例仅用免疫抑制治疗成功治愈血管炎相关的支气管扩张的病例:27 岁的男性患者,间断咯血、咳嗽,MPO-ANCA 阳性,诊断为 MPA 合并 DAH,肺 CT 提示支气管扩张,支气管肺泡灌洗检查提示无肺部感染,给予糖皮质激素及利妥昔单抗等免疫治疗后,ANCA 转阴,咯血、咳嗽停止,复查肺 CT 支气管扩张及斑片影消失;维持治疗中出现 2 次血管炎复发,咯血,ANCA 转阳,支气管扩张均又在原位置出现,经联合环磷酰胺及利妥昔单抗等免疫治疗后 ANCA 转阴,肺 CT 显示支气管扩张也完全消失[15]。
这个病例提示我们 MPA 患者自身免疫机制可能参与了支气管扩张的产生。一个可能的解释可能是 ANCA 在支气管腔中激活中性粒细胞,从而引发支气管炎症损伤气道壁而导致支气管扩张。
当血管炎与支气管扩张发生于同一患者,发病的先后顺序可能提示了发病机制的不同。早在 1983 年,Pinching 等[16]就发现 GPA 患者发病前多有支气管扩张或化脓性中耳炎病史。1990 年,Sitara 等[17]又报道了 2 例慢性支气管扩张患者分别发展成 GPA 和 MPA,他们认为这提示了慢性气道化脓性感染可能会诱发血管炎的发生。2018 年法国的一项研究报道,58 例血管炎患者中胸部高分辨 CT 显示有 22 例(37.9%)支气管扩张,均为 MPA,其中 3 例既往有多年支气管扩张病史[11]。多因素分析表明,血管炎患者合并支气管扩张与 MPO-ANCA 抗体阳性、女性及年龄正相关[11]。他们还发现,合并支气管扩张的 MPA 患者更易发生神经系统累及,而不易发生肾脏累及[11]。作者认为在欧洲高加索人种 MPA 患者中,支气管扩张也是一种较常见的先前存在的气道疾病,部分患者诊断支气管扩张多年后发生血管炎,提示长期慢性气道感染可能诱发 MPO-ANCA 抗体阳性,且这部分患者临床表型具有一定的特点[11]。另有报道 1 例患者手术切除扩张的病变支气管,MPO-ANCA 抗体转阴[18],这个病例也从反面提示支气管扩张所致慢性感染与 MPO-ANCA 抗体阳性有关。以上研究均提示,早先存在的支气管扩张可能与血管炎,特别是 MPA 的发病有关。可能机制为:ANCA 阳性与中性粒细胞破坏所致抗中性粒细胞抗体激活有关,而支气管扩张合并的反复细菌感染可以导致中性粒细胞的破坏并产生 MPO-ANCA,从而在 MPA 的发病机制中起了重要作用[19]。
2019 年另一篇法国的研究报道对于既有的支气管扩张和血管炎的关系有着不同的观点[20]。文献报道了 61 例血管炎合并支气管扩张的病例,其中 MPA 27 例,GPA 27 例,EGPA 7 例,病例纳入时排除了继发于间质纤维化的牵拉性支气管扩张。61 例病例中支气管扩张的诊断先于血管炎 25 例(41%),两种诊断之间的中位时间为 16 年,这部分患者多为 MPA(80%),累及神经系统(64%),且死亡率 5 倍于其他患者。作者认为支气管扩张与 AAV 的关系可能不是偶然的,而且主要与 MPO-ANCA 有关,支气管扩张先于 AAV 具有明显的临床和生物学特征,预后较差。作者还认为先前诊断的支气管扩张患者可能系 MPA,只是因为最初没有其他系统的累及而被忽略,基于此,作者强调了新诊断的支气管扩张需行 ANCA 血清学检测排除 MPA。
MPA 可导致 DAH,严重时危及生命,是 MPA 致死的重要原因之一[21]。2019 年日本学者发表了一项回顾性队列研究分析 113 例 MPA 患者发生 DAH 的危险因素,发现合并支气管扩张的 MPA 患者发生 DAH 的风险高于合并间质性病变的患者,多因素分析显示高龄、慢性气道疾病、急性肾小球肾炎均与 DAH 的发生独立相关[22]。这项研究结果表明,有支气管扩张等慢性气道疾病的 MPA 患者发生 DAH 的几率增加,提示合并支气管扩张可能有助于预测 MPA 患者 DAH 的发生。所以,MPA 合并支气管扩张等慢性气道疾病,需警惕发生 DAH,必要时早期予以临床干预,有助于临床预测及改善预后。
总之,以上各研究报道从不同方面说明了支气管扩张与 MPA 有着密切的内在联系,MPA 可引起支气管扩张,支气管扩张慢性感染也可能诱发 MPA,具体内在的病理生理机制有待于进一步研究。研究支气管扩张与血管炎之间的内在关系,不仅有助于了解 MPA 及支气管扩张的发病机制及临床表型特点,也有助于预测严重 DAH 的发生,为这两种疾病的预防及临床诊治提供新的思路。
利益冲突:本研究不涉及任何利益冲突。
参考文献略。
引用本文:黄燕, 黄志芳, 张静瑜, 刘一. 支气管扩张合并显微镜下血管炎一例并文献复习. 中国呼吸与危重监护杂志, 2021, 20(1): 54-57. doi: 10.7507/1671-6205.202005136
本文转载自公众号「中国呼吸与危重监护杂志」


