目的:探讨慢性肺曲霉病(CPA)的基础疾病。
方法:回顾分析 2009 年 1 月至 2016 年 12 月原南京军区南京总医院收治的 CPA 患者的病历资料。
结果:总共收治 108 例 CPA 患者,其中 87 例有基础疾病,21 例无基础疾病。务农者比例 66.7%,该比例在无基础疾病组更高(85.7% 比 62.1%)。慢性坏死性肺曲霉病(CNPA)是最多见的类型(72/108,66.7%),在无基础疾病组中的占比高于基础疾病组(85.7% 比 62.1%),在系统性基础疾病组中的占比高于仅肺部基础疾病组(82.8% 比 51.7%)。慢性空洞性肺曲霉病均合并肺部基础疾病(24/108,22.2%)。基础疾病组以陈旧性肺结核(40.2%)、支气管扩张症(39.1%)、慢性阻塞性肺疾病(35.6%)等慢性肺部疾病多见。系统性因素以糖尿病(16.1%)和糖皮质激素使用(13.8%)多见。
结论:患者无论有无基础疾病均可发生 CPA。CNPA 是最常见的类型,其比例在无基础疾病及系统性基础疾病组更高。务农可能是 CPA 的危险因素。慢性肺部疾病是最常见的基础疾病。糖尿病和使用糖皮质激素是最常见的系统性因素。
慢性肺曲霉病(chronic pulmonary aspergillosis,CPA)正成为全球性健康问题[1-4]。与急性侵袭性肺曲霉病(acute invasive pulmonary aspergillosis,AIPA)不同,CPA 常见于无免疫抑制或轻微免疫抑制或因肺部疾病引起肺组织局部免疫缺陷的患者[2, 5-8]。多数情况下 CPA 起病隐匿,病情进展缓慢,病程短则数月,长可达数年甚至数十年,加之症状和体征缺乏特异性,极易被误诊和漏诊。CPA 发生率和病死率较高,且因其极易复发,通常需要长期、甚至终身治疗,部分患者会难以耐受药物不良反应,或进展为耐药。我们对中国人民解放军南京总医院(原南京军区南京总医院)2009 年至 2016 年收治的所有 CPA 患者的 CPA 类型和基础疾病进行了全面回顾性分析。
资料与方法
临床资料
回顾性分析 2009 年 1 月至 2016 年 12 月南京军区南京总医院经肺组织病理诊断 CPA,以及呼吸道标本培养或血清学试验阳性(GM 试验),并排除其他有类似临床和影像表现的其他病原体感染后,诊断 CPA 患者的病历资料。
方法
1、纳入标准
患者均需符合如下条件:(1)胸部 X 线或 CT 影像发现肺部结节或实变,伴或不伴空洞或邻近胸膜增厚;或发现肺部空洞,伴或不伴曲霉球。(2)连续 2 次血清学试验阳性[GM 试验半乳甘露聚糖≥0.5 ng/ml,单克隆抗体双夹心酶联免疫分析法,美国伯瑞(Bio-Rad)实验室],或呼吸道分泌物(痰、气管抽吸物或支气管肺泡灌洗液)、肺组织(包括胸膜腔)标本培养出曲霉,或经肺活检组织病理证实曲霉感染。(3)有如下任一慢性呼吸道或全身症状:发热、体重减轻、疲劳、咳嗽、咯痰、咯血,且持续时间>1 个月;或无明显临床症状,但符合条件(1)和(2)。(4)通过恰当的培养、血清学试验或组织病理检查,排除有类似临床和/或影像表现的其他病原体感染,如活动性肺结核、其他真菌肺部感染、肺部肿瘤、韦格纳肉芽肿等。
2、排除标准
排除系统性免疫缺陷患者,包括:(1)粒细胞缺乏;(2)人免疫缺陷病毒感染或艾滋病患者 CD4+ T 淋巴细胞计数<200/μl;(3)近 3 个月口服或静脉糖皮质激素累计剂量>700 mg;(4)移植物抗宿主病;(5) AIPA 患者。
3、CPA 分类标准
根据临床表现,病程及肺部影像,对纳入的 CPA 患者进行分类[2, 4, 6, 9-11]。(1)单纯曲霉肿(simple aspergilloma,SA):临床症状轻微或无明显临床症状,胸部影像见孤立性空洞伴曲霉球,数月内病情稳定。(2)曲霉结节(Aspergillus nodule,AN):临床症状轻微或无明显临床症状,胸部影像见单发结节影,数月内病情稳定。(3)慢性空洞性肺曲霉病(chronic cavitary pulmonary aspergillosis,CCPA):至少有 1 个慢性呼吸道或全身症状,且持续时间>3 个月;病情进展缓慢,胸部影像见单个或多个厚壁空洞、伴或不伴曲霉球、可合并胸膜增厚或纤维化。SA 患者出现咯血归为 CCPA。(4)慢性纤维化性肺曲霉病(chronic fibrosis pulmonary aspergillosis,CFPA):CCPA 患者出现至少累及 2 个肺叶的肺纤维化。(5)慢性坏死性肺曲霉病(chronic necrotizing pulmonary aspergillosis,CNPA):至少有 1 个慢性呼吸道或全身症状,持续时间 1~3 个月;胸部影像表现为结节、实变、伴或不伴薄壁空洞,或肺部空洞伴空洞周围浸润影,或经一定时间空洞形状大小发生改变;疾病进展更迅速(从数月缩短为数周),伴血清炎症标志物(如 C 反应蛋白)浓度升高。
4、观察指标
记录患者人口统计学资料、CPA 分类、基础疾病分类等。其中,长期大量吸烟定义为吸烟指数≥20 包年;嗜酒定义为每天饮酒,1 个月纯酒精总量≥3 000 ml,或间断大量饮酒,每周至少 2 次,每次纯酒精量≥100 ml。
统计学方法
使用 SPSS 13.0 统计软件。正态分布的数字变量以均数±标准差表示,偏态分布的数字变量以中位数(百分位数)表示。数字变量组间比较采用 t 检验,分类变量组间比较采用 χ2 检验或 Fisher 精确检验。P<0.05 为差异有统计学意义。
结果
患者人口统计学分析
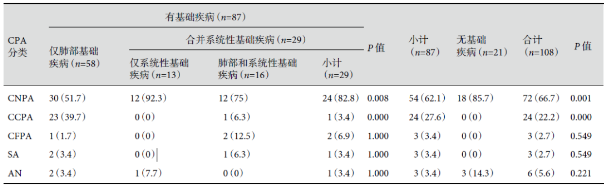
共纳入 108 例 CPA 患者,男 53 例,女 55 例;年龄(52.7±14.7)岁;体重指数(BMI)20.4 kg/m2(Q1~Q3:18.3~22.6 kg/m2),38.9% 的患者 BMI<19 kg/m2;72 例(66.7%)患者来自农村;有基础疾病者 87 例(82.5%),无任何基础疾病者 21 例(18.5%);有基础疾病组与无基础疾病组患者的年龄、性别比例及 BMI 无明显差异,但无基础疾病组务农者的比例显著高于有基础疾病组(85.7% 比 62.1%)。结果见表 1。
表1:患者人口统计学分析
患者 CPA 分类
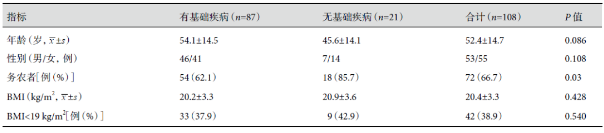
CNPA 是本组最多见的 CPA 类型,总占比高达 66.7%(72/108)。其中,无基础疾病组占比显著高于有基础疾病组(85.7% 比 62.1%,P=0.001);合并系统性基础疾病组占比显著高于仅合并肺部基础疾病组(82.8% 比 51.7%,P =0.008);仅合并系统性基础疾病的 CPA 中 92.3%(12/13)为 CNPA。CCPA 是本组 CPA 第二多见的类型,共计 24 例(22.2%),均为合并肺部基础疾病的患者;其中,23 例仅合并肺部基础疾病,1 例在肺部疾病的基础上合并系统性基础疾病。其他 CPA 类型在本组病例中较为少见;无基础疾病组和仅合并系统性基础疾病组无 CCPA、CFPA 和 SA。结果见表 2。
表2:患者 CPA 分类[例(%)]
CPA 患者基础疾病的类型
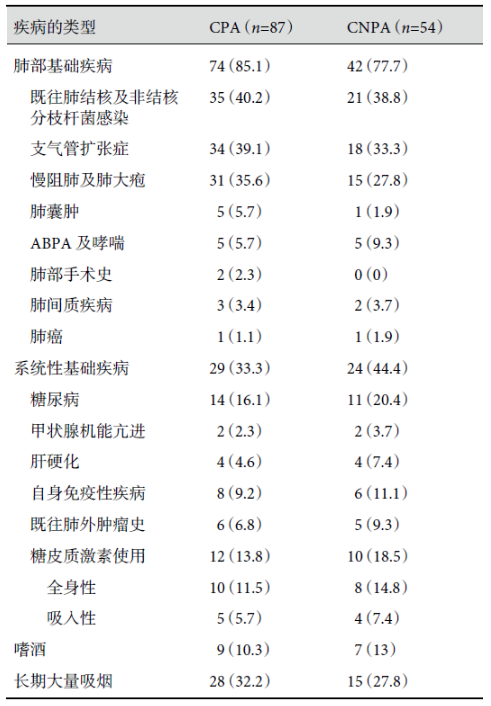
基础疾病组中,81.6%(71/87)的患者至少合并 2 种基础疾病,85.1%(74/87)的患者存在肺部基础疾病。既往结核及非结核分枝杆菌感染(35/87,40.2%)、支气管扩张症(34/87,39.1%)、慢性阻塞性肺疾病(简称慢阻肺)及肺大疱(31/87,35.6%)是三类最主要的肺部基础疾病。包括哮喘、变应性支气管肺曲霉病(ABPA)、肺部手术史及肺癌在内的其余肺部基础疾病所占比例较低。罹患系统性基础疾病患者的比例为 33.3.%(29/87),其中,糖尿病所占比例最高,达 16.1%(14/87)。自身免疫性疾病 8 例(8/87,9.2%),分别为系统性红斑狼疮(2 例)、血管炎(1 例)、干燥综合征(2 例)、过敏性紫癜性肾炎(1 例)、强直性脊柱炎(1 例)、血小板减少性紫癜(1 例),这些患者在罹患 CPA 前均有全身应用糖皮质激素和免疫抑制剂超过 3 个月的病史。肺外肿瘤病史患者 6 例(6/87,6.9%)均接受过放化疗。所有自身免疫性疾病和肺外肿瘤患者均不存在严重免疫缺陷和粒细胞缺乏。肝硬化患者 4 例(4/87,4.6%)均为乙型肝炎患者。还有 2 例患者为未经治疗的甲状腺功能亢进患者。本组无脏器功能衰竭患者。全身应用和/或吸入糖皮质激素占比分别为 11.5%(10/87)和 5.7%(5/87)。其中,全身应用糖皮质激素者单日剂量均超过 7.5 mg 甲基泼尼松龙,且持续时间均超过 3 个月。长期大量吸烟者 28 例(28/87,32.2%),其中确诊慢阻肺者 25 例,另有 3 例为支气管扩张患者。嗜酒者 9 例(9/87,10.3%),嗜酒患者中没有酒精性肝硬化患者,其中肺外肿瘤患者 4 例,合并糖尿病者 5 例。结果见表 3。
有基础疾病的 CNPA 患者中 77.7%(42/54)合并肺部基础疾病,既往结核或非结核分枝杆菌肺部感染、支气管扩张症和慢阻肺也是最常见的三种肺部基础疾病。44.4%(24/54)合并系统性基础疾病,其中以糖尿病、自身免疫性疾病、糖皮质激素使用者为主。嗜酒和长期大量吸烟者比例也较高。结果见表 3。
表3:CPA 患者基础疾病的类型[例(%)]
讨论
国内关于 CPA 基础疾病的较大规模病例总结数据较少,因此我们做了这样一个回顾性分析。CNPA 是本组最常见的临床类型,该类型在无基础疾病组及合并系统性基础疾病组占比更高。CCPA 是本组第二常见的临床类型,仅见于合并肺部基础疾病的患者中。合并基础疾病的 CPA 患者多数存在 2 种或 2 种以上基础疾病。以结核及非结核分支杆菌感染、支气管扩张症、慢阻肺为主的慢性肺部疾病是最主要的肺部基础疾病。糖尿病是最常见的系统性基础疾病。糖皮质激素长期大量使用在本组 CPA 中占比也较高。
本组 CPA 中近 1/5 患者既往体健,无任何基础合并症及基础用药,亦无长期大量吸烟和嗜酒。无基础疾病的肺曲霉病在文献中也有不少报道[6, 12-18]。我们发现本组 CPA 中从事农业生产的患者占相当大的比例(66.7%),且该比例在无基础疾病组更高(18/21,85.7%)。曲霉孢子多见于腐烂的植物和泥土中,乡村环境中曲霉孢子的密度远高于城市环境。这提示环境中大量曲霉孢子的吸入与 CPA 的发生、尤其无基础疾病 CPA 的发生有极大关系[19]。21 例无任何基础疾病的 CPA 中,有 4 例报告明确的曲霉孢子暴露史。1 例患者在重新粉刷发霉的农舍后患病,1 例患者在用机器粉碎发霉的玉米棒后患病,1 例患者在搬运发霉的稻谷后患病,还有 1 例患者在搬运发霉豆腐后患病。学者们早就提出肺曲霉病与环境因素相关的假设,他们认为大量曲霉孢子的暴露是导致 CPA 的重要原因[20-22]。对于存在肺部结构性病变且从事农业生产的肺部感染患者,临床医生需警惕曲霉大量吸入导致感染的可能。既往研究发现,白细胞介素-10、γ 干扰素和转化生长因子-β先天性减少[23-24],TLR4 受体、甘露糖结合外源凝集素、2 型肺泡表面活性蛋白及 Pentraxin 3 的基因多态性[25-27],都会增加曲霉感染的易感性。由于本研究是回顾性研究,我们无从探究这 21 例未发现任何基础疾患的 CPA 是否合并上述不易发现的免疫异常问题。
肺部疾病、尤其结构性肺病,是本组病例中最主要的基础疾病。绝大多数 CPA 都会存在不同程度的呼吸系统病理改变,国外文献报道其比例超过 50%[3, 5-6, 13, 28-33]。全球范围内,陈旧性肺结核是 CPA 最常见的基础疾病。非典型分枝杆菌感染、慢阻肺、支气管扩张、结节病、既往肺癌病史、ABPA 和气胸也不少见。肺组织结构破坏导致气道上皮清除能力和局部免疫受损是继发曲霉感染最可能的原因。与文献报道类似,既往结核及非结核分枝杆菌感染是本组患者最主要的肺部基础疾患。中国是全球肺结核患病率最高的国家之一,本组病例来源于综合医院,而非结核专科医院,因此国内 CPA 患者陈旧性肺结核的实际比例可能远高于本组。有学者根据世界卫生组织的数据对全球肺结核继发 CPA 的发病率进行估算[7],预计全球肺结核生存者年 CPA 发病数 37 万,5 年 CPA 发病率 18%;中国肺结核生存者年 CPA 发病数 6.7 万,5 年 CPA 发病率 16.2%[7]。一项对 544 例生存时间≥12 个月、残留空洞直径≥2.5 cm 肺结核患者的研究发现,22% 的患者在 3 年后空洞内寄生曲霉球[33]。非结核分枝杆菌肺部感染在国外 CPA 患者中也占相当大的比例[6, 9, 14-15, 34],为 9.5%~60%。本组病例中仅 3 例非结核分枝杆菌肺部感染,该比例远低于国外文献报道。非结核分枝杆菌属于机会致病菌,可引起与结核病类似的多种临床综合征,国内对此认知尚不足;加之非结核分支杆菌培养需专业技术设备,国内尚未普及,因此本组患者有漏诊非结核分枝杆菌感染的可能。
支气管扩张症是本组 CPA 中排名第二的肺部基础疾病,该比例远高于国外文献中报道的比例[9, 13, 28, 31, 34-37],这可能与中国支气管扩张症的患病率高于西方国家有关[38-41]。慢阻肺/肺大疱是本组 CPA 中排名第三的基础疾病,该比例与文献报道的数据接近[9, 10, 14, 31-32, 35-37, 42-44]。中国是烟草消费大国,吸烟是慢阻肺最主要诱因,本组慢阻肺患者均有长期大量吸烟史。慢阻肺患者罹患 IPA 的风险也极高[45-47],吸入或全身应用糖皮质激素、入住 ICU、机械通气、广谱抗生素是慢阻肺/肺气肿继发 IPA 最主要的危险因素[46-47]。哮喘和 ABPA 在国外文献中是 CPA 中位居第二的基础疾病,所占比例为 7%~27.3%[6, 9, 14, 42-43],但在本组 CPA 患者中比例均较低,不足 5%。中国 ABPA 患病率远低于欧美,可能是其所占比例低的重要原因。我们无法解释为何本组患者哮喘所占比例也很低,总病例数较少是可能的原因之一;部分哮喘-慢阻肺重叠综合征在本研究中被划归为慢阻肺患者也是可能的原因之一。肺炎、肺部手术史及肺癌继发 CPA 的比例在国外文献中也屡见不鲜[2, 6, 10, 14, 28-31, 34, 42, 44, 48],但在本组 CPA 患者中所占比例也较低。
系统性基础疾病导致的轻度免疫缺陷是 CPA 的重要诱因[2, 5],本组病例中超过 1/4 的 CPA 患者合并系统性基础疾病。糖尿病和糖皮质激素是两个最主要的系统性基础因素,其次是自身免疫性疾病和肺外肿瘤史。这些系统性因素和文献报道类似[14, 15, 32, 34-37, 43-44]。超过 80% 的合并系统性基础疾病的 CPA 患者为 CNPA。因此,糖尿病及糖皮质激素长期使用的患者罹患肺部感染需要警惕肺曲霉感染的可能。
综上所述,CPA 常见于有基础疾病者,但也见于无基础疾病者。CNPA 是最常见的类型,其比例在无基础疾病及合并系统性基础疾病组更高。有基础疾病的 CPA 多数合并 2 种以上基础疾病,以支气管扩张、陈旧性肺结核及慢阻肺等慢性肺部疾病为主。糖尿病是最常见的系统性基础疾病,糖皮质激素治疗、长期大量吸烟酒者比例也较高。
参考文献略。
引用本文:李培, 苏欣, 施毅. 慢性肺曲霉病基础疾病 108 例回顾性分析. 中国呼吸与危重监护杂志, 2018, 17(4): 348-353. doi: 10.7507/1671-6205.201801004
本文转载自公众号「中国呼吸与危重监护杂志」


