
前言
在《呼吸界》日前推出的「遏制、终止、终结肺结核」第二季系列直播中,我们邀请了王辰院士及结核病领域专家赵雁林、李燕明、沙巍、余方友、逄宇、李仁忠、初乃惠、陈效友,他们在直播间就「我国结核病综合医院诊疗能力及新形势下防治技术对策、耐药肺结核的诊疗技术与新进展、非结核分枝杆菌的临床鉴别诊断和精准治疗」等话题为大家做了精彩报告并互动,《呼吸界》编辑特此整理直播文字,经专家审阅后与大家分享。
今天我主要从非结核分枝杆菌(NTM)概述、NTM病与病原体、NTM检测方法这三个方面来和大家做分享。
一、NTM概述
分枝杆菌属(抗酸染色阳性)主要分为三大类,一个是大家熟悉的结核分枝杆菌复合群,还有非结核分枝杆菌和麻风分枝杆菌。我们今天主要讲「非结核分枝杆菌」,因为很多时候我们都忽略了非结核分枝杆菌,更多地想到结核分枝杆菌,而非结核分枝杆菌抗酸染色也是阳性,它和结核分枝杆菌有一些很相似的地方,但同时也有很多不同。
首先,NTM在环境中普遍存在,由于其细胞壁具有较强的疏水性,能天然耐受多种消毒剂、抗生素以及重金属,常生存于饮水系统中。
而且,NTM可以在很多物体表面形成生物膜,从而使其能够抵御外界不利因素,帮助其在自然界或者物体表面长期存活。已经发现的NTM超过190余种,仅少部分与人类致病相关,分为疾病来源与非疾病来源。另外,标本采集过程或者实验室操作过程中容易导致污染,应正确区别。
根据NTM生长速度及产色情况来分类的话,大致可以分为这4种:1、光产色分枝杆菌:堪萨斯分枝杆菌、海分枝杆菌、猿分枝杆菌等;2、暗产色分枝杆菌:瘰疬分枝杆菌、戈登分枝杆菌和苏尔加分枝杆菌;3、不产色分枝杆菌:鸟/胞内分枝杆菌复合群、嗜血分枝杆菌、溃疡分枝杆菌等;4、快速生长分枝杆菌:偶发分枝杆菌、脓肿分枝杆菌、龟分枝杆菌、耻垢分枝杆菌。
我们现在主要根据生长速度来分类NTM:在固体培养基上培养7天或小于7天就可以获得肉眼可见菌落的NTM,我们就认为是快速生长型分枝杆菌(rapidly growing NTM),而如果需要大于7天才能在固体培养基上获得肉眼可见菌落的NTM,就是慢生长型分枝杆菌(slowly growing NTM)。快速生长型分枝杆菌包括脓肿分枝杆菌复合群(脓肿分枝杆菌脓肿亚型、马赛亚型、博莱亚型)、龟分枝杆菌、偶发分枝杆菌、耻垢分枝杆菌;慢生长型分枝杆菌包括堪萨斯分枝杆菌、鸟-胞分枝杆菌复合群、海分枝杆菌、蟾蜍分枝杆菌。
二、NTM病与病原体
我们前面已经提到过,非结核分枝杆菌病(NTM)易被误诊为结核病,它是一种条件致病菌,广泛存在于水、土壤等自然环境中,也就是说,在一定的条件下,比如宿主免疫力低下、菌群失调等情况下,NTM有机会有条件可以引起宿主发病,所以其传播途径主要是从「环境中感染」获得。它可以引起多器官疾病,其中NTM肺病占绝大部分,还包括淋巴结病、皮肤病、播散性NTM病等……
长期以来,我们未能获得NTM人与人之间传播的证据,普遍认为人类从环境中感染NTM而致病,而不引起人与人、人与动物之间传播,并据此推断NTM不具有传染性,但近年来发现,在「囊性纤维化」患者中存在脓肿分枝杆菌的人与人之间传播。
还有一个特点:NTM对一般抗结核药物多数耐药、天然耐药率非常高,如果被误诊为结核病常导致治疗失败。
近年来,NTM病呈明显上升趋势,NTM分离率逐年上升。我们来看看这些数据:
1、中国NTM的分布[1]:
基于2013年收集的抗酸阳性痰样本估计中国NTM病例的比例:
中国31个省鉴定出317株NTM菌株(317/4917,6.4% ),其中南部地区共检出287株;NTM感染率因地理区域而异:南部地区的NTM感染率高于北部地区(7.7% vs 2.5%);沿海地区的NTM感染率高于内陆地区(10.7% vs 3.0%)。如下图所示,中国北方和南方RGM与SGM的组成比例存在显著差异;中国沿海地区的RGM显著高于内陆地区。
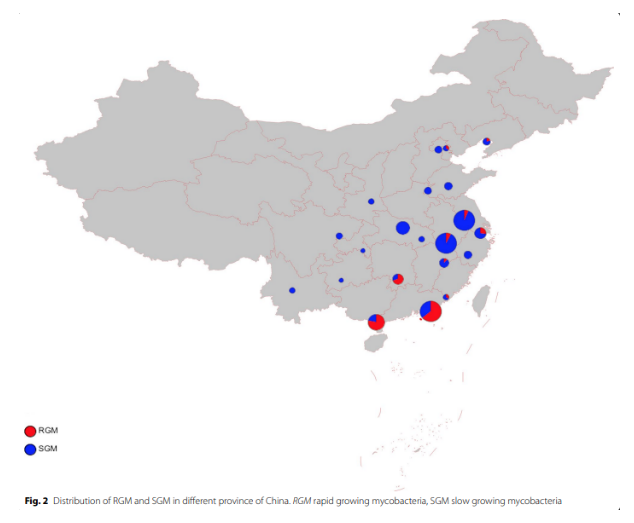
从菌种的分布来看,317株NTM中最常分离的三种占比79.9%,分别为:1、脓肿分枝杆菌复合群(36.0%);2、鸟胞内分枝杆菌复合群(34.1%);3、堪萨斯分枝杆菌(9.8%)。
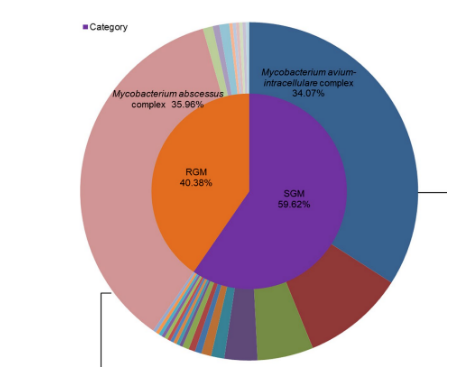
图:RGM快速生长分枝杆菌;SGM缓慢生长分枝杆菌
2、中国南方NTM的分布[2]:
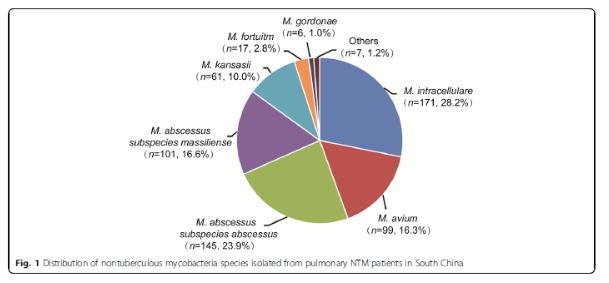
2013-2016年广州胸科医院分离的607株NTM,胞内分枝杆菌最常见,占28.2%,其次为脓肿分枝杆菌,占23.9%;马赛分枝杆菌,16.6%;鸟分枝杆菌,占16.3%。
3、NTM感染的发病率[3]:
在过去的40年中,一些国家和地区NTM的发病率和患病率呈增加趋势,甚至可能超过结核病的发病率和患病率。美国20世纪80年代NTM占分枝杆菌感染的1/3(1.4-6.6/100000),90年代早期已超过2/3,NTM阳性培养物的检出率大约为1.4-6.6/100000;英国2007年和2012年的NTM阳性培养物的检出率分别为4.0/100000和6.1/100000;加拿大1998-2002年为29.3/10万,2006-2010年为41.3/10万。
我国NTM占分枝杆菌的比例有上升趋势。上海市肺科医院NTM占NTM培养阳性的大约25%-28%,这个统计数据不一定很准确,但是可见它是逐年上升的趋势。
总体来说,许多因素造成了我国不同地区或人群的NTM感染发生率差异,造成较高感率的因素包括南方地区、沿海地区、气候温和地区人群年龄大,而造成较低感染率的因素包括北方地区、内陆地区、寒冷地区、人群年龄轻。
4、这是几种NTM感染增加的可能原因:
1)结核分枝杆菌感染率的下降,潜在地降低了人群对分枝杆菌的免疫力;更多地使用药物会损害宿主对NTM的免疫力。2)通过家用热水器的更灵活温度设置以及更多接触喷雾气溶胶导致增加接触NTM的机会。3)在肺部炎症性疾病的治疗中,长期使用抗生素可能会导致有利于NTM生长的肺部生态。4)某些NTM菌种在特定的人群中(囊性纤维化患者)导致的人与人之间的传播。5)检测方法的改进和医生意识的增强使NTM感染诊断率增加。
5、NTM病的易感人群:
1)免疫受损/抑制患者:如HIV/AIDS、器官移植、肿瘤、生物制剂的使用、免疫抑制剂的使用等。2)慢性肺部疾病患者:如囊性纤维化(CF)、非CF支气管扩张、慢性阻塞性肺疾病、肺结核、肺尘埃沉着症、肺间质纤维化、哮喘、过敏性支气管肺曲霉病。3)外伤或医源性感染人群:手术器械、注射器具、医疗用水等灭菌不合格或者使用不规范等可导致暴发感染。4)其他:类风湿性关节炎、低维生素D、低体重指数(BMI)、营养不良、胃食管反流病、Lady Windermere 综合症。
6、NTM不同部位感染的病原体[4]:
NTM可引起不同部位的感染,最常见的为肺部,皮肤、软组织、淋巴结及播散型也可见,以潮热地带为多见。前面已经讲过,人的感染感染途径为水和土壤,目前除发现脓肿分枝杆菌在囊性纤维化患者中存在人与人之间传播外,没有发现其他NTM感染发在人与人之间、动物与人之间传播。
我在这里要特别提到:由于NTM可以短暂、间歇或长期定植在人体的肺部,但不引起感染,在决定哪些患者什么时候需要治疗时造成相当大的困难。
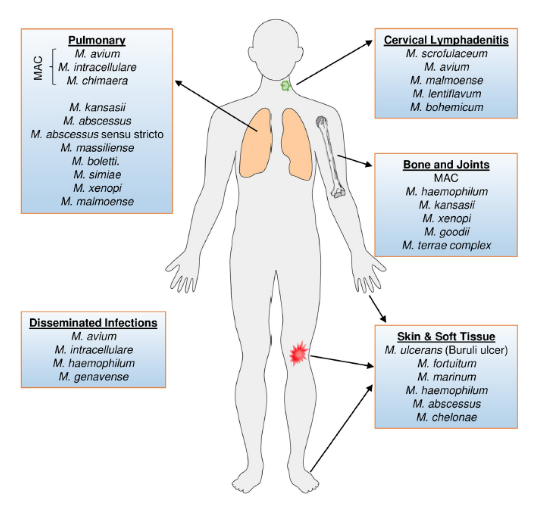
这张表格中作了详细列举[5]:

该参考专家共识将导致各种类型NTM病的主要菌株和次要菌株纳入检测,再根据国内研究报道数据,将未见报道并且无法获得标准株的嗜血、隐藏和日内瓦分枝杆菌去除,增加缓黄和不产色分枝杆菌,共纳入17种分枝杆菌。
三、NTM检测方法
1、NTM肺病诊断标准:

首先,临床要有肺部或全身症状;影像中,胸片显示结节或空洞性斑片影,或高分辨率CT扫描显示支气管扩张伴多发小结节。以上两者需同时满足,且适当排除了其他诊断结论。
在微生物学方面,1、至少两次留取的痰标本培养阳性。如果结果不具诊断性,考虑重新留取痰样培养或涂片,查找AFB;(或)2、至少一次支气管冲洗或灌洗液的阳性培养结果;(或)3、经支气管或其他肺活检查出有分枝杆菌组织学特征(肉芽肿性炎症或AFB),且NTM阳性培养,或活检显示分枝杆菌组织学特征(肉芽肿性炎症或AFB),同时一个或多个痰液或支气管冲洗液的NTM培养为阳性。
当培养到少见的或通常代表环境污染的NTM时,应获得专家咨询。对于怀疑有NTM肺病但不符合诊断标准的患者,应进行随访,直到确诊或排除。根据诊断标准,当获得两次培养阳性结果时,各次的分离株须为相同的NTM菌种(对于脓肿分枝杆菌,也可是相同的亚种)。
2、NTM肺病的检测标本的要求:
首先,痰、诱导痰、支气管冲洗液、支气管肺泡灌洗液或支气管活组织等,取材创伤小的样本优先选择。尽量在抗菌药物使用前采样,用药患者应停药后2周再采样。第二,NTM肺病疑似患者首先取痰液进行检查,若痰液培养阴性,可以考虑CT引导下取支气管冲洗液。第三,口咽拭子不能作为检测样本,因为所含的下呼吸道NTM菌量不够;血清学检测不用于NTM的诊断。另外,标本收集后24小时内进行处理,否则由于其他细菌快速生长影响NTM的检出。若24小时内不能处理应4℃冷藏保存。
3、我们比较熟悉的是「抗酸染色或荧光染色」:
所有的呼吸道标本都应进行染色镜检检查,它包括简便、快速、价廉、可长期保存等优点,但敏感性偏低,5000-10000条菌/ml,涂阳检出率低于5%,专业机构涂阳率可达到30%,而且特异性差,无法区分结核分枝杆菌与非结核分枝杆菌,也无法区别「死菌」与活菌——结果均为阳性。
涂片染色应常规进行,可粗略判断NTM的菌量,尽量使用荧光染色,因为荧光染色敏感性更高。需要注意,不能仅凭显微镜下细菌形态区别NTM和结核分枝杆菌。
4、NTM培养有一些注意事项:
为了避免共生细菌过快生长抑制了NTM的生长,标本需进行去污染处理,常用去污染试剂有:2%的N-乙酰基L-半胱氨酸(Nalc) -氢氧化钠、草酸和1%的 N-乙酰基L-半胱氨酸(Nalc) -氢氧化钠。但过长的标本去污染时间会导致NTM活力下降,因此,去污染时间不宜过长。
呼吸道标本应同时进行固体培养和液体培养8周,必要时可延长至12周。固体培养的优点是可以观察到单个菌落的形态,及时发现混合细菌的生长,液体培养的优点是缩短培养时间。NTM感染高度疑似患者若培养阴性,应考虑更换培养基、改变培养温度、延长培养时间、使用分子生物学方法等,或送参考实验室。我们需要留心,NTM不同菌种最佳培养时间不同,许多NTM菌种在28℃-30℃时生长最佳,如脓肿分枝杆菌,而有些菌种最佳生长温度为45℃,如蟾蜍分枝杆菌。
5、NTM「鉴定到种」非常重要:
在快速分枝杆菌鉴定方法中,NTM感染患者分离的NTM菌株需利用分子生物学方法或质谱法鉴定到种,NTM「鉴定到种」非常重要,因为不同的NTM菌种的耐药谱不同,引起的感染不同,对临床治疗具有指导作用;脓肿分枝杆菌应利用分子生物学方法鉴定到亚型;从疑似人与人之间传播的患者中分离的脓肿分枝杆菌还应进行同源性分析。
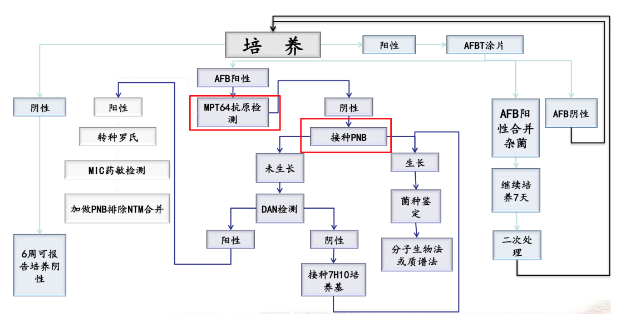
6、上海肺科医院检验科分枝杆菌培养鉴定流程:
7、多色熔解曲线分析技术[6]:
MeltPro® Myco检测是首个基于实时PCR平台的多色熔解曲线分析技术,在单个反应中识别19种临床相关分枝杆菌的诊断系统。整个测定可在3 h内完成,且准确率高达99.7%,快速准确,可被用作结核病流行地区的一种筛查工具。可准确鉴定51种非分枝杆菌菌株;解决龟与脓肿、苏加与马尔摩、结核与牛分枝杆菌无法区分的问题;每个鉴定对象都具有特异的信号,具备对混合感染的检测能力。

针对每个菌种,检测限均能达到300 杆菌/ml,在相同或不同的荧光通道中,都能检测1%的混合感染。与其他方法比较而言,以16S rRNA基因测序为标准,熔解曲线法检测一致率达97%,能够用于分枝杆菌菌种的快速鉴定,具有较好的临床应用价值;相比之下基因芯片法一致率仅为84%。[7]
以下有几个应用案例:
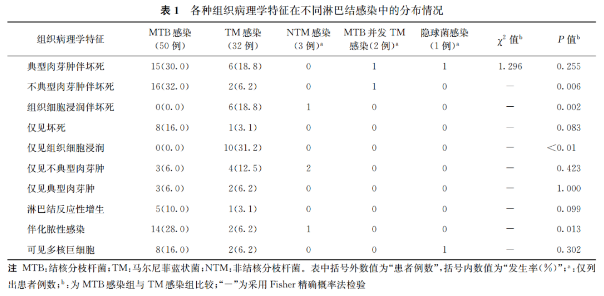
1)浅表性淋巴结感染性疾病的88例HIV感染/AIDS患者的「淋巴结活检组织样本」,进行涂片及荧光定量PCR技术检测MTB和荧光定量PCR熔解曲线法进行分枝杆菌菌种鉴定。[8]

2)中国NTM流行分布研究:北京结核病创新诊疗技术联盟组织成立的中国非结核分枝杆菌监测研究组(CNTMS),包括17家来自全国各个地区的临床单位,共纳入了 6766 名结果有效的痰样本,应用多色熔解曲线分析技术进行菌种鉴定,其中 6236 名(92.2%)患有 PTB,458 名(6.8%)患有 NTM-PD,72 名(1.0%)患有定植。
由北向南,由西向东:NTM-PD的流行有逐步递增的趋势。我国NTM分布区域差异大:胞内分枝杆菌(约占一半)占比随着纬度降低而减少。

中国NTM肺病的「比例」:2019年12月1日至2020年6月30日共6963名抗酸杆菌涂片阳性患者,在6840例结果明确的患者中:
74例(1.1%)患者为结核分枝杆菌和NTM混合感染;多数患者(6766例)为单一感染,其中结核分枝杆菌6236例(92.2%),NTM 530例(7.8%);458例患者被归类为NTM- pd,而其他72例患者有NTM定植或污染。因此,在该分析中纳入的患者中,中国6.8%的疑似结核患者患有NTM-PD。
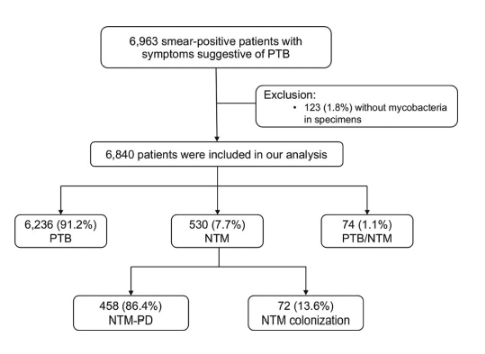
中国NTM肺病的「分布」:下图是该分析中不同地区疑似肺结核患者中NTM-PD的比例。总体而言,这一比例表现出显著的地理多样性,从西北地区3.2%的疑似肺结核患者,到中国中部6.1%的疑似肺结核患者,以及南方9.2%的疑似肺结核患者。可见,由北向南,由西向东NTM-PD的流行有逐步递增的趋势。
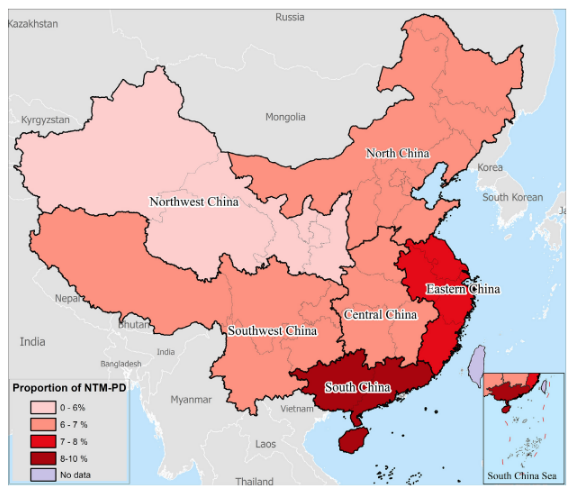
与中国NTM肺病相关的分枝杆菌种类:最常见的5种是胞内分枝杆菌(241例;52.6%)、脓肿分枝杆菌复合体(106例;23.1%)、鸟分枝杆菌(39例;8.5%),堪萨斯分枝杆菌(37例;8.1%)和苏氏分枝杆菌(12例;2.6%)。除西北地区外,所有地区的NTM-PD患者均以胞内分枝杆菌为主,而堪萨斯分枝杆菌为西北地区最常见的分枝杆菌。[9]
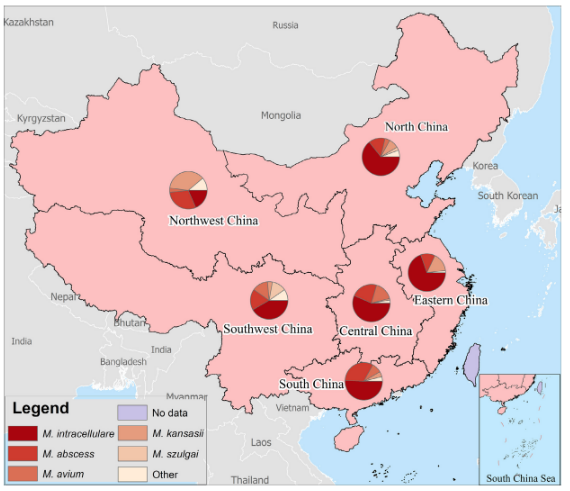
3)MDR-TB患者混合感染NTM研究:北京胸科医院、广州胸科医院和福州肺科共837例MDR-TB临床分离株,分枝杆菌鉴定(熔解曲线法)准确鉴定出22例(2.6%)混合感染,共鉴定出5种不同的NTM,最常见的混合感染NTM是胞内分枝杆菌。[10]

8、免疫组化法[11]:
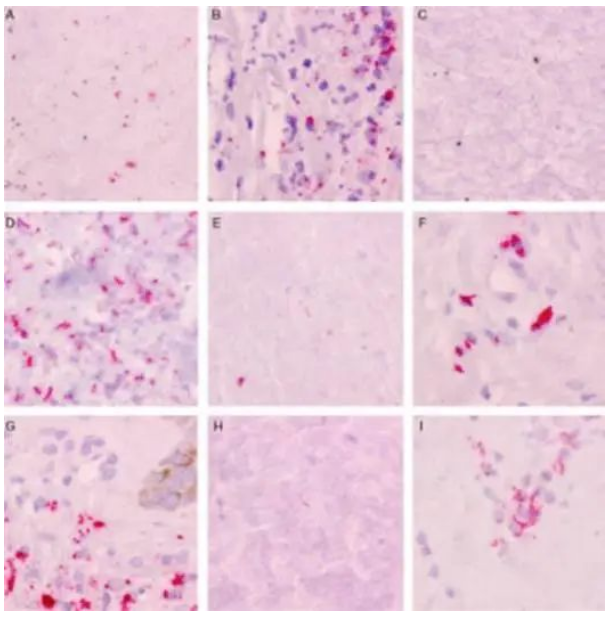
免疫组化使用带有红色显色原(碱性磷酸酶)的兔多克隆抗分枝杆菌抗体,聚碱性磷酸酶抗兔IgG用于检测,产生红色信号。观察到杆状生物体的病例被解释为阳性。
免疫组化检测多种分枝杆菌阳性:抗分枝杆菌抗体对禽分枝杆菌(A)、嗜血杆菌(B)、耻垢分枝杆菌(C)、海洋分枝杆菌(D)、褐分枝杆菌(E)、堪萨斯分枝杆菌(F)、麻风分枝杆菌(G)、金黄色分枝杆菌(H)、诺卡菌属(I)具有广泛的反应性。但是,在形态上无法区分物种。AFB阴性对照组未观察到染色。
9、宏基因组二代测序技术(mNGS)[12]:
近年它备受关注,是通过直接测定样本中所有 DNA/RNA 基因组信息即可实现所有病原菌的鉴定及分型,具备高通量、覆盖度广、速度快、灵敏度高、不依赖传统分离培养、无需特异性引物等优点。利用mNGS对 NTM 的 47 个类型菌株进行了测序,其中快生型分枝杆菌 11 株、慢生型分枝杆菌 36 株,同时,重构和分析了 41 个以前未被描述的 NTM 物种的基因组,拓展了对 NTM 的认识。
提醒大家在使用时一定要注意环境,因为如果NTM被环境污染了,即使使用了mNGS,测出来也是没有意义的。
总结
1、NTM感染有增加的趋势,但要注意排除实验室污染及定植菌。
2、NTM菌种繁多,鉴定到种困难,常需检测多个分子靶标,质谱技术可快速鉴定NTM菌种,商品化的分子生物学技术可直接对临床标本进行检测。
3、不同NTM引起的疾病特点不同,对抗菌药物的耐药谱不同,治疗方案也不同,对NTM鉴定种,对临床诊断与治疗NTM具有帮助。
参考文献
[1] Liu et al. Infect Dis Poverty (2021) 10:59
[2] Tan et al. BMC Pulmonary Medicine (2018) 18:168
[3] Haworth CS, et al. Thorax 2017;72:ii1–ii64.
[4] PLoS Negl Trop Dis 13(2): e0007083.
[5] 中华医学会结核病学分会. 非结核分枝杆菌病诊断与治疗专家共识[J]. 中华结核和呼吸杂志, 2012, 35(8): 572-580.
[6] Xu et al. Journal of Clinical Microbiology, 2019,57(1): e01096-18.
[7] 李爱芳, 谈小文, 崔晓利,等. 荧光PCR熔解曲线法在非结核分枝杆菌菌种鉴定中的应用价值[J]. 中国防痨杂志, 2021, 43(7):6.
[8] 林静, 张晨, 董宇杰,等. HIV感染/AIDS患者感染性浅表淋巴结病的临床病理特征分析[J]. 中国防痨杂志, 2021, 43(3):6.
[9] Tan et al. Journal of Infection 83 (2021) 46–53
[10] Huang M, Tan Y, Zhang X, Wang Y, Su B, Xue Z, Wang J,Pang Y. Effect of Mixed Infections with Mycobacterium tuberculosis and Nontuberculous Mycobacteria on Diagnosis of Multidrug-Resistant Tuberculosis: A Retrospective Multicentre Study in China. Infect Drug Resist. 2022 Jan 20;15:157-166.
[11] Am J Surg Pathol. 2017 Oct;41(10):1364-1370.
[12] Sci Rep. 2017; 7: 45258.
[13] Griffith DE, et al. An official ATS/IDSA statement:diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases.Am J Respir Crit Care Med. 2007;175(4):367–416.
[14] Haworth CS, et al. British Thoracic Societyguidelines for the management of nontuberculous mycobacterial pulmonary disease(NTM-PD). Thorax. 2017;72(Suppl2):ii1-ii64.
[15] Andrejak C, et al. Characterization of mouse modelsof Mycobacterium avium complex infection and evaluation of drug combinations.Antimicrobial agents and chemotherapy. 2015;59(4):2129–35.
[16] Bryant J, et al. Emergence and spread of a humantransmissible multidrug-resistant nontuberculous mycobacterium. Science.2016;354:751.
[17] Huh HJ, et al. Recent advances in moleculardiagnostics and understanding mechanisms of drug resistance in nontuberculousmycobacterial diseases. Infection, Genetics andEvolution,https://doi.org/10.1016/j.meegid.2018.10.003.
[18] Tan Y, et al. Nontuberculous mycobacterialpulmonary disease and associated risk factors in China: A prospectivesurveillance study. J Infect. 2021 Jul;83(1):46-53.
[19] Liu CF, et al. Nontuberculous mycobacteria inChina: incidence and antimicrobial resistance spectrum from a nationwidesurvey. Infect Dis Poverty. 2021 Apr 29;10(1):59.
[20] Huang M, et al. Effect of Mixed Infections withMycobacterium tuberculosis and Nontuberculous Mycobacteria on Diagnosis ofMultidrug-Resistant Tuberculosis: A Retrospective Multicentre Study in China.Infect Drug Resist. 2022 Jan 20;15:157-166.
[21] Xu Y, et al. Rapid Identification of ClinicallyRelevant Mycobacterium Species by Multicolor Melting Curve Analysis. J ClinMicrobiol. 2019 Jan 2;57(1):e01096-18.
[22] CLSI,M24 and M62,2018
本期直播嘉宾

余方友
上海市肺科医院(同济大学附属肺科医院)检验科主任、医学博士、教授/主任技师、博士研究生导师。先后主持课题17项,其中国家自然科学基金面上项目6项。以通讯作者或第一作者发表论文180余篇,其中SCI收录论文80余篇。获中华医学科技奖一等奖和浙江省科学技术奖一等奖各1次;为浙江省新世纪151人才工程第一层次人才、浙江省卫生高层次创新人才等。中国防痨协会结核病基础分会副主任委员、中国防痨协会人兽共患结核病分会副主任委员、中国医促会临床微生物学与感染分会常委等。

逄宇
首都医科大学附属北京胸科医院研究员,博士生导师,任职首都医科大学附属北京胸科医院细菌免疫室主任。主持国家自然科学基金2项,国家传染病重大专项3项,北京市首发重大项目1项,获得省部级以上奖励5项,并于2020年入选北京市百千万人才工程,2018年入选北京市高创计划青年拔尖人才,2018年入选北京市科技新星;中华医学会结核病学分会委员兼副秘书长,中华医学会结核病学分会青年委员会常务副主任委员,中国防痨协会基础专业分会副秘书长,中国医促会结核病分会基础学组副组长。
本文由《呼吸界》编辑 Jerry 整理、排版,感谢余方友教授的审阅修改!
* 感谢厦门致善生物科技股份有限公司的大力支持


