病例介绍
现病史:患者4个月前高热,伴活动后气短,查自然状态下动脉血气氧分压为49mmHg,3次痰抗酸染色均阴性,胸部CT见图1,加用泼尼松40mg/d,半月后症状好转,复查胸部CT病变明显吸收【图2】。2月余后激素逐渐减停,但再次发热,复查胸部CT肺部渗出性病变再度略显加重,且出现明显的铺路石征【图3】。
图1】胸部CT(起病时):
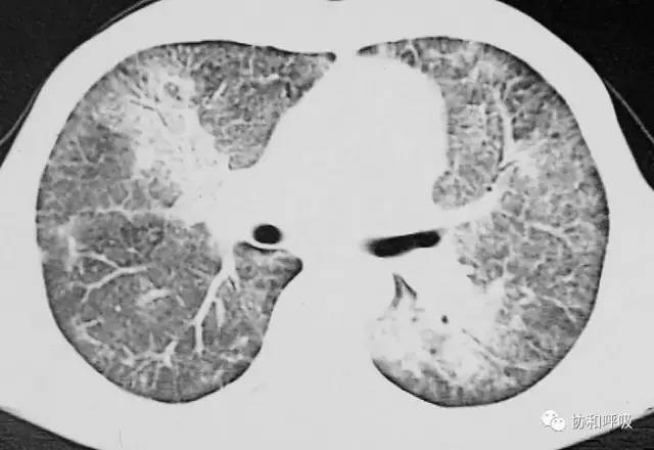
双肺弥漫性磨玻璃样变,可见小叶间隔增厚及局部实变影,以右中叶和左下肺为著
【图2】胸部CT(应用激素2月后):
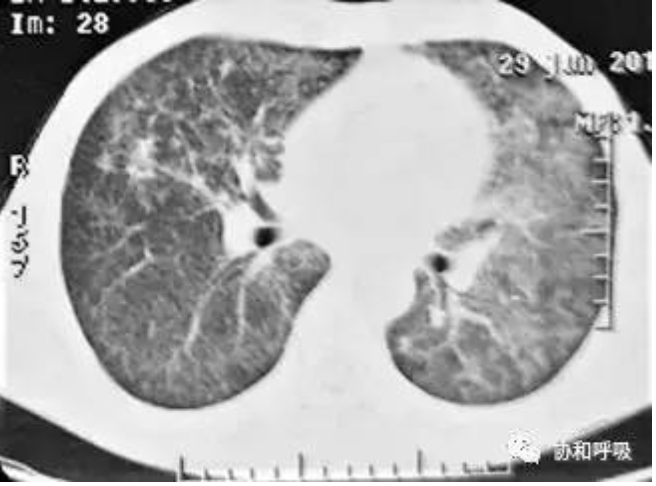
双肺弥漫性磨玻璃样变和实变影均较前有所减轻
【图3】胸部高分辨CT(逐渐减停激素后):
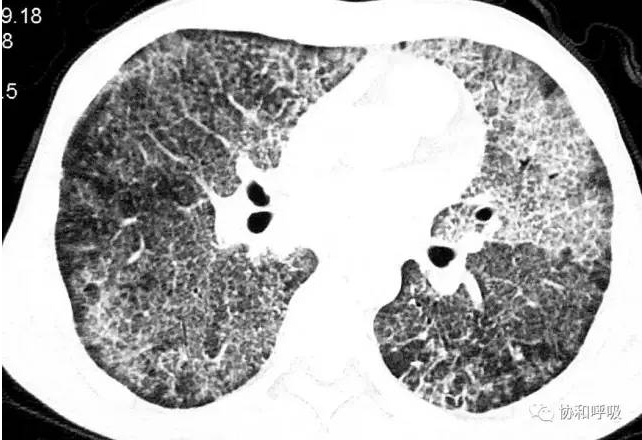
可见双肺弥漫性磨玻璃影,可见小叶间隔增厚,「铺路石征」改变,符合PAP的典型影像学改变
既往史及个人家族史:
既往史:「贫血」史30年。
个人史:从事装修工作19年,工作中接触电焊。
家族史:无特殊。
体格检查:
血压90/60mmHg,SpO2 93%(@RA),浅表淋巴结未及明显肿大;双肺未闻及干湿性啰音;肝脾脏肋下及边。
辅助检查:
血白细胞为(2.9~5.4)×10^9/L,血色素 (65~85)g/L,血小板为(58~98)×10^9/L;G试验、GM试验、抗核抗体、抗中性粒白细胞质抗体、抗粒细胞巨噬细胞集落刺激因子(GM-CSF)抗体均阴性;骨髓涂片示两系病态造血及个别吞噬细胞及吞噬血细胞现象。
PET-CT示双锁骨及纵隔多发代谢增高淋巴结,双肺弥漫性代谢增高,肝脾增大,全身骨髓普遍代谢增高,外周骨髓扩张,考虑为血液系统恶性病变。
支气管肺泡灌洗液(BALF)为米汤样浑浊液体,BALF沉渣包埋病理示粉染聚集的蛋白样物,可见针形裂隙,PAS(+),D-PAS(+)(图4);BALF病原学阴性。
【图4】肺泡灌洗液沉渣包埋显微镜下图(HE 40×):
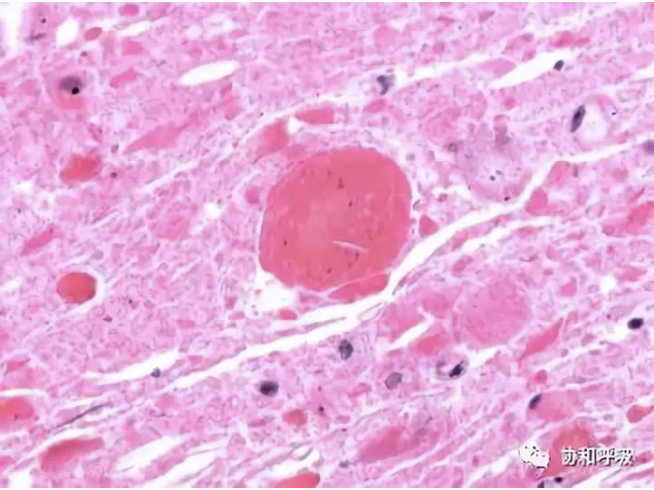
可见大量粉染蛋白样物,其中见蛋白聚集及针形裂隙,形态符合肺泡蛋白沉积症
住院期间发现患者锁骨下淋巴结肿大和多发皮下结节,先后行右锁骨下淋巴结、左上肢及右下肢皮下结节活检,病理均提示纤维、脂肪组织化脓性肉芽肿性炎,伴坏死及脓肿形成,分枝杆菌快速培养阳性,菌种鉴定为龟分枝杆菌。
临床诊断
肺泡蛋白沉积症(PAP),骨髓增生异常综合征(MDS),可能为龟分枝杆菌感染所继发
治疗与转归
加用乙胺丁醇+头孢美唑+阿米卡星+克拉霉素的抗非结核分枝杆菌治疗后退热。
半月后患者再次发热,呼吸困难加重。骨髓染色体示多条染色体异常(17/20个中期分裂相出现8+)【图5】,复查骨髓涂片结合骨髓染色体结果诊为MDS。
患者最终因呼吸衰竭加重死亡。
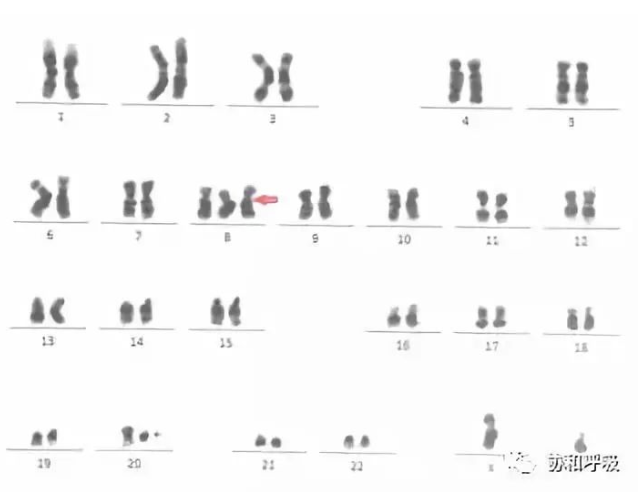
图5 染色体核型分析
(红色箭头示47 XY 8+)
最终诊断
原发MDS继发肺泡蛋白沉积症(PAP),合并播散性非结核分枝杆菌感染。
讨论
肺泡蛋白沉积症
患者胸部HRCT影像特征为弥漫的磨玻璃影及小叶间隔增厚,即铺路石征或者称crazy paving,符合典型的PAP表现。但确诊仍需要病理证据,可以通过肺泡灌洗液和肺组织获得病理诊断依据。肺泡灌洗液呈白色或豆浆样,静置后沉淀。将沉淀物进行沉渣石蜡包埋,染色后可见大量粉染的均质物,淀粉酶消化后过碘酸雪夫氏(PAS)染色阳性。肺组织镜检典型病理表现为:肺泡及终末气腔内有PAS强阳性物质充塞,常可见针形裂隙。该病人BALF中可见粉染聚集的蛋白样物,可见针形裂隙,PAS(+), D-PAS(+),因此PAP诊断成立。
Tips:铺路石征
可以见于多种疾病,如某些感染,如肺结核、肺孢子菌肺炎、病毒性肺炎,肺水肿甚至肺腺癌患者也可出现。
然而该患者整个病程难以单纯用PAP解释,包括:影像学激素治疗后一过性好转,病程中高热,血三系降低,PET-CT的高代谢病灶等等。需要我们进一步挖掘背后潜在病因。
继发性肺泡蛋白沉积症
PAP分先天性、获得性和继发性(secondary pulmonary alveloar proteinosis,SPSP)。SPAP常与血液系统肿瘤、免疫抑制剂、吸入粉尘、有毒气体,以及特殊感染导致的肺泡巨噬细胞功能缺陷有关,其GM-CSF抗体检测阴性。我院资料显示,SPAP常见的病因包括血液系统疾病,如MDS和感染性疾病如肺结核。
SPAP目前无特异治疗方法,仅有个别报道在等待移植过程中行全肺灌洗或吸入GM-CSF有一定效果。
在本例患者中:
继发于非结核分支杆菌感染
本例患者经病理确诊为PAP,且GM-CSF抗体阴性,就诊过程中反复发热,淋巴结和皮下结节活检确诊为非结核分枝杆菌感染,首先考虑为非结核分枝杆菌感染继发的PAP。但经抗感染治疗后患者退热,但之后病情再次反复提示SPAP可能继发于其它原因。
继发于MDS
该患者长期贫血,入院时血三系显著下降,提示存在血液系统疾病,最后确诊MDS。SPAP可继发于多种血液系统疾病,以MDS最常见。SPAP可以先于血液系统疾病几年出现,并且可以在治疗原发病后缓解。但是SPAP常是血液系统肿瘤致死的并发症,预后不佳。
本例要点
1、肺泡蛋白沉积症的典型影像表现:弥漫的磨玻璃影及小叶间隔增厚,即铺路石征。
2、肺泡蛋白沉积症的诊断一定要除外继发因素,常见继发病因包括MDS、白血病、淋巴瘤等血液系统肿瘤,结核分枝杆菌感染、粉尘吸入等。
参考文献
[1] 郭小贝,贾觉睿智,张冬梅,万璐,赵雨,田欣伦。继发性肺泡蛋白沉积症合并播散性龟分枝杆菌感染一例。中华结核和呼吸杂志。2017,40(9):717-718
[2] Dongmei Zhang, Xinlun Tian , Ruie Feng, Xiaobei Guo, Peng Wang, Yusen Situ, Yi Xiao and Kai-Feng Xu. Secondary pulmonary alveolar proteinosis: a single-center retrospective study (a case series and literature review). BMC Pulmonary Medicine (2018) 18:15. DOI 10.1186/s12890-018-0590-z.
本文转载自订阅号「协和呼吸」
作者:郭小贝、贾觉睿智、张冬梅、赵雨、万璐、田欣伦
文字整理:汪劭婷 彭敏
原文发布于6月12日,链接戳:肺里的“牛奶” | 病例拾萃·协和呼吸


