肺癌是导致中国人癌症死亡的首要原因。肺癌筛查是实现肺癌「早诊、早治」,提升肺癌患者生存、降低肺癌患者病死率的重要措施。随着我国肺癌筛查指南与共识的更新
[1, 2, 3]
,肺结节的管理策略也在逐步完善。但中国各地经济水平发展不一致、医疗资源参差不齐,许多县域医院无法长期、规范地管理肺结节与诊治肺癌患者。因此,提高县域医务工作者的肺结节管理水平与肺癌诊治能力,尽可能减少不同地域、不同医院和不同层级的诊疗差异,最大可能地实现肺结节管理与肺癌诊治规范化迫在眉睫
[4]
。由中华医学会呼吸分会肺癌学组牵头,中国县域肺癌筛查共识专家组在总结县域肺癌筛查、肺结节管理经验,广泛听取多学科专家的意见,参考国内外已有的指南共识后,特制定本共识。共识更新定义了我国肺癌风险人群,强调了不同分类下肺结节的管理流程,以及肺癌筛查多学科合作重点与分工等,以期为提高我国县域医院医生肺癌筛查与肺结节管理能力提供参考。
一、肺癌筛查人群和筛查方法
1、肺癌筛查人群
建议使用《肺癌筛查问卷》(表1)采集受试者年龄、吸烟及油烟接触史、职业环境暴露史、既往病史与家族史等,根据采集的信息评估肺癌风险。
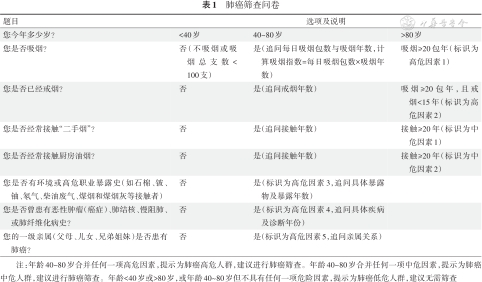
表1:肺癌筛查问卷
1、肺癌高危人群:年龄40~80岁且具有以下任一危险因素者:(1)吸烟≥20包年(或400年支),或曾经吸烟≥20包年(或400年支),且戒烟时间<15年;(2)有环境或高危职业暴露史(如石棉、铍、铀、氡等接触者);(3)合并慢性阻塞性肺疾病、弥漫性肺纤维化或既往有肺结核病史者;(4)既往罹患恶性肿瘤或有肺癌家族史者。对于肺癌高危人群,优先推荐进行肺癌筛查。
2、肺癌中危人群:年龄40~80岁且具有以下任一危险因素者:(1)被动吸烟≥20年;(2)接触烹饪油烟 ≥20年。对于肺癌中危人群,推荐进行肺癌筛查。
3、肺癌低危人群:年龄<40岁或>80岁,或年龄40~80岁但不具有任何一项危险因素。对于肺癌低危人群,不推荐进行肺癌筛查。
2、肺癌筛查方法
肺癌评估手段包括影像学技术、肿瘤标志物、痰脱落细胞学检查、呼吸内镜技术等。目前,国内外指南共识推荐的常规肺癌筛查方法为胸部低剂量螺旋CT(LDCT)检查。
1、胸部X线片:胸部X线片曾是最常见的肺癌筛查手段。早期的随机对照研究显示胸部X线片可显著提高肺癌的早期检出率、生存率,却并未显示可降低肺癌的病死率[5, 6]。美国在前列腺癌、肺癌、结直肠癌和卵巢癌筛查试验(PLCO)中对胸部X线片筛查的效果进行了评估,结果发现胸部X线片筛查不能降低肺癌的病死率[7]。因此,目前已不再推荐胸部X线片作为肺癌筛查的常规方法。
2、痰脱落细胞学检查:痰脱落细胞学检查也曾是常见的肺癌筛查方法,可以发现被胸部X线片漏诊的中央型肺癌。痰脱落细胞学检查具有极高的特异性,一般在98%以上,但敏感度不高,仅为20%~30%。在欧美和日本的大样本临床试验采用年度胸部X线片联合1年4次痰检同样并未获得可降低肺癌病死率的证据[8]。薄层痰液基细胞学技术对于诊断早期或疑似肺癌的病例效果明显优于常规痰脱落细胞学技术,但在肺癌筛查中的应用价值仍有待大规模临床研究验证。
3、胸部LDCT:与胸部X线片相比,胸部LDCT扫描可显著提高肺癌的早期检出率、生存率,降低肺癌的病死率。国际早期肺癌行动计划(I-ELCAP)显示:经LDCT肺癌筛查确诊并1个月内接受手术治疗者10年生存率为92%[9];美国国家肺癌筛查试验(NLST)结果提示:与胸部X线片筛查相比,采用LDCT对肺癌高危人群进行筛查可降低25%的肺癌病死率[10];荷兰-比利时肺癌筛查研究(NELSON)发现:与胸部X线片筛查相比,采用LDCT对肺癌高危人群进行筛查可降低26%(男性)、39%~61%(女性)的10年死亡风险[11]。胸部LDCT扫描较胸部X线片可提供更多关于肺结节位置、大小、形态、密度、边缘及内部特征等信息,可更好地评价肺结节的形态特征。建议设定LDCT检查参数和扫描的范围如下(表2)[3]。
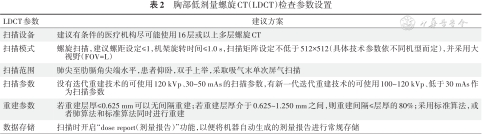
表2:胸部低剂量螺旋CT(LDCT)检查参数设置
4、PET-CT:PET-CT是基于肿瘤细胞具有较高的葡萄糖摄取与代谢率辅助判断肺结节的良恶性;标准化摄取值(SuV)是PET-CT常用的重要参数,当SuV值>2.5时,提示恶性肿瘤的可能性大。但PET-CT对实性成分长径<8 mm的肺结节,尤其是亚实性结节(磨玻璃结节,GGN)判断的价值有限[12],目前不推荐常规使用PET-CT进行肺癌筛查。但对于高度可疑恶性的肺结节患者,PET-CT可推荐用于术前分期。对于多发实性肺结节,或有肺外恶性肿瘤病史的肺结节患者,可推荐行PET-CT排查转移[13, 14]。
5、肿瘤标志物:常用的肺癌相关肿瘤标志物在早期肺癌检测中灵敏度低,不建议用于常规的肺癌筛查,但如果在随访阶段发现肺癌相关肿瘤标志物进行性增高,应警惕肺癌的可能性[15]。而探索性标志物,如自身抗体、血浆/血清游离DNA(cfDNA/ctDNA)甲基化、循环肿瘤细胞(CTCs)等,在肺癌筛查中的应用价值仍有待大规模临床研究验证[16, 17, 18, 19]。
6、呼吸内镜技术:支气管镜检查是重要的肺癌评估手段,新型呼吸内镜技术如自荧光支气管镜(AFB)、窄谱光成像支气管镜(NBI)、荧光共聚焦显微镜(FCFM)、光学相干断层成像(OCT)、细胞内镜(ECS)等是近年来发展起来的肺癌早期诊断新方法[20]。AFB灵敏度高,特异性好,可显著提高气管支气管黏膜癌前病变、原位癌的检出率;对于早期中央型肺癌,特别是CT难以显示的支气管腔内小病灶优势明显[21]。NBI、FCFM特异性和敏感性足以发现早期肺癌,可以识别异常增生、原位癌和浸润癌[22, 23]。OCT、ECS可辅助临床判断组织学类型,但以上新型呼吸内镜技术在肺癌筛查中的价值目前还在探索。
二、肺结节概述
1、肺结节定义
影像学表现为长径≤3 cm的局灶性、类圆形、密度增高的实性或亚实性肺部阴影,可为孤立性或多发性,不伴肺不张、肺门淋巴结肿大和胸腔积液。
2、肺结节分类
1、按结节大小分类:肺结节中长径≤5 mm者为微小结节,5 mm<长径≤10 mm者为小结节,10 mm<长径≤30 mm 定义为结节。
2、按结节密度分类:分为实性肺结节和亚实性肺结节。亚实性肺结节又包含磨玻璃病灶内不含有实性成分的纯磨玻璃结节(pGGN,又称非实性结节),以及磨玻璃病灶内含有实性成分的混杂磨玻璃结节(mGGN,又称部分实性结节)。
3、按结节分布分类:分为孤立性肺结节、多发性肺结节。单个病灶定义为孤立性,≥2个的病灶定义为多发性。弥漫性肺结节一般不属于肺癌筛查管理的范畴。
3、早筛肺结节的特征
肺癌筛查中发现的肺结节绝大多数为亚厘米结节(长径≤10 mm),呈孤立性或多发性。在早筛肺结节中,亚实性结节较实性结节肺癌风险率更高[24, 25, 26, 27, 28],随访新发肺结节较基线肺结节肺癌风险率更高[29]。
此外,早筛肺结节的自然病程也与既往有症状的肺结节自然病程存在不同。早筛肺结节,尤其是磨玻璃结节,自然病程存在长期稳定、逐渐增长、假性缩小、稳定后进展四种常见类型。自然病程的表现形式往往反映的是肺结节进化的不同阶段,观察和评估早筛肺结节的自然病程有助于判断良恶性以及后续临床决策。研究发现磨玻璃结节中绝大多数表现为长期稳定的自然病程[25, 26, 27,30,31, 32, 33],其中既有良性肺结节,也有恶性肺结节,这类结节中形态学或预测模型提示高度可疑肺癌的不建议直接手术,而应多学科团队诊疗(MDT)决定诊治方案。长期稳定的肺结节一旦出现进展(即稳定后进展的自然病程)应高度警惕恶性的可能,其表现形式又分为同一病灶稳定后进展以及出现新病灶两类;前者的临床决策相对简单,而后者的临床决策相对复杂,需要多学科讨论决定。对于自然病程表现为逐渐增长的早筛肺结节,可以通过体积测定计算容积倍增时间来辅助判断结节良恶性[26, 34, 35]。假性缩小是近年来发现的恶性磨玻璃结节的特殊自然病程,它表现为肺结节长径或体积缩小而实性成分增大,表现为这一类型自然病程的肺结节很容易被误诊为良性肺结节,而事实上出现这一自然病程往往反映的是早期肺癌侵袭性的增大,是提示手术时机的指标[36, 37, 38, 39]。
4、肺结节临床恶性概率评估
在肺结节的管理中,根据临床信息和影像学特征综合评估临床恶性肿瘤的概率具有重要意义,有助于选择合适的后续检查方法和随访模式[40]。
1、实性肺结节:本共识推荐美国胸科医师协会(ACCP)指南采用的由梅奥临床研究人员开发的Mayo模型评估。该研究使用多因素logistic回归模型分析了419例非钙化、胸部影像学检查结节长径为4~30 mm的患者,确定了6种独立的预测因子,其中包括年龄、目前或过去吸烟史、结节发现前的胸腔外恶性肿瘤史>5年、结节长径、毛刺征和位于上叶。预测模型:恶性概率=ex/(1+ex);x=-6.827 2+(0.039 1×年龄)+(0.791 7×吸烟史)+(1.338 8×恶性肿瘤)+(0.127 4×长径)+(1.040 7×毛刺征)+(0.783 8×结节位置)。其中e是自然对数;年龄为患者的年龄(岁);是否目前或以前吸烟,是=1,否=0;是否有胸腔外恶性肿瘤史>5年,是=1,否=0;长径为结节的长径(mm);结节边缘是否有毛刺征,是=1,否=0;结节位置是否位于上叶,是=1,否=0[41]。
2、亚实性肺结节:本共识推荐全加拿大筛查研究(Pan-Canadian Screening Study)基于患者特征和结节特征而制定的预测结节恶性概率的Brock模型评估。该模型涵盖了9种独立的预测因子,其中包括年龄、性别、肺癌家族史、肺气肿、结节大小、结节类型、结节个数、位于上叶和毛刺。预测模型:恶性概率=100×[e(Logodds)/(1+e(Logodds))]。Logodds=0.028 7×(年龄-62)+性别+肺癌家族史+肺气肿-5.385 4×[(结节大小/10)-0.5-1.581 138 83)]+结节类型-[0.082 4×(结节个数-4)]+结节位置+毛刺征-6.789 2。其中e为自然对数;年龄为患者的年龄(岁);性别:女性=0.601 1,男性=0;是否合并肺癌家族史:是=0.295 3,否=0;是否合并肺气肿史:是=0.295 3,否=0;结节大小为结节的长径(mm);结节类型:非实性结节=-0.127 6,部分实性结节=0.377,实性结节=0;结节是否位于上叶,是=0.658 1,否=0;结节毛刺:是=0.772 9,否=0[42]。
三、实性肺结节的管理与诊治
1、长径≤10 mm的实性肺结节管理
可根据如下流程评估并管理长径≤10 mm的实性肺结节,见图1。
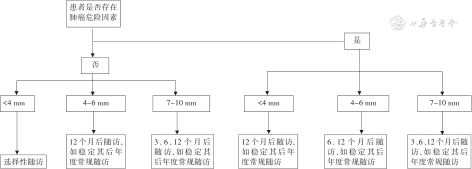
图1:长径≤10 mm的实性肺结节管理
1、单个实性结节长径≤10 mm且无肺癌危险因素者:建议根据结节大小选择LDCT随访的频率与持续时间:(1)结节长径<4 mm者选择性进行随访,但应告知患者不随访的潜在危害;(2)结节长径4~6 mm者应在12个月后重新评估,如无变化(稳定),其后转为常规年度随访;(3)结节长径7~10 mm者应在3、6、12个月进行随访,如无变化(稳定),其后转为常规年度随访。
2、单个实性结节长径≤10 mm且存在一项或多项肺癌危险因素者:建议根据结节的大小选择CT随访的频率和持续时间:(1)结节长径<4 mm者应在12个月重新评估,如果没有变化(稳定)则转为常规年度随访;(2)结节长径为4~6 mm者应在6、12个月后随访,如果没有变化(稳定),其后转为常规年度随访;(3)结节长径为7~10 mm者应在最初的3、6、12个月后随访,随后在9~12个月随访,如果没有变化(稳定),其后转为常规年度随访。
2、长径>10 mm的实性肺结节管理与诊治
可根据如下流程评估并管理长径>10 mm的实性肺结节,见图2。
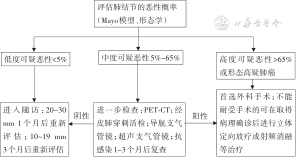
图2:长径>10 mm的实性肺结节管理与诊治
1、单个实性结节长径>10 mm者:建议临床医生通过定性地使用临床判断(形态学)和定量地使用验证模型(Mayo模型)评估肺结节的恶性概率。
2、单个实性结节长径>10 mm且恶性肿瘤的预测概率为低(<5%)者:建议进入随访,长径10~20 mm者可3个月后重新评估,长径20~30 mm者可1个月后重新评估。
3、单个实性结节长径>10 mm且恶性肿瘤的预测概率为中度(5%~65%)者:建议行进一步检查,包括PET-CT、经皮肺穿刺活检、导航支气管镜、超声支气管镜等检查明确结节性质,或诊断性抗感染治疗1~3个月后复查。经活检确诊为恶性的肺结节建议行外科手术,经活检确诊为良性的肺结节建议进入随访管理。
4、单个实性结节长径>10 mm且恶性肿瘤的预测概率为高度(>65%)者或形态学高度疑似肺癌者:MDT评估外科手术治疗或非手术治疗(立体定向放疗或射频消融治疗)的方案。
四、亚实性肺结节管理与诊治原则
可根据如下流程评估并管理亚实性肺结节(磨玻璃结节,包括pGGN和mGGN),见图3。
(1)单个亚实性结节且初诊时形态学高疑肺癌者,建议进行MDT决定下一步诊治方案(随访、活检、手术治疗或非手术治疗)。
(2)单个亚实性结节且有既往影像学资料(间隔3个月以上)者,对影像进行对比评估,并根据评价结果进入下一步诊治方案。
(3)单个亚实性结节且无既往影像学资料(或既往影像学间隔<3个月)者,建议在3个月后进行第1次随访,并对比影像变化,根据评价结果进入下一步诊治方案。
(4)单个亚实性结节且与既往影像对比评估为肺结节吸收者,进入常规年度随访。
(5)单个亚实性结节且与既往影像对比评估为肺结节缩小者,应在6个月后重新评估,如果排除假性缩小,建议进入常规年度随访;如果判断为假性缩小者(结节长径缩小但实性成分增多),则建议进行MDT决定下一步诊治方案。
(6)单个亚实性结节且与既往影像对比评估为肺结节稳定者,建议临床医生通过定性地临床判断(形态学)和定量地使用验证模型(Brock模型)评估肺结节的恶性概率。恶性概率为低度(<10%)者,或长期随访均稳定者,建议进入常规年度随访;恶性概率为高度(>10%)者,或形态学高度疑似肺癌者,建议采取MDT决定下一步诊治方案(随访、活检、手术治疗或非手术治疗)。
(7)单个亚实性结节,且与既往影像对比评估为肺结节增长、假性缩小、稳定后进展者:建议采取MDT决定下一步诊治方案(随访、活检、手术治疗或非手术治疗)。

图3:亚实性肺结节管理与诊治
五、新发肺结节管理与诊治原则
可根据如下流程评估并管理新发肺结节(图4)。(1)随访新发肺结节者:应考虑是否为感染或非感染性炎症。(2)随访新发肺结节,不考虑感染或非感染性炎症者,建议根据结节类型,按基线肺结节管理与诊治流程进行评估与管理。(3)随访新发肺结节,考虑为感染或非感染性炎症者,建议抗感染或抗炎治疗后1~3个月随访。(4)随访新发肺结节,考虑为感染或非感染性炎症者,如1~3个月后再次随访肺结节吸收者,建议进入常规年度随访。(5)随访新发肺结节,考虑为感染或非感染性炎症者,如1~3个月后再次随访肺结节缩小者,建议3~6个月后随访,如结节继续缩小或稳定,可进入常规年度随访;如结节增长或假性缩小(结节长径缩小但实性成分增多),则建议根据结节类型,按基线肺结节管理与诊治流程进行评估与管理。(6)随访新发肺结节,考虑为感染或非感染性炎症者,如1~3个月后再次随访肺结节稳定、增长、假性缩小、稳定后进展者,建议根据结节类型,按基线肺结节管理与诊治流程进行评估与管理。
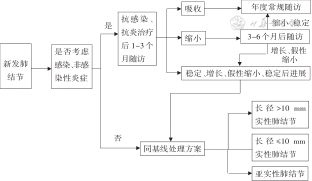
图4:新发肺结节管理与诊治
六、多发性肺结节管理与诊治原则
(1)多发性肺结节建议单独评估每个结节,并筛选出优势结节(优势结节为最可疑的结节,其不一定是最大的结节);多发性肺结节的处理,原则上应根据优势结节的情况采取相应临床策略。
(2)对于多发性实性肺结节,应考虑肺转移瘤、感染性肉芽肿(如结核、真菌)、非感染性肉芽肿等(表3)。PET-CT有助于判断转移性结节及其原发灶,对多发性肺结节诊疗有一定价值;且在绝大多数情况下,转移灶3个月内可以明显观察到增大。
(3)对于多发性亚实性肺结节,应考虑多原发肺癌、感染性炎症、非感染性炎症等(表3)。如病灶在3个月首次随访CT后无明显减小、变淡或吸收,应考虑多原发肺癌的可能性;但PET-CT对于多发性亚实性肺结节的判断有局限性。
(4)对于多发性肺结节进行分类和采取最佳治疗存在困难时,建议MDT。
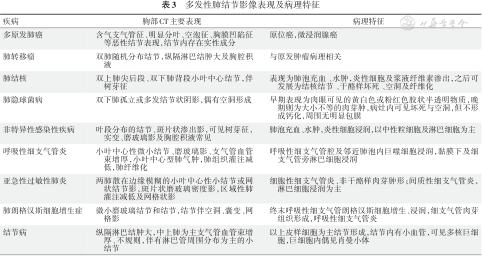
表3:多发性肺结节影像表现及病理特征
七、肺癌筛查需要多学科合作
(一)肺癌相关领域多学科专家共同组成的肺结节MDT是实施肺癌筛查的关键
除了肺癌早诊、早治阶段强调多学科合作外,在肺癌患者的全程管理阶段,特别是涉及治疗方案更改时,MDT都是不可或缺的模式。MDT并不是疑难病例的会诊,患者诊疗过程中都需要全程个体化的跟踪指导。
(二)肺结节多学科团队构成
建议由呼吸与危重症医学科医生、胸外科医生、肿瘤科医生与放射科(包含放射介入科)医生组成,在有条件的县域医院可加入病理科医生。
(三)早筛肺结节管理与诊治过程中推荐MDT的环节
(1)单个实性肺结节长径>10 mm,且恶性概率为中度(5%~65%)者:建议MDT明确活检指征及最佳活检途径。单个实性肺结节长径>10 mm,且恶性概率为高度(>65%)者:建议MDT明确手术指征、手术术式以及存在手术禁忌时的最佳替代治疗。(2)单个亚实性肺结节,且形态学高度疑似肺癌者,或恶性概率为高度(>10%):建议MDT明确活检指征及最佳活检途径,或手术指征及手术术式,以及存在手术禁忌时的最佳替代治疗。(3)多发肺结节者:建议MDT明确结节恶性概率评估及最佳治疗方案。
八、不同级别学科在肺癌筛查过程中的分工
我国各地经济水平发展不一致、医疗资源参差不齐,对于县域医院而言,仅仅依靠当地的资源很难做到长期的规范化诊疗。综合性大型公立医院与县域医院建立上下联动的专病联盟,对肺结节、肺癌进行分级管理与诊治非常必要。基于此,本共识对不同级别学科在肺癌筛查过程中的分工推荐如下:
(一)部属医院(呼吸与危重症医学科、胸外科、肿瘤科、放射科与病理科)
推荐负责肺癌筛查规范的制定,疑难肺结节/肺癌综合诊治、并发症与合并症综合评估处理、肺结节/肺癌临床研究开展、向下转诊、对下级医院培训和技术指导、肺结节/肺癌规范化管理质控、健康宣教、戒烟咨询、康复指导等工作。
(二)省市级医院(呼吸与危重症医学科、胸外科、肿瘤科、放射科与病理科)
推荐负责高危、中危人群筛查(肺癌筛查问卷)、肺结节/肺癌综合诊治、并发症与合并症综合评估处理、肺结节/肺癌临床研究开展、向下向上转诊、培训县域医院医生、健康宣教、戒烟咨询、康复指导等工作。
(三)(县域)县级医院(呼吸科、胸外科、肿瘤科、放射科)
推荐负责高危、中危人群筛查(肺癌筛查问卷)、肺结节/肺癌初级诊治、并发症与合并症综合评估处理、向下向上转诊、健康宣教、戒烟咨询、康复指导等工作。
(四)(县域)乡镇卫生院
推荐负责高危、中危人群筛查(肺癌筛查问卷)、随访期管理、向上转诊、健康宣教、戒烟咨询、居家护理等工作。
九、小结
本共识阐述了肺癌筛查的人群与方法,早筛肺结节定义、分类、特征、恶性概率模型;对不同类型肺结节制订了不同的管理与诊治流程。同时基于县域医院临床工作特点,并对肺癌筛查过程中多学科合作模式及不同级别学科分工进行了阐释。本县域肺癌筛查共识的建立,有助于推进我国肺癌筛查的精准管理,提升肺癌筛查的效率和效果,是整体肺癌防控体系的重要补充。
中国县域肺癌筛查共识编写专家组:
主任委员:王辰(中国医学科学院北京协和医学院)
执行主任:胡成平(中南大学湘雅医院呼吸与危重症医学科)
项目秘书:李敏(中南大学湘雅医院呼吸与危重症医学科)
执笔专家:李敏(中南大学湘雅医院呼吸与危重症医学科);杨萌(中日友好医院呼吸与危重症医学科)
核心专家成员(按姓氏拼音排序):操乐杰(安徽省立医院呼吸与危重症医学科);陈宏(哈尔滨医科大学附属第二医院呼吸与危重症医学科);高俊珍(内蒙古医科大学附属医院呼吸与危重症医学科);何梅(山西省人民医院呼吸与危重症医学科);胡成平(中南大学湘雅医院呼吸与危重症医学科);金阳(华中科技大学同济医学院附属协和医院呼吸与危重症医学科);李敏(中南大学湘雅医院呼吸与危重症医学科);刘丹(四川大学华西医院呼吸与危重症医学科);罗壮(昆明医科大学第一附属医院呼吸与危重症医学科);覃寿明(广西医科大学附属第一医院呼吸与危重症医学科);王琪(大连医科大学附属第二医院呼吸与危重症医学科);阎锡新(河北医科大学第二医院呼吸与危重症医学科);杨萌(中日友好医院呼吸与危重症医学科);叶贤伟(贵州省人民医院呼吸与危重症医学科);岳红梅(兰州大学第一医院呼吸与危重症医学科);张伟(南昌大学第一附属医院呼吸与危重症医学科);张晓菊(河南省人民医院呼吸与危重症医学科);张捷(吉林大学第二医院呼吸与危重症医学科);张艰(解放军空军军医大学第一附属医院呼吸与危重症医学科)
县域专家成员(按姓氏拼音排序):白淑叶(山西省山阴县人民医院呼吸内科);白毅(四川省平昌县人民医院呼吸内科);蔡海波(云南省宣威云峰医院肿瘤科);曹晓红(山西省汾阳医院老年科);常利兼(四川省泸州市合江县人民医院呼吸内科);陈国荣(湖南省华容县人民医院呼吸内科);陈凯(河南省永城市人民医院呼吸与危重症医学科);戴丹菁(湖北省汉川市人民医院肿瘤科);杜驰(四川资中资州医院肿瘤科);杜明华(河北省丰宁满族自治县医院呼吸与危重症医学科);段焕发(湖南省安仁县人民医院呼吸内科);冯剑(河南省新郑市人民医院呼吸与危重症医学科);冯绍斌(四川省南部县人民医院呼吸内科);高天敏(重庆市丰都县人民医院呼吸与危重症医学科);巩晓峰(陕西省周至县人民医院呼吸与危重症医学科);郭荣(河南省新乡市获嘉县同盟医院呼吸内科);韩振军(安徽省临泉县人民医院呼吸与危重症医学科);何剑(云南昆钢医院呼吸内科);胡利(重庆市垫江县中医院呼吸与危重症医学科);胡玄(湖南省隆回县人民医院肿瘤科);黄莉(贵州省盘江总医院肿瘤科);蒋跃文(湖南省祁阳县人民医院呼吸与危重症医学科);井泉(河南省邓州市人民医院呼吸与危重症医学科);李翠荣(辽宁省北票市中心医院呼吸内科);李锋(湖南省石门县人民医院肿瘤科);李辉(黑龙江省铁力市人民医院呼吸与危重症医学科);李贱(四川省峨眉山人民医院呼吸肿瘤科);李淑敏(山西省长治市北大医疗潞安医院呼吸内科);李学鹏(辽宁省绥中县人民医院肿瘤科);李艳(吉林省梅河口市中医院呼吸与危重症医学科);李艳红(湖南省冷水江市人民医院呼吸与危重症医学科);李艳萍(云南省红河州第三人民医院呼吸与危重症医学科);李元盈(河南省新安县人民医院呼吸与危重症医学科);李作盐(辽宁省铁煤集团总医院呼吸内科);刘劲松(湖北省仙桃市第一人民医院肿瘤科);刘匡飞(河北省乐亭县中医院肿瘤科);刘喜龙(内蒙古开鲁县医院胸外科);刘跃海(安徽省定远县总医院呼吸与危重症医学科);马玉民(河南省浚县人民医院呼吸与危重症医学科);莫剑(广西壮族自治区北流市人民医院呼吸与危重症医学科);丘统强(广西壮族自治区横县人民医院呼吸内科);谭祥(四川省安岳县人民医院肿瘤科);田海生(湖南省安化县人民医院呼吸与危重症医学科);田雨(四川省安岳县人民医院呼吸与危重症医学科);王贵锋(黑龙江省安达市医院呼吸内科);王会锋(河北省邢台市第九医院呼吸与危重症医学科);王磊(陕西省渭南市渭北中心医院呼吸内科);王睿荣(陕西省岐山县医院呼吸与危重症医学科);王献华(河南省上蔡县人民医院呼吸与危重症医学科);王玉平(辽宁省庄河市中心医院呼吸与危重症医学科);王院生(河北省河间市人民医院肿瘤内科);王志刚(贵州省盘州市人民医院肿瘤科);温所龙(山西省五四一总医院呼吸内科);吴政华(湖南省安乡县人民医院呼吸内科);谢华(河南省息县人民医院呼吸与危重症医学科);徐大林(安徽省庐江县人民医院呼吸与危重症医学科);徐秋平(江西省丰城县人民医院肿瘤科);许宁(山西省汾阳医院肿瘤科);于玲(辽宁省海城市中心医院呼吸内科);于水玲(内蒙古开鲁县医院呼吸内科);岳鹏程(四川省射洪市人民医院呼吸与危重症医学科);张解军(湖南省桂阳县第一人民医院呼吸内科);张淑芳(黑龙江省安达市人民医院呼吸内科);张雪艳(陕西省子长县人民医院呼吸内科);赵春红(安徽省界首市人民医院呼吸与危重症医学科);郑崇杰(河南省郸城县人民医院呼吸与危重症医学科);钟金菊(湖南省平江县第一人民医院肿瘤科);周悦乔(海南省琼海市人民医院血液肿瘤内科);邹佳江(四川省大竹县人民医院呼吸内科);邹璇(湖南省浏阳市人民医院呼吸内科);邹长庚(湖南省南华大学附属南华医院祁东分院呼吸与危重症医学科)
指导专家成员(按姓氏拼音排序):白莉(解放军陆军军医大学第二附属医院呼吸与危重症医学科);陈良安(解放军总医院第一医学中心呼吸与危重症医学科);程渊(北京大学第一医院呼吸与危重症医学科);付秀华(内蒙古医科大学附属医院呼吸与危重症医学科);高蓓莉(上海交通大学医学院附属瑞金医院呼吸与危重症医学科);韩一平(解放军海军军医大学第一附属医院呼吸与危重症医学科);何勇(解放军陆军特色医学中心呼吸与危重症医学科);洪群英(复旦大学附属中山医院呼吸与危重症医学科);胡洁(复旦大学附属中山医院呼吸与危重症医学科);姜丽岩(上海市胸科医院呼吸与危重症医学科);兰芬(浙江大学医学院附属第二医院呼吸与危重症医学科);李强(上海市东方医院呼吸与危重症医学科);刘晓芳(首都医科大学附属北京同仁医院呼吸与危重症医学科);吕镗烽(东部战区总医院呼吸与危重症医学科);穆传勇(苏州大学附属第一医院呼吸与危重症医学科);施焕中(首都医科大学附属北京朝阳医院呼吸与危重症医学科);施敏骅(苏州大学附属第二医院呼吸与危重症医学科);唐华平(青岛市市立医院呼吸与危重症医学科);王凯(浙江大学医学院附属第四医院呼吸与危重症医学科);王珂(吉林大学第二医院呼吸与危重症医学科);王孟昭(中国医学科学院北京协和医院呼吸与危重症医学科);王悦虹(浙江大学医学院附属第一医院呼吸与危重症医学科);吴迪(深圳市人民医院呼吸与危重症医学科);谢宝松(福建省立医院呼吸与危重症医学科);谢敏(华中科技大学同济医学院附属同济医院呼吸与危重症医学科);徐淑凤(秦皇岛市第一医院呼吸与危重症医学科);徐小嫚(中国医科大学附属盛京医院呼吸与危重症医学科);杨侠(西安交通大学第二附属医院呼吸与危重症医学科);余宗阳(解放军联勤保障部队第九〇〇医院呼吸与危重症医学科);赵微(解放军总医院第一医学中心呼吸与危重症医学科);钟殿胜(天津医科大学总医院肿瘤内科);周承志(广州医科大学附属第一医院呼吸与危重症医学科);周向东(解放军陆军军医大学第一附属医院呼吸与危重症医学科);周燕斌(中山大学附属第一医院呼吸与危重症医学科)
利益冲突 所有作者均声明不存在利益冲突
参考文献 略
引用本文:中国县域医院肺癌筛查共识编写专家组, 中华医学会呼吸分会肺癌学组. 中国县域肺癌筛查共识(2020年) [J] . 中华医学杂志, 2021, 101(14) : 979-988. DOI: 10.3760/cma.j.cn112137-20201130-03227.
本文转载自订阅号「中华医学杂志」(ID:nmjc1915)
本文完
排版:Jerry


