摘要
慢性阻塞性肺疾病(慢阻肺)全球创议(global initiative for chronic obstructive lung disease,GOLD)2020年修订版于2019年11月5日发布,其最重要的改变是增加了起始吸入性糖皮质激素治疗需要考虑的因素,调整了慢阻肺管理循环图表,改进非药物治疗的随访,明确了慢阻肺急性加重的鉴别诊断。
对新增内容进行的简介和解读已全文发表于《中国医学前沿杂志(电子版)》2019年第12期,内容如下。
【关键词】慢性阻塞性肺疾病;吸入性糖皮质激素;急性加重;生物标志物;个体化治疗
前言
1998年慢性阻塞性肺疾病(慢阻肺)全球创议(global initiative for chronic obstructive lung disease,GOLD)启动,其目标是根据已发表的最佳研究结果制订慢阻肺的管理推荐。第1版慢阻肺诊断、治疗及预防全球策略于2001年发布,并于2006年和2011年分别根据已发表的研究进行了全面修订。GOLD 2011修订版的修订分别于2013年1月、2014年1月、2015年1月和2016年1月发布,国内呼吸领域相关专家亦分别对其进行了解读 [1-4]。
2015—2016年,GOLD科学委员会发现,关于慢阻肺的病理生理、诊断、评估和治疗方法有较多新内容出现,因此需要进行全面修订,由写作委员会制订各章节大纲。2016年9月,GOLD科学委员会对各章节进行审阅,然后送至GOLD委员会之外的10名专家处,提出建议并进行修改。GOLD 2017作为第4次全面修订,于2016年11月16日在美国费城举办的GOLD慢阻肺全程管理会议上发布,笔者对GOLD 2017、GOLD 2018、GOLD 2019进行了详细解读[5-7]。
GOLD 2020是GOLD 2017的第3次修改,检索了2018年1月至2019年7月发表的文献,新增文献62篇,其中有4篇来自中国学者的研究,1篇为合作研究,于2019年11月5日发布。
总体来说,GOLD 2020更新幅度较小,与GOLD 2019类似,分为6个章节,GOLD 2020增加起始吸入性糖皮质激素(inhaled corticosteroid,ICS)治疗需要考虑的因素,调整了慢阻肺管理循环图表,改进了非药物治疗的随访,并明确了慢阻肺急性加重的鉴别诊断[8]。2019年11月20日是第18个世界慢阻肺日,主题为「防控慢阻肺,你我携手行(All together, to end COPD)」。本文对GOLD 2020重要更新内容进行简介和解读。
第一章:慢阻肺定义和概述
关键点
• 慢阻肺是一种常见的、可预防和可治疗的疾病,其特征在于持续呼吸道症状和气流受限,这是由于气道和/或肺泡异常所致,通常是由于长期暴露于有害颗粒或气体所引起。
• 最常见的呼吸症状包括呼吸困难、咳嗽和/或咳痰。患者对这些症状的报告可能不足。
• 慢阻肺的主要危险因素是吸烟,但其他环境暴露,如生物燃料暴露和空气污染可能参与发病。除暴露外,个体宿主易感性也会导致慢阻肺的发生,其中包括基因异常、肺发育异常和加速衰老。
• 慢阻肺可伴有呼吸系统症状的急性恶化,称为慢阻肺急性加重。
• 大多数慢阻肺患者存在重大的共患慢性病,可增加慢阻肺的致残率和死亡率。
更新要点
GOLD 2020对于慢阻肺的定义略加修改,强调了宿主因素在慢阻肺发生发展中的作用以及合并症对预后的影响:慢阻肺是一种常见的、可以预防和治疗的异质性疾病,以持续呼吸症状和气流受限为特征,通常是由于暴露于有毒颗粒或气体引起的气道和/或肺泡异常所导致,并受到宿主因素如肺发育异常的影响,合并症可增加慢阻肺的致残率和死亡率。GOLD 2020更新了慢阻肺的疾病负担,指出随着发展中国家吸烟率的升高和高收入国家老龄化加剧,预计慢阻肺的发病率在未来40年仍会继续上升,至2060年可能每年有超过540万人死于慢阻肺及其相关疾病。慢阻肺主要的危险因素是吸烟,GOLD 2020新增影响慢阻肺发生发展的危险因素包括职业暴露、固体燃料、空气污染和铜绿假单胞菌定植。最常见的呼吸症状包括呼吸困难、咳嗽和/或咳痰,这些症状可能被患者漏报。慢阻肺的呼吸症状在某一时期迅速恶化称为慢阻肺急性加重。GOLD 2020新增应该进一步深入研究无气流受限但已出现肺病理改变(如肺气肿)的临床意义。
1.1 职业暴露与慢阻肺
职业暴露因素是慢阻肺重要的、可预防的病因[9,10]。一项基于人群的英国生物样本库队列评价了职业暴露与肺功能的关系,研究人群仅限于从不吸烟者,从而排除了最重要的吸烟混杂因素[11]。在116 375名有完整职业暴露的受试者中,94 551人有肺功能和吸烟信息,发现有6种职业的慢阻肺风险在从不吸烟和无哮喘的人群中增加,包括「雕刻家、画家」「园丁、公园管理员」「食品、饮料、烟草商」「塑料加工者、铸模者」「农民、渔民」「仓库管理员」,并有暴露-效应趋势。对于从不吸烟的人群,应询问他们的职业暴露,并采取针对性的预防策略,以更好地进行疾病管理。
1.2 固体燃料与呼吸系统疾病发生的风险
虽然横断面研究和病例对照研究发现使用固体燃料造成的室内空气污染与慢阻肺发生风险相关,但不同研究得出的结论不一致。既往几乎没有大规模队列研究证据表明固体燃料的使用与主要呼吸系统疾病的住院率和死亡率之间的关系。中国慢性病前瞻性研究项目(简称CKB)是由中国医学科学院与英国牛津大学联合开展的慢性病国际合作项目[12]。GOLD 2020纳入的研究重点关注固体燃料使用与急性和慢性呼吸系统疾病风险之间的关系。研究对277 838名既往无重大慢性病的中国不吸烟者进行了队列研究,在9年的随访中,19 823人首次住院或因重大呼吸系统疾病死亡,包括10 553例慢性下呼吸道疾病(chronic lower respiratory disease,CLRD)、4398例慢阻肺、7324例急性下呼吸道感染(acute lower respiratory tract infection,ALRI)。总体来说,91%的参与者表示经常做饭,52%使用固体燃料。与清洁燃料使用者相比,固体燃料使用者对主要呼吸系统疾病的校正风险比为1.36(95%CI:1.32~1.40),而从固体燃料转向清洁燃料的使用者的校正风险比为1.14(95%CI:1.10~1.17)。使用木材的风险比高于使用煤炭[1.37(95%CI:1.33~1.41)︰1.22(95%CI:1.15~1.29)],长期使用的风险比升高[≥40年,1.54(95%CI:1.48~1.60)︰<20年,1.32(95%CI:1.26~1.39)],但使用通风炉灶人群的风险比低于不使用通风炉灶人群[1.22(95%CI:1.19~1.25)︰1.29(95%CI:1.24~1.35)]。CLRD、慢阻肺和ALRI与固体燃料使用相关的风险比分别为1.47(95%CI:1.41~1.52)、1.10(95%CI:1.03~1.18)和1.16(95%CI:1.09~1.23)。在中国成年人中,使用固体燃料做饭增加患重大呼吸系统疾病和死亡的风险,而改用清洁燃料或使用通风炉灶则降低非吸烟者慢阻肺的发生风险。
1.3 空气污染与慢阻肺
环境空气污染增加了呼吸系统疾病死亡的风险,但有关其对肺功能和慢阻肺影响的证据尚不充分。一项基于人群的英国生物样本库研究分析了303 887名年龄为40~69岁的受试者,发现细颗粒物(particulate matter 2.5,PM2.5)每增加5 μg/m³,第1秒用力呼气容积(forced expiratoryvolume in one second,FEV1)下降(-83.13 ml,95%CI:-92.50~-73.75),用力肺活量(forced vital capacity,FVC)下降(-62.62 ml,95%CI:-73.91~-51.32 ml)。慢阻肺患病率与高PM2.5(OR:1.52,95%CI:1.42~1.62,每增加5 μg/m³)、高可吸入颗粒物(particulate matter 10,PM10)(OR:1.08,95%CI:1.00~1.16,每增加5 μg/m³)和高NO2(OR:1.12,95%CI:1.10~1.14,每增加10 μg/m³)浓度相关,与粗颗粒物无关。男性、低收入和「高危」职业与肺功能下降相关,肥胖、低收入、非哮喘人群与慢阻肺患病相关。这项大型研究证实了环境空气污染与肺功能下降和慢阻肺患病率增加有关[13]。
1.4 铜绿假单胞菌定植增加慢阻肺急性加重和死亡风险
呼吸道感染会诱发慢阻肺急性加重,但在疾病发生发展中的作用尚不明确。铜绿假单胞菌在慢阻肺远期预后中的作用尚不清楚。来自丹麦的一项多区域流行病学研究基于2010年1月1日至2017年10月31日慢阻肺门诊患者的完整数据及相应的微生物学和国家登记资料,共随访22 053例慢阻肺门诊患者,平均随访1082 d(427~1862 d),其中905例(4.1%)患者存在铜绿假单胞菌;在730 d的随访中,铜绿假单胞菌增加了慢阻肺急性加重住院治疗或全因死亡风险(HR:2.8,95%CI:2.2~3.6)和全因死亡风险(HR:2.7,95%CI:2.3~3.4)。在曾被铜绿假单胞菌「定植」的患者中,第一次定植后因慢阻肺急性加重住院的风险增加了1倍。目前正在进行的一项研究应用针对清除铜绿假单胞菌定植的抗生素来降低这种风险[14]。
第二章:诊断和初始评估
关键点
• 存在呼吸困难、慢性咳嗽或咳痰,有复发性下呼吸道感染史和/或有接触该疾病危险因素史的患者均应考虑慢阻肺。
• 肺功能检查是确诊慢阻肺的必备条件。如支气管扩张剂后FEV1与FVC的比值(FEV1/FVC< 0.70),可确定存在持续气流受限。
• 慢阻肺评估的目标在于确定气流受限程度、疾病对患者健康状况的影响和远期不良风险(如慢阻肺急性加重、住院或死亡),从而用以指导治疗。
• 慢阻肺患者常合并心血管疾病、骨骼肌功能障碍、代谢综合征、骨质疏松、抑郁、焦虑、肺癌等慢性病。鉴于这些合并症是影响患者住院和死亡的独立危险因素。因此,对慢阻肺患者均应积极寻找合并症,并给予正确治疗。
更新要点
GOLD 2020慢阻肺的初始评估与GOLD 2019相同,要评价患者的症状、气流受限程度、急性加重发生的风险、合并症,依据症状、急性加重风险将患者分为A―D组。GOLD 2020对于慢阻肺和哮喘的鉴别诊断、生物标志物的临床指导意义进行了更新。
2.1 肺量计正常者慢性呼吸系统症状的预后意义
临床上有些患者存在慢性呼吸系统症状而肺量计正常,对于远期预后的影响需要进一步研究。一项丹麦人群队列研究纳入108 246名年龄为20~100岁的受试者,慢性呼吸系统症状包括呼吸困难、慢性黏液分泌过多、喘息和咳嗽,评估肺量计正常存在慢性呼吸系统症状因气道疾病加重和肺炎而住院的风险以及呼吸系统疾病相关死亡和全因死亡。2003—2018年随访,有52 999人肺量计正常但无慢性呼吸系统症状,30 890人肺量计正常同时伴有慢性呼吸系统症状。随访期间,1037例因呼吸系统疾病加重住院,5743例因肺炎住院,8750例死亡,其中463例死于呼吸系统疾病。与肺量计正常无慢性呼吸系统症状者相比,肺量计正常有慢性呼吸系统症状增加了呼吸系统疾病住院率(校正风险比:1.62,95%CI:1.20~2.18)、肺炎住院率(校正风险比:1.26,95%CI:1.17~1.37)、呼吸道死亡率(校正风险比:1.59,95%CI:1.2~2.06)和全因死亡率(校正风险比:1.19,95%CI:1.13~1.25)。症状数量和预后风险之间存在剂量-反应正相关。在2年的随访中,对于非吸烟者或戒烟者也得到相似结果。对于肺量计正常除外已知气道疾病的人群,应关注慢性呼吸系统症状对预后的不良影响[15]。
2.2 肺功能FEV1/FVC不同阈值与慢阻肺相关的住院和死亡率
根据目前众多的指南,慢阻肺的诊断标准是吸入支气管扩张剂后FEV1/FVC<0.70,然而对于这一固定比值仍存在争议。美国国家心肺血液研究所(National Heart, Lung and Blood Institute,NHLBI)整合了来自4项基于美国人群的队列研究(社区动脉粥样硬化风险研究,心血管健康研究,健康、衰老和体质研究,动脉粥样硬化多种族研究),比较了基线FEV1/FVC<固定阈值范围(0.75~0.65)或<正常值下限(lower limit of normal,LLN)对于慢阻肺相关事件的识别。研究从1987—2000年纳入45~102岁共24 207例受试者,平均随访15年。超过340 757人年随访中,3925例受试者发生慢阻肺相关事件(每1000人年发病密度为11.5),其中包括3563例慢阻肺相关住院和447例慢阻肺相关死亡。与其他固定阈值和LLN相比,FEV1/FVC<0.70在识别慢阻肺相关住院和死亡事件方面差异均无统计学意义,甚至更加准确。上述结果支持使用FEV1/FVC<0.70来识别有慢阻肺风险的个体[16]。
2.3 基于模型评价基层慢阻肺病例发现的长期成本效益
在确定新病例时,使用呼吸筛查问卷对慢阻肺进行系统的病例发现较常规方法更有效、更具成本效益[17]。然而,尚不清楚早期诊断和治疗是否有长期获益[18]。基于马尔可夫决策分析模型,比较针对年龄≥50岁吸烟者的3年系统病例发现计划与英国初级保健目前常规诊疗的成本效益,系统病例发现与常规方法成本效益比每增加额外的质量调整生命年(quality-adjusted life year,QALY)为16 596英镑,78%的成本效益概率为每QALY支付阈值2万英镑。主要驱动因素为初始筛查问卷的应答率和肺量计检查率。尽管治疗效果存在不确定性,但在初级保健中使用筛查问卷对慢阻肺进行定期、系统的病例发现可能具有长期成本效益。进一步了解病例发现患者的自然史及其管理的有效性将增强实施这种方法的信心[17]。
2.4 慢阻肺与哮喘的鉴别
GOLD 2020指出不再将哮喘慢阻肺重叠(asthma-COPD overlap,ACO)作为一种疾病,而是强调慢阻肺与哮喘是两种不同的疾病,同时指出由于两种疾病可能存在某些相似的临床特征(嗜酸粒细胞增高的炎症,支气管舒张试验阳性),同一个体可能同时存在两种疾病。对于一些患者,目前的影像技术和呼吸生理技术较难区别。如果怀疑哮喘和慢阻肺合并存在,药物治疗应首先遵循哮喘指南,但针对患者慢阻肺病情,药物和非药物治疗也是必要的。需要进一步研究慢阻肺和哮喘的临床表型及其内在的发生机制,以便给予个体化的精准治疗。对ACO的认识目前国内外学者仍存在较多争议,本文不做过多阐述。
2.5 生物标志物——中国好声音
北京大学人民医院呼吸与危重症医学科高占成教授团队对血清降钙素原(procalcitonin,PCT)预测慢阻肺急性加重细菌感染和指导抗生素应用进行了荟萃分析,纳入研究中PCT的平均界值为0.35 ng/ml(0.155~0.76 ng/ml)[19]。在13项涉及2571例患者的研究(9项随机对照试验和4项队列研究)中,多数(8/13)为单中心研究。11项研究患者来自急诊和/或呼吸科门诊,2项研究来自ICU。PCT诊断慢阻肺急性加重呼吸道细菌感染的敏感性和特异性分别为0.60和0.76,PCT指导策略可以减少抗生素处方和暴露时间,不影响临床预后指标(如治疗失败、住院天数、再次急性加重频率、总体死亡率)。但对于住ICU患者,PCT在诊断呼吸道感染和减少抗生素暴露方面的应用价值有限。
国内外学者一直希望能够寻找特异的生物标志物辅助临床医生诊断和指导治疗。GOLD 2020增加了Summit研究事后分析,发现血清生物标志物Clara细胞分泌蛋白(Clara cell secretion protein,CC16)、C反应蛋白(C-reactive protein,CRP)、可溶性糖原终产物受体(soluble receptor for advanced glycation end product,sRAGE)、表面活性蛋白D(surfactant protein D,SPD)和纤维蛋白原的系统水平与FEV 1 基线、FEV 1 下降、急性加重或住院无关,纤维蛋白原和CRP与平均随访2.3年的死亡率相关,经过维兰特罗、糠酸氟替卡松或糠酸氟替卡松/维兰特罗治疗3个月后,仅CC16水平下降,其临床意义不明。上述结果使人们对将这些蛋白作为预测慢阻肺结局的生物标志物的临床有效性产生了怀疑 [20] 。
近年来,血嗜酸粒细胞在预测慢阻肺急性加重风险和吸入激素获益中具有重要的价值,血CRP和PCT有助于限制针对慢阻肺急性加重的抗生素的应用,但与生物标志物相比,痰色在判断高细菌负荷方面仍然具有较高的敏感性和特异性。 对于生物标志物的界值,不同研究有不同结果,其应用价值仍需要深入分析。 需要转变研究思路来开发有价值的慢阻肺生物标志物,包括关注特定临床表型中的内源性生物标志物、慢阻肺早期的生物标志物、慢阻肺加重亚型生物标志物和预测药物疗效的生物标志物。
第三章:预防和维持治疗的支持证据
关键点
• 戒烟是关键。药物治疗和尼古丁替代疗法确实提高了长期戒烟率。由医疗专业人员提供的立法禁烟和咨询提高了戒烟率。
• 目前,电子烟作为戒烟辅助手段的有效性和安全性尚不确定。
• 药物治疗可减轻慢阻肺症状,降低急性加重发生频率和严重程度,改善患者健康状况和运动耐力。
• 每种药物治疗方案均应根据症状的严重程度、急性加重的风险、不良反应、合并症、药物的可用性和成本以及患者的反应、偏好和使用各种药物递送装置的能力进行个体化指导。
• 需要定期评估吸入技术。
• 流感疫苗可降低下呼吸道感染的发生率。
• 肺康复可以改善症状、生活质量和日常活动中的身心参与。
• 在严重静息慢性低氧血症患者中,长期氧疗可提高其生存率。
• 对于稳定期慢阻肺患者和静息或运动引起的中度去饱和,不应常规进行长期氧疗。但是,在评估患者对补充氧气的需求时,必须考虑患者的个体因素。
• 对于有严重慢性高碳酸血症和急性呼吸衰竭住院史的患者,长期无创通气可降低死亡率并防止再次住院。
• 对于某些晚期难治性肺气肿患者,最佳治疗可能是外科手术或支气管镜介入治疗。
• 姑息治疗是控制晚期慢阻肺症状的有效方法。
更新要点
慢阻肺的基础药物治疗是吸入支气管扩张剂,临床医生需要识别哪些患者起始治疗就需应用含有吸入激素的联合治疗,GOLD 2020增加了强烈支持、考虑使用和反对使用吸入激素的证据。稳定期慢阻肺支气管扩张剂、抗炎药物的使用原则同GOLD 2019,并增加了关于慢阻肺药物治疗、非药物治疗的更多循证医学证据。
3.1 慢阻肺起始治疗包含吸入激素的联合治疗需要考虑的因素[21](图1)。

3.2 电子烟、戒烟与肺损伤
电子烟(e-cigarettes)可以传递尼古丁并减轻烟草戒断症状,许多吸烟者用它来帮助戒烟。一项随机对照优效性试验调查了在帮助吸烟者戒烟方面,电子烟是否较尼古丁贴片更有效,主要终点是在6个月时经生化验证的持续戒断(呼出气一氧化碳测量值<10 ppm)。在6个月时,尼古丁电子烟的戒断率为7.3%,尼古丁贴片的戒断率为5.8%,安慰剂电子烟的戒断率为4.1%。电子烟在烟草控制中的地位存在不确定性,迫切需要进行更多的研究,以明确其在个体和人群层面的总体效益和危害[22]。
迄今为止,英国戒烟服务组织一直不愿将电子烟纳入他们的治疗方案。一项随机对照研究发现尼古丁替代治疗(nicotine replacement therapy,NRT)组参与者1年的戒烟率为9.9%,电子烟组为18.0%,电子烟组参与者在所有时间点均具有更高的有效戒烟率。与NRT组相比,电子烟组参与者在戒烟尝试的最初4周内表现出明显更好的依从性和更少的吸烟冲动,并给予分配给他们的产品更优的评级。电子烟组参与者在1年后的咳嗽和痰量均明显低于NRT组,电子烟较NRT花费更少的医疗资源,并且具有更高的戒烟率,所以电子烟的使用更具有成本效益。对于寻求帮助的吸烟者来说,如果英国戒烟服务组织提供电子烟启动包,可能会提高它们的戒烟成功率和成本效益[23]。
值得关注的问题是,GOLD 2020新增电子烟相关肺损伤,报道了4种与电子雾化产品相关的影像类型,包括急性嗜酸粒细胞性肺炎、弥漫性肺泡损伤、机化性肺炎和类脂性肺炎[24]。通过临床和病理调查,确定了巨细胞间质性肺炎、过敏性肺炎和弥漫性肺泡出血的类型。美国疾病预防控制中心食品药品监督管理局、州政府和其他临床及公共卫生合作伙伴携手调查电子烟产品相关的肺部疾病的爆发情况[25]。至2019年10月15日,已报道有1479例肺部疾病和33例死亡与使用电子烟产品有关。所有患者均有使用电子烟或蒸汽产品史,多为既往不吸烟的青少年或年轻人,大多数患者有使用四氢大麻酚产品史,另外其他包括大麻油、维生素E或其他芳香剂或添加剂,尤其是街头或非官方来源的产品,与本次暴发中的大多数病例有关。2019年7月,威斯康星州卫生服务部和伊利诺伊州公共卫生部收到了与使用电子烟(也称电子雾化产品)有关的肺部疾病报告,将病例定义为在症状出现前90 d内报告使用电子烟设备和相关产品,并在影像学上表现为肺部浸润,共有53例患者,其中83%为男性,患者的中位年龄为19岁;大部分患者表现为呼吸系统症状(98%)、胃肠道症状(81%)、全身症状(100%)。所有患者胸部影像均为双侧浸润,94%的患者住院,32%的患者接受插管和机械通气,1例死亡;报告的产品和设备种类繁多,84%的患者使用的电子烟设备中含有四氢大麻酚产品。来自伊利诺伊州的综合征监测数据显示,2019年6月至8月与严重呼吸系统疾病相关的月平均访视率是2018年同期的2倍。临床表现相似。虽然使用电子烟导致肺损伤的特征尚未确定,但此类疾病代表了一种新的临床综合征或综合征,病程较长,激素治疗可以改善患者临床症状。需要开展更多的工作来描述此类疾病的病理生理学,并明确病因。
3.3 茶碱联合吸入激素
茶碱在慢阻肺患者中的应用非常广泛,尤其是在中国患者中。研究表明,较低的血浆茶碱浓度(1~5 mg/L)可增强皮质类固醇的抗炎作用,发表于JAMA的TWICS研究探讨在慢阻肺患者ICS中添加小剂量茶碱的有效性,这项研究包括了121个英国初级和二级医疗机构的1578例患者,入选患者基线用药包括ICS,既往1年至少有2次需要应用抗生素和/或口服糖皮质激素治疗的急性加重,低剂量茶碱组(200 mg,每天1~2次)发生慢阻肺急性加重事件1727个(平均每年2.24个,95%CI:2.10~2.38),安慰剂组1703个(平均每年2.23个,95%CI:2.09~2.37)。茶碱组患者的不良事件包括心脏反应(心悸、心动过速等)、胃肠道反应(恶心、呕吐、腹痛、腹泻等)和头痛。在ICS治疗的慢阻肺高风险人群中,添加低剂量茶碱并未减少慢阻肺急性加重的发作次数[26]。
3.4 三联治疗
既往以死亡率为主要研究终点的大规模研究未能发现丙酸氟替卡松/沙美特罗、糠酸氟替卡松/维兰特罗降低慢阻肺死亡率。三联吸入治疗的疗效优势多在症状严重、中度至极重度气流受限、并有频繁和/或严重急性加重病史的慢阻肺患者中。最新研究表明,与长效抗胆碱能药物(long-acting muscarinic antagonists,LAMA)、长效β2受体激动剂(long-acting β2-agonists,LABA)/LAMA或LABA/ICS相比,使用LABA/LAMA/ICS三药联合治疗可降低死亡率[27]。一项事后分析纳入3项为期52周对重度至极重度慢阻肺患者的研究,发现与不含ICS的治疗相比,含有ICS的药物治疗发生急性加重致死性事件的风险有所降低(HR:0.71,95%CI:0.50~1.02)。另一项在52个州进行的为期52周的Ⅲ期临床研究发现,在有症状和有急性加重史的慢阻肺患者中,含有ICS的治疗方案与双支气管扩张剂组相比,可降低全因死亡风险(ICS/LABA/LAMA︰LABA/LAMA,HR:0.58;ICS/LABA︰LABA/LAMA,HR:0.61)[28]。与既往试验不同,最新研究针对的是呼吸系统症状加重的患者,以及有频繁和/或严重急性加重病史的患者,其中大多数在研究入组前已接受三联或LABA/ICS治疗。新增的KRONOS研究进一步证明了固定三联疗法在慢阻肺患者中的获益[29]。另外,GOLD 2020还提到,如果此类患者达到呼吸功能稳定后考虑逐步ICS降级治疗时,应谨慎。
(1)KRONOS研究[29]:
该研究是一项双盲、平行组、多中心、Ⅲ期随机对照试验,比较布地奈德/格隆溴铵/福莫特罗共悬浮递送技术三联法与双联疗法对慢阻肺中的效果。从加拿大、中国、日本和美国的215个中心筛选了3047例患者,并随机分配1902例患者接受布地奈德/格隆溴铵/福莫特罗气雾剂(BGF MDI)320/18/9.6 μg、格隆溴铵/福莫特罗气雾剂(GFF MDI)18/9.6 μg、布地奈德/福莫特罗气雾剂(BFF MDI)320/9.6 μg或布地奈德/福莫特罗干粉(BUD/FORM DPI)400/12 μg。在24周内,三联治疗显著改善FEV1 AUC 0~4(与BFF MDI比较,增加了104 ml,95%CI:77~131;与BUD/FORM DPI比较,增加了91 ml,95%CI:64~117)。三联治疗中-重度急性加重的年发生率低于双支气管扩张剂(0.46︰0.95),接受三联治疗首次发生中-重度急性加重的患者比例较接受双支气管扩张剂治疗患者下降41%。外周血嗜酸粒细胞的水平高低与含有吸入激素的联合治疗方案改善肺功能、减少急性加重相关,嗜酸粒细胞>150/μl,患者肺功能改善,嗜酸粒细胞>75/μl,患者急性加重次数减少。最常见的不良事件是鼻咽炎和上呼吸道感染,肺炎发病率较低。在GFF MDI组中有2例与治疗相关的死亡。无论是否有加重病史,BGF MDI治疗效果好,耐受性好。
(2)IMPACT研究[28]:
IMPACT是一项为期52周的Ⅲ期、随机、双盲、平行组、37个国家的多中心研究,比较了糠酸氟替卡松/乌美溴铵/维兰特罗(FF/UMEC/VI)与乌美溴铵/维兰特罗(UMEC/VI)或糠酸氟替卡松/维兰特罗(FF/VI)的疗效、安全性和耐受性。研究中FF/UMEC/VI组死亡98例(2.36%),FF/VI组死亡109例(2.64%),UMEC/VI组死亡66例(3.19%)。与FF/VI组相比,FF/UMEC/VI组死亡风险下降11%(HR:0.89,95%CI:0.67~1.16),与UMEC/VI组相比,三联治疗死亡风险下降28%(HR:0.72,95%CI:0.53~0.99)。FF/UMEC/VI三联疗法降低有症状和有急性加重病史的慢阻肺患者的全因死亡风险的效果优于双支气管扩张剂。
3.5 双支气管扩张剂还是ICS/LABA?
对7项关于双支气管扩张剂乌美溴铵/维兰特罗(UMEC/VI)62.5/25 μg治疗慢阻肺的有效性和安全性研究进行荟萃分析,对照药物为噻托溴铵(TIO)18 μg或丙酸氟替卡松/沙美特罗(FP/SAL)250/50 μg。与TIO和FP/SAL相比,UMEC/VI在不同年龄和不同气流受限严重程度亚组中均能改善患者肺功能,特别是对老年、重度/极重度气流受限患者安全有效[30]。
在真实临床实践中,是选择双支气管扩张剂LABA/LAMA还是吸入激素联合支气管扩张剂ICS/LABA?英国55岁以上的慢阻肺患者队列研究发现,在慢阻肺治疗的真实临床实践中,LABA/LAMA在预防慢阻肺急性加重方面似乎与ICS/LABA同样有效,然而,LABA/LAMA较少发生重症肺炎[31]。
3.6 生物制剂
贝那利珠单抗是一种白细胞介素-5(interleukin-5,IL-5)受体α亚基单克隆抗体,其预防中度至极重度慢阻肺患者急性加重的有效性和安全性尚不清楚。在GALATHEA和TERRANOVA研究中,纳入尽管接受了基于指南的吸入治疗,但仍频繁加重的慢阻肺患者,根据嗜酸粒细胞计数分为≥220/μl和<220/μl。随机分配接受贝那利珠单抗(GALATHEA研究30 mg或100 mg,TERRANOVA研究10 mg、30 mg或100 mg)或安慰剂治疗,每8周给药(前三剂每4周给药)。在中度至极重度慢阻肺患者中,有频繁中度或重度加重病史,且血嗜酸粒细胞计数≥220/μl,与安慰剂相比,贝那利珠单抗并未降低慢阻肺患者年急性加重次数,今后应继续从临床特征和生物标志方面来明确哪些患者可以从抗IL-5受体抗体治疗中获益[32]。
近期的4项大型Ⅲ期研究验证了抗IL-5单克隆抗体美泊利单抗[33]和抗IL-5受体-α抗体贝那利珠单抗[32]在即使采取高强度吸入疗法但近期仍发生急性加重且外周血存在嗜酸粒细胞炎症的重度慢阻肺患者中的有效性,研究显示:使用单克隆抗体的患者重度急性加重的发生率减少了15%~20%,但疗效并不总是具有统计学意义,且在不同的研究和实验剂量之间存在差异。此外,单克隆抗体对患者的FEV1和生活质量并无改善,且其疗效与患者外周血嗜酸粒细胞无关。一项关于美泊利单抗的事后研究显示,血嗜酸粒细胞相关疗法在既往使用口服糖皮质激素治疗急性加重的患者中具有更加明显的疗效,提示单克隆抗体可能对需要经常口服激素治疗的血嗜酸粒细胞性慢阻肺患者有效,但仍需更多临床试验证实。
3.7 维生素D
维生素D预防慢阻肺急性加重的研究结果存在不一致。一项荟萃分析纳入了4项随机对照研究共560例受试者,维生素D的服用方法有3种:每月给予1次2.5 mg(100 000 IU),每2个月给予1次3 mg(120 000 IU),或每天1次口服30 μg(1200 IU)。补充维生素D安全且有效地降低了基线25-羟基维生素D水平<25 nmol/L的患者中/重度慢阻肺急性加重的比例(校正发生率比值:0.55,95%CI:0.36~0.84),但未降低基线25-羟基维生素D水平较高的患者中/重度慢阻肺加重的比例(校正发生率比值:1.04,95%CI:0.85~1.27)。临床上可通过检测25-羟基维生素D水平给予个体化补充维生素D[34]。
3.8 血嗜酸粒细胞计数与慢阻肺
慢阻肺患者存在气道嗜酸粒细胞炎症,ICS可以短期获益。英国2项平行随机对照研究的二次分析纳入3177例年龄40岁以上的受试者,有66%的患者基线嗜酸粒细胞≥2%。与单纯使用维兰特罗相比,使用氟替卡松/维兰特罗的患者急性加重发生率降低,其中基线嗜酸粒细胞计数≥2%且<4%的患者降低24%,≥4%且<6%的患者降低32%,≥6%的患者降低42%。进一步验证了血嗜酸粒细胞计数可以作为评价慢阻肺患者ICS长期疗效的生物标志物[35]。
3.9 黏液溶解剂和抗氧化剂
慢性支气管炎或慢阻肺患者可能会出现反复加重的症状,如痰量增加或脓性痰,或二者兼有,改善咳痰可能减轻慢阻肺加重程度。一项基于38项临床研究的荟萃分析显示,应用的黏液溶解剂包括N-乙酰半胱氨酸、羧甲司坦、厄多司坦、氨溴索,时间2个月至3年,纳入10 377例受试者,结果发现:对于慢性支气管炎或慢阻肺的患者,使用黏液溶解剂治疗可使急性加重的可能性(每月致残天数和住院天数)略有降低,但并未增加不良事件。这种作用强弱与黏液溶解剂的类型或剂量、慢阻肺的严重程度、急性加重史均无关,长期应用较短期应用获益少,对肺功能或生活质量影响有限,不能确定是否对死亡率有影响。不同研究之间的异质性影响研究结局[36]。
越来越多的研究关注抗氧化剂在预防慢阻肺急性加重方面的作用。一项网络荟萃分析评价了厄多司坦(600 mg/d)、羧甲司坦(1500 mg/d)和N-乙酰半胱氨酸(1200 mg/d)对慢阻肺急性加重的影响,纳入的7项随机对照试验中提取了2753例慢阻肺患者的数据,黏液溶解剂/抗氧化剂显著降低慢阻肺急性加重的风险(RR:0.74,95%CI:0.68~0.80)。网络荟萃分析提供了如下有效性等级:厄多司坦>羧甲司坦>N-乙酰半胱氨酸。厄多司坦可显著缩短慢阻肺急性加重的病程,且仅有厄多司坦降低了至少1次慢阻肺急性加重的发生风险和因慢阻肺急性加重住院的风险,但厄多司坦仍需在相同的慢阻肺人群中进一步研究[37]。
基于上述证据,GOLD 2020在慢阻肺常用的维持药物黏液溶解剂中除厄多司坦外,增加了N-乙酰半胱氨酸和羧甲司坦。
3.10 吸入装置
正确使用定量气雾剂(metered-dose inhaler,MDI)对促进有效的肺部药物沉积至关重要。基于使用MDI的美国成人阻塞性肺疾病患者的荟萃分析显示,86.7%的患者存在至少1种装置使用错误,76.9%的患者装置使用错误率超过20%。研究中最常见的错误是未能:①完全呼气,在吸入前远离吸入器(65.5%);②屏气5~10 s(41.9%);③缓慢深吸(39.4%);④吸入后呼气(35.9%);⑤使用前摇匀吸入器(34.2%)。因此,对患者进行持续的教育,并考虑使用替代设备来减少错误非常必要[38]。
随着时间的推移,患者的吸入技术是否有所改进?一项基于144篇报道共54 354例受试者的研究发现,在最常见的MDI使用错误中,协调性占45%,吸气速度和/或深度占44%,吸气后未屏气占46%。常见的干粉吸入剂(dry powder inhalers,DPI)使用错误中,准备不正确占29%,吸入前未完全呼气占46%,吸入后未屏气占37%。不正确的吸入技术经常发生,并且在过去的40年中没有改善,这表明迫切需要新的教育和吸入装置来改善目前存在的问题[39]。
3.11 肺康复与健康教育
慢阻肺患者体力活动增加可以减少住院和死亡,肺康复能够增加体力活动,最简单有效的方法就是步行训练。一项研究在12个月的无监督步行训练中增加持续反馈(包括电话指导、通过计步器监测指标、进阶式目标设定等),观察对慢阻肺患者体力活动的影响,受试者被随机分为干预组和常规组。通过SenseWear Pro3腕带在基线、训练2个月后、训练12个月后连续测定7 d,用每天能量消耗(kcal)、每天步数和在不同强度日常活动的时间表示体力活动的大小,分为静息(代谢当量≥1.0且<1.5 METs)、轻度体力活动(≥1.5且<3.0 METs)、中度体力活动(≥3.0且<6.0 METs)、重度体力活动(≥6.0 METs)。从基线到方案完成的任何体力活动在组间均无显著差异。在12个月的无监督步行训练中,持续的反馈在改善体力活动方面并不比没有反馈更有效,因此需要研究可以有效提高体力活动的方法[40]。
慢阻肺患者常合并焦虑、抑郁,需要评价肺康复在其中的作用。一项荟萃分析共纳入11项研究734例受试者,采用医院焦虑抑郁量表焦虑亚量表(hospital anxiety and depression scale-anxiety subscale,HADS-A)、汉密尔顿焦虑量表(Hamilton anxiety scale,HAM-A)、症状自评量表焦虑亚量表(symptomcheck-list-90-R-anxiety subscale,SCL-90-R-A)、状态-特质焦虑调查表(state-trait anxiety inventory,STAI)评价焦虑,采用医院焦虑抑郁量表抑郁亚量表(hospital anxiety and depression scale-depression subscale,HADS-D)、汉密尔顿抑郁量表(Hamilton depression scale,HAM-D)、症状自评量表抑郁亚量表(symptom check-list-90-R- depression subscale,SCL-90-R-D)、贝克抑郁量表(Beck depression inventory,BDI)评价抑郁。肺康复时间至少4周以上,与常规治疗相比,肺康复对焦虑症状有中等程度改善(标准化均数差:-0.53;95%CI:-0.82~-0.23),明显改善抑郁症状(标准化均数差:-0.70;95%CI:-0.87~-0.53),康复时间不论是≤8周还是>8周均可改善焦虑和抑郁。因此,肺康复对焦虑和抑郁症状有显著的临床获益[41]。
肺康复场所是居家康复还是门诊督导康复?一项倾向配对队列研究比较了154例慢阻肺患者居家康复和门诊督导康复的效果。居家康复为8周方案,包括每周个体化运动至少3 d、患者教育,每周电话访视、有氧训练(主要是步行),同时进行上下肢锻炼。门诊督导康复包括8周在健身房或社区进行的康复,每周进行2次督导训练和至少1次未督导的居家康复。与门诊督导康复相比,居家康复对患者运动能力的改善较小,但在生活质量方面有类似的改善。居家康复不能有效替代门诊督导康复[42]。
慢阻肺患者的自我管理与改善预后有关,近年来受到越来越多的关注,但目前尚缺乏有效可行的干预方法。纳入215例因慢阻肺急性加重住院后随访的患者,由呼吸治疗师或护士提供健康教育,出院后至少与患者面访1次,持续2 h,随后前3个月每周1次电话随访,以后每月1次电话随访,制订行动计划,增强患者的自我管理能力,采用慢性呼吸系统疾病问卷(chronic respiratory questionnaire,CRQ)评估慢阻肺患者的自我管理能力(CRQ包括4个方面的内容:呼吸困难、疲乏、精神状态、自我管理能力)。从基线至6个月,干预组患者CRQ评分增加了0.58分,对照组增加了0.17分,随访12个月,两组患者CRQ总分比较差异无统计学意义。干预组和对照组分别有55%和38%的患者CRQ自我管理能力评分增加了0.5分以上,健康教育是引起CRQ发生有临床意义改善的独立预测因素。健康教育改善了患者的自我管理能力[43]。
3.12 补充抗氧化剂和营养支持
慢阻肺患者的骨骼肌功能障碍不能通过运动训练完全逆转,抗氧化剂对肌肉的自我平衡和适应训练至关重要。随机给予64例住院后行肺康复的慢阻肺患者口服抗氧化剂补充治疗(α-生育酚30 mg/d,抗坏血酸盐180 mg/d,葡萄糖酸锌15 mg/d,硒蛋氨酸50 μg/d),并联合肺康复(24次中等强度的运动训练),28 d后评估患者肌肉耐力、氧化应激和呼吸康复效果,81%的患者至少存在一种抗氧化剂缺乏,肺康复抗氧化剂组虽然肌肉耐力没有增加,但α-生育酚/γ-生育酚和硒水平、肌肉力量和血清总蛋白水平显著升高,Ⅰ型纤维比率有增加趋势,肌肉无力比率由30%下降至10.7%,表明抗氧化剂补充(维生素C和E,锌和硒)在肺康复过程中具有潜在的「附加」作用[44]。
营养支持能否增加肺康复的短期和长期效果?来自荷兰的NUTRAIN研究将81例中度慢阻肺合并肌肉萎缩患者随机分为营养组(富含亮氨酸、维生素D和多不饱和脂肪酸)或安慰剂组(阶段1),并进行为期4个月的肺康复,之后再进行8个月的非盲维持(阶段2),营养组患者每天接受营养补充和营养咨询,继续随访3个月(阶段3)。干预12个月后,两组患者股四头肌肌肉力量和踏车耐受时间比较均无统计学差异,但营养组患者运动能力较安慰剂组每天增加1030步,营养组患者体重增加和安慰剂组体重减轻的组间差异在干预12个月后为1.54 kg,医院焦虑抑郁量表(hospital anxiety and depression scale,HADS)下降1.92分,15个月后每个QALY的成本为16 750欧元。对中度慢阻肺肌肉萎缩的患者进行营养干预,并不能提高长期运动训练对体能的影响,但可以改善患者血浆中补充的营养物质水平、总体重、运动能力和一般健康状况,相对于疾病造成的高负担,此部分增加的费用是可以接受的[45]。
3.13 氧疗
约47%的慢阻肺患者在步行运动试验中出现血氧饱和度低于90%,不能耐受高强度训练,从而限制了运动效果。虽然补充氧气可以改善氧饱和度,但其对运动训练的影响尚不清楚。一项研究纳入111例血氧饱和度静息状态下正常但运动后下降的慢阻肺患者,随机分为补充氧气组和对照组,在8周监测的运动训练中,补充氧气组患者的运动耐力、生活质量与对照组比较均无显著学差异,两组患者的运动耐力和生活质量均较运动前有所改善。本研究的临床意义在于,患者从运动训练中获益并不需要补充氧气来纠正氧饱和度降低。因此,对于慢阻肺患者,他们在休息时血氧饱和度正常,但在运动过程中出现血氧饱和度下降,可以在没有补充氧气的地方提供运动训练计划,便于在社区开展肺康复计划[46]。
3.14 介入治疗
对于重度肺气肿患者需要寻找创伤较小的方法改善患者的健康状况。EMPROVE研究是一项来自美国的多中心、开放、随机、对照研究,纳入172例年龄≥40岁、重度异质性肺气肿患者,评估SPIRATION支气管活瓣系统(spiration valve system,SVS)的有效性和安全性。与对照组相比,SVS组患者在充分内科治疗的基础上,可以显著改善FEV1、过度充气、肺总量、呼吸困难和生活质量,安全性好,最常见的不良事件是严重气胸。该研究提出用定量CT方法评估靶叶肺气肿特征从而明确患者是否适合行支气管镜肺减容术[47]。
LIBERATE研究评估Zephyr支气管活瓣(endbronchial valves,EBV)治疗几乎没有侧支通气的慢阻肺患者12个月的有效性和安全性,共纳入190例患者,随访12个月,使用Zephyr EBV患者的肺功能、运动耐力、呼吸困难和生活质量均发生具有临床意义的改善;不良事件为气胸,从手术至术后45 d的发生率为26.6%,4例患者在45 d内死亡。在目标叶侧支通气很少甚至没有的患者中,Zephyr EBV安全有效[48]。
第四章:稳定期慢阻肺的管理
关键点
• 稳定期慢阻肺的管理策略应主要基于症状的评估和未来急性加重的风险。
• 应大力鼓励和支持所有吸烟者戒烟。
• 主要治疗目标是减轻症状和降低未来急性加重的风险。
• 管理策略包括药物和非药物干预。
更新要点
GOLD 2020药物治疗的初始治疗原则和随访管理与GOLD 2019相同。将慢阻肺治疗推荐方案细化为诊断、初始评估、初始管理、回顾、调整。起始治疗在缺乏高质量证据的情况下,按照ABCD分组进行药物推荐。随访治疗不再依据ABCD分组推荐用药,而是依据可治疗的特征将患者分为呼吸困难和急性加重两类进行治疗调整,对于急性加重次数多的患者同时考虑其血嗜酸粒细胞数量,推荐相应含ICS的治疗。GOLD 2020增加了非药物治疗,尤其是肺康复。
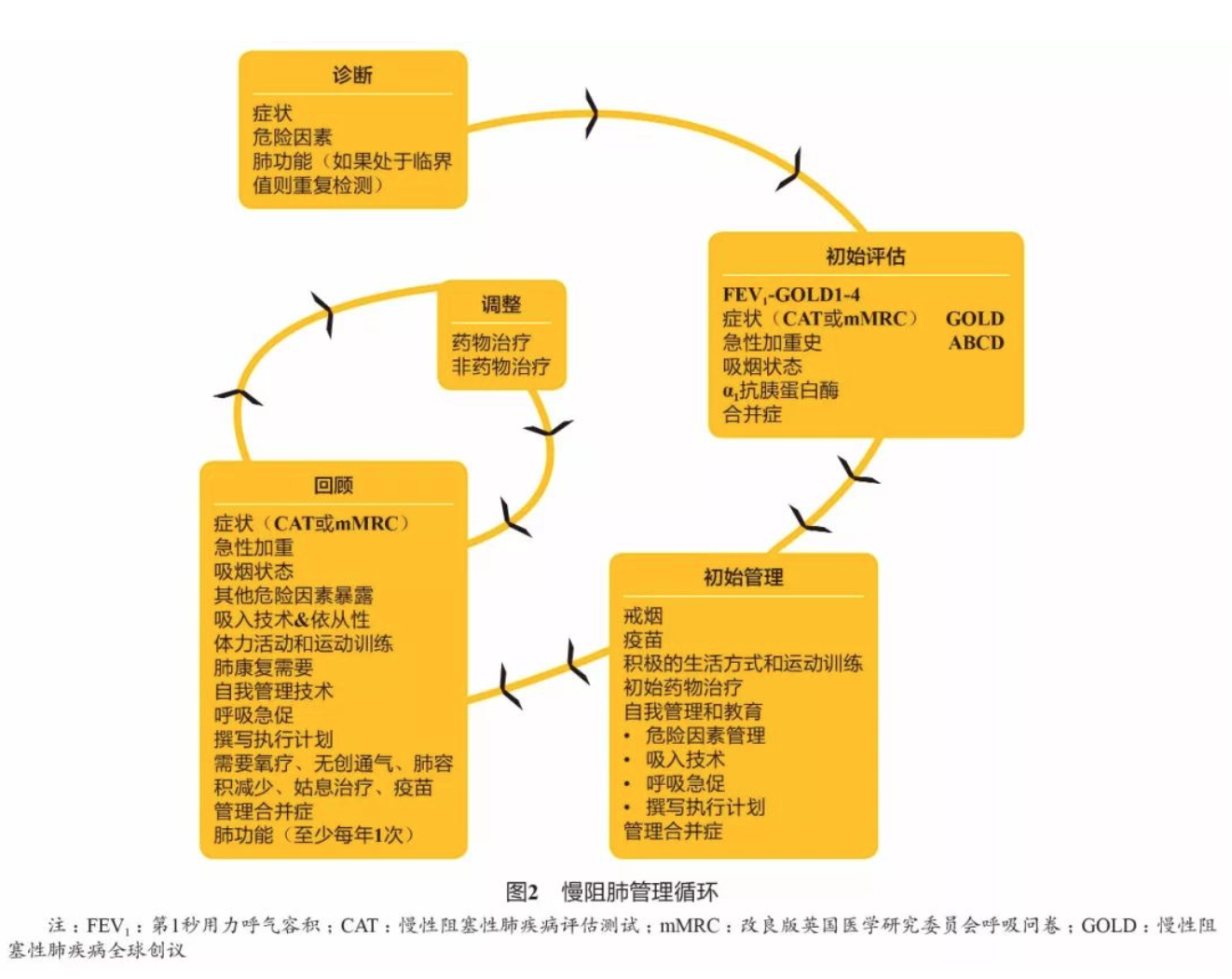
4.1 慢阻肺的管理循环
GOLD 2020第一次纳入了完整的慢阻肺管理流程图,包括初始评估、初始管理、随访评估和随访治疗调整,提升了指南的临床可用性。该管理流程是基于患者症状严重程度和急性加重风险制订的,临床医生可根据患者病情进行升级或降级治疗(图2)。这些管理建议结合了随机对照试验证据和专家的临床经验用以支持临床决策。
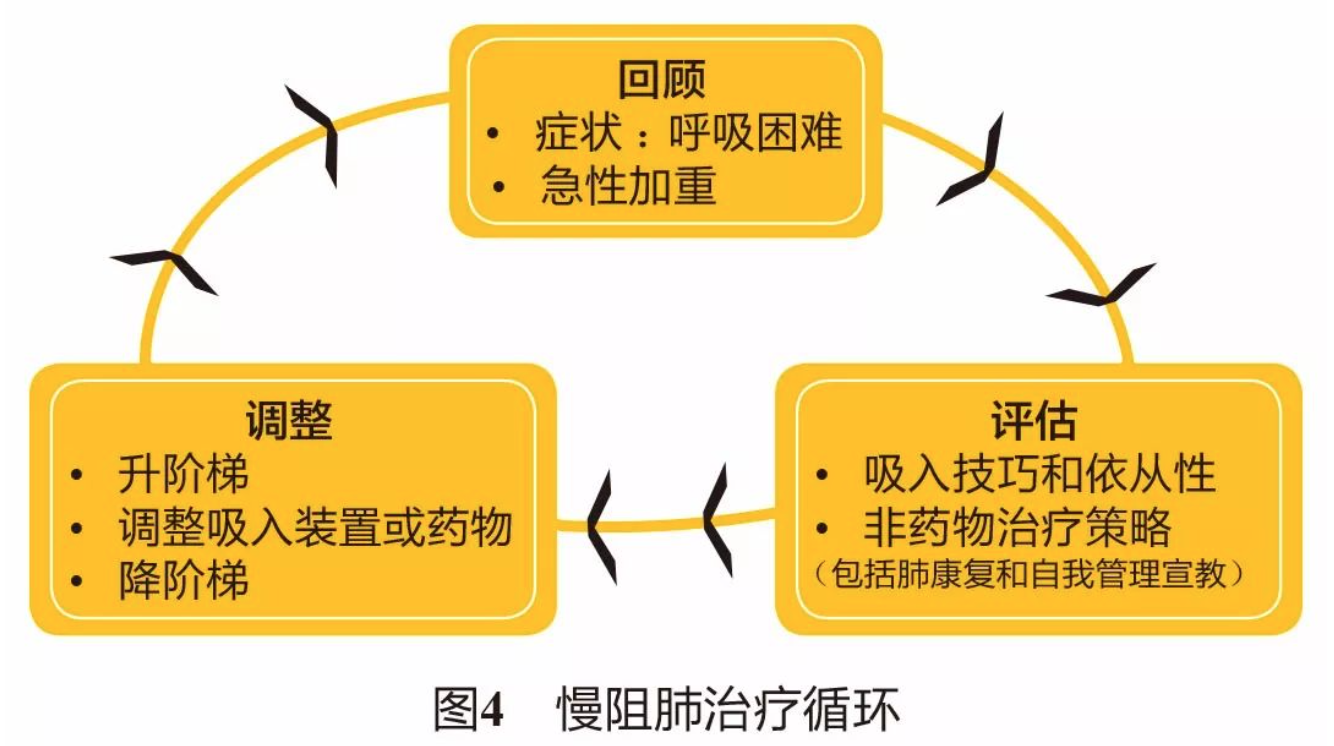
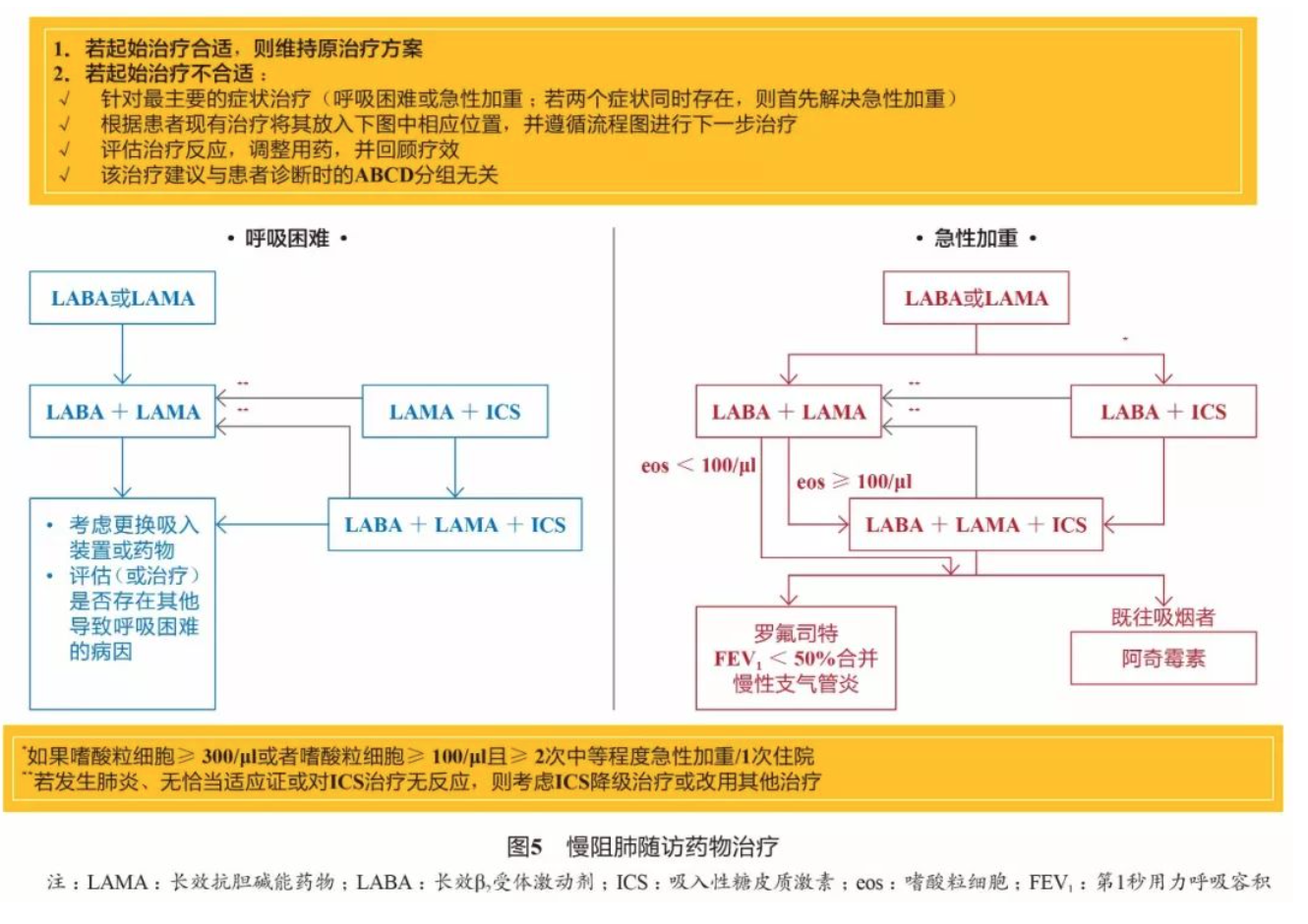
4.2 慢阻肺起始药物治疗和随访期药物治疗 同GOLD 2019(图3、图4、图5)。

4.3 慢阻肺非药物治疗
随访时应根据患者的可治疗目标进行非药物治疗措施的调整,GOLD 2020首次加入了非药物治疗随访措施调整表(图6)。

4.4 体力活动
基于网络技术的干预措施可以提供便捷可行的方法以加强锻炼的自我成就感,并教育和激励人们努力改变,使生活方式更健康。一项基于网络体力活动干预,纳入了112例患有慢阻肺并且自我成就感降低的美国退伍军人,将其随机分为对照组(单独使用计步器)和干预组(计步器+通过网络媒介的体力活动干预)。在对照组,锻炼的自我成就感高与体力活动改善明显相关,然而在干预组,体力活动的改善与基线自我成就感的高低无关。在身体健康和运动能力方面的结果与之相似。因此,提示采用互联网媒介的干预措施可使自我成就感降低的慢阻肺患者在增加体力活动方面获益[49]。
4.5 肺康复项目
2017年2月,世界卫生组织发布的「康复2030」行动呼吁将便捷的和可负担的康复项目作为卫生服务的基本组成部分,声明其对实现可持续发展目标3「良好健康与福祉」至关重要。虽然肺康复在改善健康、福祉和经济生产力方面具有明显的潜力,但仍需要研究来发展适合中低收入国家文化背景的肺康复;对于不同的文化和国家,肺康复项目应不同[50]。
第五章:慢阻肺急性加重的管理
关键点
• 慢阻肺急性加重定义为导致额外治疗的呼吸系统症状严重恶化。
• 由于慢阻肺症状具有非特异性,应考虑相关的鉴别诊断。
• 慢阻肺急性加重可由多种因素引起,最常见的原因是呼吸道感染。
• 慢阻肺急性加重的治疗目标是尽量减少当前急性加重的负面影响,并预防随后的事件。
• 单用短效β2受体激动剂,联用或不联用短效抗胆碱能药物,推荐为急性加重的初始治疗。
• 长效支气管扩张剂的维持治疗应在出院前尽快开始。
• 全身性糖皮质激素可改善肺功能和氧合作用,并缩短恢复时间和住院天数,治疗天数不应超过5~7 d。
• 抗生素治疗可以缩短恢复时间,降低早期复发、治疗失败和住院天数增加的风险,治疗天数应为5~7 d。
• 不建议使用甲基黄嘌呤,因为会增加不良反应。
• 无创机械通气是慢阻肺急性呼吸衰竭患者的首选通气方式,因其可以改善气体交换,减少呼吸功和插管,缩短住院天数,提高生存率,无绝对禁忌证。
• 对急性加重进行随访,应采取适当措施预防急性加重。
更新要点
慢阻肺急性加重具有异质性,常伴有气道炎症加重、黏液高分泌、气体陷闭,临床症状包括呼吸困难、痰量增多、脓性痰、咳嗽、喘息等。在慢阻肺的管理中要关注急性加重,GOLD 2020增加了慢阻肺急性加重的鉴别诊断、诱发因素、生物标志物指导的抗生素和激素治疗。
5.1 慢阻肺急性加重的鉴别诊断
慢阻肺患者存在多种合并症也会加重呼吸道症状,因此需要除外其他原因才能诊断慢阻肺急性加重。主要鉴别诊断见图7。

5.2 减少慢阻肺急性加重频率的干预措施
慢阻肺急性加重的治疗目标是减轻本次急性加重造成的影响,同时采取有效措施预防下一次急性加重。减少急性加重频率的干预措施是在GOLD 2019的基础上增加了补充维生素D,但仅限于维生素D重度缺乏(<10 ng/ml或<25 nmol/L)患者(图8)。

5.3 大气污染与慢阻肺急性加重住院——中国好声音
短期暴露于PM2.5与慢阻肺急性加重所致住院增加和慢阻肺死亡率增加相关。一项由首都医科大学附属北京朝阳医院童朝晖教授团队发起的研究,纳入自2013年1月18日至2017年12月31日北京市记录的161 613例因慢阻肺急性加重而住院的患者。研究发现,此5年间SO2平均环境浓度降低了68%,PM2.5平均环境浓度降低了33%。每增加1个四分位距污染物浓度,当天因慢阻肺急性加重所致的住院风险增加,各污染物RR分别为:PM10为1.029(95%CI:1.023~1.035),PM2.5为1.028(95%CI:1.021~1.034),PM粗颗粒为1.018(95%CI:1.013~1.022),NO2为1.036(95%CI:1.028~1.044),SO2为0.019(95%CI:1.013~1.024),CO为1.024(95%CI:1.018~1.029),以及在温暖的季节(5~10月)O3为1.027(95%CI:1.010~1.044)。女性和≥65岁患者较男性和<65岁患者更易受到这些污染物对住院风险的影响。2013年由于PM2.5污染超标导致的慢阻肺急性加重为12 679例,2017年为7377例。该研究说明,尽管整体空气质量有所改善,但北京市急性空气污染事件的增加与慢阻肺急性加重住院人数的增加显著相关。严格的空气污染控制政策对于降低慢阻肺发病率是重要和有效的,需要长期的多维政策来保障[51]。
5.4 寒流与慢阻肺预后——中国好声音
慢阻肺死亡率或因天气寒冷而升高。由暨南大学环境与气候研究院杨军教授团队、南方医科大学公共卫生学院生物统计系器官衰竭防治国家重点实验室欧春泉教授团队和中国疾病预防控制中心传染病预防控制所刘起勇教授团队联合发起的研究,收集2007—2013年全国31个省会城市的日死亡率和气象数据。一般来说,死亡风险在暴露于寒流3~6 d后增加至最大,然后在接下来的3周内趋于平稳,寒流最大效应预估在总呼吸系统疾病和慢阻肺中最大,RR分别为1.88(95%CI:1.65~2.11)和1.88(95%CI:1.58~2.19)。老年人、受教育程度较低者和中国南方居民更易受到寒流的影响。这些发现可能有助于发展寒冷警报预警系统和促进制订针对弱势群体的预防措施[52]。
5.5 雾化吸入装置是空气驱动还是氧气驱动
在慢阻肺急性加重期,如果选择雾化器递送支气管扩张剂,为避免氧气驱动给药增加动脉血二氧化碳分压(partial pressure of carbon dioxide in arterial blood,PaCO2)的潜在风险,空气驱动更好。一项新西兰的双盲、随机、平行对照研究对比了氧气驱动与空气驱动雾化吸入对慢阻肺急性加重的影响,该研究共纳入90例慢阻肺急性加重住院患者,均给予2.5 mg沙丁胺醇喷雾剂,随机以8 L/min的速度由空气或氧气驱动,每次给药时间均超过15 min,中间间隔5 min;在给药后35 min,氧气驱动组和空气驱动组患者经皮二氧化碳分压(transcutaneous partial pressure of carbon dioxide,PtcCO2)的平均变化分别为3.4 mmHg和0.1 mmHg,差异为3.3 mmHg(95%CI:2.7~3.9)。干预期间氧气驱动组和空气驱动组PtcCO2变化≥4 mmHg的患者比例分别为18/45(40%)和0/44(0)。氧气驱动的雾化导致慢阻肺急性加重患者PtcCO2的增加。研究者认为在慢阻肺急性加重时,空气驱动的支气管扩张剂雾化较氧气驱动的雾化更可取[53]。
5.6 糖皮质激素治疗疗程与预后
激素在慢阻肺急性加重治疗中的地位得到了肯定,但需要权衡激素治疗的利与弊。基于循证医学证据,自GOLD 2014起均推荐小剂量、短疗程激素治疗。丹麦一项全国性的观察性队列研究评估了口服糖皮质激素长疗程与短疗程对死亡率和肺炎的影响,纳入10 152例慢阻肺门诊患者(平均年龄为70岁)因急性加重接受了短疗程(≤250 mg)或长疗程(>250 mg)的口服糖皮质激素治疗。与短疗程口服糖皮质激素治疗相比,长疗程治疗与1年内肺炎住院或全因死亡增加(校正风险比:1.3,95%CI:1.1~1.4)、肺炎住院率增加(校正风险比:1.2,95%CI:1.0~1.3)和全因死亡率增加(校正风险比:1.8,95%CI:1.5~2.2)相关。这项研究进一步支持了口服糖皮质激素短疗程治疗的有效性[54]。
即使短期暴露于糖皮质激素,也与随后肺炎、败血症和死亡的风险增加相关。美国研究者发起了一项基于全国私人保险索赔数据库的回顾性队列研究和自我对照病例系列分析,观 察短期(<30 d)口服糖皮质激素的使用率,比较糖皮质激素使用者和未使用者不良事件发生率、用药后30 d和31~90 d的不良事件发生率。在1 548 945名成年人中,327 452名(21.1%)在3年内至少接受过1次门诊处方的短期口服糖皮质激素治疗;口服糖皮质激素在老年患者、女性和白种成年人中的使用率更高,具有显著的区域差异。口服糖皮质激素最常见的适应证是上呼吸道感染、脊柱疾病和过敏。在开始用药后30 d内,败血症(发病率比:5.30,95%CI:3.80~7.41)、静脉血栓栓塞(发病率比:3.33,95%CI:2.78~3.99)和骨折(发病率比:1.87,95%CI:1.69~2.07)的发生率均增加,并在随后的31~90 d内减少。当泼尼松剂量<20 mg/d时,风险仍会增加(败血症的发病率比为4.02,静脉血栓栓塞的发病率比为3.61,骨折的发病率比为1.83) [55] 。
5.7 嗜酸粒细胞作为生物标志物指导慢阻肺急性加重激素治疗
丹麦一项多中心、随机、对照、开放标签的非劣效试验(CORTICO-COP)[56]结果表明糖皮质激素治疗血嗜酸粒细胞水平较低的慢阻肺急性加重的效果可能较差。该研究纳入318例在24 h内因急性加重入院的患者,将血嗜酸粒细胞≥300 /μl的患者随机分为嗜酸粒细胞指导组和对照组。指导组以嗜酸粒细胞≥300/μl为标准给予患者37.5 mg泼尼松口服。若血嗜酸粒细胞<300/μl则停用泼尼松。对照组患者一直口服37.5 mg泼尼松。评估患者的住院天数和口服激素的使用时间。与标准治疗相比,嗜酸粒细胞指导的治疗在存活天数和入选后14 d内出院天数方面是非劣效的,但减少了系统性糖皮质激素暴露的持续时间。
5.8 CRP指导抗生素应用
既往CRP指导慢阻肺急性加重抗生素治疗的研究结果多不一致。初级保健机构大多基于Anthonisen标准根据患者临床表现开具相应抗生素处方,即呼吸困难加重、痰量增多和脓痰增多,但据此预测治疗安全的准确性并不高。近期一项研究旨在评估在初级保健机构中采用CRP即时检测能否安全减少慢阻肺急性加重患者的抗生素使用[57]。该项多中心、随机、开放、对照试验纳入了英国86家全科医疗机构的653例慢阻肺急性加重患者,CRP指导组(317例)患者初诊和随后4周内因慢阻肺急性加重复诊时均予以CRP即时检测,而常规治疗组患者不接受CRP即时检测。根据相关指南的推荐意见对患者施治:对于CRP水平<20 mg/L者,抗感染治疗无益,不使用抗生素;对于CRP水平为20~40 mg/L者,抗生素治疗可能有益(针对脓痰);对于CRP水平>40 mg/L者,抗生素治疗可能有益。CRP指导组使用抗生素的患者(入组后由患者自报因慢阻肺急性加重使用抗生素的情况)较常规治疗组显著减少,当CRP水平较低时,抗生素使用率由77.4%下降至47.7%。在4周随访期间,CRP指导组的抗生素处方频率显著低于常规治疗组,两组患者口服糖皮质激素无显著差异;此外,两组患者的健康指标、疾病相关生活质量、医疗资源利用(初级和二级保健)等也均无显著差异。在初级保健诊所,基于CRP的抗感染策略可以减少慢阻肺急性加重患者抗生素的使用。
荷兰一项 针对慢阻肺急性加重住院患者的研究纳入101例患者,并将其随机分为CRP组(根据CRP水平≥50 mg/L标准指导抗生素治疗)和GOLD组(根据GOLD推荐指导抗生素治疗)。CRP组使用抗生素的患者比率低于GOLD组(31.7%︰46.2%)。30 d治疗失败率(44.5%︰45.5%)、至下次急性加重的时间(32 d︰28 d)、住院天数(7 d︰6 d)比较无显著差异。第30天,患者症状评分、生活质量和严重不良事件发生情况均未发现明显差异。将CRP作为指导慢阻肺重度急性加重抗生素治疗的生物标志物,可显著减少抗生素治疗,且不增加治疗失败率 [58] 。
5.9 呼吸支持——经鼻高流量氧疗
经鼻高流量氧疗(high-flow nasal cannula oxygen therapy,HFNC)涉及通过特殊设备经鼻输送加热和增湿的氧气,婴儿流量最高可达8 L/min,成人流量最高可达60 L/min,其已成为治疗呼吸衰竭的一种安全、有效的方法,GOLD 2020增加的几项临床研究分析了HFNC在不同临床情况下的有效性。
一项前瞻性、随机、交叉研究关注了HFNC对呼吸生理的改变[59]。该研究纳入了15例住重症监护病房的急性低氧性呼吸衰竭患者,平均氧合指数(PaO2/FiO2)为(130±35)mmHg,随机分为HFNC治疗组(流量设定为40 L/min)和面罩吸氧组,结果显示HFNC可发挥多种生理效应,包括减少呼吸频率,降低呼吸功,改善气体交换、肺容积、顺应性、跨肺压和均质通气。这些益处可能是HFNC改善急性低氧性呼吸衰竭患者氧合和临床疗效的基础。
对于存在高碳酸血症的稳定期慢阻肺患者,通过HFNC疗可以减少高碳酸血症,改善生活质量。一项德国多中心、随机、对照、交叉研究纳入102例患者[平均年龄为(65.3±9.3)岁,61%为女性,平均体质指数为(23.1±4.8)kg/㎡,90%为GOLD D组,平均PCO2为(56.5±5.4)mmHg],随机分为两组,一组先接受6周HFNC,后接受6周无创通气,另一组顺序相反。结果提示,PCO2自基线下降,HFNC组为4.7%,无创通气组为7.1%。两组患者血气、圣乔治呼吸问卷评分、严重呼吸功能不全问卷评分均改善,这提示:对于存在慢性高碳酸血症的慢阻肺患者,需要降低PaCO2,改善生活质量,但不能耐受或排斥无创通气,HFNC可能成为无创通气的替代选择[60]。
意大利学者对HFNC在稳定期和加重期慢阻肺患者中的应用文献进行了系统回顾。共纳入26项研究。HFNC可提供加热、加湿的空气-氧气混合剂,冲洗上气道的解剖死腔,产生小的呼气末正压,较传统氧疗能够保证更稳定的吸入氧分数,且与传统氧疗和无创通气相比,HFNC更舒适。对于稳定期慢阻肺患者,与传统氧疗相比,HFNC改善了患者的气体交换和生活质量,缓解了呼吸困难症状,降低了肌肉能量消耗成本。对于慢阻肺急性加重患者,HFNC可替代无创通气(在不耐受的情况下),也可能在拔管或撤除无创通气时替代传统氧疗[61]。
根据现有的证据,有几个问题仍然没有答案,如特定病因的急性呼吸衰竭的随机对照研究、HFNC纠正成功的急性呼吸衰竭的早期预测因素、最佳流量的设定、成本-效益分析、HFNC在慢性呼吸系统疾病中的应用价值等。在没有任何统一意见的情况下,应根据患者具体情况对HFNC治疗作出个体化的决定。
第六章:慢阻肺合并症
关键点
• 慢阻肺常合并其他疾病,对预后有显著影响。
• 总体来说,合并症的存在不应改变慢阻肺的治疗方案,并且合并症应按照常规标准进行治疗,而与慢阻肺的存在无关。
• 肺癌常见于慢阻肺患者中,是导致死亡的主要原因。
• 心血管疾病是慢阻肺常见且重要的合并症。
• 骨质疏松症和抑郁/焦虑是慢阻肺常见的重要合并症,常被漏诊,且与不良的健康状况和预后相关。
• 胃食管反流与慢阻肺急性加重风险增加和健康状况差有关。
• 当慢阻肺是多种疾病护理计划的一部分时,应注意确保治疗的简便性并最大限度地减少多药物治疗。
更新要点
GOLD 2020在合并症方面增加了2篇文献,关注肺癌合并慢阻肺患者的预后和慢阻肺患者的精神症状。
6.1 肺癌患者合并慢阻肺对预后的影响——中国好声音
慢阻肺是肺癌的危险因素,合并慢阻肺对肺癌预后的影响有待阐明。浙江大学医学院附属第二医院胸外科范军强教授团队对29项研究的荟萃分析发现,与非慢阻肺患者相比,慢阻肺患者5年生存期较短。其中10项研究评估慢阻肺和肺癌术后并发症发生风险之间的关联,发现合并慢阻肺的患者在肺癌术后支气管胸膜瘘(OR:1.84,95%CI:1.30~2.60)、肺炎(OR:3.62,95%CI:2.60~5.03)、长时间漏气(OR:2.77,95%CI:1.30~5.90)、长期机械通气(OR:2.60,95%CI:1.52~4.43)发生率均高于未合并慢阻肺的肺癌患者,但脓胸发生率无显著差异(OR:1.45,95%CI:0.69~3.03)。合并慢阻肺的肺癌患者值得关注,同时需要进一步研究慢阻肺严重程度、病程与肺癌预后的关系[62]。
6.2 慢阻肺是自杀的危险因素
慢阻肺患者通常存在日常活动受限、抑郁、生活质量降低等情况,这使该人群成为自杀的风险群体。荟萃分析总样本包括1390例慢阻肺患者自杀病例,基于5项病例对照研究,发现慢阻肺患者的自杀率是非慢阻肺患者的1.9倍。慢阻肺患者经常被漏诊漏治,与自杀相关的精神疾病也经常被漏诊漏治,慢阻肺患者确诊后应采取有效的干预措施预防自杀,包括心理治疗、调整日常活动等[63]。
小结
GOLD近20年的变迁主要关注慢阻肺的个体化评估和治疗,其目标是改善慢阻肺患者的预后。在解读GOLD 2020的过程中,笔者有几点体会:
(1)临床上要关注有呼吸系统症状但无气流受限的人群,应对其进行密切随访,但是否需要干预及干预方法目前尚无证据。近期国外专家基于COPDgene的研究结果提出要重新定义慢阻肺的诊断标准:根据危险因素暴露、临床症状、呼吸生理、胸部CT改变4个方面的特征进行分类,如果具备上述4个特征,为确诊慢阻肺;具备其中3个特征,为拟诊慢阻肺;具备其中2个特征,为疑诊慢阻肺。对于这样的观点是否能够被接受有待进一步讨论。另外,应关注有气流受限但无明显呼吸系统症状的人群,最新的流行病学研究发现有60%的慢阻肺患者无症状,这些患者往往存在对自己症状的低估,但此类人群肺功能下降速度更快,应早期干预。
(2)关注慢阻肺急性加重高风险人群的临床特征,采取有效的干预措施预防急性加重。由于慢阻肺急性加重的异质性,基于症状和事件的定义各有优缺点,临床医生需要了解慢阻肺急性加重的危险因素,如既往急性加重频率、肺功能、临床症状严重程度、症状表型的分型、胸部CT检查的评估(肺气肿面积、小气道病变、肺主动脉横截面比例)、6 min步行试验、合并症、生物标志物(如嗜酸粒细胞等),这些指标与慢阻肺急性加重风险或疾病预后密切相关。
(3)慢阻肺的管理包括药物治疗和非药物治疗,需要形成医生与患者之间的闭环管理,借鉴高血压、糖尿病等慢性病管理策略,建立适合本国特色的分级诊疗、交叉学科合作的患者管理和呼吸康复体系。
纳入GOLD的文献很多都是多中心、大样本、前瞻性、队列研究,临床医生在实践中发现问题,做好顶层设计,同时注重数据质量,具备较高的循证医学证据等级。慢阻肺具有复杂性和异质性,随着对慢阻肺研究的深入,未来需要关注慢阻肺可治疗的特征,如吸烟、急性加重、嗜酸粒细胞、小气道疾病、肺气肿等,实现从表型到内型驱动的个体化治疗。
参考文献

专家介绍 - 陈亚红

主任医师、教授、博士生导师,北京大学第三医院呼吸与危重症医学科副主任;专业特长:呼吸系统常见病及疑难危重症疾病;研究方向:气道慢性炎症疾病;社会任职:现任中华医学会呼吸病学分会慢阻肺学组委员,中国医师协会呼吸医师分会慢阻肺工作委员会委员,中国基层呼吸疾病联盟副主席。承担多项国家级和省部级科研基金,获得北京市科技新星计划支持和教育部新世纪优秀人才支持计划。研究结果获得北京市科技进步三等奖和中华医学科技奖三等奖。已发表论著100篇,SCI论著34篇。硕士研究生毕业9名,博士研究生毕业1名,在读2名。
* 本文版权属人民卫生出版社《中国医学前沿杂志(电子版)》所有,引用本文:陈亚红.2020年GOLD慢性阻塞性肺疾病诊断、治疗及预防全球策略解读[J].中国医学前沿杂志(电子版),2019,11(12):32-50.
本文转载自订阅号「医学前沿网」(ID:yixueqianyan)
原链接戳:2020年GOLD慢阻肺诊断、治疗及预防全球策略解读


