推荐语
采用低剂量CT对肺癌高危人群进行筛查可使肺癌死亡率下降20%,但其中的假阳性率也高达24%?哪部分人可称之为高危人群?目前国内外有哪些肺癌筛查相关研究?从影像学特征上进行肺结节良恶性诊断有技巧吗?恶性风险预测该怎么做?筛选早期肺癌有前景的方法又在何方?河南省人民医院张晓菊教授在CACP 2018上做了全面权威的讲解,《呼吸界》特此整理分享。
1 肺癌筛查现状
2013《NCCN 非小细胞肺癌临床实践指南》中推荐低剂量螺旋(LDCT)筛查肺癌,并肯定其可减少肺癌高危人群的死亡。烟草暴露是肺癌的首要致病因素,85%~90% 的肺癌是由直接或间接吸烟引起。
?
但是,有报道指出筛查的假阳性率也高达24%。
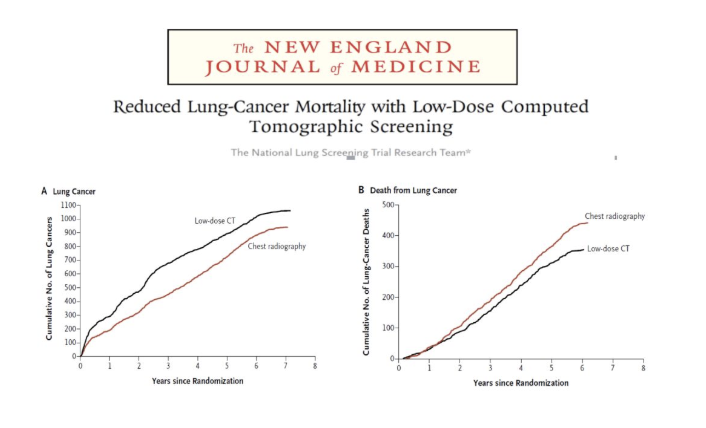
2011年,美国国家肺癌筛查试验(NationalLung Screening Trial)的随机对照研究结果显示,与拍X光胸片相比,采用低剂量CT对肺癌高危人群进行筛查可使肺癌死亡率下降20%。
NLST肺癌筛查研究项目
研究对象:于2002年8月至2004年4月招募美国33个医疗中心的53454名肺癌高风险人群为研究对象。
入选标准:55~74岁,30盒/年吸烟史,或曾经30盒/年吸烟史但戒烟未超过5年的人群。
对象处理:将研究对象随机分为低剂量CT组(26722人,每年3次低剂量CT筛查)、胸片组(26732人,每年3次胸片筛查),并收集截至2009年12月31日时各组肺癌病例数和肺癌死亡数。
结果:90%的研究对象完成了筛查,筛查人群的平均年龄为62岁,平均吸烟约50盒/年,与拍X光胸片相比,采用低剂量CT对肺癌高危人群进行筛查可使肺癌死亡率下降20%。
全球四大著名的肺癌筛查研究项目
1
I-ELCAP(国际肺癌早期筛查)
- 1993年开始
- 基于低剂量螺旋CT
- 入组:31567
- 因没有随机对照,饱受争议
2
NLST(美国国立肺癌筛查)
- 2002开始,2009结束
- 33个多中心研究
- 入组:53454
- 基于LDCT对比胸片
3
NELSON(荷兰-比利时肺癌筛查)
- 2003年开始
- 基于LDCT对比胸片
- 入组:15822
4
ECLS(英国肺癌早筛)- NHS
- 2012年开始,2018年结束
- 基于血液肺癌7种自身抗体
- 入组:12000
筛查手段:X线、生物标志物、低剂量螺旋CT、风险因素

欧洲放射协会、欧洲呼吸学会在2015年4月30日联合发表一个针对肺癌筛查的白皮书:
→ Leading US medical societies recommend large scale screening for high risk individuals
→ 美国医学协会推荐对高危人群大规模筛查
→ There are no lung cancer screening recommendations or reimbursed screening programmes in Europe as yet
→ 欧洲到目前还没有筛查推荐和医保支付项目
对低剂量螺旋CT的担心:
→ 低剂量螺旋CT的高假阳性(96.4%)
→ 辐射暴露致癌风险
NLST肺癌筛查研究项目
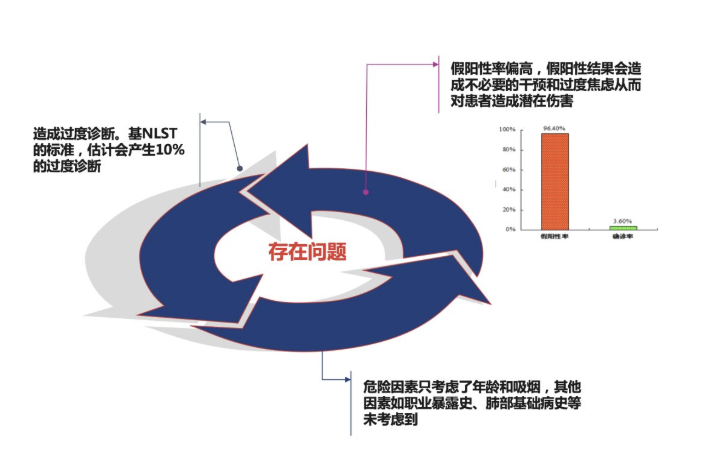
存在问题:
基NLST的标准,估计会产生10%的过度诊断;危险因素只考虑了年龄和吸烟,其他因素如职业暴露史、肺部基础病史等未考虑到;假阳性率偏高,假阳性结果会造成不必要的干预和过度焦虑从而对患者造成潜在伤害。
2 肺癌筛查模型及相关研究

肺癌筛查模型可以作为优化筛查效果及质量的潜在工具,准确的识别肺癌高危人群,能够最大限度的提高肺癌筛查的好处。
人们越来越认识到,不是选择使用简单的二分风险因素对吸烟者进行筛查,而是根据人口统计学、临床和吸烟特征进行个体化风险计算,可以大大提高CT筛查计划的有效性和效率。因此,美国NCCN最近的肺癌筛查指南允许使用个体化风险模型对吸烟者进行筛查,不同的模型用于不同的筛查人群。

01
Bach 肺癌筛查模型
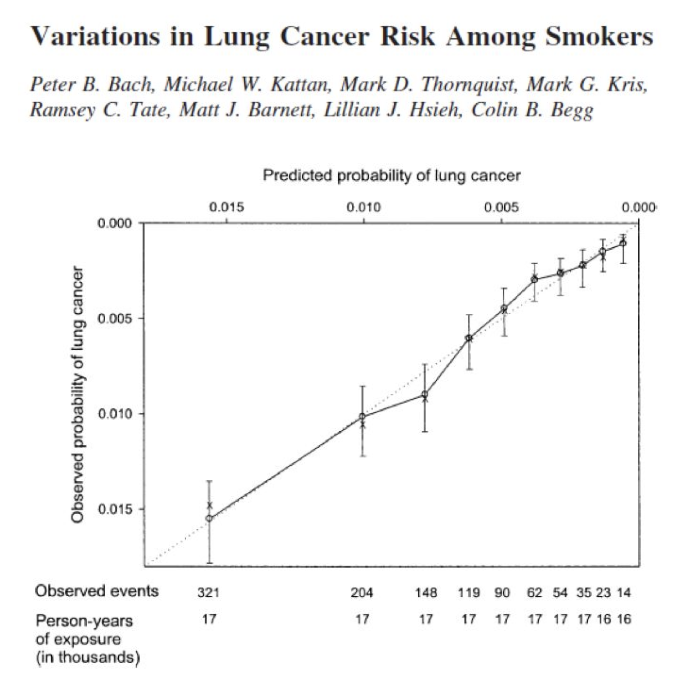
该模型纳入了18172名肺癌高风险吸烟者,设定研究目标终点为1年肺癌发生率,目标人群主要针对既往吸烟者,最终可得到可靠的预测因素包括:年龄;性别;吸烟程度、持续时间、戒烟年数;石棉暴露;其曲线下面积为0.72,模型精度相对一般。
02
Spitz模型

该模型纳入人群为hospital-based population,包括1851例肺癌病例组及2001例正常对照组,研究目标终点为1年肺癌发生率;其将目标人群分为3组,正在吸烟人群、既往吸烟人群及从未吸烟人群。
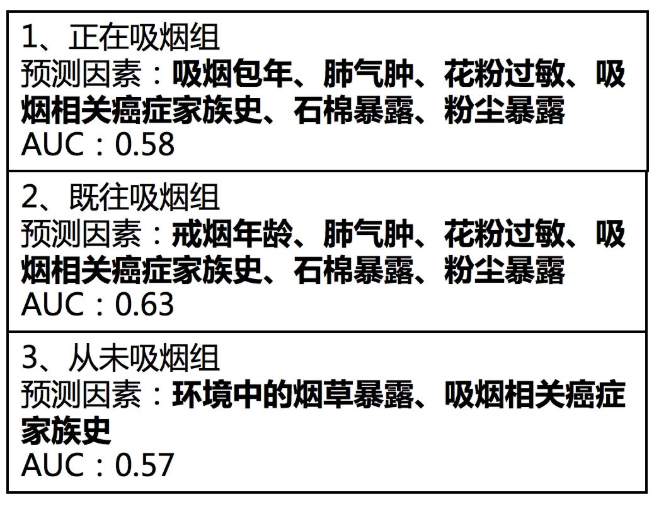
其结果表明:
正在吸烟组的预测因素包括:吸烟包年、肺气肿、花粉过敏、吸烟相关癌症家族史、石棉暴露、粉尘暴露,其曲线下面积AUC:0.58;
既往吸烟组的戒烟年龄、肺气肿、花粉过敏、吸烟相关癌症家族史、石棉暴露、粉尘暴露;其曲线下面积AUC:0.63;
从未吸烟组:环境中的烟草暴露、吸烟相关癌症家族史,如果以0.75为界值的话,可见其精度均相对较低。其曲线下面积AUC:0.57。
03
利物浦LLP肺癌筛查模型
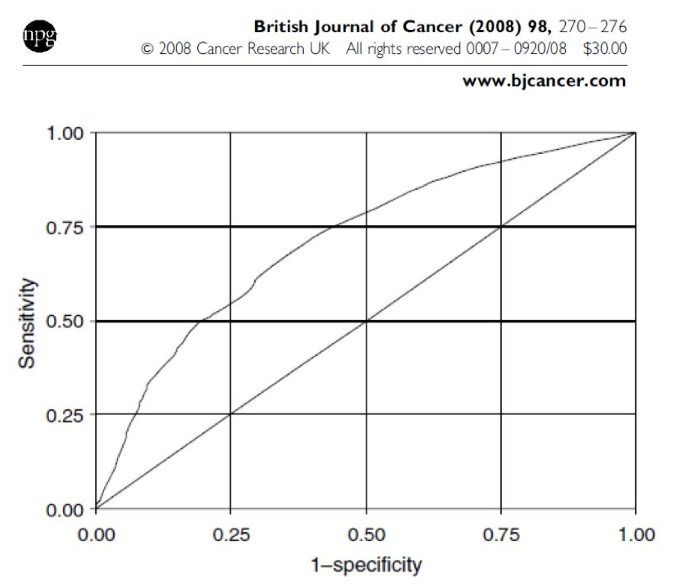
利物浦LLP肺癌筛查模型,其纳入579例肺癌患者为病例组,1157例年龄性别匹配的正常人群为对照组;研究目标终点为5年肺癌发生率,其研究人群选为一般人群。结果可见,其相对有意义的危险因素包括:吸烟持续时间;肺炎病史;肿瘤病史;家族肺癌史;石棉暴露。其曲线下面积0.7;精度相对一般。
04
PLCO肺癌筛查模型
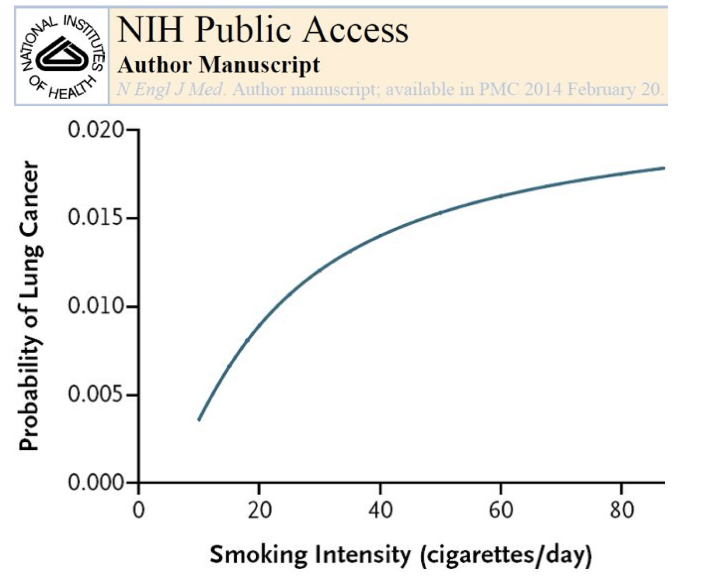
PLCO肺癌筛查模型的纳入人群选用了36826例PLCO试验的对照组人群(即55~74岁的有吸烟史的人群);并分别采用37332例PLCO试验的吸烟干预组人群:55~74岁正在吸烟人群和51033例NLST试验的参与人群进行了验证;其研究目标终点为6年肺癌发生率;目标人群为既往吸烟人群。
最终结果表明其危险因素包括:年龄;种族;教育程度;BMI;吸烟状态、程度、持续时间、戒烟年数;COPD;肿瘤病史;家族肺癌史。
其在PLCO 人群中的曲线下面积为0.797;在NLST人群中曲线下面积为0.701;精度相对一般。
05
来自JAMA的一个肺癌筛查模型
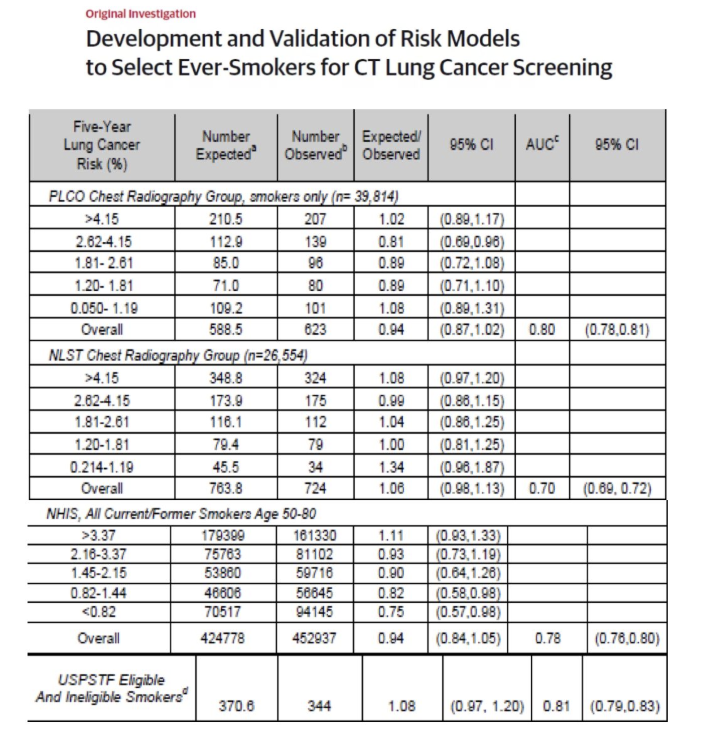
这里分为2部分。
第一部分:纳入人群为PLCO研究中的对照组
纳入人群
PLCO研究中的对照组:39180例吸烟者,年龄在55~74岁
验证:PLCO研究中的干预组:39822例吸烟者,年龄在55~74岁,以及NLST研究中26554对照组
研究目标:肺癌5年发生率
目标人群:既往吸烟人群
预测因素:年龄;性别;教育程度;种族;BMI;吸烟状态、包年、持续时间、戒烟时间;肺气肿;家族肺癌史;
AUC:1、PLCO 0.80 2、NLST 0.70
(在PLCO人群中的曲线下面积为0.80; 在NLST人群中的曲线下面积为0.70)
第二部分:纳入人群为PLCO研究中的对照组
纳入人群:
PLCO研究中的对照组:39180例吸烟者,年龄在55~74岁
验证:PLCO研究中的干预组:39822例吸烟者,年龄在55~74岁;及NLST研究中26554对照组;及NHIS研究中29091例年龄50~80岁的吸烟者
研究目标:肺癌5年死亡率
目标人群:既往吸烟人群
预测因素:年龄;性别;教育程度;种族;BMI;吸烟状态、包年、持续时间、戒烟时间;肺气肿;家族肺癌史;
AUC:1、PLCO 0.81 2、NHIS 0.78
(在PLCO人群中的曲线下面积为0.81; 在NHIS人群中的曲线下面积为0.78)
06
Bach模型外部验证

这是为了排除不同人群对模型的精度造成干扰。
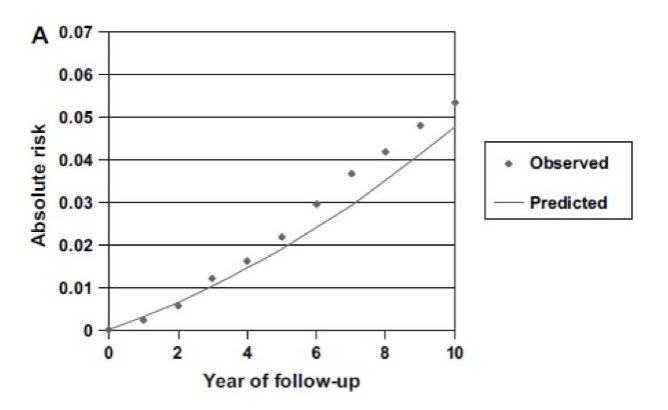
由上图可以看出,实际肺癌人口比例与从Bach绝对风险模型中获得的预期比例之间的差异会随着随访时间的延长而增加。
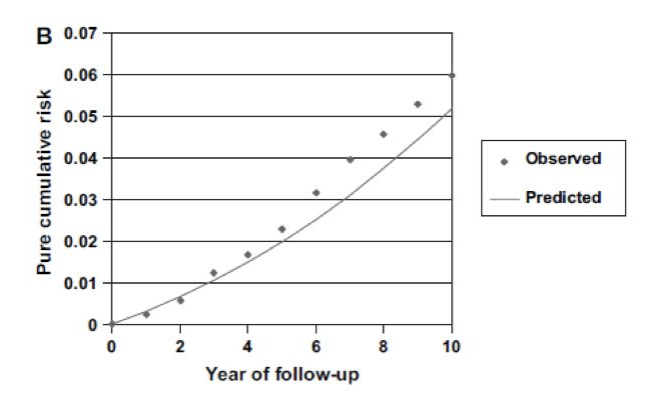
5年后吻合度有所降低,其总体一致指数等于0.69 (95%Cl=0.66~0.72)。
07
PLCO模型外部验证
PLCOm2012是基于美国数据的逻辑回归模型,纳入社会人口学和健康因素可以预测吸烟者6年的肺癌风险,因此可能会更好预测那些可能受益于筛查的人,而不仅仅是基于年龄和吸烟的标准。此篇文章验证了PLCOm2012在一组澳大利亚吸烟者预测肺癌方面的表现。

纳入人群:95,882名年龄≥45岁的吸烟者
结果:总共诊断1035例肺癌
结论:较好的AUC:(0.8 , 95%Cl 0.78~0.81)
敏感性较高:(69.4%,95%CI 65.6-73.0%)
特异性较低:(72.0%,95%CI 71.7-72.4%)

此篇文章对比了比较三种模型:LLP模型、Spitz模型、Bach模型的区分能力和精确度。

结果表明:LLP模型和Spitz模型具有相等区分能力(0.69),而Bach模型的功效显著较低(0.66;P=0.02)。 Spitz模型的阳性预测值最高,而LLP模型的阴性预测值最高。Spitz模型和Bach模型的灵敏度较低,但特异性较好。
识别高危人群
由于筛查项目需要巨大的经费,肺癌筛查的卫生经济学效益问题就成了一个饱受争议的问题。因此,需合理、准确地选择筛查对象,尽量降低「无效筛查」的比例,即识别「高危人群」。
2017年《NCCN 非小细胞肺癌临床实践指南》中指出:高危人群指吸烟30年包的正在吸烟或既往吸烟的烟民(既往吸烟的戒烟少于15年)、年龄55~74岁且无肺癌证据,目前仍在吸烟或戒烟不足15年(1类)。
美 国 胸 科 医 师 协会(ACCP)及美国临床肿瘤协会(ASCO)、美国癌症协会(ACS)对高危人群的界定与NCCN指南相似。
另外还有ATS与USPSTF对高危人群的界定标准。
美国胸外科协会(ATS):高危人群:在55~79岁、 吸烟≥30包/年的人群及≥50岁、吸烟≥20包/年且同时合并其他肺癌危险因素[如慢性 阻 塞 性 疾 病 (COPD)、 环境或职业暴露、 既往罹患癌症、 接受过放射治疗、 家族史等人群。
美 国 预 防 服 务 工 作 组(USPSTF):高危人群:55~ 80 岁,吸烟 30 包/年,或符合上述条件的曾经吸烟者且戒烟不足 15年,但戒烟已超过 15年, 或已有威胁寿命的健康问题, 或者不能承受或不愿意进行肺部手术者可不作为高危人群进行筛查。
3
肺结节风险预测模型
肺结节发病情况?
由于美国国家肺筛查试验(NLST)报告显示,筛查可明显改善选定的肺癌高危患者的死亡率,许多癌症学会,以及美国预防服务工作组(USPSTF)都已建议对相关人群进行肺癌 CT 筛查。在未来几年里,其胸部 CT 的检查数量,以及偶然发现的肺结节数量,可能还会有显著的增长。
随着肺癌筛查的推广,肺结节的检出率程逐年上升的趋势,国内多项大型肺癌检查试验,结节的发生率已经从 8% 升至 51%。

Risk factors for pulmonary nodules in north China: A prospective cohort study
方法:2014年1月至2016年3月期间,在河北省对32438名40至75岁的受试者开展了一个大型前瞻性队列研究 ,对受试者完成一份问卷并接受低剂量CT(LDCT),随访到2017年3月。
结果:本研究共纳入7752名受试者,其中肺结节患者2040例(26.32%);年龄、吸烟、二手烟暴露、饮食因素、职业暴露、疾病史和家族史可能影响肺结节的发病率;其中蔬菜消费,茶叶和豆类降低了风险,约10.09%和8.58%的肺结节发病率分别是由于吸烟和低水果摄入量;估计有6.36%和3.88%的肺结节患者可归因于癌症家族史和肺部疾病史。
肺结节公认的临床危险因素?
- 年龄
- 吸烟或曾经吸烟
- 肿瘤史(包括家族史)
- 肺部慢性炎症
- 石棉、放射性物质暴露
对于任何肺结节病人的决策,均应从对患者的危险分层,及对其不同干预策略的效益 / 风险咨询服务开始。
恶性肺结节的影像学特征?
- 分叶征
- 毛刺征
- 棘突征
- 空泡征
- 细支气管充气征
- 血管集束征
- 胸膜牵拉征
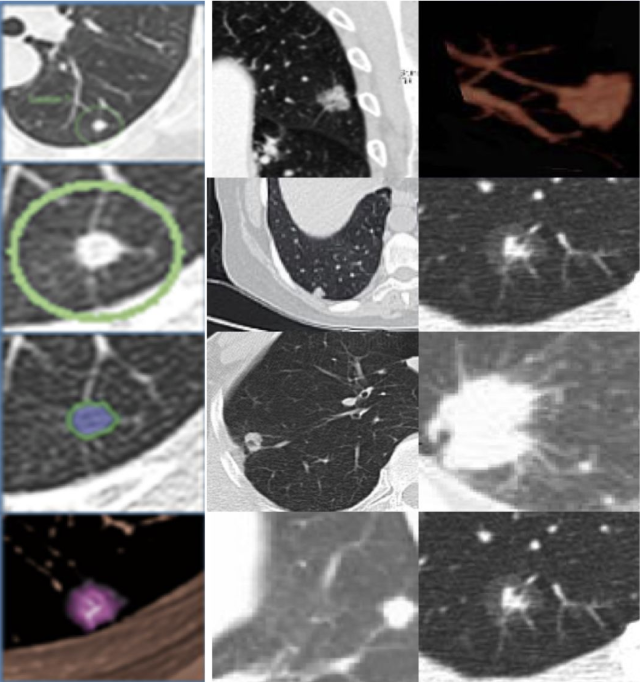
肺结节恶性概率的计算?
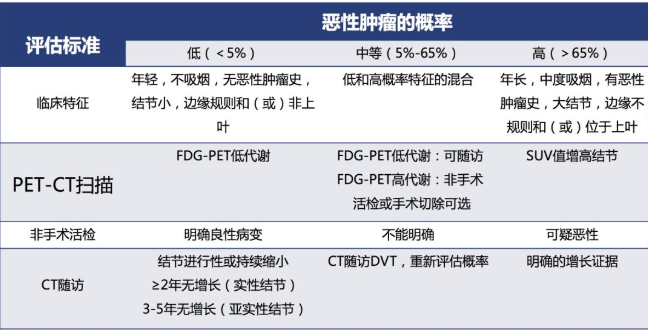
这在一定程度上能辅助临床医生对肺结节做出初步的评估。
肺结节恶性风险预测?
数学模型具有客观、精确、稳定及可重复等优点,一个特异度好、灵敏度高的数学模型能够在一定程度上消除医生的主观臆断。
现在美国胸科医师学会(ACCP)、英国胸科协会(BTS)指南以及2015年「肺部结节诊治中国专家共识」,均明确的推荐使用数学模型对初诊肺结节进行恶性风险的评估,以下将为大家介绍以下肺结节恶性风险预测模型的相关研究:
1、美国梅奥模型(Mayo Clinic模型)

美国梅奥模型作为最经典的数学模型之一,在建立时收集了1984年1月1日至1986年5月1日间共计629例(男性320,女性309)经胸部X线新发现的不确定的肺结节,直径在4mm至30mm之间。
入组病例中,65%的SPN被确诊为良性结节,23%为恶性,其中有12%的SPN无明确的病理诊断(随访2年无明显变化者判断为良性)。
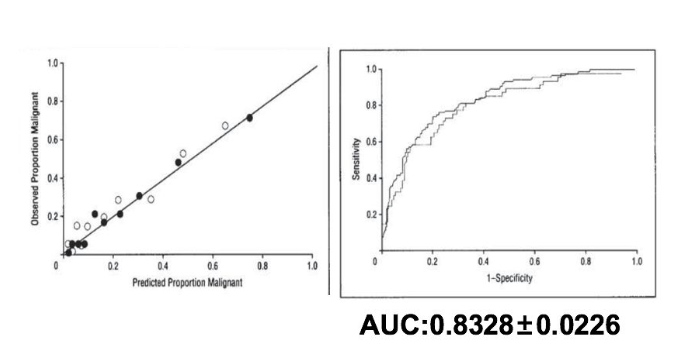
基于采集的临床及影像学信息,通过多因素回归分析计算出影像肺结节良恶性的独立危险因素,分别为年龄、吸烟史、恶性肿瘤史、直径、毛刺征、位于上叶,将筛选出的独立危险因素及相关系数带入函数方程,得到风险预测模型。
T=ex/(1+ex);x=-6.8272+(0.0391×年龄)+(0.7917×吸烟史)+(1.3388×恶性肿瘤史)+(0.1274×直径)+(1.0407×毛刺征)+(0.7838×上叶)
结论:该模型AUC为0.8328,检验精度较高,但是在SPN良恶性判断上与临床医生的判断相比并无统计学的差异。值得注意的是,Mayo模型对低度恶性或良性SPN的评价会更加客观。
2、A Clinical Model To Estimate the Pretest Probability of Lung Cancer in Patients With Solitary Pulmonary Nodules
美国退伍军人事务部在10个不同地区的 VA 站点登记收集了532名参与者资料(1988年9月和2001年6月之间,CSP 027 研究)。
每个受试者最终通过手术或活检获得的明确的病理诊断,或当 SPN 发现后临床随访X线至少2年且稳定,可诊断为良性肺结节。
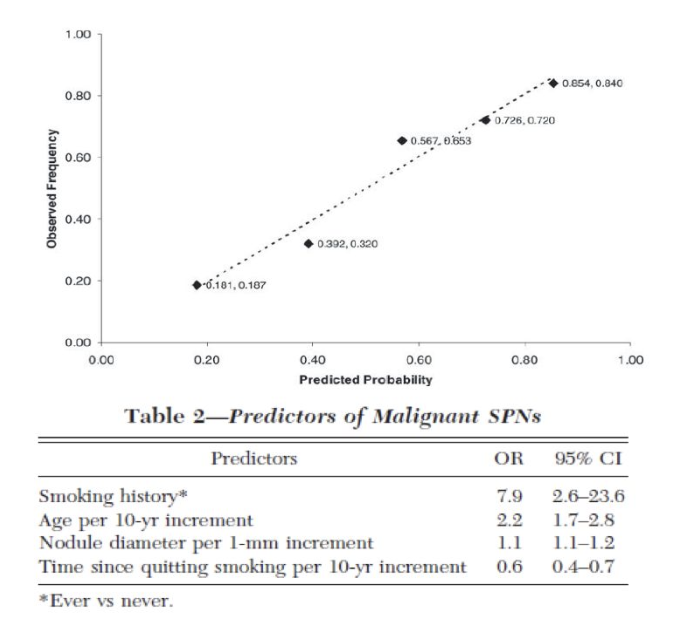
VA模型:T=ex/(1+ex);x=-8.404+(2.061×吸烟史)+(0.779×年龄)+(0.112×直径)-(0.567×戒烟时间(10年))
结论:模型精度较好 (AUC, 0.79; 95% CI, 0.74 到 0.84), 预测恶性概率与恶性spn 的观测频率有很好的一致性。
3、北大模型

利用371例患者资料建立模型,62例患者进行验证,并与Mayo、VA模型进行对比,北大模型的AUC为0.888,高于MAYO及VA模型的0.747、0.707。
收集2000年1月到2009年9月期间,共有手术切除并且有明确病理诊断的SPN患者371例,用于数学模型的建立;
收集2009年10月到2010年5月期间,经手术切除且明确病理诊断的SPN患者62例,例经过手术确诊的SPN患者,用于数学模型的验证;
北大模型的AUC为0.888,高于Mayo及VA模型的0.747、0.707,AUC优于另外3种模型,但是与Brock model差异无统计学意义。
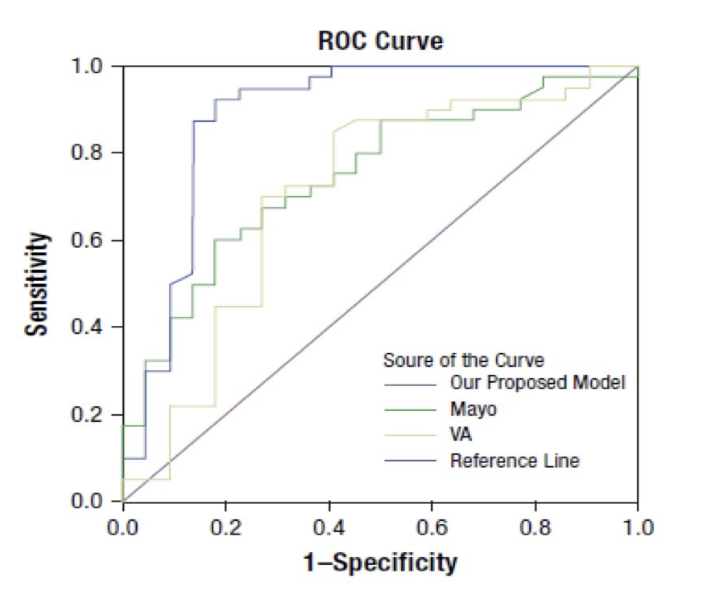
T=ex/(1+ex);x=-4.496 +(0.07×年龄)+(0.676×直径)+(0.736×毛刺征)+(1.267×肿瘤家族史)-(1.615×钙化)-(1.408×边界清楚)
结论:北大模型(AUC0.888)的预测精度高于Mayo模型(AUC0.747)及VA模型(AUC0.707)
4、南方医科大学建立的预测模型

回顾收集2005年1月至2011年12月病例,共收集312例经过手术确诊的SPN患者,用于数学模型的建立;
收集2012年1月到2014年12月期间病例,共收集120例经过手术确诊的SPN患者,用于数学模型的验证。
T=ex/(1+ex);x=-14.417+(0.111*年龄)+(1.009*吸烟史)+(2.597*直径)+(1.056×毛刺征) + (−1.258×边界清楚) + (1.184×Cyfra21-1)
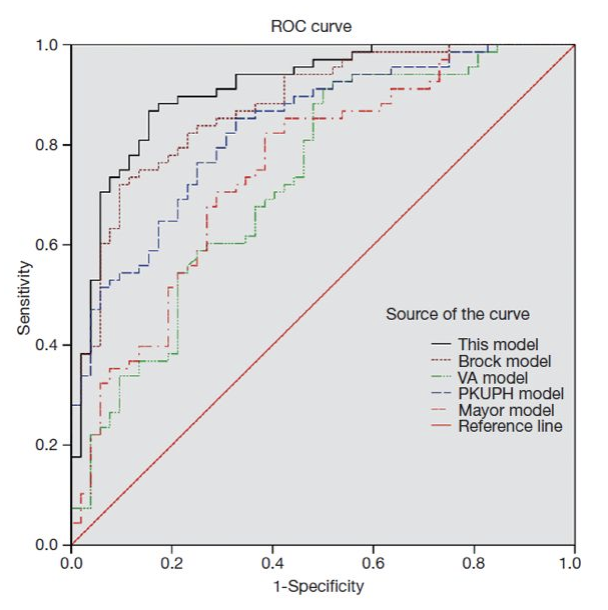
结论:(首次将与Cyfra21-1加入模型之中),该模型AUC为0.910,与Brock model、VA model、北大模型及Mayo model相比,检验效能更高,但是与Brock model差异无统计学意义。
5、LCBP风险预测模型
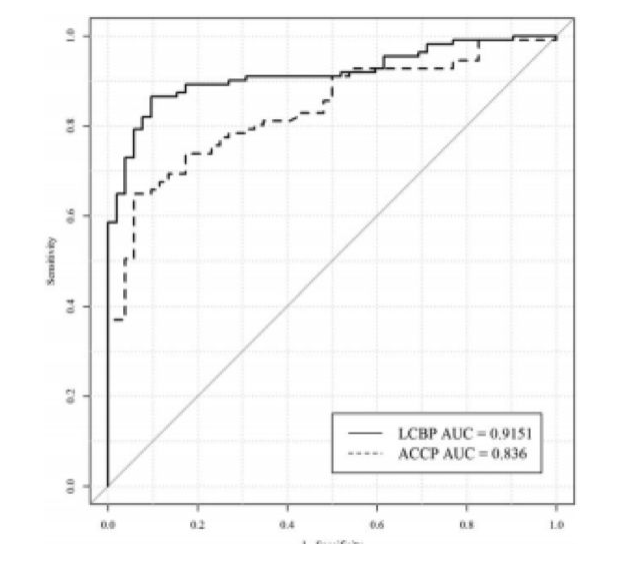
在本研究的受试者中,收集342例被检出肺结节的受试者资料,163例受试者用于建立肺结节恶性风险预测模型,179例用于对模型检验效能的验证及对比;该模型纳入的评估指标包括:危险因素(年龄、性别、吸烟史),CT影像数据和基于ARCHITECT检测平台的4项肿瘤标志物(ProGRP,CYFRA21-1,CEA 和SCC)
LCBP模型:x=-2.9169+(0.03*年龄)+(1.0721*吸烟史)+(0.306*肿瘤病史)+(-0.7012*性别)+(-0.000155*ProGRP)+(0.0151*SCC)+(0.1238*Crfra21-1)+(-0.00043*CEA)
结论:该模型AUC为0.915,LCBP 模型对肺结节患者进行危险分层,其敏感性达 94.6%,特异性可达 94.2%,同时通过对比发现,LCBP 模型较美国的 ACCP 模型更适合国内肺癌高危人群进行肺结节的风险评估。
6、A Mathematical Model: Risk Prediction Solitary Pulmonary Nodule
收集2015年1月至2016年10月期间就诊于河南省人民医院经外科手术治疗且有明确病理诊断的肺结节患者,共有患者346例,其中266例患者资料建立模型,另80例病例用于验证数学模型。
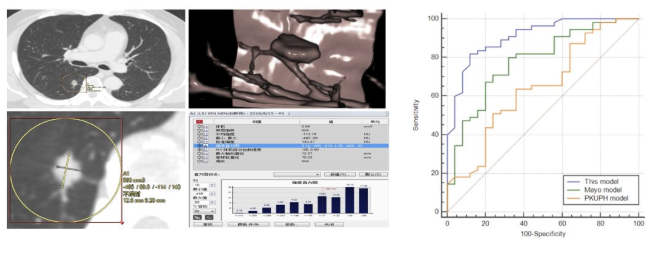
p=ex/(1+ex),x= -4.339+(0.040×年龄)-(1.018×瘤-肺界面光滑)-(1.220×瘤-肺界面清楚)+(1.016×空泡征)+(2.211×分叶征)+(2.449×血管集束征)
结论:本模型的AUC为0.908,高于北大模型(0.647)及梅奥模型(0.783),差异有统计学意义(P<0.05)
7、Validation of two models to estimate the probability of malignancy in patients with solitary pulmonary nodules
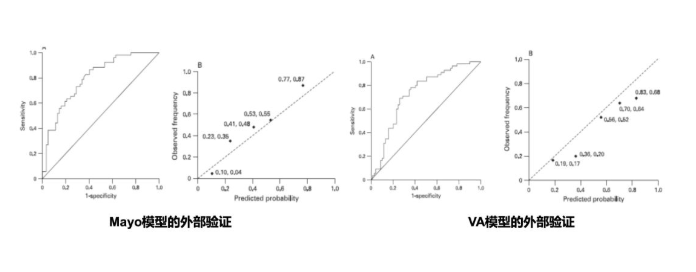
该研究通过外部人群对Mayo及VA模型进行验证,外部验证数据集纳入人群:共151例患者,96%为男性,平均年龄为 66.9 岁,80%为白种人,95%的非西班牙裔或拉丁裔,恶性肿瘤比例为44%。
结论:梅奥模型的 ROC 曲线下面积(0.80;95% CI 0.72 至 0.88)高于 VA 模型(0.73;95% CI 0.64 至 0.82),但这一差异没有统计学意义(P= 0.07;95% CI 20.03 到 0.16)
与梅奥模型相比,VA 模型是由一个相对较高的恶性肿瘤患病率(54%)的样本开发的。所以在此次验证中,VA模型高估了我们验证样本中患者的恶性肿瘤概率。
因此,临床医生的可以选择同时使用这两种模型进行预测:梅奥模型可以提供低限,VA 模型将提供上限。或者,在某些情况下,使用 VA 模型代替梅奥模型可能也是合理的,因为高估结节的恶性概率要比低估好的多。
8、A retrospective validation study of three models to estimate the probability of malignancy in patients with small pulmonary nodules from a tertiary oncology follow-up centre
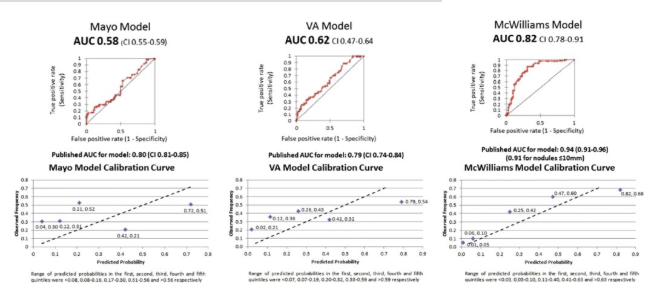
这个外部验证研究通过702名患者,对McWilliams、Mayo及VA模型进行验证及比较,最后得出曲线下面积(AUC)分别为0.82、0.62和0.58。
三种模型中,McWilliams模型检验效能最好,但是McWilliams模型在既往恶性肿瘤的患者中表现较差,而Mayo和 VA 模型在该组的表现略好。
但是,三种模型均低估了本验证样本的恶性概率,建议在使用预测模型之前,应首先评估当地人群的特点。
4 肺结节最新研究进展
1、Dynamic contrast-enhanced MRI versus 18F-FDG PET/CT: Which is better in differentiation between malignant and benign solitary pulmonary nodules?
方法:对49例SPNs患者进行前瞻性研究,其中32例为恶性SPNs。所有患者均行动态增强磁共振成像(DCE-MRI)和18F-FDG PET/CT检查。使用扩展的FETTS线性模型计算定量MRI药物动力学参数,包括跨内皮转移常数(KTRAN)、再分布速率常数(KEP)和分数体积(VE)。另外还测量18F-FDG PET/CT参数,最大标准摄取值(SUVMAX)。
结果:
KTRAN、KEP和SUVMAX值在良恶性结节间有显著性差异(P<0.05)。
KTRAN、KEP和SUVMAX的ROC曲线下面积分别为0.909、0.838和0.759。
KTRAN对恶性和良性SPN敏感性和特异性分别为90.6%和82.4%;KEP分别为87.5%和76.5%;SUVMAX分别为75%和70.6%。
KTANK和KEP的敏感性和特异性均高于SUVMAX,但差异无统计学意义(P>0.05)。
!
磁共振呈像MRI对于肺结节的鉴别诊断有重要临床意义
2、Vasculature surrounding a nodule: a novel lung cancer biomarker
收集来自匹兹堡肺筛查研究(PulsS)中的100名受试者的LDCT扫描数据集(50名肺癌,50名良性结节)。对于肺癌病例,分析已知的恶性结节,而良性病例中,选取最大结节用于分析。
开发一种计算机算法来识别周围血管并量化连接或接近结节的血管数量和体积。
结果:非肺癌组中,附着于结节的血管数量为4(±4.3),肺癌组中则为9.7(9.6±4.3),肺癌组附着于结节的血管数量显著多于非肺癌组。

在LDCT肺癌筛查中,周围血管特征可作为判断不确定结节的肺癌生物标志物。
3、

在LDCT筛查的8313名志愿者中,随机选择32个磨玻璃结节(GNS)患者和19名健康志愿者。同时有15例肺癌患者也入选。CellCollector是一种新的CTC捕获装置,用于CTC检测。
经检测:GGNs组有6例CTC阳性患者,15.6%例为阳性;在肺癌组中,73.3%CTCs阳性;健康组未见CTCs阳性事件。
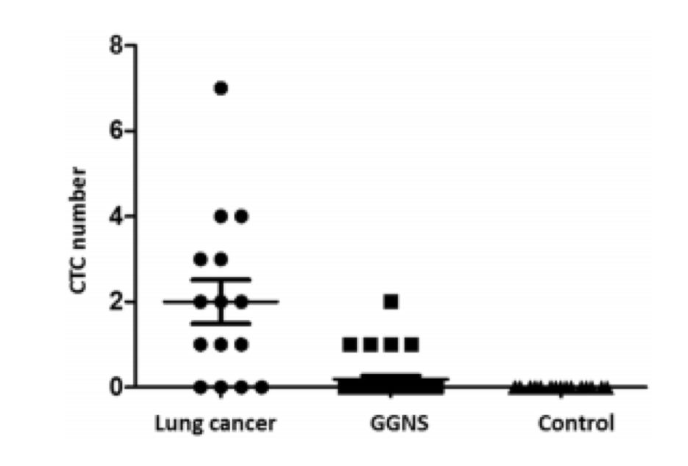
GGNs组检测到的所有CTCs均从细胞集落功能域中分离,并通过全基因组测序(NGS)分析,NGS数据显示:3个肺癌相关基因在5例CTCs阳性患者中存在突变,包括KIT、SMARCB1和TP53基因,4例患者中有16个突变基因存在。
!
LDCT结合CTCs检测是筛选早期肺癌的一种很有前景的方法。
4、Detection of Lung Cancer and EGFR Mutation by Electronic Nose System

方法: 将金纳米颗粒传感器阵列电子鼻应用到良性结节、肺癌(早期16例)及携带EGFR突变的肺癌患者组在呼气的鉴别中。
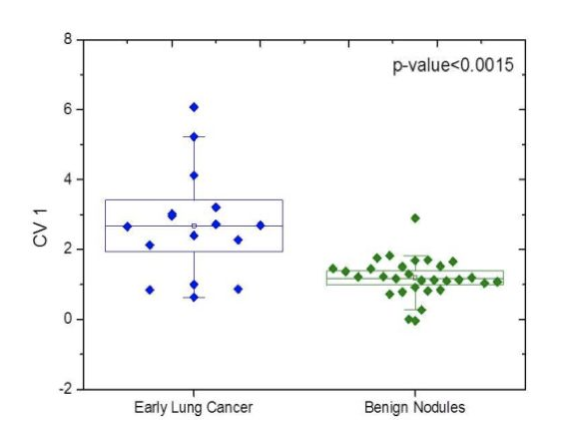
结果:有119例患者参与,其中良性结节30例,肺癌 89例(早期16例,晚期73例)。
携带EGFR突变的肺癌患者(n=19)可与野生型(n=34)项鉴别,准确性为83%,敏感性为79%,特异性为85%;早期肺癌与良性结节的鉴别准确率为87%,阳性预测值和阴性预测值分别为87.7和87.5%。重度吸烟者的LC与从未吸烟或远近的轻度吸烟者的鉴别(准确率为76%)。
5、Clinical Utility of Chromosomal Aneusomy in Individuals at High Risk of Lung Cancer

人群来自以下四项试验:Colorado High Risk Cohort,NLST,匹兹堡肺筛查研究(PLUS)和Colorado Pulmonary Nodule BiomarkerTrial (PuNBaT),利用荧光原位杂交(FISH)技术对痰染色体的异常进行分析。
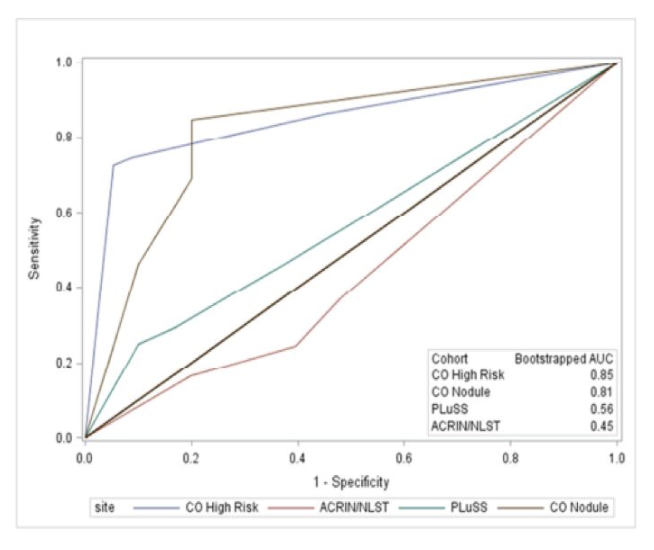
进行巢式病例对照研究,CA-FISH法的ROC曲线和曲线下面积(AUC)。
?
痰液CA-FISH阳性率高,提示它可作为高危人群LDCT的辅助治疗手段。然而,筛查,其阳性似然比较低限制了临床实用性。

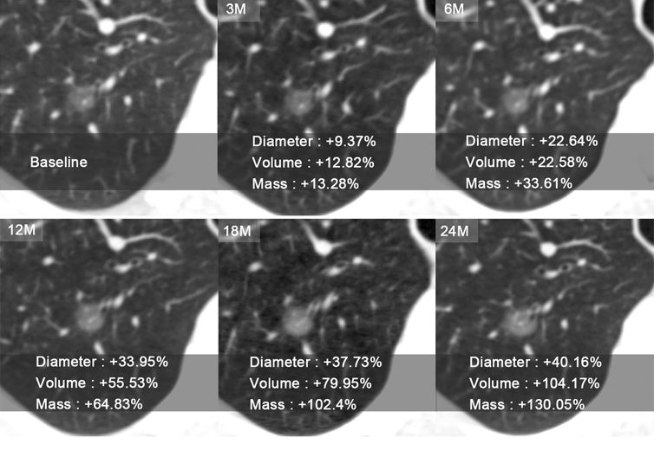
肺结节质量增长比例(MPR)相对于单纯的直径和体积增长(VDT),有更好的精准性、一致性,并且可重复性较好。

53例患者的CTTA围绕病变和对侧正常实质,提取了4个地区的20个纹理特征,包括Haralick、Laws特征和汇总统计;发现CTTA能够识别结节周围微环境中的纹理变化,这些实质变化可作为恶性肿瘤的生物标志物。
来自牛津大学的一项研究发现:肺癌的CT纹理分析(CTTA)已被确定为恶性肿瘤的潜在成像标志物。
总结:
肺癌筛查能够减低肺癌高危人群死亡率,意义重大;在开展肺癌筛查时,如何精准的的识别高危人群至关重要;肺癌筛查模型对高危人群的筛选,显示了良好的精度;肺结节恶性风险预测模型能够对不确定的肺结节做出初步评估,辅助临床决策;越来越多的基于本地人群的大数据能够帮助我们更好的诊断肺结节的良恶性。
参考文献
[1] National Lung Screening Trial Research Team. Reduced lung-cancer mortality with low dose computed tomographic screening[J]. N Engl J Med, 2011, 2011(365): 395-409.
[2] The National Lung Screening Trial: Overview and Study Design. Radiology. 2010.
[3] Ettinger DS,Akerley W,Borghaei H,et a1.Non-small cell lung cancer,version 2.2013[J].J Natl Compr Cane Netw,2013,11(6):645-653.
[4] National Lung Screening Trial Research Team. Reduced lung-cancer mortality with low-dose computed tomographic screening[J]. New England Journal of Medicine, 2011, 365(5): 395-409.
[5] Kovalchik S A, Tammemagi M, Berg C D, et al. Targeting of low-dose CT screening according to the risk of lung-cancer death[J]. New England Journal of Medicine, 2013, 369(3): 245-254
[6] Bach PB, Kattan MW, Thornquist MD, Kris MG, Tate RC, Barnett MJ, et al. Variations in lung cancer risk among smokers. J Natl Cancer Inst. 2003;95(6):470–8.
[7] Spitz MR, Hong WK, Amos CI, Wu X, Schabath MB, Dong Q, et al. A risk model for prediction of lung cancer. J Natl Cancer Inst.2007;99(9):715–26
[8] Cassidy A, Myles JP, van TongerenM, Page RD, Liloglou T, DuffySW, et al. The LLP risk model: an individual risk prediction modelfor lung cancer. Br J Cancer. 2008;98(2):270–6.
[9] Tammemagi MC, Katki HA, Hocking WG, Church TR, Caporaso N, Kvale PA, et al. Selection criteria for lung-cancer screening. N Engl J Med. 2013;368(8):728–36.
[10] Katki HA, Kovalchik SA, Berg CD, Cheung LC, Chaturvedi AK. Development and validation of risk models to select ever-smokers for CT lung cancer screening. JAMA. 2016;315(21):2300–11.
[11] Cronin KA, Gail MH, Zou Z, Bach PB, Virtamo J, Albanes D.Validation of a model of lung cancer risk prediction among smokers. J Natl Cancer Inst. 2006;98(9):637–40.
[12] Weber M, Yap S, Goldsbury D, Manners D, Tammemagi M,Marshall H, et al.Identifying high risk individuals for targeted lung cancer screening: independent validation of the PLCOM2012 risk prediction tool. Int J Cancer. 2017;
[13] D’Amelio AM Jr, Cassidy A, Asomaning K, Raji OY, Duffy SW,Field JK, et al. Comparison of discriminatory power and accuracy of three lung cancer risk models. Br J Cancer. 2010;103(3):423–9.
[14] Jaklitsch MT, Jacobson FL, Austin JH, et al. The American Association for Thoracic Surgery guidelines for lung cancer screening using low-dose computed tomography scans for lung cancer survivors and other high-risk groups[J].J Thorac Cardiovasc Surg, 2012, 144 (1) :33-38
[15] Moyer VA. Screening for lung cancer: U.S. Preventive Services Task Force recommendation statement[J].Ann Intern Med, 2014, 160 (5) :330-338.
[16] Gould MK, Donington J, Lynch WR, Mazzone PJ, Midthun DE,Naidich DP, et al. Evaluation of individuals with pulmonary nodules:when is it lung cancer? Diagnosis and management of lungcancer, 3rd ed: American College of Chest Physicians evidencebasedclinical practice guidelines. Chest. 2013;143(5 Suppl):e93S–e120S.
[17] Swensen S J, Silverstein M D, Edell E S, et al. Solitary pulmonary nodules: clinical prediction model versus physicians[C]//Mayo Clinic Proceedings. Elsevier, 1999, 74(4): 319-329.
[18] Gould MK, Ananth L, Barnett PG. A clinical model to estimate the pretest probability of lung cancer in patients with solitary pulmonary nodules. Chest.
2007;131(2):383–8.
[19] Li Y, Chen K Z, Wang J. Development and validation of a clinical prediction model to estimate the probability of malignancy in solitary pulmonary nodules in Chinese people[J]. Clinical lung cancer, 2011, 12(5): 313-319.
[20] Zhang M, Zhuo N, Guo Z, Zhang X, Liang W, Zhao S, et al.Establishment of a mathematic model for predicting malignancyin solitary pulmonary nodules. J Thorac Dis. 2015;7(10):1833–41.
[21] Yang DW, Zhang XJ, Powell CA, et al. Probability of Cancer in High-Risk Patients Predicted by the Protein-Based Lung Cancer Biomarker Panel in China: LCBP Study. Cancer, 2018, 124(2):262-270.
[22] Schultz EM, Sanders GD, Trotter PR, Patz EF Jr, Silvestri GA, Owens DK, et al. Validation of two models to estimate the probability of malignancy in patients with solitary pulmonary nodules.Thorax. 2008;63(4):335–41.
[23] Talwar A, Rahman NM, Kadir T, Pickup LC, Gleeson F. A retrospective validation study of three models to estimate the probability of malignancy in patients with small pulmonary nodules from a tertiary oncology follow-up centre. Clin Radiol. 2017;72(2): 177.e1–8.
[25] Feng F, Qiang F, Shen A, et al. Dynamic contrast-enhanced MRI versus 18F-FDG PET/CT: Which is better in differentiation between malignant and benign solitary pulmonary nodules?[J]. Chinese Journal of Cancer Research, 2018, 30(1): 21.
[26] J Thorac Dis 2018;10(Suppl 7):S797-S806
专家介绍



