推荐语
21日晚,第七期PCCM疑难病例讨论(解放军总医院专场)如期进行,会议现场讨论环节畅所欲言、激烈有序,直播间互动区的线上参与者们也跃跃欲试、各抒己见。
这位患者既往诊断肾病综合征,发热、咳嗽、咳痰,肺部阴影,阴影吸收却出现空洞,治疗过程一度好转却又出现新发阴影,原有感染进展吗?还是出现新的感染?难道是出现了肿瘤?再次诊治过程中,患者体温症状好转明显,但为何肺部CT却还在继续进展,是治疗药物不对,还是又出现了新的病原?使用了9个多月的药物后,再发的肺部阴影是因停药过早?或是药物耐药?还是再次出现了新的感染?每一次的肺部阴影出现,究竟是感染还是非感染,究竟是何种病原菌,抗生素的使用究竟如何考量?
在一次又一次的肺部阴影面前,专家们怎样逐步进行深入诊断,最终拨云见日?诊疗过程中的哪些亮点应被记住?
66岁老年男性,主因咳嗽咳痰,间断发热3月余,于2017年1月25日入院。
既往2016年诊断「肾病综合征」,给予激素、雷公藤、环磷酰胺等药物治疗。
第一阶段
2016年10月中旬,患者无明显诱因出现高热伴咳嗽,外院胸部CT示:两肺透过度不均,肺纹理增重、紊乱,左肺下叶斑片影,给予抗感染治疗4天后好转出院(具体用药不详)。
2016年11月3日,胸部CT左上肺多发结节影。患者无发热、咳嗽等肺部症状,未关注。
2016年11月24日,患者咳嗽,痰不多,体温37.1℃,血WBC 5.82×10^9/L,N 0.852,L 0.136;CRP 1.02mg/L,ESR 45mm/h。
2016年11月25日,肺部CT提示右肺上叶新发斑片状密度增高影,内见空洞影,左肺上叶索条影及结节样影较前相仿。予「美罗培南」抗感染治疗,症状有所好转。
2016年12月初,出现发热,体温最高40℃,伴有咳嗽、咳黄痰,无咯血,盗汗,胸痛等症状。为进一步诊治入我院。
2016年11月3日肺部CT:
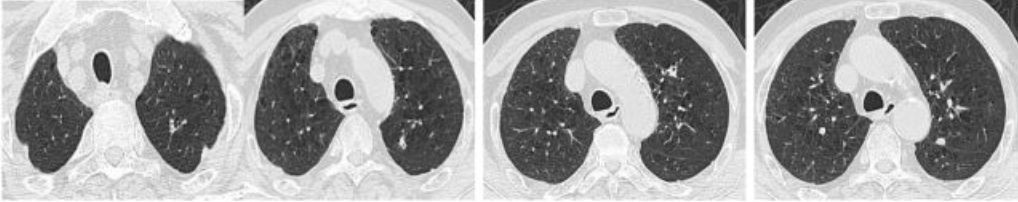
2016年11月25日肺部CT:
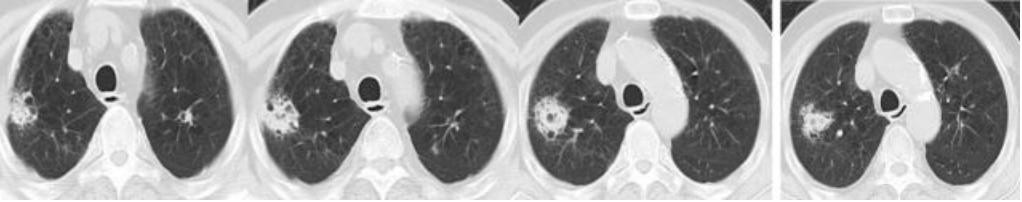
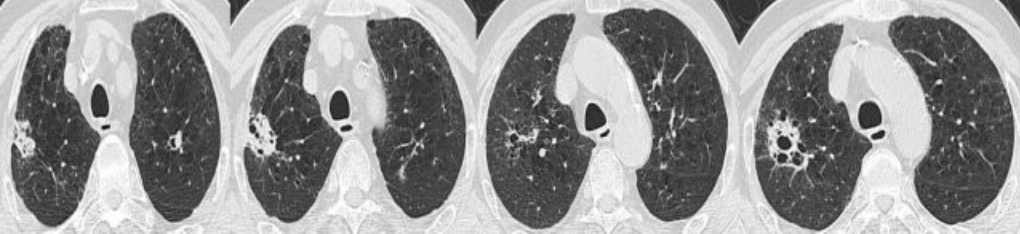
2016年12月8日肺部CT:
讨论要点
1、患者咳嗽咳痰发热,外院强力抗感染治疗,效果欠佳(症状+影像学)。肺部病变是感染性病变还是非感染性病变?
患者为老年男性,长期服用激素,属免疫抑制人群,有发热、咳嗽、咳痰临床症状,感染指标有一定升高,肺部CT可见新发肺部阴影,首先考虑感染性病变,其中常见的细菌感染不能除外,但患者外院曾使用美罗培南等强力抗生素治疗,却改善不明显,考虑尤其对于免疫抑制患者,真菌、结核、病毒以及机会性致病菌的感染可能性更大,另外,患者肺部CT可见右肺阴影,可见小毛刺、胸膜牵拉等表现,结合患者曾使用环磷酰胺史,肿瘤同样不能除外。
2、两次下呼吸道合格痰标本培养:烟曲霉,临床诊断亚急性侵袭性肺曲霉病(慢性坏死性肺曲霉病),而曲霉的抗原检测试验,即半乳甘露聚糖抗原检测(GM试验)为何却为阴性?
GM是曲霉菌细胞壁上的一种多糖,在曲霉菌丝向组织侵袭性生长时释放进入血液循环,这种抗原血症可持续存在1~8周。感染的曲霉菌种不同、中性粒细胞水平、肾功能、感染部位营养、血中出现抗曲霉抗体、进行抗真菌治疗、患者基础疾病及免疫抑制状态等因素会影响GM在血中的浓度。
在一些儿科患者、肠粘膜受损患者、应用哌拉西林他唑巴坦及阿莫西林克拉维酸抗生素的患者、使用环磷酰胺的患者中可能会出现假阳性,而在一些高抗曲霉抗体滴度的患者、真菌释放GM量少的患者、已经使用抗真菌药物的患者以及局部侵袭性曲霉感染的患者中可能会出现假阴性的结果。
研究表明:血和BALF GM试验对血液病患者侵袭性曲霉病具有较好的敏感性和特异性,血GM试验对非粒缺患者侵袭性曲霉病的诊断价值有限,而BALF GM试验对其却具有很好的敏感性和阴性预测值。因此,指南推荐对恶性血液病和造血干细胞移植患者,将血清和BALF GM检测作为诊断 IA 的精确标志物,对接受抗真菌治疗或预防者,不建议常规筛查血液GM,但可检测支气管镜样本GM,对实体器官移植(SOT)受体或慢性肉芽肿病(CGD)患者不建议筛查GM。在慢性肺曲霉病的诊断中应采用BALF进行GM测定,而不宜采用血浆进行GM测定。
本例患者属免疫抑制人群,诊断亚急性侵袭性肺曲霉病,事实上指南推荐BALF进行GM测定,而不宜采用血浆进行GM测定。
第二阶段
2017年1月11日,复查肺部CT提示右肺上叶病灶较前明显吸收,而双肺却又新发多发的结节和斑片影,2017年1月20日,患者再次出现发热,体温最高39.6℃,畏寒,无寒战,偶有咳嗽,少量咳痰,给予对症退热治疗后体温下降至正常。后患者间断出现发热,2017年1月24日,复查胸部CT提示病变较前进展,于次日为进一步治疗入院。
血常规提示中性粒细胞及CRP有升高,G试验、GM试验正常,结核感染T细胞检测阴性,类风湿三项、抗核抗体五项、自身抗体谱11项均阴性,体液免疫IgG 449mg/dl。
2017年1月11日肺部CT:
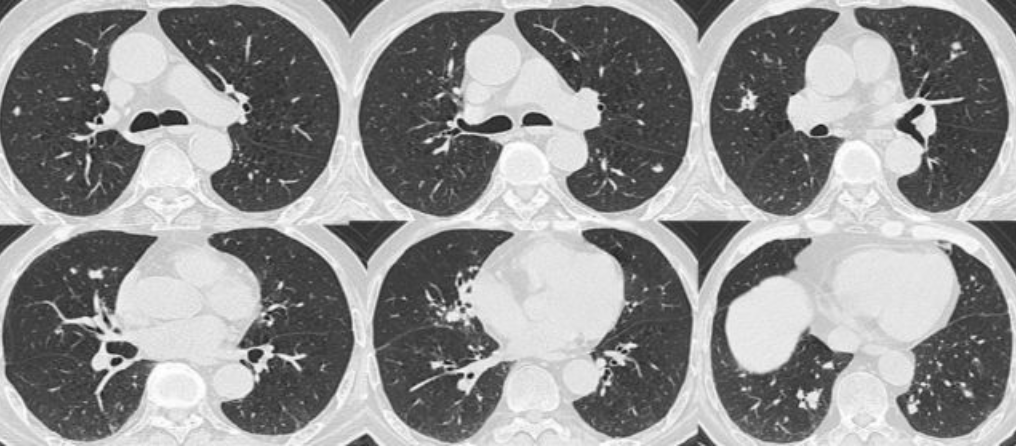
2017年1月24日肺部CT:
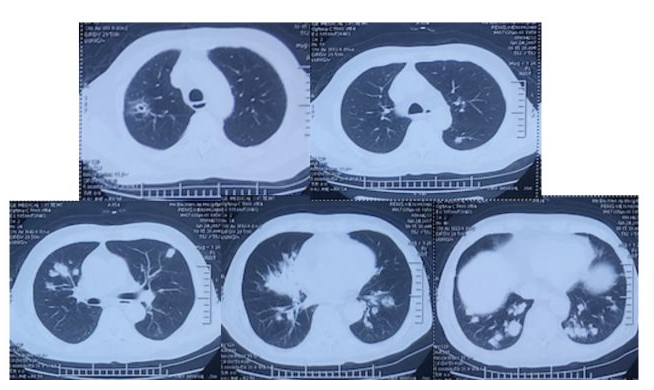
2017年2月4日肺部CT:
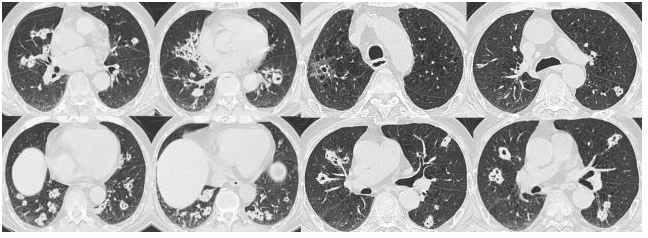
讨论要点
1、患者肺部再次新发阴影,是感染性疾病还是非感染性疾病?如果是感染性疾病,是原有曲霉感染未能有效控制还是出现新的病原菌感染?
患者有发热、畏寒,中性粒细胞及CRP有升高,肺部CT有新发阴影,首先仍然考虑感染性病变。由于患者一直规律服用伏立康唑抗曲霉治疗,所以认为此次双肺多发病灶与原右上肺病灶不同,并非曲霉感染病灶。新的感染性病灶的病原菌依然要考虑是细菌、其他真菌、病毒、结核还是其他的少见致病菌。其次,患者病灶有游走性,尿中可见红细胞,虽然风湿相关指标为阴性,但非ANCA相关性血管炎也不能除外,对于肿瘤,由于患者短时间内病灶变化速度较快,不考虑肿瘤可能。
2、经过治疗,4天后患者体温即下降至正常,但10天后复查肺部CT却发现病灶出现空洞,是否是抗生素治疗无效?肺部CT表现为空洞性病变的病原学如何考虑?
2017年2月4日复查肺部CT提示双肺多发病灶中出现空洞,并非意味着抗生素治疗无效,事实上可以发现复查的CT中的病灶周围的渗出影较前有吸收,主要考虑是炎症治疗过程中,肺部影像学吸收表现的滞后性所致。肺部CT空洞的病理基础为:空洞是具有完整壁的含气腔隙,空洞壁一般厚1mm以上,病变中心坏死后,其液化成分经支气管排出并引入空气而形成。可引起空洞性病变的病原学主要有:1.细菌:金黄色葡萄球菌、革兰阴性杆菌、放线菌、分支杆菌、类鼻疽、厌氧菌、肺炎球菌、奴卡菌;2.真菌:组织胞浆菌、毛霉菌、曲霉菌、隐球菌;3.寄生虫:包虫病、肺吸虫病、阿米巴病。
第三阶段
2017年11月10日,患者于肾内科复查住院期间再次出现发热,体温最高38℃,无明显畏寒、寒战,咳嗽、黄痰。
实验室化验提示:血常规 WBC 7.29×10^9/L,N 0.656,CRP 2.056mg/dl,IL-6 11.7pg/ml,血沉 14mm/h。体液免疫IgG 787mg/dl,CD4淋巴细胞亚群 0.16。PCT 0.084-0.172。T.spot-TB阴性,多次痰涂片未查见抗酸杆菌。G实验:16.3-21.1pg/ml。GM实验:0.72ug/L。EB病毒、CMV病毒 IgM : 阴性。支原体、衣原体:阴性,支原体抗体滴度:1:40。痰涂片:奈瑟菌属 草绿色链球菌。肺部CT可见左肺上叶及右肺中叶新发肺部阴影。
给予伏立康唑抗感染治疗10天后,患者却出现发热,复查肺部CT提示病灶较前有增大;2017年11月22日加用美罗培南+左氧氟沙星+利奈唑胺抗感染治疗后体温却无下降,2017年11月30日加用磺胺(并未出现过敏现象,考虑患者提供过敏史有误),4天后(即2017年12月5日)体温正常,之后调整抗生素为米诺环素+舒普深也并未出现体温反复。2017年12月2日行气管镜检查,床旁气管吸物快速涂片中查见克雷伯菌属,同时可见中性粒细胞吞噬细菌现象……
2017年12月5日,痰培养结果回报为肺炎克雷伯菌,并随后多次培养出该菌。患者后病情平稳,于2018年1月4日出院,院外口服米诺环素+伏立康唑,复查肺部CT随访发现,患者左肺病变吸收良好。
2017年11月10日肺部CT:

2017年11月20日肺部CT:
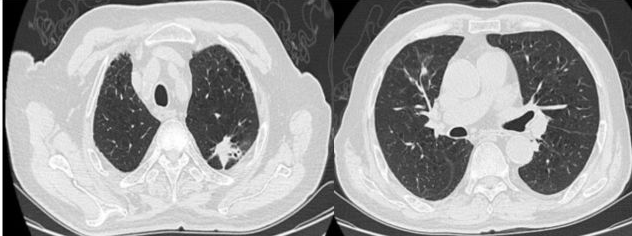
讨论要点
患者此次是何种病原菌导致的感染?是泛耐药肺炎克雷伯菌?还是曲霉菌?还是奴卡菌?
患者有感染CRE的危险因素,但其临床表现较轻,与CRE感染似乎不符,同时,CRE的治疗一般推荐以替加环素或多粘菌素为基础的两药联合或三药联合,该患者治疗中并未使用替加环素或多粘菌素,却效果很好,无法解释。但国外有关于以磺胺单药治疗CRE成功的案例,本例患者是否因使用磺胺而治愈CRE,持怀疑态度。同时,患者2017年11月10日肺部即出现新发阴影,2017年12月5日才查出CRE感染,考虑CRE很可能是治疗过程中药物筛选的一个结果,而不能以CRE感染来解释患者最初的肺部病变。
患者自本次入院,规范给予伏立康唑抗真菌治疗,治疗过程中却出现发热,同时肺部病变进展,考虑此次曲霉菌感染的可能性较小。
患者为免疫抑制人群,曾诊断肺奴卡菌病,治疗9月左右自行停药,相对于目前推荐的免疫抑制人群至少12个月的治疗疗程而言,停药过早,是否考虑本次为奴卡菌感染,事实上也不能以奴卡菌感染来解释此次发病。因为2017年11月22日加用的美罗培南、利奈唑胺、左氧氟沙星等药物均有很好的抗奴卡菌感染的作用,但患者发热却一直持续到2017年12月5日,而以加用磺胺后体温能迅速下降,也无法解释奴卡菌感染。
本次感染的病原学并不能明确,考虑很可能为混合感染。
大咖发言总结
呼吸与危重症科佘丹阳主任就第一阶段病程进行点评:
1、肺曲霉病并非一种病,是一类疾病。肺曲霉病的症状体征、影响表现、治疗预后均与患者的免疫状态有关,不同免疫背景之下,患者的感染特点并不一致,严重免疫缺陷患者感染之后通常表现为血管侵袭性为特点的侵袭性曲霉病,可见空气新月征、晕征、楔形实变,但在轻中度免疫缺陷的患者中,影像改变主要以沿气管支气管束分布为主的病变,结构性肺病患者的曲霉感染通常为慢性肺曲霉病,以空洞、洞中球、毁损肺为主要表现。本例患者最初肺部CT左肺病变可见沿气管支气管束分布的特点以及支气管管壁增厚,其早期为气道侵袭性改变,该患者为轻中度免疫缺陷基础上发生的亚急性侵袭性曲霉病。
2、根据宿主因素及肺部CT表现选择诊断技术,痰培养曲霉生长的临床意义取决于宿主的免疫状态。免疫正常患者,通常意味着定植、不需要立即进行抗真菌治疗,必须进行恰当的辅助检查排除肺曲霉病。免疫缺陷患者,痰培养的意义对IPA具有很高的预测价值。痰培养阴性不能排除肺曲霉病。BALF涂片和培养:与痰培养相比,特异性较高、敏感性较差。血和BALF GM试验对血液病患者侵袭性曲霉病具有较好的敏感性和特异性。血GM试验对非粒缺患者侵袭性曲霉病的诊断价值有限,但BALF GM试验对其具有很好的敏感性和阴性预测值。
呼吸与危重症科管希周主任就第二阶段病程进行点评:
肺奴卡菌的诊断主要包括以下几个方面:存在易感因素,有发热、咳嗽、咳黄脓痰等临床表现,胸部CT有相应表现,体液、组织标本培养奴卡菌阳性可确诊。临床表现无特异性,咳嗽、咳黄脓痰、发热是奴卡菌的常见临床症状,咯血、胸闷、胸痛、乏力、体重下降等,因受累部位及病程时间而异。影像表现多种多样,胸部CT有小叶性肺炎、大叶性肺炎、肺脓肿、肺部空洞、结节、胸腔积液等多种表现,结节/肿块、实变、空洞(多发脓肿及小空洞)、胸腔积液等CT表现最常见。实验室检查无特异,血常规中白细胞、中性粒细胞升高,血沉增快,PCT一般无明显升高,细菌培养和鉴定是诊断该病的金标准。标本可以是痰液、支气管肺泡灌洗液、胸腔积液、经皮肺穿组织等,奴卡菌生长缓慢,需氧培养2~7天可见菌落生长,有时2周时间才出现菌落特征性外观,因此,对可疑标本需与检验科室沟通,延长培养时间。
治疗药物主要包括磺胺类、四环素类(多西环素、米诺环素)、喹诺酮类、B-内酰胺类、大环内酯类、恶唑烷酮类(利奈唑胺)。该患者肺奴卡菌病诊断明确,由于患者提供磺胺类药物过敏的病史,给予了美罗培南+左氧氟沙星治疗的方案,出院后继续米诺环素+左氧氟沙星的治疗,经过随访,吸收良好。但该患者短期内出现曲霉感染、奴卡菌感染,充分说明其免疫力存在问题,患者未来的感染之路也许会很长,是否仍会一样幸运,却令人担忧。
呼吸与危重症科科主任解立新主任为本次PCCM病例讨论进行点评:
1、PCCM对未来的中国呼吸与危重症的发展是一个里程碑式的事件,对年轻医生的规范化培训和培养有很重要的价值,对规范年轻医生的临床思维和诊疗思维很有意义,甚至我个人作为一个高年资医生,也从中学习到了很多东西,一个年轻的医生在这个病例的诊治和准备过程中,也是自己的一个临床逻辑思维的训练,目前我们科每周都有一个类似的PCCM的病例讨论,我也很高兴看到了短短几个月,我们的学员的进步,同时也感谢互联网的发展,让各个城市的年轻学员们能方便、快捷地获取知识,共同成长。
2、本例患者的第一次、第二次感染都能迅速地明确病原学,进行规范治疗,第三次的病原学确实目前不是很明确,这也是临床工作中存在的比较现实的问题,但是,作为一个呼吸与危重症专业的医生,我们一定要跳出自己临床的局限性,除了关注病原体,应同时关注到患者免疫状态,从而从患者的整体一个更高的角度去考虑问题,这位患者是很无奈的,但是他不应该被动等待下次感染。对于患者而言,原发疾病要做治疗,要做免疫抑制,而免疫抑制很可能诱发感染,临床医生的智慧应该表现在免疫力的维持、感染的早期预防、感染的治疗中找到平衡,使患者最大获益。
3、同时,快速床旁病原学评价技术的发展对于诊断提供很大的帮助,我们也期待更多的新技术的出现,呼吸与危重症医学科医生除了依赖微生物等相关科室的结果,应更多掌握新的技术手段,帮助在第一时间第一现场大概明确感染的病原体,及时的判断对于快速诊断和后续治疗有很大帮助。
作者介绍

点击文末「阅读原文」可回看本次直播


