前言
侵袭性肺曲霉病常见于免疫功能受损/抑制的患者,包括中性粒细胞减少的患者和具有高危因素的非中性粒细胞减少(器官移植、危重症、肝肾功能衰竭、使用激素等)的患者。近年来研究者发现当健康成人大量接触曲霉菌孢子时(如:接触发霉的干草、树皮、溺水),也会导致侵袭性肺曲霉病的发生。[1,2] 侵袭性肺曲霉病的发病率在所有侵袭性真菌感染中占一半以上,预后差,病死率高,早期诊断和及时治疗可以显著降低患者死亡率。
临床资料
患者,女,49岁,湖北宜昌人。因「咳嗽咳痰伴发热、呼吸困难半月,心前区疼痛两天」于2015年7月16日入院我科。患者2015年7月1日因「肾功能不全、全身皮肤疼」于宜昌市中心医院肾内科住院治疗,入院后予抗感染、激素、抗过敏治疗(具体不详),一周后出现咳嗽、咳白色粘痰,伴发热,最高39.3℃。加强抗感染及对症治疗后一周,突发胸闷、心慌、气促,大汗淋漓,无胸痛、恶心呕吐等其他不适,查BNP 1618 pg/ml。给予患者强心、利尿治疗后上述症状有所好转。次日出现咳黄色脓痰、呼吸困难、声嘶,治疗后症状无缓解。两天前患者出现心前区持续性针刺样疼痛。为求进一步治疗于2015年7月16日以「肺部感染,心功能衰竭?慢性肾功能衰竭」转入我院继续治疗。患者自患病以来,精神,睡眠,饮食一般,大小便正常。
20余年前发现「贫血」,具体不详,未经正规治疗。发现肾功能不全1年。否认高血压、糖尿病及心脑血管疾病史,否认乙肝、结核病史,否认手术及外伤史,否认吸烟饮酒、吸毒史,否认药敏史。
入院查体
体温 36.6℃,心率120次/分,呼吸28次/分,血压137/83 mmHg。患者意识清楚,精神稍差,皮肤巩膜无黄染。浅表淋巴结未触及肿大。双肺呼吸音粗,未闻及明显干湿性啰音。心律齐,各瓣膜区未闻及病理性杂音。腹部及神经系统无阳性体征。双下肢不肿。
入院时辅助检查
血常规白细胞计数 14.42 ×10^9/L,中性粒细胞(%) 77.5 %,嗜酸细胞(%) 14.1 %,淋巴细胞(%) 5.6 %,红细胞计数 3.03×10^12/L,血红蛋白 82.0 g/L,血小板计数 69.0×10^9/L 。
血生化白蛋白 21.6 g/L,球蛋白 43.0 g/L,尿素 16.07 mmol/L,肌酐 278 umol/L,尿酸 649.8 umol/L,肾小球滤过率估值(eGFR) 15.7 ml/(min·1.73㎡),甘油三酯 2.39 mmol/L,高密度脂蛋白 0.69mmol/L。乳酸脱氢酶 302 U/L。超敏C反应蛋白 64.3 mg/L,降钙素原 0.48 ng/mL,血沉 116 mm/H。N末端B型利钠肽原(NT-proBNP) 1972 pg/mL, D-二聚体定量 1.34 ug/mL FEU。总免疫球蛋白E 2199.32 IU/mL。风湿全套抗核抗体胞浆颗粒型1:320,核颗粒型1:320。P-ANCA(+)。免疫全套补体C4 0.04 g/L。
粪常规及隐血、肌钙蛋白、血清蛋白电泳、尿蛋白电泳正常范围。抗GBM抗体、抗O、输血前八项、T-SPOT、痰找抗酸杆菌均阴性。心电图提示Ⅱ、Ⅲ、aVF导联可见q波,心脏彩超及大血管彩超无明显异常。肾脏彩超示双肾体积缩小、血流灌注减少、双肾囊肿。乳腺彩超示右侧乳腺囊性病灶。
7月20日胸部CT示双肺多发结片影,部分内可见厚壁空洞,多考虑为感染性病变;双侧胸膜增厚,局部粘连;纵隔及双侧腋窝淋巴结增多,部分增大(图1)。
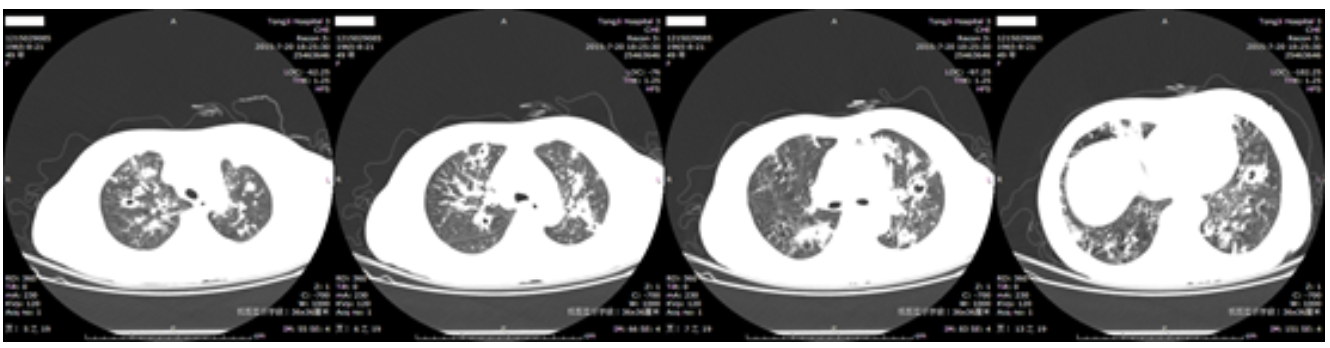
【图1】2015-7-20胸部CT:双肺多发结片影,部分(右上叶、左舌叶)可见厚壁空洞。
7月24日行经纤支镜肺穿刺活检检查,纤支镜内镜所见:喉、气管、隆突可见大量污垢样坏死物附壁,生理盐水冲洗后不能吸出。双侧支气管管腔亦可见少许污垢样坏死物附壁,(图2)。
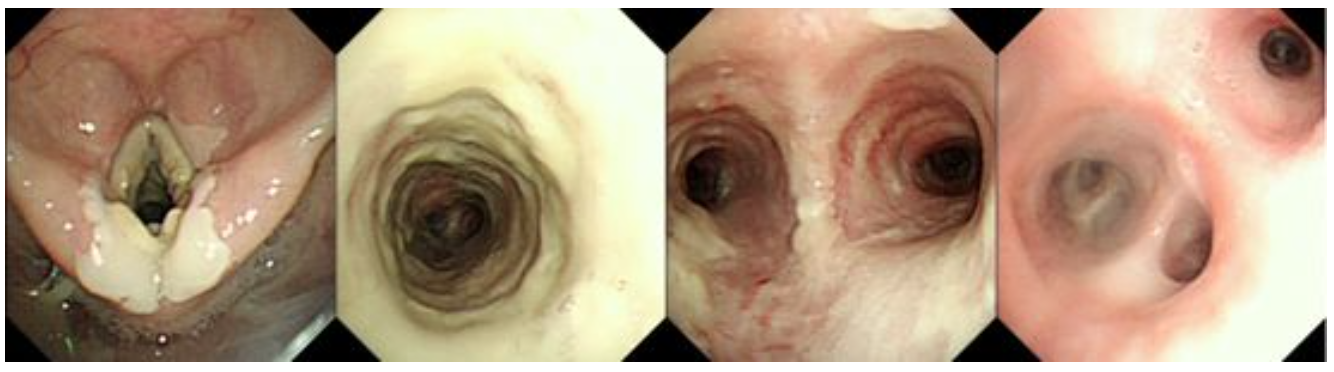
【图2】纤维支气管镜镜下所见:声门、气管、隆突可见大量污垢样坏死物附壁,支气管镜负压不能完全吸出。左右支气管管腔通畅。
纤支镜病理结果:(肺右上叶前段组织)肺组织呈慢性炎症改变,周围可见少许菌丝及真菌菌团,考虑曲菌感染(图3)。
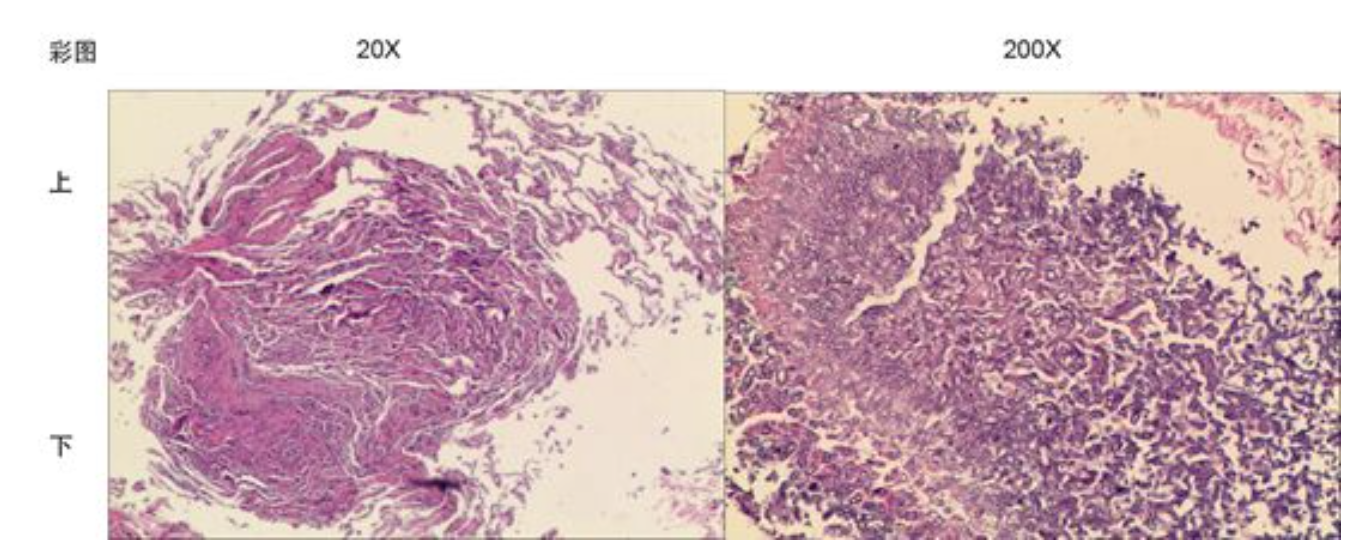
【图3】纤支镜病理结果:(肺右上叶前段组织)肺组织呈慢性炎症改变,周围可见少许菌丝及真菌菌团,考虑曲菌感染。
诊疗过程
入院后首先给予美罗培南0.5 g q6h联合莫西沙星0.4 g qd抗感染治疗,静脉注射甲基强的松20 mg qd。患者病情无明显好转(胸闷、胸痛、气促、咳嗽等症状及痰量及性状未见明显改善,白细胞无明显下降)。
7月21日及7月22日痰检出烟曲霉。遂予卡泊芬净 50 mg qd抗真菌治疗,增加甲基强的松剂量至40 mg qd,并静脉丙种球蛋白治疗。
7月24日行经纤支镜肺活检检查,术后患者出现右侧胸闷、胸痛、气急症状不能缓解,氧饱和度波动在88%左右,胸部听诊提示右肺呼吸音低。急查床边胸片证实存在气胸。行胸腔闭式引流术后患者胸闷症状明显好转。
7月27日痰培养出鲍曼不动杆菌(MDR),铜绿假单胞菌(PDR)。7月27日肺组织活检结果提示肺组织可见真菌菌丝,曲霉感染。遂加用伏立康唑200 mg q12h联合卡泊芬净抗真菌治疗。
7月31日复查胸部CT提示:双肺改变,考虑为感染性病变,真菌感染可能,与前片比较,空洞增大增多,部分斑片影减小;右侧少量气胸;双侧颈部、胸壁及纵隔广泛积气;双侧胸膜增厚,局部粘连;纵隔及双侧腋窝淋巴结增多,部分增大(图4)
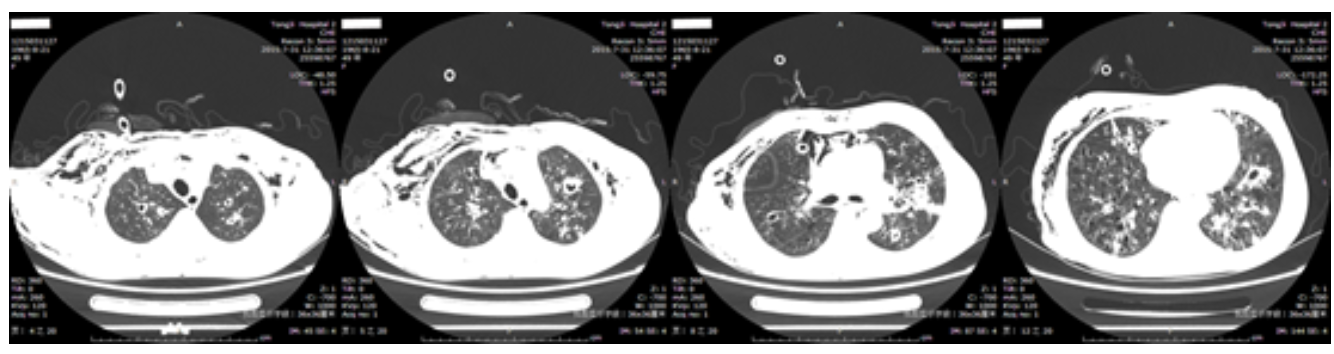
【图4】2015-7-31胸部CT:双肺多发结片影,较前片(2015-7-20)部分缩小,可见厚壁空洞,较前片增多增大
复查血常规正常范围,肾功能示尿素 14.40 mmol/L,肌酐 202 umol/L,尿酸 426.4 umol/L。C反应蛋白 57.6 mg/L,降钙素原 0.37 ng/mL,血沉 44 mm/H。NT-proBNP 3716 pg/mL。总免疫球蛋白E 435.70 Iu/mL。经过上述治疗患者胸闷、胸痛、气促等症状有所缓解。8月3日患者要求回当地医院继续治疗,自动出院。
最后诊断
侵袭性气管、支气管、肺曲霉菌病累及声门,I型呼吸衰竭;右侧气胸闭式引流术后,皮下气肿;慢性肾功能不全,氮质血症;多脏器功能受损(肝脏、心脏);中度贫血;风湿性疾病待排。
随访一周患者在当地医院因感染未控制、呼吸衰竭死亡。
讨论
曲霉菌是一种常见的真菌,包括烟曲霉、黄曲霉、黑曲霉、土曲霉等。大部分人群吸入曲霉菌孢子无任何症状及体征,只有少部分人会发展为肺曲霉菌病。肺曲霉病主要由烟曲霉引起,疾病的发展由真菌和宿主之间的相互作用所决定,很大程度上取决于患者的免疫状态。对于免疫亢进患者,变应性支气管肺曲霉病、外源性过敏性肺泡炎较常见。慢性肺曲霉病主要发生在有慢性肺病的患者中,可无免疫缺陷或伴随轻度免疫缺陷。侵袭性肺曲霉病常见于免疫损伤/缺陷的患者,包括中性粒细胞减少患者(造血干细胞移植患者、正在接受化疗的患者)和日益增加的非中性粒细胞减少患者(使用糖皮质激素治疗的患者、肺移植患者、危重症患者、应用多种广谱抗生素、肝衰竭、肾功能衰竭、艾滋病患者等)[3]。
近三十年来,随着化疗药物、免疫抑制剂、广谱抗生素的广泛使用,以及器官移植的开展,侵袭性肺曲霉病的发病率逐年增加。[4]法兰克福歌德医院的流行病学调查显示从1978年到1992年,侵袭性肺曲霉的发病率从0.4%增至3.1%,[5]而1993年至2005年发病率由~4.2%增至~5.5%。[6]活检结果显示侵袭性肺曲霉病在所有真菌感染中所占的比例也从17%增至60%。
侵袭性肺曲霉病临床症状无特异性,可表现为发热、咳嗽、咳痰、咯血、呼吸困难,抗生素治疗无反应等。[7]非中性粒细胞减少患者早期表现不典型,较少出现发热。本例患者早期即表现为咳嗽、咳痰、发热,逐渐出现胸闷呼吸困难,抗生素治疗无效,应高度警惕肺曲霉菌感染。
侵袭性肺曲霉病的早期CT的特征性表现是晕轮征。曲霉菌侵犯血管,引起出血性梗死,与结节中心性坏死组成晕轮征。[8]此外,近年来研究者提出的反晕轮征也是侵袭性肺曲霉病的一种早期CT表现,以HRCT所示周围较高密度实变影环绕中央磨玻璃样影为特征,[9]多见于接合菌病(毛霉菌感染)。无中性粒细胞减少的侵袭性肺曲霉病通常无血管累及,可形成化脓性肉芽肿性炎症或炎症性坏死,CT表现为单发或多发的结节影或结片影。疾病晚期,结节周围组织坏死、液化形成含气空腔,表现为典型的新月空气征。[10]无中性粒细胞减少的侵袭性肺曲霉感染往往缺乏典型的症状和影像学改变,病情进展相对缓慢(通常需要数周),导致诊断比较困难,延误治疗的几率显著增加。本例患者有激素使用、肝功能不良、肾功能不全、应用多种抗生素等高危因素,且血总Ig E明显升高,结合患者的症状体征及入院后胸部CT影像,在痰检和肺组织病理未果的情况下,亦应高度怀疑侵袭性肺曲霉病。
临床表现及影像学的特征有一定的时间性且没有任何一种征象可以同时具备较高的灵敏度和特异度,[11]确诊仍有赖于真菌培养或组织病理学检查。此外,实验室检查还包括血标本和BALF标本中曲霉菌的免疫学(GM和G实验)和分子生物学检测(PCR法),两种方法的敏感度及特异度相当。[12]研究证实,BALF GM 试验对于非中性粒细胞减少患者敏感度较高,而血清GM 试验的敏感度较低。[13]进行多个检测可以增加诊断的敏感度,但是不会改善特异性。本例患者2次检痰提示烟曲霉,纤支镜病理结果显示肺组织周围可见少许菌丝及真菌菌团,考虑曲霉菌,侵袭性肺曲霉菌病的诊断明确。
侵袭性肺曲霉病进展迅速,且往往是致命的。因此,一旦怀疑侵袭性肺真菌病,尽管诊断依据不够成分,应开始经验性抗真菌治疗,首选静脉用药。目前为止,传统的两性霉素B(amphotericin B)及伏立康唑(voriconazole)是侵袭性肺曲霉病的一线用药。伏立康唑能显著改善侵袭性肺曲霉病患者的预后。由于两者的肝肾毒性,患者合并肝、肾功能衰竭时需权衡利弊,谨慎使用。使用伏立康唑需密切监测血药浓度,同时关注药物间的相互作用。非中性粒细胞减少的 IA 患者的疗程至少 12 周,可通过 CT 随访了解病变情况,同时结合免疫抑制 / 缺陷情况来决定疗程长短。卡泊芬净(caspofungin)和米卡芬净(micafungin)属于棘白菌素类抗真菌药物,治疗耐受性良好,为部分患者提供了新的选择,但目前仍然是侵袭性肺曲霉病的二线治疗方案,作为其他药物治疗失败的补救药物。本病例中患者有激素使用史,以发热及呼吸困难,咳嗽咳痰为主要症状,胸部CT提示双肺多发结片影,部分内可见厚壁空洞。因存在肝肾功能不全,开始给予卡泊芬净(50mg qd)经验性抗真菌治疗。在患者纤支镜肺活检提示曲霉感染时,立即给予伏立康唑(0.2g,q12h)联合治疗,同时甲基强的松龙等对症、支持等治疗,患者一般状况稍有所好转,遂要求回当地继续治疗。
本例患者曲霉菌不仅侵袭肺脏,而且累及大气道和声门。导致患者声嘶和呼吸困难。声门曲霉病发病率低,在免疫功能正常病人中非常罕见[14-16],多与吸入性激素和细胞毒性药物的使用相关。大气道也是曲霉菌感染的少见部位,仅占呼吸系统曲霉菌病的7%左右。[17]侵袭性气道曲霉菌病预后差,病死率高,早期诊断及治疗至关重要。
然而,由于病例罕见且缺少长期随访资料,目前声门及大气道曲霉菌感染的治疗经验尚不充分。停止局部激素使用(比如吸入性激素),行手术治疗(伪膜清理术、喉囊肿切除、激光烧灼术等)联合抗真菌药物治疗声门曲霉菌感染可以获得良好的效果。[18]喉曲霉感染的抗真菌治疗包括局部及全身治疗,两性霉素含片(10 mg,qid)被证实有效,两性霉素漱口水可作为术后的辅助治疗。全身治疗可选用两性霉素及唑类药物,口服唑类可作为静脉两性霉素治疗的后续辅助治疗,疗程一般为21-28天,根据患者的免疫功能及病史调整。[16,19] 部分专家认为相比于酮康唑(ketoconazole)和两性霉素B,伊曲康唑(itraconazole)的副作用小,预后好。15侵袭性气管曲霉菌感染可采用手术(气管切开、支架植入)联合伏立康唑(1-4 mg/l)治疗。[20,21]
侵袭性肺曲霉病患者预后差,病死率极高。研究显示BAFL标本GM试验结果可以作为判断患者预后的指标,GM指数≥2.0反映患者预后较差的灵敏度和特异度分别是100%和77%。[22] 本例患者侵袭性肺曲霉病的诊断及治疗及时有效,但因病情凶险,患者要求回当地继续治疗,随访患者死亡。从病例中我们学到侵袭性肺曲霉病的经验性治疗非常重要,从疑诊、临床诊断到确诊,需要结合临床表现、影像学特征、多种检测结果,经过合理的分析和判断,才能有效的减少漏诊率和误诊率,对我们日后的临床工作有一定的指导意义。
参考文献
[1] Butler L, Brockley T, Denning D, et al. Acute Aspergillus pneumonia associated with mouldy tree bark chippings, complicated by anti-glomerular basement membrane disease causing permanent renal failure. Med Mycol Case Rep 2013; 2:125-127
[2]Ratermann KL, Ereshefsky BJ, Fleishaker EL, et al. Fulminant Invasive Pulmonary Aspergillosis After a Near-Drowning Accident in an Immunocompetent Patient. Ann Pharmacother 2014; 48:1225-1229
[3]Kosmidis C, Denning DW. The clinical spectrum of pulmonary aspergillosis. Thorax 2015; 70:270-277
[4]Chamilos G, Luna M, Lewis RE, et al. Invasive fungal infections in patients with hematologic malignancies in a tertiary care cancer center: an autopsy study over a 15-year period (1989-2003). Haematologica 2006; 91:986-989
[5] Groll AH, Shah PM, Mentzel C, et al. Trends in the postmortem epidemiology of invasive fungal infections at a university hospital. J Infect 1996; 33:23-32
[6] Lehrnbecher T, Frank C, Engels K, et al. Trends in the postmortem epidemiology of invasive fungal infections at a university hospital. J Infect 2010; 61:259-265
[7] Kousha M, Tadi R, Soubani AO. Pulmonary aspergillosis: a clinical review. Eur Respir Rev 2011; 20:156-174
[8] Kuhlman JE, Fishman EK, Burch PA, et al. CT of invasive pulmonary aspergillosis. AJR Am J Roentgenol 1988; 150:1015-1020
[9] Wahba H, Truong MT, Lei X, et al. Reversed halo sign in invasive pulmonary fungal infections. Clin Infect Dis 2008; 46:1733-1737
[10] 朱小敏,周新. 侵袭性肺曲霉病的诊断与治疗. 中国呼吸与危重监护杂志 2005; 30:316-320
[11] Kawel N, Schorer GM, Desbiolles L, et al. Discrimination between invasive pulmonary aspergillosis and pulmonary lymphoma using CT. Eur J Radiol 2011; 77:417-425
[12] Torelli R, Sanguinetti M, Moody A, et al. Diagnosis of invasive aspergillosis by a commercial real-time PCR assay for Aspergillus DNA in bronchoalveolar lavage fluid samples from high-risk patients compared to a galactomannan enzyme immunoassay. J Clin Microbiol 2011; 49:4273-4278
[13] Meersseman W, Lagrou K, Maertens J, et al. Galactomannan in bronchoalveolar lavage fluid: a tool for diagnosing aspergillosis in intensive care unit patients. Am J Respir Crit Care Med 2008; 177:27-34
[14] Durell J, Taha R, Pipi G, et al. Aspergillus epiglottitis in a non-immunocompromised patient. BMJ Case Rep 2011; 2011
[15] Dutta M, Jotdar A, Kundu S, et al. Primary laryngeal aspergillosis in the immunocompetent state: a clinical update. Braz J Otorhinolaryngol 2015
[16] Ran Y, Lu Y, Cao L, et al. Primary laryngeal aspergillosis related to oral sex? A case report and review of the literature. Med Mycol Case Rep 2012; 2:1-3
[17] Drury AE, Allan RA, Underhill H, et al. Calcification in invasive tracheal aspergillosis demonstrated on ultrasound: a new finding. Br J Radiol 2001; 74:955-958
[18] Fairfax AJ, David V, Douce G. Laryngeal aspergillosis following high dose inhaled fluticasone therapy for asthma. Thorax 1999; 54:860-861
[19] Morelli S, Sgreccia A, Bernardo ML, et al. Primary aspergillosis of the larynx in a patient with Felty's syndrome. Clin Exp Rheumatol 2000; 18:523-524
[20] Warman M, Lahav J, Feldberg E, et al. Invasive tracheal aspergillosis treated successfully with voriconazole: clinical report and review of the literature. Ann Otol Rhinol Laryngol 2007; 116:713-716
[21] Radunz S, Kirchner C, Treckmann J, et al. Aspergillus tracheobronchitis causing subtotal tracheal stenosis in a liver transplant recipient. Case Rep Transplant 2013; 2013:928289
[22] Russo A, Giuliano S, Vena A, et al. Predictors of mortality in non-neutropenic patients with invasive pulmonary aspergillosis: does galactomannan have a role? Diagn Microbiol Infect Dis 2014; 80:83-86
作者:李晓晨、黄宏 - 华中科技大学同济医学院附属同济医院呼吸与危重症医学科
本文转载自订阅号「重症与康复」(ID:CriticalAndRehabCare)


