前言
流行性感冒病毒是危害人类最为严重的呼吸道病毒,主要分为三个型别,甲型(A型),乙型(B型),丙型(C型)。2015年在猪和牛中发现到一种新的流感病毒,被命名为丁型流感病毒(D型)[1]。在人群中广泛传播并致病的是甲型和乙型流感病毒。
目前,临床上针对流感患者使用的抗病毒药物主要有两类,一类为烷胺类药物,即流感病毒M2离子通道阻断剂,在60年代开发出来并用于临床,包括金刚烷胺和金刚乙胺,该类药物仅针对甲型流感,对乙型流感无效[2];另外一类药物为神经氨酸酶(Neuraminidase,NA)抑制剂,包括奥司他韦(Oseltamivir,达菲)、扎那米韦(Zanamivir,易乐韦)、帕拉米韦(Peramivir)、拉尼那米韦(Laninamivir),其中前三种在我国已上市。由于目前流行的流感病毒均对烷胺类药物耐药(病毒NS基因出现S31N突变),神经氨酸酶抑制剂类药物是流感患者抗病毒治疗的唯一选择,其耐药情况值得我们重点关注。
临床常用NA抑制剂及其作用原理
流感病毒表面布满了两个主要的糖蛋白,血凝素(Hemagglutinin,HA)和神经氨酸酶(Neuraminidase,NA),血凝素主要负责粘附宿主细胞表面的唾液酸受体从而启动感染,待子代病毒在细胞表面组装完毕后,NA负责切割细胞与病毒之间的乙酰神经氨酸,从而使子代流感病毒从宿主细胞表面释放进而感染更多的细胞。因此,当流感病毒的神经氨酸酶受到抑制时,新合成的子代病毒将聚集在宿主细胞表面而无法释放,从而阻遏了下一步的扩散和感染新细胞[3]。
目前的NA抑制剂药物是基于唾液酸的异构体2,3-双脱氢-2-脱氧-N-乙酰神经氨酸(DANA)设计出来的。DANA在70年代发现具有较弱的神经氨酸酶抑制活性[4], 但直到1983年NA的三维立体结构被解析出来后[5],通过对DANA进行药物设计,才开发出了具备较强NA结合能力的扎那米韦(Zanamivir)和奥司他韦(Oselamivir),并于1999年被美国FDA批准用于临床治疗甲型流感和乙型流感感染,随后其他国家陆续批准这两类药物。
相比较最初的唾液酸异构体DANA,扎那米韦有一个4-胍基,而在奥司他韦中,4-胍基被4-氨基取代,6-丙三醇被疏水的戊烷基取代(图1),这种改造使二者对NA的结合能力比DANA提高了1000多倍,远远高于细胞表面的N-乙酰神经氨酸,其结果是病毒的NA优先结合NA抑制剂类药物,无法与细胞和病毒之间的天然底物N-乙酰神经氨酸结合,无法切割病毒与细胞之间的连接,导致子代病毒聚集在细胞表面无法释放,从而抑制其感染新的细胞 [6]。
磷酸奥司他韦相比较扎那米韦具备更好的生物利用度,口服后在肝脏中转化为活性的碳酸奥司他韦[7]。扎那米韦的生物利用度较低,因而一般采用吸入的方式直接到达呼吸道起作用[8]。帕拉米韦(Peramivir)和拉尼米韦(Laninamivir)是后来开发的NA抑制剂药物,最初在日本获批。我国也在2013年批准了帕拉米韦氯化钠注射液用于临床流感患者的抗病毒治疗。
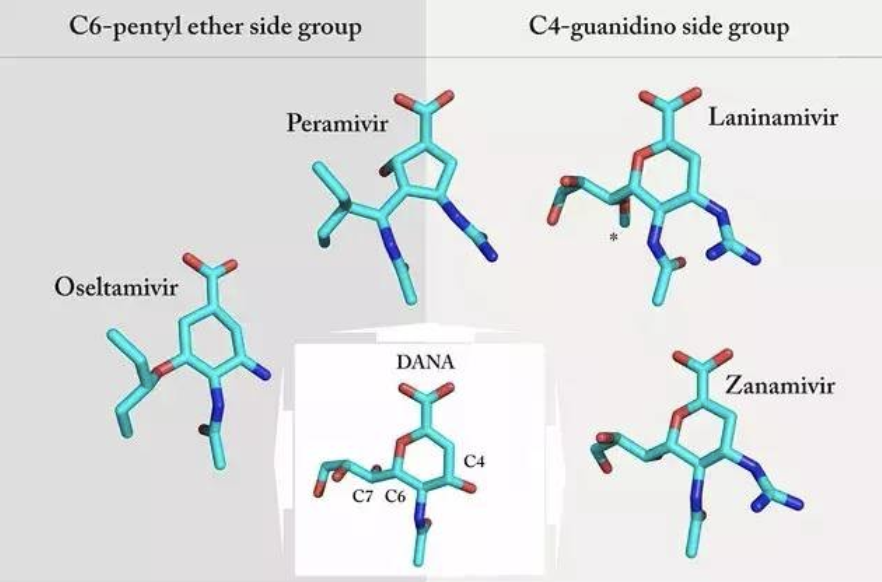
图1 NA抑制剂药物的结构
流感病毒NA抑制剂耐药概况
季节性H1N1亚型病毒
流行于人群中的H1N1病毒主要分为两种,2009年之前流行于人群中的季节性流感H1N1和2009年出现的引起全球性流感大流行的新甲流H1N1(pdm H1N1)。H1N1奥司他韦耐药毒株一般都存在着NA H274Y突变(H-组氨酸,Y-酪氨酸,H2714Y指NA蛋白274位的氨基酸由组氨酸突变成酪氨酸),且NA I22R和S246N突变可加强H274Y对奥司他韦的耐药 [9]。 此外,N294S突变也可引起季节性流感的奥司他韦耐药。在奥司他韦用于临床的最初5年中(1999~2004),成人患者中奥司他韦耐药的临床样本比例仅为0.33%,儿童患者中耐药比例较高,达到18% [10]。但在2007-2008流感流行季中,奥司他韦耐药的季节性流感H1N1比例急剧上升,导致随后的2008-2009流感流行季,在美国,地中海东部,欧洲和东南亚,几乎100%的季节性H1N1毒株均对奥司他韦耐药,表明奥司他韦耐药毒株迅速扩散至全球 [9]。目前人群中季节性H1N1已被2009年出现的pdmH1N1取代,已很少流行。
pdmH1N1流感病毒
2009年出现的新甲型H1N1流感(pdmH1N1)引起了21世纪第一次流感大流行,并迅速取代原来流行于人群中季节性流感H1N1。目前整体而言,对奥司他韦耐药的pdmH1N1比例一直稳定在一个较低水平,全球的耐药率为1.5%左右 [11]。尽管在某些地区使用了NA抑制剂,但绝大多数pdmH1N1对奥司他韦敏感。值得注意的是,在部分未使用奥司他韦治疗的患者中,出现了奥司他韦耐药毒株,这表明在在这些患者中,耐药毒株的出现很可能是由于耐药毒株在人群中传播而获得的,并非是由于药物选择的原因 [12]。扎那米韦和帕拉米韦对大部分季节性H1N1和pdmH1N1均敏感,耐药毒株报到较少 [9]。
季节性H3N2和B型流感病毒
季节性H3N2病毒的耐药通常是由R292K和E119V突变引起的,而在B型流感中,D198N和R371K突变会引起轻微耐药。目前,绝大部分季节性H3N2病毒和B型流感病毒对NA抑制剂敏感,耐药株主要分离自免疫缺陷患者 [13]。不过在2004~2005流感流行季,一位日本患者体内分离到了一株对奥司他韦和扎那米韦敏感性降低的B型流感毒株 [14],在2011年初,美国出现14例对奥司他韦和帕拉米韦敏感性降低,但对扎那米韦敏感性保持不变的B型流感聚集性病例 [15]。目前总体而言,季节性H3N2和B型流感病毒对NA抑制剂类药物还是高度敏感的 [16]。
禽流感耐药情况
目前感染人的禽流感病毒主要为H5N1和H7N9亚型。虽然偶有H5N1病例毒株显示对NA抑制剂敏感性减低,大部分H5N1临床毒株对奥司他韦依然敏感。自2013年出现首例人感染禽流感H7N9病例后 [17],H7N9禽流感病例人数迅速超过H5N1并引起了5波流行[18]。NA R292K突变可以导致H7N9对奥司他韦和帕拉米韦的高度耐药,对扎那米韦的部分耐药。E119V和I222K/R突变也可造成H7N9对奥司他韦耐药,但影响程度低于R292K [19]。这些突变不仅在体外实验中表现出对奥司他韦耐药,在雪貂体内实验中也显示出相似的耐药性。有研究显示,针对H7N9患者进行奥司他韦的抗病毒治疗可能导致奥司他韦耐药突变的产生 [20]。但总体而言,在H7N9患者发病的早期使用奥司他韦对患者改善患者预后作用很大,即使在发病48h后使用,也能改善患者预后有益 [20]。目前的监测显示,人感染H7N9毒株出现R292K突变的比例总体较低 [21]。我们通过对国际流感数据库中686个分离自患者的流感毒株序列分析显示,仅有32个毒株出现R292K突变,总体比例为4.66%。
国内流感耐药概况
根据国家流感中心的监测数据显示 [16],我国北方地区近期流行亚型主要是B型Yamagata及pdmH1N1,其次为甲型H3N2。自2017年4月1日-2018年1月21日,耐药监测数据显示,所有的甲型H1N1和H3N2毒株均对烷胺类药物耐药;所有的H3N2亚型和B型流感毒株均对NA抑制剂敏感,3株pdmH1N1对NA抑制剂敏感性高度减低,其余pdmH1N1对NA抑制剂均敏感。
耐药性检测方法
流感病毒的耐药性检测方法有两种:表型(Phenotype)检测和基因型(Genotype)检测。表型检测主要是检测神经氨酸酶抑制剂对流感病毒表面蛋白神经氨酸酶酶活性抑制作用是否减低来判断病毒是否耐药,通常用使病毒NA活性减低50%时的药物稀释倍数(CI50值)来表示;而基因型检测是检测病毒NA基因中是否存在导致耐药的突变。目前,临床上并无定义病毒为耐药的IC50阈值,因而通常联合使用两种方法评估病毒的耐药性 [3]。
1、流感病毒耐药表型检测方法
表型检测又称为功能监测,是通过神经氨酸酶抑制(Neuraminidase inhibition, NI)实验实现的。如前所示,流感病毒NA的功能是在病毒释放的环节切割病毒血凝素蛋白HA与细胞表面唾液酸SA的结合,从而使病毒得以释放,因此流感病毒NA的天然底物是宿主细胞表面与病毒HA蛋白相连接的糖基化唾液酸。小分子读物4-MUNANA模拟了病毒与宿主细胞的链接,在流感病毒NA的作用下水解生成的4-MU(4-methylumbeliferone)在碱性溶液中具有很强的荧光作用。通过测定反应后溶液的荧光强度即可确定生成产物的量,进而体现酶的活性 [22]。将神经氨酸酶抑制剂倍比稀释,观察不同稀释度的药物对病毒NA酶活性的抑制作用,记录NA酶活性减低一半时药物的稀释倍数,即IC50值,将其与敏感株的IC50值相比较,进而判断该病毒是否发生药物敏感性降低甚至耐药。目前,临床上并无绝对的IC50值用来定义病毒耐药,在临床抗病毒治疗时需综合考虑各种因素。

图2 NA催化4-MUNANA水解反应
2、基因型检测方法
基因型检测方法,即基于核酸序列的检测方法,主要包括测序和荧光定量PCR。通过设计引物和单碱基特异性的探针 [23],荧光定量PCR可实现实现4h检测耐药性突变,相比较测序和表型检测方法要简单迅速许多,并可直接对原始样本进行检测,避免了病毒分离和增值等费时费力的操作。由于基因变异与耐药突变的相关性并不完全清除,因而基因型检测仅能检测已知的耐药性突变,无法检测未知的突变,还不能替代传统的表型检测方法。
除了简单快捷,基因型检测方法还可以准确检测病毒群体中敏感/耐药毒株的比例。在2009 pdmH1N1和H7N9患者中,均出现敏感和耐药毒株同时存在的情形 [24]。而通过二代测序或者荧光定量PCR,含量低于总病毒数目1%的耐药毒株即可检测到。敏感和耐药毒株同时存在的情形将对IC50的解释产生困扰,因为这种同时含有敏感/耐药的混合病毒在表型检测时往往表现出敏感的性状,掩盖了耐药毒株的出现的事实 [25]。在焦磷酸测序时,当耐药毒株比例超过10%时,即报告病毒耐药的出现。但耐药毒株比例与总的混合病毒耐药表型之间的关系并未完全建立,病毒群体中的少量耐药毒株对患者治疗和传播的影响依然需要进一步研究。
结论
神经氨酸酶抑制剂依然是目前治疗流感病毒唯一的特异性抗病毒药物,在发病早期使用将显著改善患者的预后。尽管部分病毒存在耐药性突变,但总体上目前流行的H3N2,H1N1和B型流感病毒对其均敏感。在重症患者和免疫抑制患者的使用上,应密切关注其耐药性的出现,联合应用基因型和表型检测方法监测耐药毒株的出现。积极开发新的抗病毒药物,提高重症流感病例的救治水平。
参考文献
1.DucatezMF, Pelletier C, Meyer G. Influenza D virus in cattle, France, 2011-2014.Emerging infectious diseases 2015;21(2): 368-71.
2.Highlevels of adamantane resistance among influenza A (H3N2) viruses and interimguidelines for use of antiviral agents--United States, 2005-06 influenzaseason. MMWR Morbidity and mortality weekly report 2006; 55(2): 44-6.
3.NguyenHT, Fry AM, Gubareva LV. Neuraminidase inhibitor resistance in influenzaviruses and laboratory testing methods. Antiviral therapy 2012; 17(1 Pt B): 159-73.
4.PaleseP, Schulman JL, Bodo G, Meindl P. Inhibition of influenza and parainfluenzavirus replication in tissue culture by2-deoxy-2,3-dehydro-N-trifluoroacetylneuraminic acid (FANA). Virology 1974; 59(2): 490-8.
5.ColmanPM, Varghese JN, Laver WG. Structure of the catalytic and antigenic sites ininfluenza virus neuraminidase. Nature 1983;303(5912): 41-4.
6.vander Vries E, Schutten M, Fraaij P, Boucher C, Osterhaus A. Influenza virusresistance to antiviral therapy. Advances in pharmacology 2013; 67: 217-46.
7.MosconaA. Neuraminidase inhibitors for influenza. The New England journal of medicine 2005; 353(13): 1363-73.
8.HaydenFG, Gubareva LV, Monto AS, et al. Inhaled zanamivir for the prevention ofinfluenza in families. Zanamivir Family Study Group. The New England journal ofmedicine 2000; 343(18): 1282-9.
9.SamsonM, Pizzorno A, Abed Y, Boivin G. Influenza virus resistance to neuraminidaseinhibitors. Antiviral research 2013;98(2): 174-85.
10.WardP, Small I, Smith J, Suter P, Dutkowski R. Oseltamivir (Tamiflu) and itspotential for use in the event of an influenza pandemic. The Journal ofantimicrobial chemotherapy 2005; 55Suppl 1: i5-i21.
11.RenaudC, Kuypers J, Englund JA. Emerging oseltamivir resistance in seasonal andpandemic influenza A/H1N1. Journal of clinical virology : the officialpublication of the Pan American Society for Clinical Virology 2011; 52(2): 70-8.
12.HigginsRR, Beniprashad M, Chong-King E, et al. Recovery of influenza B virus with theH273Y point mutation in the neuraminidase active site from a human patient.Journal of clinical microbiology2012;50(7): 2500-2.
13.KisoM, Mitamura K, Sakai-Tagawa Y, et al. Resistant influenza A viruses in childrentreated with oseltamivir: descriptive study. Lancet 2004; 364(9436): 759-65.
14.HatakeyamaS, Sugaya N, Ito M, et al. Emergence of influenza B viruses with reducedsensitivity to neuraminidase inhibitors. Jama 2007; 297(13): 1435-42.
15.SleemanK, Sheu TG, Moore Z, et al. Influenza B viruses with mutation in theneuraminidase active site, North Carolina, USA, 2010-11. Emerging infectiousdiseases 2011; 17(11): 2043-6.
16. 中国国家流感中心. 流感周报(2018年第4周)
.Available
at:http://www.chinaivdc.cn/cnic/zyzx/lgzb/201802/t20180202_158647.htm.
17. GaoR, Cao B, Hu Y, et al. Human infection with a novel avian-origin influenza A(H7N9) virus. The New England journal of medicine 2013; 368(20): 1888-97.
18. WangX, Jiang H, Wu P, et al. Epidemiology of avian influenza A H7N9 virus in humanbeings across five epidemics in mainland China, 2013-17: an epidemiologicalstudy of laboratory-confirmed case series. The Lancet Infectious diseases 2017; 17(8): 822-32.
19.MarjukiH, Mishin VP, Chesnokov AP, et al. Neuraminidase Mutations ConferringResistance to Oseltamivir in Influenza A(H7N9) Viruses. Journal of virology 2015; 89(10): 5419-26.
20.HuY, Lu S, Song Z, et al. Association between adverse clinical outcome in humandisease caused by novel influenza A H7N9 virus and sustained viral shedding andemergence of antiviral resistance. Lancet 2013;381(9885): 2273-9.
21. SuS, Gu M, Liu D, et al. Epidemiology, Evolution, and Pathogenesis of H7N9Influenza Viruses in Five Epidemic Waves since 2013 in China. Trends inmicrobiology 2017; 25(9): 713-28.
22. 杨帆, 刘艾林,杜冠华. 神经氨酸酶抑制活性测定标准研究. In: 中国科协年会——生物医药博士论坛, 2011.
23. 赵翔, 黄维娟,隗合江, et al. 利用TaqMan-MGB探针检测A(H3N2)亚型流行性感冒病毒E119V耐药突变. 中华预防医学杂志 2013; 47(5): 448-51.
24.HurtAC, Chotpitayasunondh T, Cox NJ, et al. Antiviral resistance during the 2009influenza A H1N1 pandemic: public health, laboratory, and clinicalperspectives. The Lancet Infectious diseases 2012; 12(3): 240-8.
25.Yen HL, McKimm-Breschkin JL, Choy KT, et al.Resistance to neuraminidase inhibitors conferred by an R292K mutation in ahuman influenza virus H7N9 isolate can be masked by a mixed R/K viralpopulation. mBio 2013; 4(4).
本文转载自订阅号「京港感染论坛」(ID:PIDMIC)
文章原链接:【前沿速递】流感病毒神经氨酸酶抑制剂耐药近况
点击文末「阅读原文」也可跳转至原链接阅读


