一、慢阻肺小气道病变的病理表现
1、何为「小气道」?
临床上通常将内径小于2mm的小细支气管称为小气道[1]。如果把小气道和大气道平摊开来,小气道的表面积大小约是大气道表面积的5000倍。此外,小气道的特点有分支多、横截面积大、气流相对缓慢,并且小气道在病变的早期也容易出现小气道功能受损,引起气道的阻塞[2]。
2、小气道炎症
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD),最重要的病理生理变化之一就是小气道炎症。小气道炎症包括粘液的高分泌、杯状细胞大量的扩张和增生、鳞状上皮细胞化生、气道壁增厚和纤维化,平滑肌的增生和肥大等。小气道炎症也会造成肺泡连接的破坏和肺泡弹性回缩力的下降(图1-2)[3,4]。
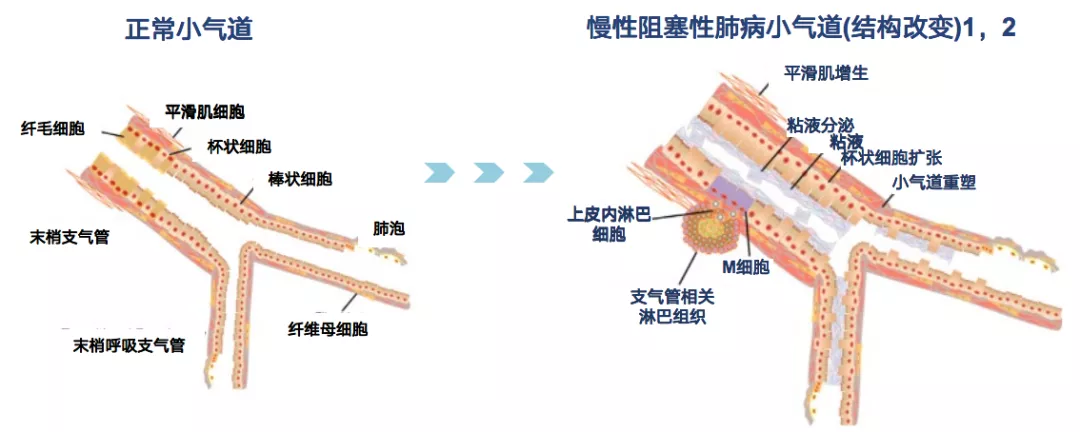
图1
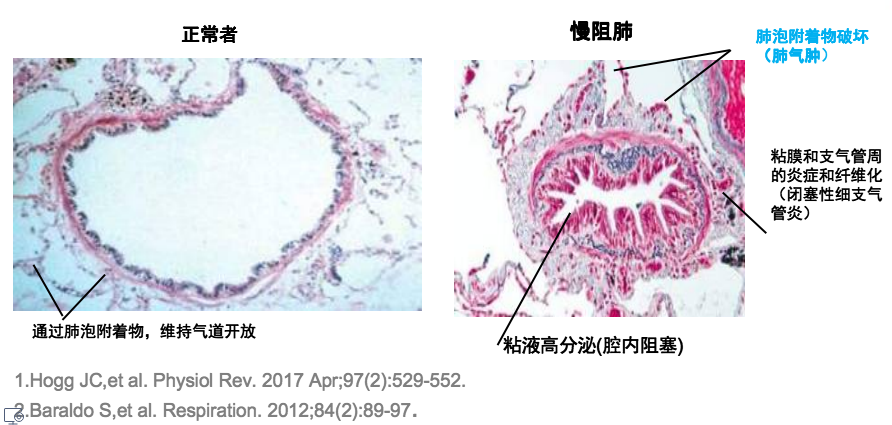
图2
3、气道狭窄是慢性阻塞性肺疾病病理特征之一
小气道炎症不可避免的造成气道管壁的增厚和管腔的狭窄(如图3)[5]。
图3:正常人(左)和有气道炎症患者(右)的气道切面
根据泊肃叶(Poiseuille)定律,气道阻力与气道内径的4次方成反比。当气道内径狭窄时,气道阻力呈至少r4倍的升高。如果小气道受损,就会导致气道阻力呈数倍甚至是数十倍升高[1],在呼吸的过程中,就会造成患者的等压点上移,当气流靠近肺泡端的时候,由于气道阻力的增高,患者呼吸的压力和气道将达到平衡,导致气体滞留(Air Trapping)的出现,引起残气容积的升高,患者就会出现不耐受和运动耐力下降等症状。
2016年《Chest》杂志发表了一项研究,研究发现,与从不吸烟人群(Never smoker)比较,长时间吸烟人群(Heavy smoking)即便做肺功能检查,1秒量在正常范围,1秒率也不会引起70%以下的改变[6],但此时已经出现了气道内径的狭窄,或小气道的结构性改变。当然,与慢阻肺患者进行比较,随着肺功能下降越来越明显,小气道的病变也会越来越严重。
二、慢阻肺小气道病变的研究进展
1、小气道病变的患病情况?
2020年肖丹教授在《LANCET RM》上发表了来自于5万例中国慢阻肺病CPH研究的调查结果,结果显示,在5万例的自然人群中,小气道功能障碍的患病率为43.5%(95% CI 40.7~46.3)。同时也做了小气道功能障碍前后的研究,吸入支气管扩张剂前几秒正常的人群,小气道功能障碍的患病率为25.5%(23.6~27.5);吸入支气管扩张剂前后都正常的人群,小气道功能障碍的患病率为11.3%(10.3~12.5)[7]。
注:小气道功能障碍的标准:临床常用标准,最大呼吸中期流速的三个指标中有两个指标小于预计值的65%,就被认为它是诊断小气道功能障碍。
2、小气道炎症与气流受限相关性?
小气道炎症与气流受限先后顺序是怎样的,两者有没有相关性?
2011年《新格兰医学杂志》发表结论,随着患者的肺功能不断下降,小气道数量随慢阻肺疾病严重程度增加而减少(图4)[8]。
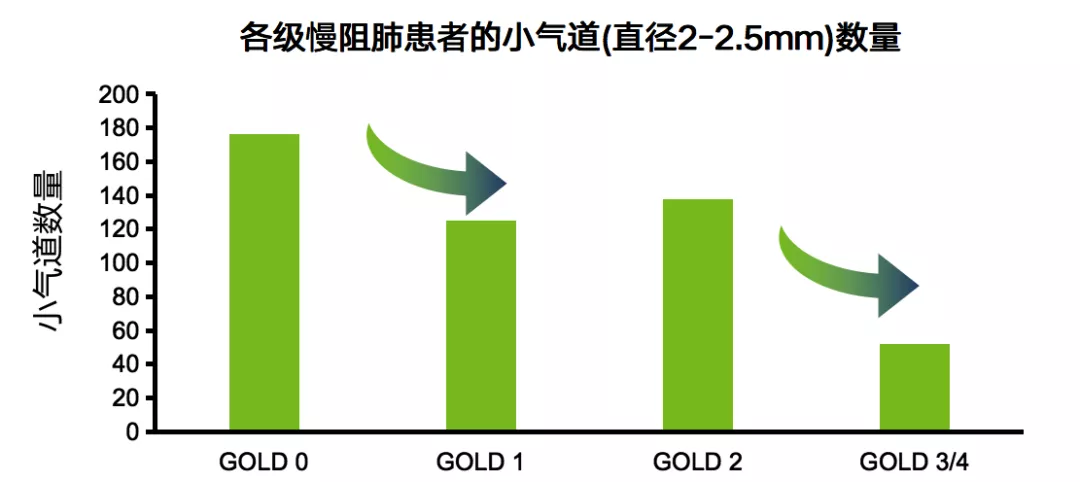
图4
2004年《新格兰医学杂志》发表的最早研究,研究比较不同GOLD分级的慢阻肺患者气道中的中性粒细胞,巨噬细胞,嗜酸性粒细胞,CD4细胞,CD8细胞和B细胞所占总数的百分比。肺功能的恶化,气道壁的厚度在不断增加,气道壁的分层包括上皮层、黏膜下层、平滑肌层、外膜层都可以看到。气道壁的厚度肺功能的分级有明显的相关性,即肺功能越差的患者,在不同分级中气道壁厚度也是逐渐增加的(图5)[9]。
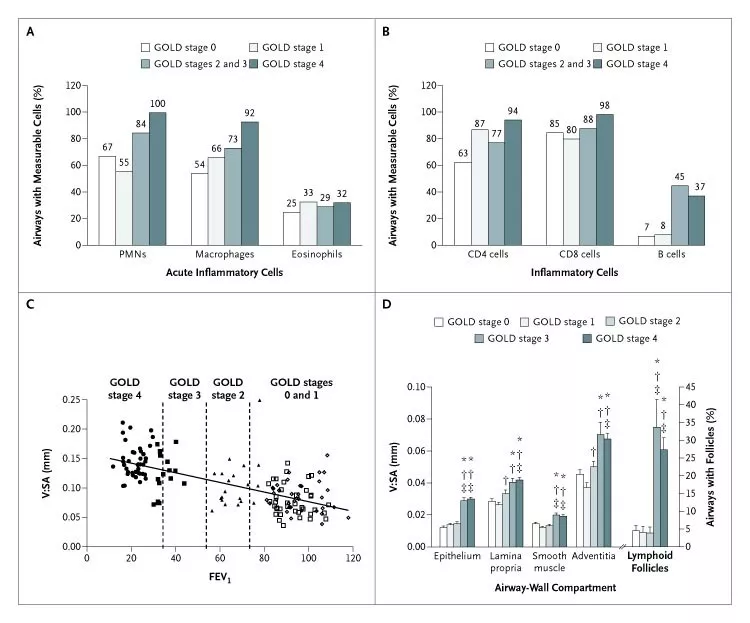
图5
7年后《新格兰医学杂志》发表,小气道的炎症性改变,可能是导致早期慢阻肺患者出现肺功能下降的重要原因。早期慢阻肺患者的肺功能下降不明显时,小气道的一些功能可能已经下降,导致最大呼吸流速的下降,气流受限越严重的患者小气道的炎症就越明显[10]。随着病情的不断加重,到肺功能1秒量下降之后,小气道病变也向严重的方向不断发展。
另外,《新格兰医学杂志》的研究还发现,GOLD4级慢阻肺患者较健康者对照,终末细支气管的横截面积减少了81.0%~99.7%,终末细支气管的数量减少了72%~89%(图 6)。因此,
严重气流受限的患者小气道数量会减少[11] 。
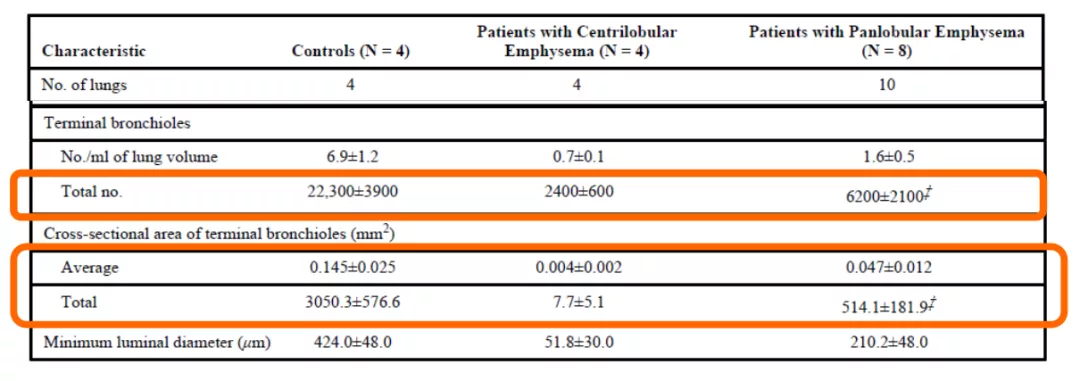
图6
《新格兰医学杂志》另一研究发现,跟吸烟的患者比,病情越重的慢阻肺患者,气流受限越严重,小气道数量越少;中末细支气管的数量随着病情的加重有不断的下降趋势(图7)[12]。
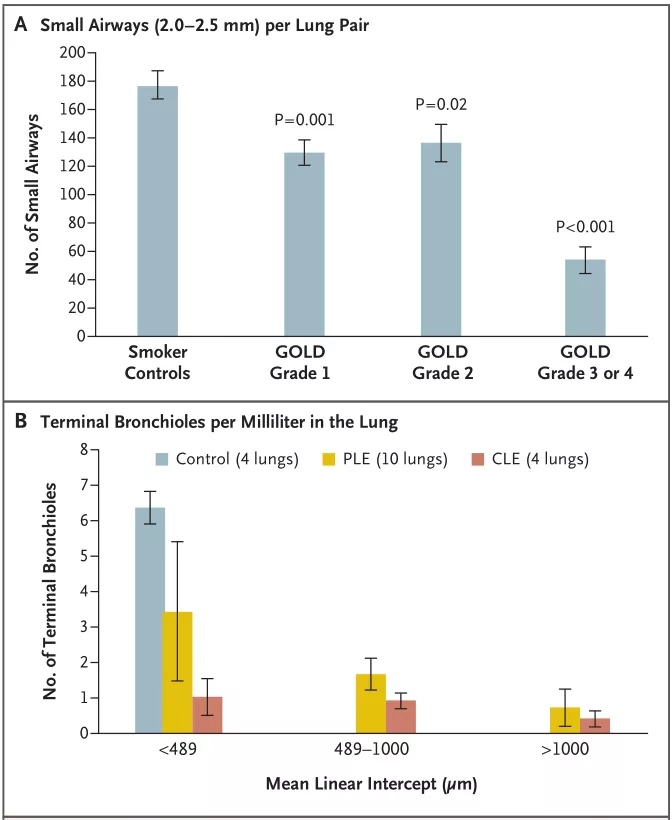
图7
近几年来,对于小气道病变,不管是哮喘还是慢阻肺,都备受关注。《新格兰医学杂志》《Chest》《呼吸杂志》等高水平杂志都有许多关于呼吸类的文献,的确值得我们关注。
2018年《柳叶刀呼吸医学》发表的一项关于早期慢阻肺患者的研究,所有研究对象均为GOLD 1级和GOLD 2级的急性慢速肺患者(图8),不论患者是哪一分级,只要这些病人没有患有肺气肿,则小气道末梢与其他患者相比较而言,小气道的数量会减少的更加明显[13] 。
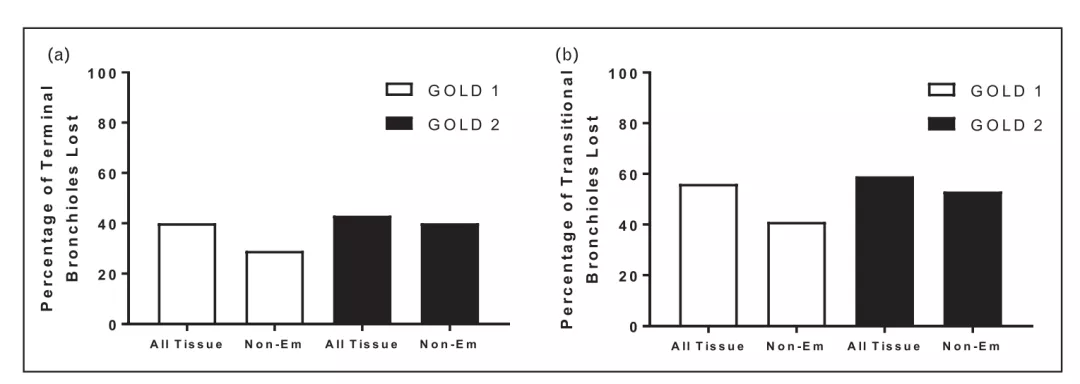
图8
3、小气道病变与病死率?
2007年《美国呼吸与危重症医学》(Am. J. Respir. Crit. Care Med)杂志做了一项研究,入组的101例慢阻肺患者因不同原因进行肺减弱手术。研究者根据小气道阻塞的程度将患者划分为4个层级,在6年的随访的过程中,研究者发现,小气道病变越重的患者,病死率越高[14]。由此得出结论,与小气道阻塞最轻微的患者比较,管腔阻塞程度最高的患者更早死亡。
4、小气道与肺气肿的先后顺序?
很多慢阻肺患者既有小气道病变也有肺气肿,二者究竟是谁先谁后?有没有一定的因果性?
①轻-中度慢阻肺患者的小气道明显受损缺失
2018年《Lancet Respir Med》发表一项研究,纳入34例接受过肺切除或肺移植的吸烟者,包括吸烟的健康对照组(肺功能正常)、GOLD1轻度COPD组、GOLD2中度COPD组、GOLD4极重度COPD组。通过系统抽样获取了有代表性的262例肺组织样本,其中肺功能正常的有75例,GOLD1级的有21例,GOLD2级的有62例,GOLD4级以上是44例,整体肺功能一秒量占预期值的百分比是22%~90%不等(图9)。所有标本中,GOLD1级和GOLD2级患者中仍有约半数的小气道破坏。随着慢阻肺GOLD分级越来越严重,终末细支气管的数量在大幅度下降,移行细支气管数量也有类似的结论[15]。
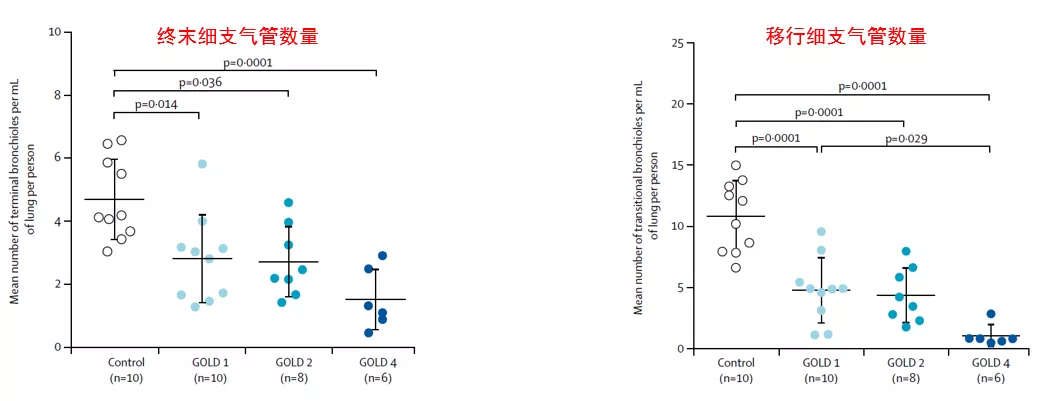
图9
②轻-中度慢阻肺患者的肺泡表面积下降
研究发现肺气肿指标有相同的趋势,随着患者肺功能的下降,肺泡表面积在不断减少,肺气肿的形成不断增多。
③小气道病变早于肺气肿的发生,是轻-中度慢阻肺的早期病理特征
262例样本中,有121例肺泡表面积介于正常范围(对照组的肺泡表面积)的肺组织。在这121例样本中,终末细支气管的平均数量(TB/mL),与对照组相比,GOLD1级慢阻肺(COPD)患者下降29%,GOLD2级慢阻肺患者下降40%。移行细支气管的平均数量(TB/mL),与对照组相比,GOLD1级慢阻肺患者下降41%,GOLD2级慢阻肺患者下降53%。其中,GOLD4级慢阻肺患者只有2例肺泡表面积正常(图10)。
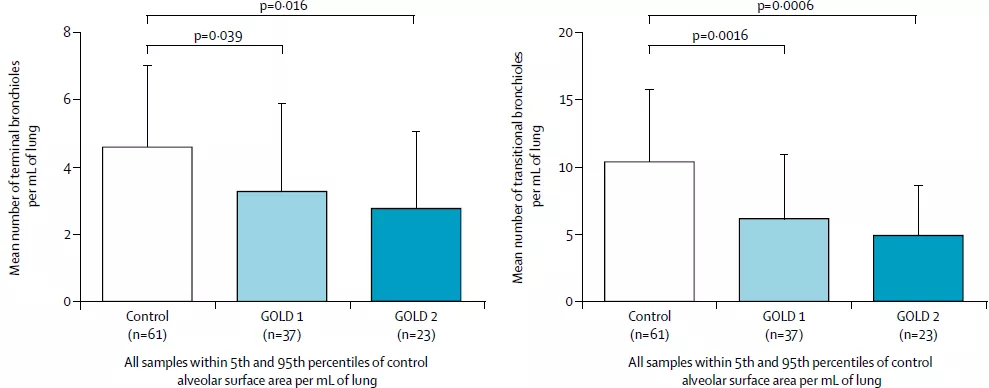
图10:终末细支气管数量(左)移行细支气管数量(右)
以上结论说明,262例的样本中有121例样本即使没有肺气肿,也能明确表明小气道的损毁。小气道功能下降的程度随着GOLD分级的加重而加重。
④小气道病变存在于肺功能正常的吸烟者
通过对不同肺功能分级的人群进一步研究,发现很多肺功能正常的这些人群中,也会有气道壁增厚,甚至极少数部分患者也有小气道闭塞。气道壁增厚和小气道闭塞随着肺功能的下降越来越严重,呈现出上升趋势的变化。
⑤小气道病变的发生早于肺气肿,并随疾病进展加重
在很多慢阻肺的早期阶段,即便患者还没有形成肺泡的破坏,肺泡的融合没有形成肺气肿的时候,也已经出现了小气道破坏。
2017年《呼吸杂志(首尔)》做了一项线性回归分析,纳入慢阻肺基因1508例既往或现吸烟患者,采用线性回归法评估5年内FEV 1(ml/年) 变化的预测因子,采用PRM将呼气与吸气双向的CT图像配对以定义肺气肿(PRMemph )和小气道疾病(PRM fSAD ),以了解小气道疾病和肺气肿在5年观察期 内疾病严重程度与肺功能下降的相关性。 动态CT的PRM参数结果显示:较肺气肿,小气道病变发生更早,并随疾病严重程度增加(图11) [16-17] 。
注:PRM:Parametric response mapping,参数反应图
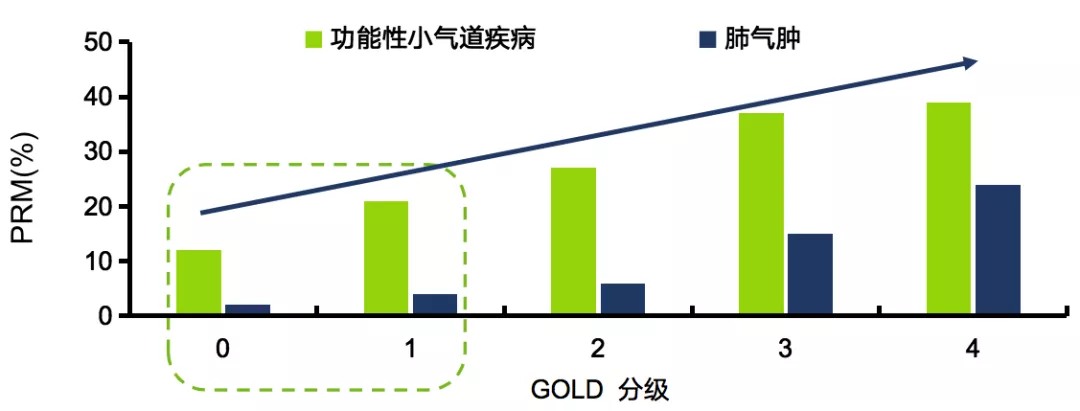
图11
小结
①气流受限越严重的患者小气道的炎症就越明显,小气道的数量也会随着气流受限的严重程度而减少;
②CT图像显示肺气肿可能预示肺功能将快速下降,因为在肺气肿被发现之前,已经有大量的小气道破坏。
③「Quiet zone」静默区:数量庞大,代偿功能强,只有疾病进展严重时,才出现症状或肺功能下降[16]。
④早期小气道病变时,患者可能没有明显的症状,需要对有危险因素的患者做早期识别、功能改变、早期干预以及解除危险因素。
三、慢阻肺小气道功能的检测方法及其临床应用
临床用的较多的小气道检测方法是呼吸病理生理的检测,也就是肺功能的检测。
近年来,影像学检测得到了一些具体的临床应用,应用最多的是用呼吸流检测肺功能(Spirometry),强迫震荡技术检测呼吸阻力,支气管镜进行光学检测(OCT),H3标记的核磁共振检测(H3HeMRI)、HRCT检测等。
最常用的小气道及呼吸生理学的研究是最大呼气流量(容积曲线(MEFV)呼气中期流量(FEF25%-75%)、三秒率(FEV3/FVC)、脉冲震荡技术(IOS)。
1、肺量计-呼气流量检查
小气道功能的三个主要指标是:①MMEF,最大呼吸中期流速曲线;②FEF 50%;③FEF 25%。三个指标中有两个指标小于65%的,就被认为是小气道功能障碍的这样一个诊断标准。2020年肖丹教授发表研究也是采用该诊断标准。
MMEF检测从70年前就开始使用,到目前为止,MMEF想对来说应用广泛、优点多,但其缺点就是变异性,MMEF的可重复性有待提高[18]。
2、三秒率(FEV3/FVC)
2006年和2011年《Chest》有两项关于肺功能损伤指标分析的研究。
研究方法:排除TLC限制的患者,即TLC大于正常值,TLC上限大于LON的人群,将1万例患者分为三组。
第一组:FEV1/FVC 和FEV3/FVC正常 (n=7,937)
第二组:仅FEV3/FVC下降 (n=840)
第三组:FEV1/FVC下降 (n=4,525)
研究结果:比较三组人群肺功能参数,FEV3/FVC下降与FEV3/FVC正常相比,TLC, RV和RV/TLC增高;预计值 FEV1,IC和DLCO下降;BMI下降,男性更多,民族无差异。
总体结论:孤立的下降提示存在过度充气、气体陷闭和弥散容量下降;FEV3/FVC比值应常规报告[19]。
3、脉冲震荡技术(IOS)
早在上世纪50年代,就有脉冲震荡技术(IOS)报道,其优点是,当做呼吸阻力测试时,对病人的依从性的要求不高,老年人和儿童都可以采用脉冲震荡技术(IOS)检测方法。
脉冲震荡技术(IOS)检测中,共振频率和呼吸阻力(5~20Hz)是反映早期慢阻肺小气道病变的敏感指标(图12)[20] 。
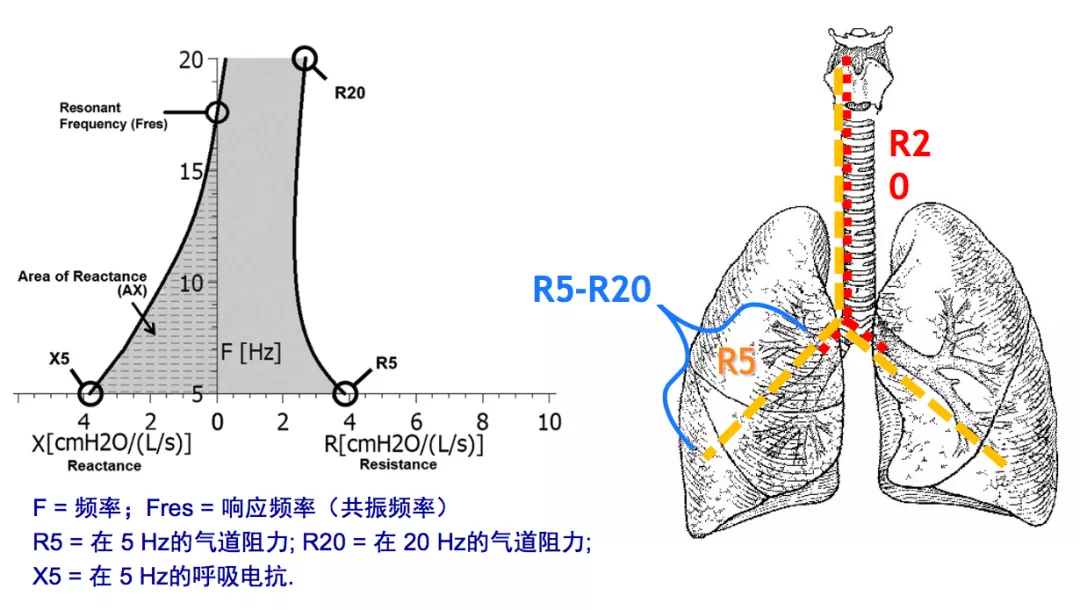
图12
应用脉冲震荡技术对健康人、哮喘患者、慢阻肺患者进行检测研究,通过比较呼吸阻力发现,不论哮喘还是慢阻肺患者,呼吸阻力都高于健康人群,并且随着病情加重,其呼吸阻力有上升趋势[20]。
4、强迫震荡技术
当我们在欧洲留学期间曾做过一项研究,采用强迫震荡技术,并建立了老年人群正常预计的回归方程,结果确实跟年龄、种族、性别、尤其是身高,有很大的相关性(图13)[21]。

图13
继续研究强迫震荡技术各种指标,对1秒量和1秒率相关性的敏感性和特性的进行分析,发现共振频率的特异性和敏感性用于诊断老年慢阻肺最佳。
5、常见的影像学方法
近几年来,除了呼吸生理学检测之外,影像学也应用很多,尤其是高分辨率CT(HRCT),结合气管镜的光学相干成像系统(OCT),还有超级化核磁共振成像(H3HeMRI)。影像方法有助于更早发现小气道病理变化[22],当然大多用于科学研究,在临床上还没有得到大幅度的推广和应用。
①高分辨率CT(HRCT)
HRCT可见小气道病变征象包括直接特征和间接影像学特征。直接症状主要是小叶中央结节和树芽征(图14),间接症状包括马赛克衰减、楔形磨玻璃区、圆柱形细支气管扩张等。
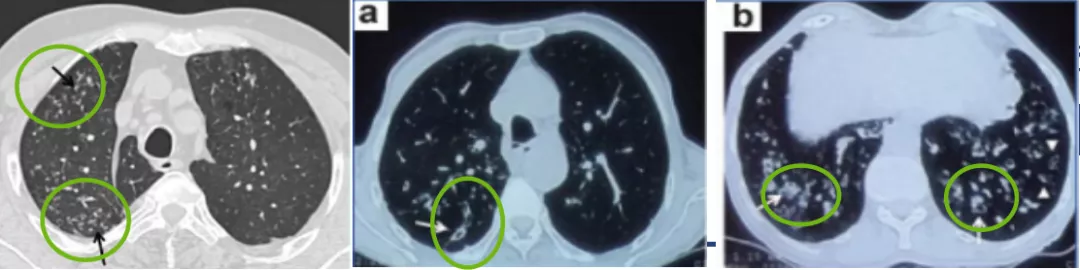
图14
关于这个影像学的检测,2016年《美国呼吸与重症医学杂志》发表研究,通过比较慢阻肺患者的小气道和肺功能的参数反应图,发现在GOLD1~4级的慢阻肺患者中,其小气道病变和肺气肿均与肺功能下降显著相关。GOLD 0级患者(肺功能正常人群),仅小气道病变在随访过程与肺功能下降有关[17]。
② 吸气呼气双向CT扫描技术
目前,越来越多人关注到吸气呼气双向CT扫描技术。当做吸气向CT扫描的时候,需要对患者的气道壁、尤其肺血管的情况作评估;而做呼气向CT扫描的时候,则清楚的看到Air衰变情况。CT扫描技术的呼气向跟吸气向对比,对肺功能会有更准确的判断。
③光学相干成像系统(OCT)
光学相干成像系统(OCT)是三维层析成像技术,应用该技术能够达到7~9级的支气管,可进行确定和量化气道壁的分层(图15)。光学相干成像系统(OCT)在血管、心内科、血管外科都有了一定程度的应用。
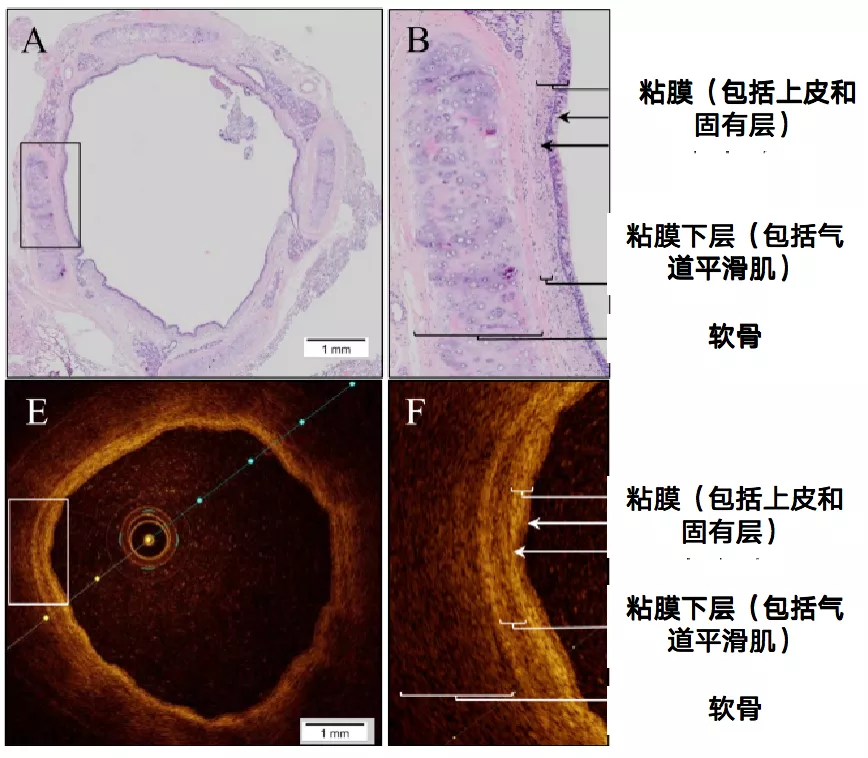
图15:支气管内光学相干断层扫描(EB-OCT)图示
2018年的一项研究中,采用光学相干断层扫描(EB-OCT)技术,对慢阻肺患者的小气道指标进行分析。研究结果,采用光学相干断层扫描(EB-OCT)之后的小气道面积的百分比和采用强迫震荡技术测得的共振频率,以及呼吸阻力(5~20Hz)呈显著正相关[25]。
④H3标记的核磁共振检测
2006年发表研究,患者吸入Helium-3之后进行核磁扫描,比较健康人群、有重度吸烟史的健康人群、轻度慢阻肺患者三组人群,通过H3标记的核磁共振检测可以对肺的弥散功能、气道和小气道功能做出相对准确的评估和测量。
四、慢阻肺小气道病变的治疗
小气道的治疗,无外乎是从药物和装置两方面来体现对小气道疾病的治疗程度。令人遗憾的是,以小气道评估作为研究重点的二期的研究相对较少。
1、噻托溴铵治疗
2008年《国际慢阻肺杂志》发表一项研究,其设计理念是对所有患者使用噻托溴铵治疗3个月后,对1秒肺活量以及小气道功能的指标进行检测。结果发现,对于急性加重发生>2次慢阻肺患者(A组),使用噻托溴铵治疗之后,跟基线时小气道功能具有显著性差别的改善和提高。对急性加重发生≤2次慢阻肺患者(B组),虽然从数值上有改善,但是并没有达到统计学的差别。
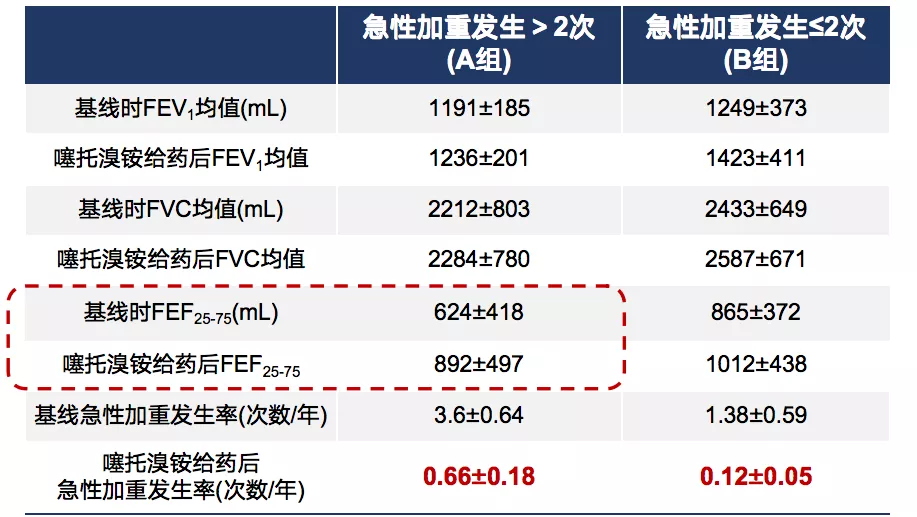
图16
近年来,我们有很多类似的二级研究,对慢阻肺患者加重的减少、病死率的减少、肺功能的改善和生活质量的提高都有很多意义。但是大多研究结果,包括主要研究结局和次要研究结局,并没有涉及到小气道的指标。
2、口服高剂量NAC
2013年《Chest》有一项关于口服高剂量NAC对小气道功能评估的研究,患者分别口服高剂量NAC和安慰剂16周和52周,口服高剂量NAC对于慢阻肺患者的小气道功能有明显的改善,无论是反应性还是气道阻力,与安慰剂相比,都有大幅的改善和提高(图17)[27] 。
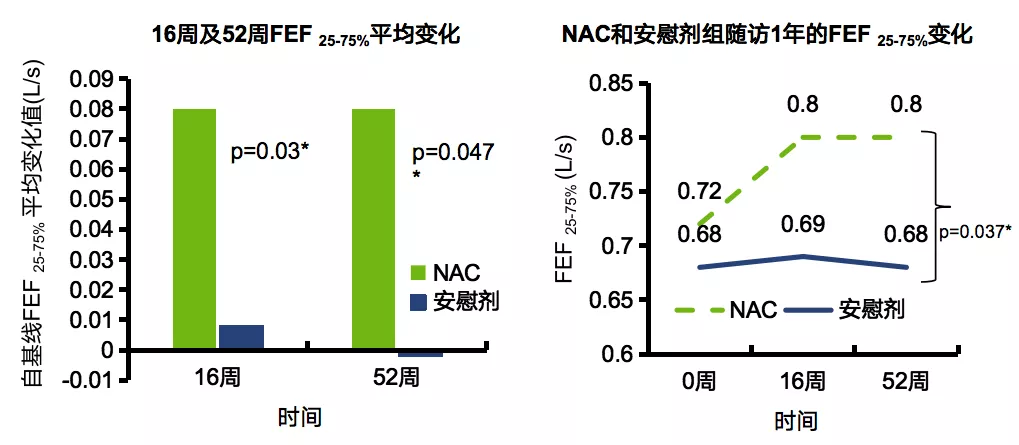
图 17
3、超细颗粒ICS/LABA
小气道是COPD 相关炎症和重塑的主要部位,已成为COPD药物治疗的潜在靶点。Pirina等人发现二丙酸倍氯米松/福莫特罗(BDP/F)超细制剂具有较好的小气道沉积能力[28]。
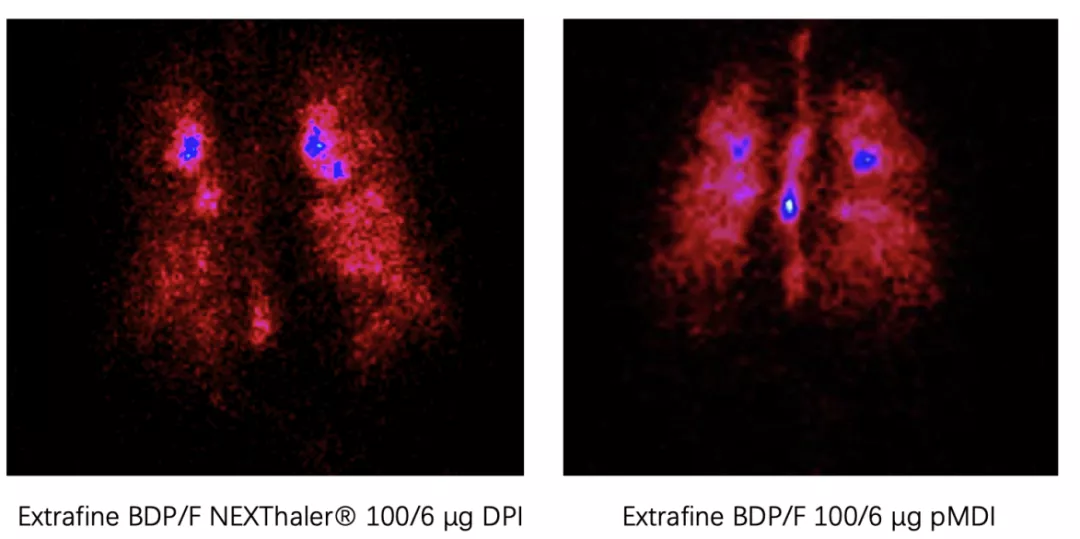
图18
4、噻托溴铵联合茶碱治疗
2018年《Advances in Therapy》发表一项研究,COPD患者分别口服噻托溴铵联合茶碱或噻托溴铵治疗6个月。结果发现,在使用噻托溴铵联合茶碱治疗的COPD患者中,小气道功能在3个月和6个月具有显著性差别的改善和提高。在6个月时使用噻托溴铵联合茶碱组与单用噻托溴铵组小气道功能有显著差别 (图 19) [29]。
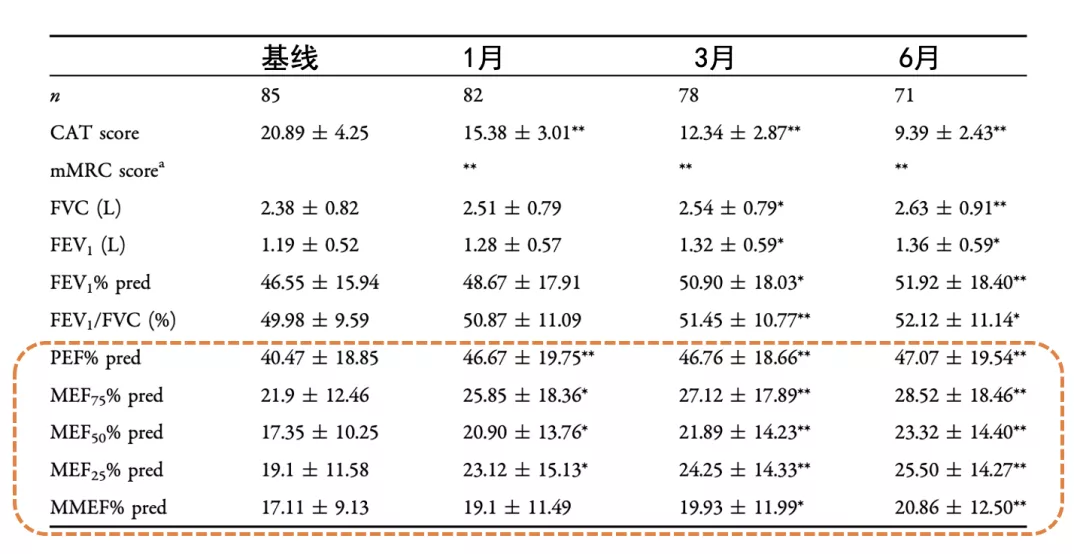
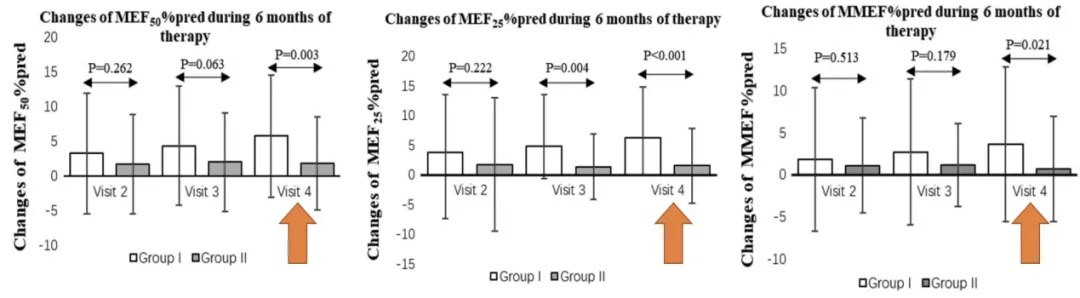
图19
5、其他药物
治疗小气道的药物除了前面的几种之外,还有TGF-β抑制剂和基质金属蛋白酶-9抑制剂,分别是处在一个体外研究和动物实验研究阶段,还没有真正的应用于临床。
小结
①小气道病变会显著增加气道阻力;
②小气道病变早于肺气肿,可能参与疾病的发展;
③现有支扩剂治疗可改善小气道功能,但仍需更多的研究数据;
④高效的吸入装置可增高药物达到小气道比例,以实现更好的临床疗效。
参考文献
[1] William McNulty, et al. Eur Clin Respir J. 2014; 1: 10.3402/ecrj.v1.25898.
[2] Desh Deepak,et al. J Clin Diagn Res. 2017 Mar; 11(3): TE01–TE05.
[3] Hogg JC,et al. Physiol Rev. 2017 Apr;97(2):529-552.
[4] Baraldo S,et al. Respiration. 2012;84(2):89-97.
[5] Brashier BB, et al. Risk factors and pathophysiology of chronic obstructive pulmonary disease (COPD). J Assoc Physicians India. 2012 Feb;60 Suppl:17-21[6] Dave Singh. Tuberc Respir Dis (Seoul). 2017 Oct; 80(4): 317–324.
[6] Ding M, et al. Chest, 2016, 150(6): 1281-1290.
[7] Xiao Dan et al;LANCET RM 2020:26.
[8] McDonough J, et al. N Engl J Med. 2011, 365: 1567-1575.
[9] James,et al.N Engl J Med 2004; 350:2645-2653.
[10] McDonough JE, Yuan R, Suzuki M, et al. Small-airway obstruction and emphysema in chronic obstructive pulmonary.N Engl J Med 2011; 365: 1567–1575.
[11] John,et al.N Engl J Med, 2011;365(17):1567-1575.
[12] Alvar Agustí,et al. N Engl J Med 2019;381:1248-56.
[14] * Hogg JC, Chu FS, Tan WC, et al. Survival after lung volume reduction in chronic obstructive pulmonary disease: insights from small airway pathology. Am J Respir Crit Care Med 2007; 176:454–459.
[15] Hyun-Kyoung Koo, Dragoş M Vasilescu, Steven Booth,et al. Small airways disease in mild and moderate chronic obstructive pulmonary disease: a cross-sectional study. Lancet Respir Med 2018 Aug;6(8):591-602.
[16] Dave Singh.Tuberc Respir Dis (Seoul). 2017 Oct; 80(4): 317–324.
[17] Surya P. Bhatt,et al. Am J Respir Crit Care Med. 2016 Jul 15; 194(2): 178-184.
[18] Stockley JA,et al. Int J Chron Obstruct Pulmon Dis. 2017 Aug 7;12:2343-2353.
[19] Chest 2014;146(3):841-847.
[20] Williamson PA et al Lung 2011.
[21] YF Guo et al; Eur Respir J 2005: 26;602.
[22] William McNulty, et al. Eur Clin Respir J. 2014; 1: 10.3402/ecrj.v1.25898.
[23] Imaging Advances in Chronic Obstructive Pulmonary Disease. Insights from the Genetic Epidemiology of Chronic Obstructive Pulmonary Disease (COPDGene) Study.Bhatt SP, et al. Am J Respir Crit Care Med. 2019.
[24] Julia N. S. d‘Hooghe, PLoS One. 2017; 12(10): e0184145.
[25] Zhu-Quan Su,et al. Int J Chron Obstruct Pulmon Dis. 2018; 13: 3031-3044.
[26] Fain et al. Radiology. 2006;239,875-883.
[27] Tse HN, et al. Chest. 2013 Jul;144(1):106-118.
[28] Pirina P, et al. Respir Med. 2018;143:74-81.
[29] Xiong XF, et al. Adv Ther. 2018;35(12):2201-13.
专家介绍

郭岩斐
现任卫生部北京医院呼吸与危重症医学科副主任、主任医师、研究生导师。中华医学会呼吸病学分会慢阻肺学组委员(8-10届)、中国医师协会慢阻肺专业组委员、中国慢阻肺联盟委员、中国女医师协会呼吸委员会常委兼任秘书长、海峡两岸医药卫生学会呼吸专业委员会委员、中国药理学会化疗专业委员会委员、中国毒理学会呼吸专业委员会委员、中国研究型医院呼吸专业委员会委员、北京医学会慢阻肺专业组委员,北京慢阻肺联盟常委、任中华结核与呼吸杂志、中华医学杂志、国际呼吸杂志等国内多项核心期刊杂志通讯编委及审稿专家,北京自然科学基金及首都科研行业专项评审专家。
本文由《呼吸界》编辑 Asiya 整理,感谢郭岩斐教授的审阅修改!
本文完,排版:Jerry
未经许可,请勿转载


