推荐语
在日前召开的第五届中国呼吸支持技术会议上,中华医学会呼吸分会危重症学组委员、苏州大学附属第一医院重症医学科郭强教授做了精彩演讲,讲到了ARDS继发肺血管功能障碍的主要原因、最终的基础病理生理机制,如何预防和治疗ARDS继发肺血管功能障碍(右心功能不全),ARDS继发ACP的相关危险因素等。
虽然经过了50年的努力,急性呼吸窘迫综合征(简称ARDS)的病死率仍然居高不下(30%-45%)。1952年正压通气应用以来,大家对呼吸机相关的肺损伤(VILI)认识越发深刻。因此,诸多学者把ARDS病死率改善的节点放在VILI的防治上。近年逐步认识到包括液体管理在内的循环维护愈发重要,特别是肺血管功能障碍及其继发的右心功能下降(急性肺心病,severe acute cor pulmonale-ACP),这很可能是ARDS病死率高的主要病理生理原因。

ARDS继发肺血管功能障碍的主因
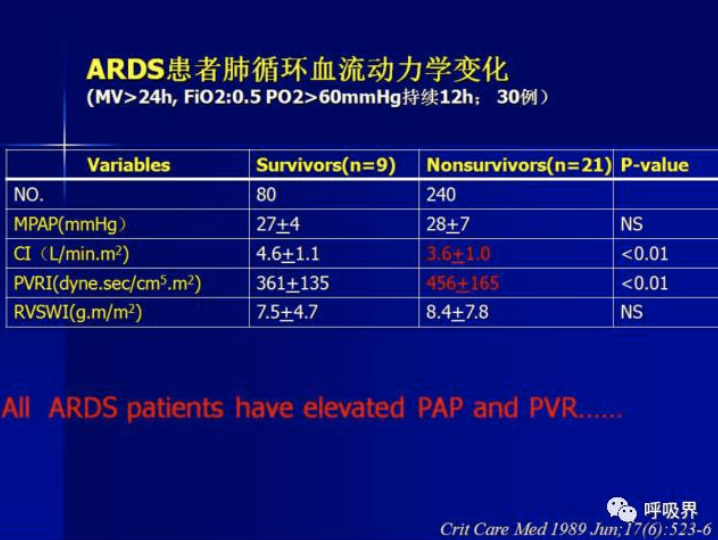
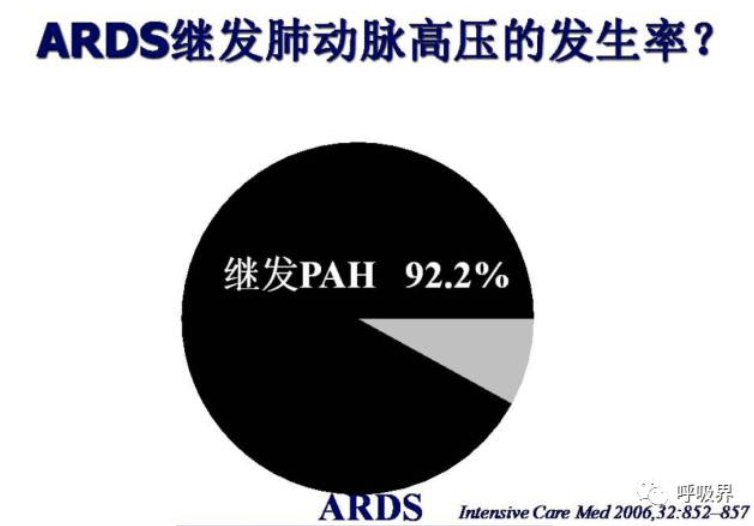
较左心功能,右心室类似一个半月形容器,收缩触发阈值更低、代偿差,舒张功能更强,右心负荷稍许增加只能通过右心室舒张来代偿。肺循环的重要组成还有肺动脉及其远端血管,通常用肺动脉压力(PAP)和肺血管阻力指数(PVRI=[PAP-LAP/CO]79.9)来评估肺血管功能障碍程度。1989年学者已经发现,几乎所有ARDS患者都存在PAP和PVRI升高。呼吸衰竭患者中,合并肺动脉高压患者病死率(60%)远远高于非肺动脉高压组(24%)。2006年有研究发现ARDS中可诊断肺动脉高压的患者比例高达92.2%。526例患者在发生ARDS后48h时已经有肺动脉压升高。进而,AJRCCM2010报道TPG(PA mean pressure-PA occlusion pressure )≥24mmHg组,ARDS的病死率远远高于<24mmHg和<12mmHg组。
因而目前认为,ARDS继发肺血管功能障碍的主要原因分为: ①内源性,肺泡和毛细血管损伤; ②外源性,机械通气的不良影响。
最终的基础病理生理机制为: ①缺氧性肺血管收缩(HPV) ②肺小动脉微血栓形成③肺小血管重塑等。
如何防治ARDS继发肺血管功能障碍
如何预防和治疗ARDS继发肺血管功能障碍(右心功能不全)?内源性机制的干预比较困难,尽管有小样本发现Bosentan和Iloprost等可以改善患者氧合和肺动脉高压,但仍缺乏大规模临床研究证据。因此,目前改良ARDS通气策略,建立肺血管功能/右心功能导向的ARDS呼吸参数(如PEEP)滴定,显得更为实用和迫切。Whittenberger’s-U型曲线发现,ALI中PEEP10cmH2O时,PVRI最低/DO2最高,PEEP高于/低于10cmH2O时PVRI均升高,因此PVRI可以指导ARDS中PEEP的滴定。早在1960年,JAP发表论文,发现跨肺压(Transpulmonary pressure ) 升高引起肺血管阻力升高。2008年Talmor等RCT研究发现呼气末跨肺压(肺泡压-胸腔内压 ,或气道平台压-食道压) 在0-10cmH2O时患者有更好的氧合改善和预后。
驱动压(Driving Pressure,∆P =PPLAT-PEEP 或VT/CRS )在临床食道压测量还未推广时,也发现其>15cmH2O时ARDS病死率增加,即使PPLAT<30 cmH2O但是Driving Pressure>19 cmH2O时,ARDS的病死率仍增加,可惜的是驱动压和ARDS在CCM和NEJM上的两项研究并未评估肺血管和右心功能。
ARDS继发ACP的3项独立相关危险因素
据估计,ARDS患者循环衰竭的约50%原因为脓毒症休克,其余约50%和急性肺血管功能障碍及其继发的右心功能下降有关。新近一项肺炎后ARDS研究发现,ARDS继发ACP的3项独立相关危险因素分别为:
① 驱动压≥18cmH2O;
② PCO2≥48mmHg;
③ PaO2/FiO2<150 mmHg
建议通过①早期充分的俯卧位通气 ②每日床边心超评估右心功能参数动态变化等呼吸支持策略的改变来保护ARDS患者的右心功能。特别是俯卧位通气,包括NEJM2013报道均认为其对于改善心血管功能和减少心脏停搏有益。
综上所述,肺血管功能/右心功能障碍是ARDS病死率高的主要原因之一。右心室和肺循环的不匹配和不平衡是ARDS病理生理机制最薄弱的环节之一。现有的证据支持大家运用俯卧位通气和肺循环动态变化导向参与ARDS治疗。
作者介绍

郭强
◆ 苏州大学附属第一医院重症医学科副主任,医学博士,副教授,副主任医师;
◆ 中国医师协会呼吸分会青委会副主任委员;中华医学会呼吸分会青年委员;中华医学会呼吸分会危重症学组委员。


