编者按
Sepsis发生率高,病情凶险,病死率也高,全球每天约14,000人死于其并发症。并且Sepsis治疗花费高,医疗资源消耗大,严重影响人类的生活质量,已经对人类健康造成巨大威胁。
在CACP 2021年会中,解立新教授就2020年Sepsis面临的经济负担、患病机制、临床研究等方面的进展做出了较为详细的介绍。
以下是《呼吸界》小编整理的解立新教授的精彩演讲,在此分享给大家。
自2019年新冠疫情的开始至今,我们对重症感染的了解也越来越深入,接下来,我将对过去一年中非新冠引起的脓毒症(Sepsis)进展进行简单报道。
一、Sepsis数据分析
1. Sepsis——中国数据
2020年《Crit Care Med》发表了中国的Sepsis数据[1](如图1),邱海波教授根据数据做了中国重症监护(Intensive Care Unit, ICU)Sepsis的研究。研究表明,呼吸系统疾病占所有ICU患者病因的37.6%。因此,呼吸系统疾病在ICU中占据非常重要的地位。
ICU中Sepsis是患者疾病的起源,其中肺炎占到了68.1%[1],并且病死率非常高。因此,在ICU中,Sepsis主要感染来源还是肺部感染。
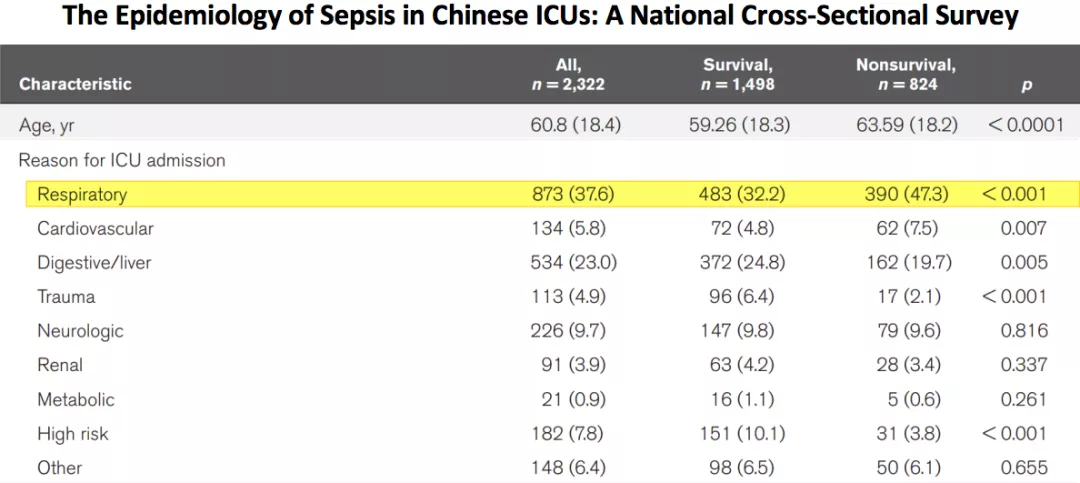
图1
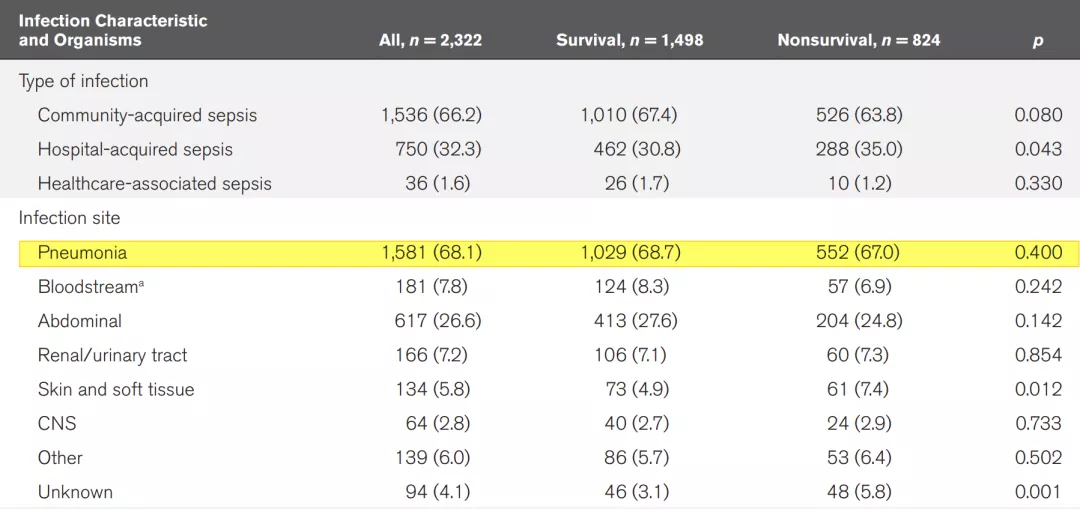
图2
研究结果显示,中国大陆ICU患者20%为Sepsis患者,90天的病死率高达35.5%,其中60%以上的Sepsis患者是重症肺炎患者。这也表明,我国重症肺部感染患者在Sepsis患者中占了重要的比例。
2.Sepsis——全球负担
2020年《Lancet》对全球的Sepsis患者做了回顾性的总结:
2017年,全球Sepsis患者大约有4890万人,死亡人数约1100万人,病死率可达19.7%,病死率较高[2](如图3)。
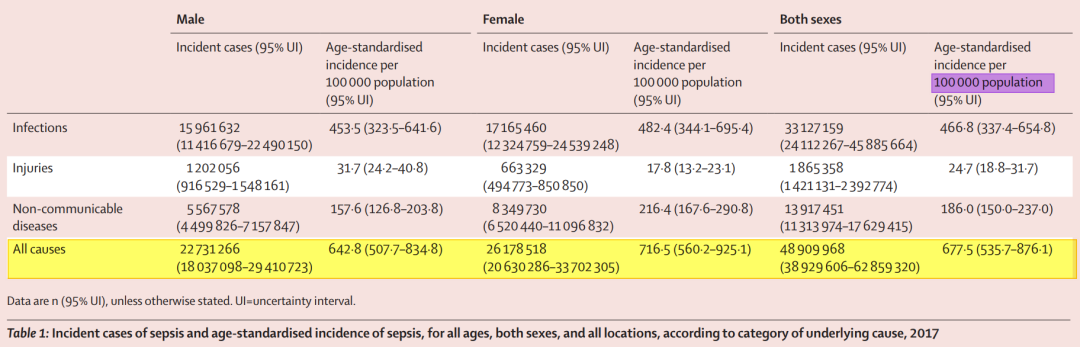
图3
据统计,Sepsis患者感染的疾病中排名第一的是下呼吸道感染,因而不论在国内还是国外,下呼吸道感染都是Sepsis感染最主要的的疾病之一[2](如图4)。

图4
3.Sepsis——医院负担
2020年《Intensive Care Med》发表一篇文章,Sepsis患者在整个医院患者中占9.3%,在ICU患者中占到了56.5%。ICU患者中伴有脏器功能障碍的Sepsis患者的病死率为52.3%[3](如图5)。此项研究结果值得我们深思和重视。
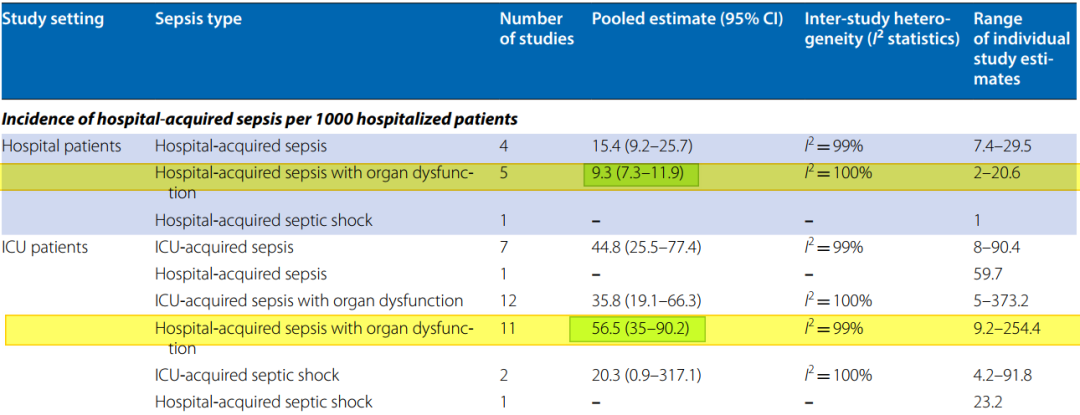
图5
4.Sepsis——经济负担
全球的Sepsis发病率不断上升,经济负担也不断增加[4](如图6)。
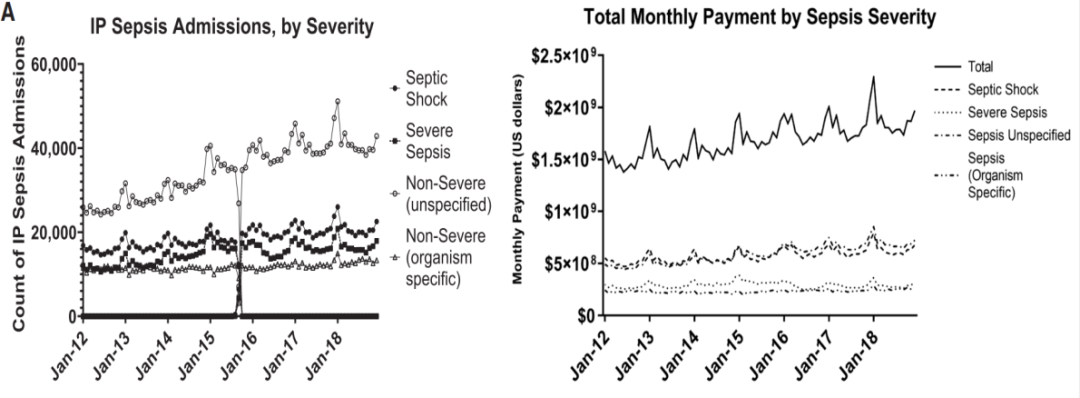
图6
2020年《Crit Care Med》上发表的一组数据显示,从2012-2018年,医院Sepsis患者的经济成本和医疗费用在不断的上升,其中,美国2012年的Sepsis经济成本大约是210亿美元,到2018年就达到了280亿美元[4](如图7)。
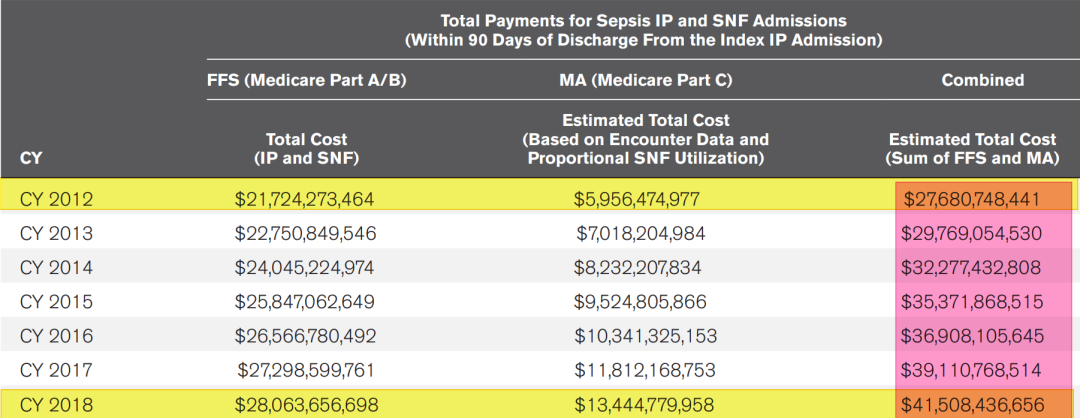
图7
二、Sepsis发病机制-感染与免疫失衡
1.Sepsis发病机制
自2016年重症感染和免疫紊乱开始提出以来,炎症风暴、免疫抑制、免疫麻痹和免疫耗竭带来的免疫紊乱,日益受到人们的重视(如图8)。

图8
近期研究发现,肺部感染实际上是肺泡炎性细胞的局部炎症反应,可进一步导致肺和全身免疫紊乱的过程,其中肺泡巨噬细胞占据的重要地位。2020年在新冠肺炎的研究中,尸检新冠患者结果发现,肺泡中浸润的白细胞主要是巨噬细胞。其他的炎症细胞基本没有,并且巨噬细胞在肺脏、肝脏、脾脏等器官里面占据非常重要的地位。巨噬细胞分为组织源性细胞和外周骨髓源性细胞。相关研究也发现,重症感染髓系细胞的过度激活会加重炎症反应及组织损伤[5](如图9)。
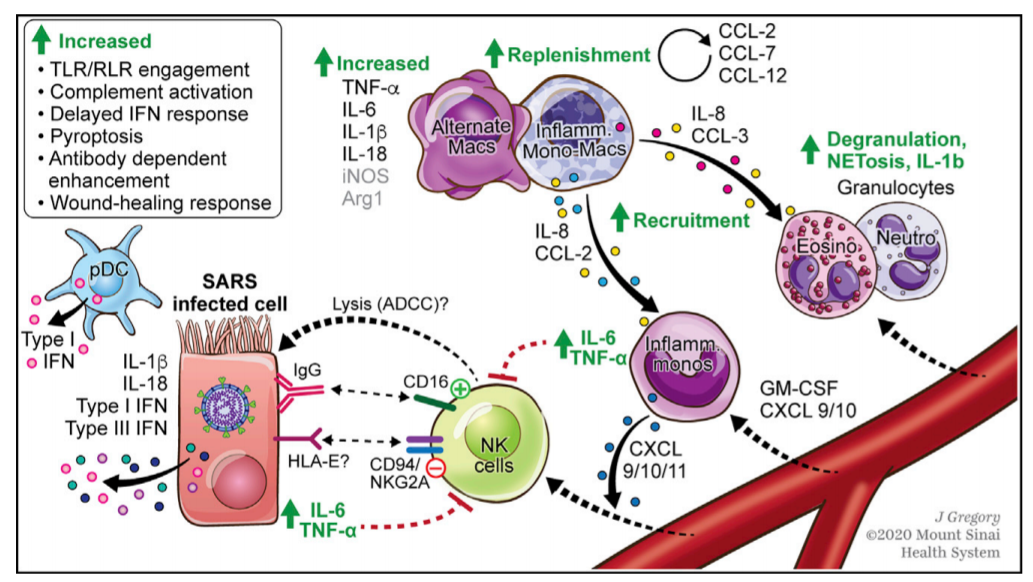
图9
外周单核/巨噬细胞的过度激活在免疫过度及炎症因子风暴中起到核心作用,多种机制可诱导外周单核/巨噬细胞的过度激活[6](如图10)。因此,肺泡巨噬细胞和外周单核细胞在炎症反应和演变过程中起了非常重要的作用。
重症感染患者中出现外周单核/巨噬细胞显著增多,而肺泡巨噬细胞明显减少的现象,外周单核/巨噬细胞及肺泡巨噬细胞的数量异常是免疫失衡的重要原因[7]。

图10
作为对抗病原体的第一道防线,肺泡巨噬细胞早期迅速激活对抗感染,后期促进炎症消退。值得让人注意和重视的是,在后期,巨噬细胞的性能是非常重要的[8](如图11),尤其是对重症免疫失衡的患者来说,肺泡巨噬细胞的数量在重症患者里面可能会明显减少。
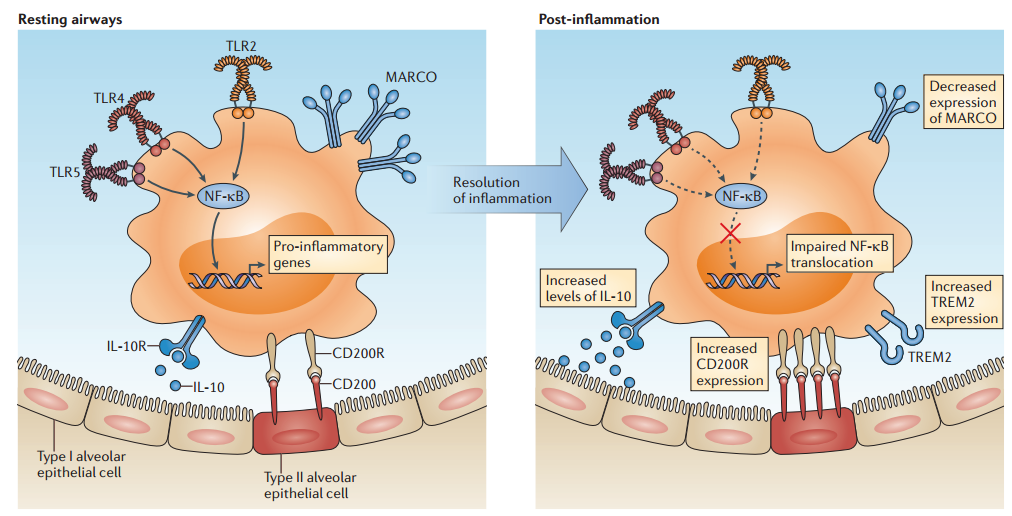
图11
2.肺泡巨噬细胞的免疫调节作用
①肺泡巨噬细胞早期对病原体可迅速应答;
②在病原体诱导下发生死亡[9];
③依靠自我增殖恢复数量[10];
④释放负性调控因子抑制过强炎症;
⑤从而促进炎症消退与损伤修复[11]。
3.肺泡巨噬细胞减少与免疫失衡的发生
为什么重症患者的肺泡巨噬细胞在减少,而死亡患者的外周血单核/巨噬细胞却很多?巨噬细胞到底发生了什么?
进一步研究发现,缺失肺泡巨噬细胞能延缓炎症及修复损伤;缺失外周单核/巨噬细胞可以大幅降低损伤程度。重症感染患者,有大量的外周血单核细胞(PBMCs)转化成巨噬细胞进入肺泡和组织器官里面,对炎症反应和免疫紊乱起到非常重要的作用。研究证明,肺泡巨噬细胞的缺失会造成外周单核/巨噬细胞的大量增加,增多的外周单核/巨噬细胞具有明显的促炎特性,介导免疫失衡的发生。恢复期肺泡巨噬细胞表现出明显的抑炎表型,起到免疫调节作用;缺失了肺泡巨噬细胞之后外周单核/巨噬细胞数量增加并上调促炎基因的表达。如何保证肺泡巨噬细胞和外周单核巨噬细胞的平衡,将是未来研究的热点和重点。
4.新冠感染中的免疫失衡-免疫抑制
免疫抑制早期是免疫反应出现的促炎基因的表达,中晚期可能会出现免疫抑制,这是重症感染的另一个重要特点,表现为淋巴细胞的减少及功能的异常(如图11)。

图11
我们的研究发现,初次急性感染和重复感染有明显不同的免疫表现,急性感染会发展为T细胞耗竭(T cell exhaustion),表现为反复严重感染导致T淋巴细胞尤其是CD4+T淋巴细胞数量减少,CD4+T细胞表面PD-1表达明显增加,Treg数量增加,因此T淋巴细胞数量减少,有可能导致功能受严重抑制[12](表1)。老年患者和反复感染的患者要注意免疫耗竭和免疫低表达现象。从另一方面也提醒我们,免疫抑制有可能是人体保护的现象之一,这需要我们进一步去研究和验证。
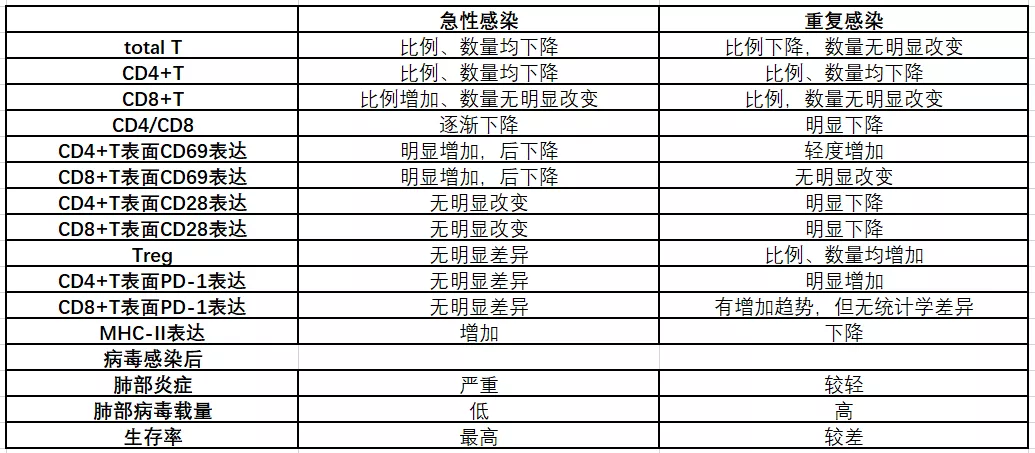
表1
5.Sepsis表型-性别
2020年《Intensive Care Med》发表的一组急诊科的重症感染的Sepsis患者性别的调查研究[13] (表2)。
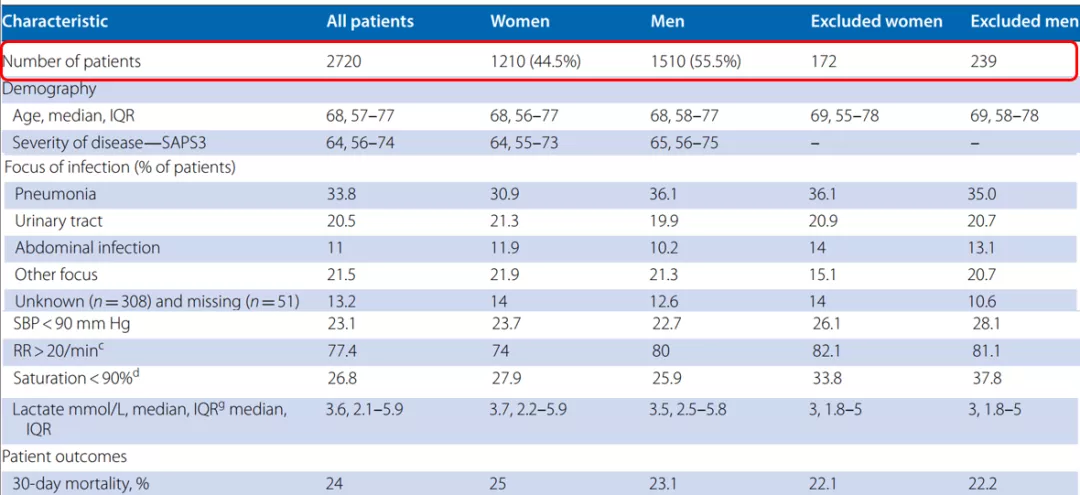
表2
研究结果,女性急诊的Sepsis患者达到了44.5%,男性是55.5%。但是当Sepsis患者到急诊科救治,就发现相关的检查、抗体应用的时间、相关的处置和检测时间明显要迟于男性,这是为什么?女性接受Sepsis Bundle 1h治疗的比例只有30%,而男性达到41.5%,很明显女性低于男性,并且第1小时应用抗菌素的比例是38.6%,男性达到47.6%。为什么会出现性别差异?30天的病死率的危险因素分析结果发现,在性别方面,如果是女性,将是一个独立的危险因素,OR是1.28。
结论是:急诊科女性脓毒症休克患者与男性患者比较,接受处置是有差异的,但不能解释女性患者死亡风险更高。
三、Sepsis临床治疗
2021年《JAMA》发表一篇文章的研究内容是,实验组受试者静脉注射维生素C 1.5g、维生素B1 100mg和氢化可的松(Hydrocortisone) 50 mg,对照组受试者静脉注射安慰剂,每6小时一次,持续96小时或直到从重症监护室出院或死亡。对比两组实验的研究结果[15]。
注:实验条件:多中心、随机、双盲、适应性样本量、安慰剂对照试验、在败血症引起的呼吸和/或心血管功能障碍的成人患者中进行。
受试者可由临床团队使用开放标签皮质类固醇进行治疗,如果每日总剂量大于或等于200mg氢化可的松的等效剂量,则不使用研究用氢化可的松或匹配的安慰剂。
研究结果是却阴性,在病史指标等方面与对照组比较并没有显著性差异。
为什么把VC、VB1和Hydrocortisone「三药合一」进行实验?这个研究的设计还是有些问题(如图12)。
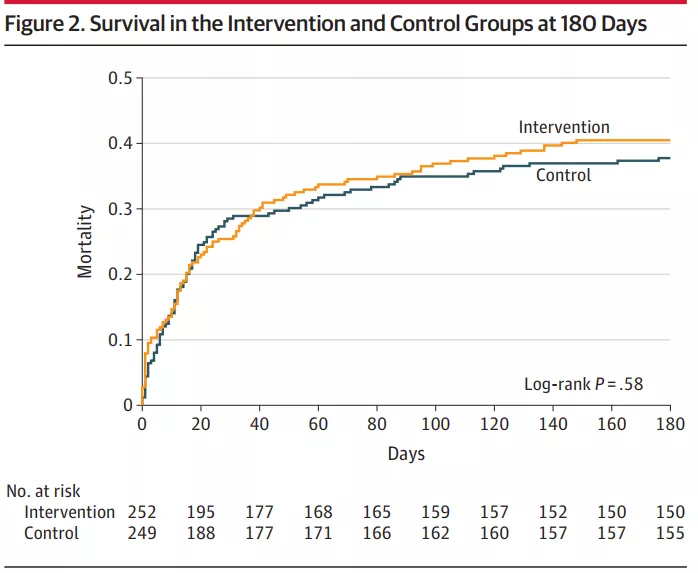
图12
众所周知阿司匹林不仅有抗凝作用,还有一定程度的抗氧化作用。《柳叶刀呼吸病杂志》发表一篇文章是进一步临床分析的研究。一组是老年患者用阿司匹林100mg/天,另一组不用阿司匹林的患者,探究长期口服阿司匹林对脓毒症发生的影响,结论是长期口服阿司匹林并没有能够减少脓毒症发生的病例[15]。
2020年《CELL》发表一篇文章, 研究65岁以上的老年人单剂量接种卡介苗后,统计一年左右继发感染的情况。有趣的是,老年人接种卡介苗后,在未来一年内,其呼吸道感染率明显降低。但对胸腹腔感染、泌尿道感染和血流感染没有明显变化,而对呼吸道感染和下呼吸道感染的比例明显降低[16](如图13)。因此,无论社会型肺炎还是医院型肺炎,接种卡介苗可以有效减少下呼吸道感染的风险。
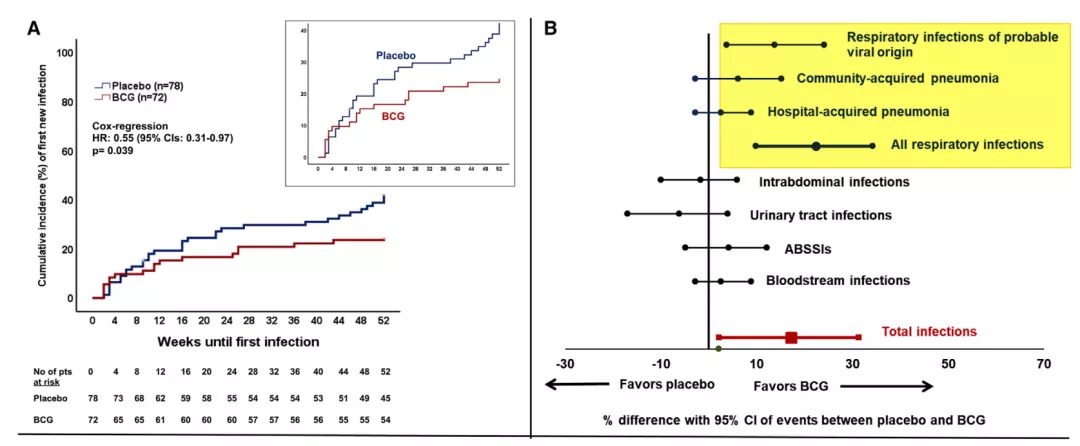
图13
该研究最有意义的是对入组老年患者免疫机制的研究,方法是将患者的血液中的外周血单核细胞(PBMCs)分离出来,在体外直接用各种条件进行刺激来看炎症因子的表达情况。结果:当老年患者接种了卡介苗以后,体外试验的PBMCs对不同感染刺激下的炎症反应能力明显提高[17](如图14)。也就是说,接种卡介苗会对老年患者对继发呼吸道感染有了名明显的炎性反应能力,从而提高了自身的免疫力[16]。
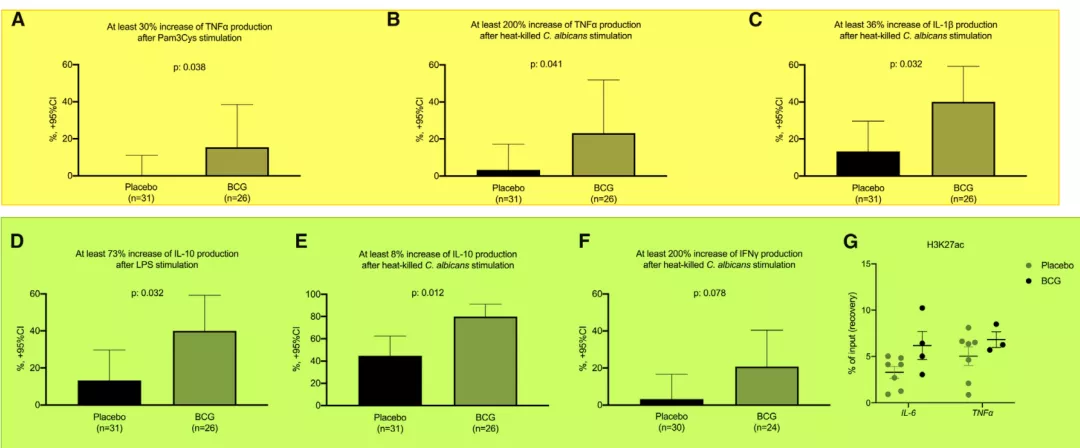
图14
当老年患者一定程度上出现免疫麻痹、免疫耗竭时,通过接种卡介苗对免疫反应的恢复具有积极作用。
2020年《Crit Care》发表一篇关于右(旋)美托咪啶对感染性休克患者血管升压药需求的文章。SPICE试验把感染性休克患者分为两组,一组用右(旋)美托咪啶给药,另一组是常规处理,观察患者。这两组的APACHEⅡ都是25分左右[17](表3-4)。结果发现,右(旋)美托咪啶可降低感染性休克患者对血管活性药物的需求。右(旋)美托咪啶组的用活性药物的时间与对照组比较有明显的缩短,而且应用统计的时间也有缩短(如图15)。
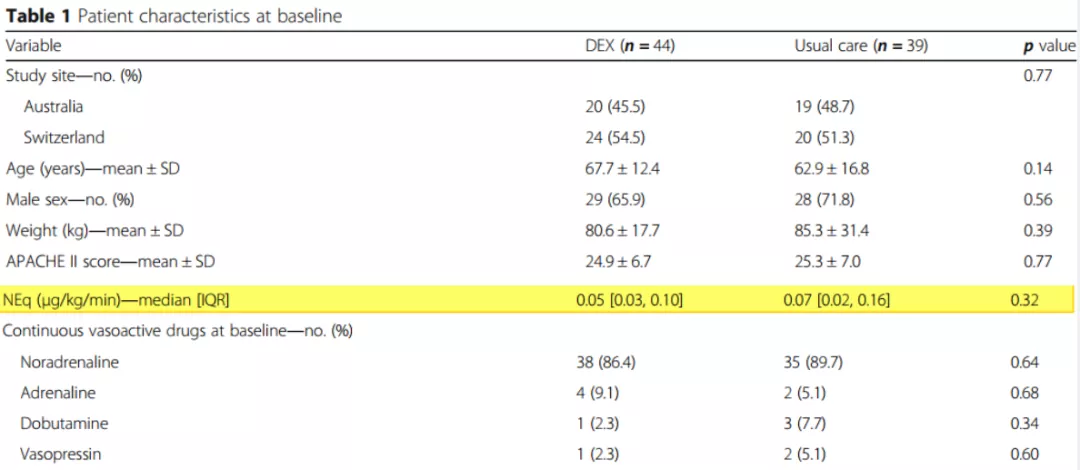
表3
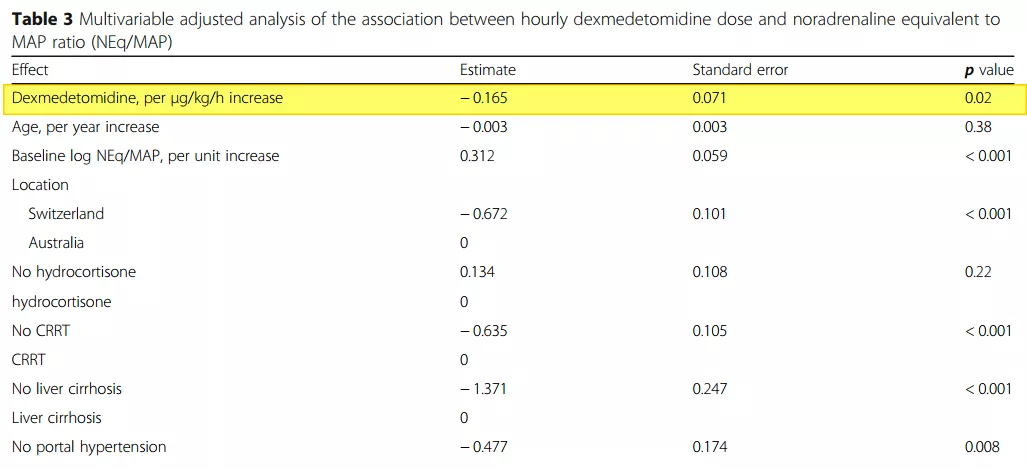
表4
结论
在感染性休克的危重病人中,与对照组相比,右(旋)美托咪啶组的病人在最初48h内接受了相似的血管升压药剂量。经过多因素校正分析后,右美托咪啶似乎与维持靶向MAP的较低血管升压药需求有关。最主要的是,右美托咪啶对血管活性药物的敏感度可能一定程度上提高,但反应机制还需要进一步的研究[18] 。
参考文献 (可上下滑动浏览)
[1] Crit Care Med. 2020 Mar;48(3):e209-e218.
[2] Lancet 2020; 395: 200–11.
[3] Intensive Care Med . 2020 Jun 22. doi: 10.1007/s00134-020-06106-2.
[4] Crit Care Med 2020; 48:276–288.
[5] Immunity. 2020 Jun 16;52(6):910-941.
[6] Nat Rev Immunol. 2020 Jun;20(6):355-362.
[7] Nat Med. 2020 Jun;26(6):842-844.
[8] Nat Rev Immunol. 2014 Feb;14(2):81-93.
[9] Eur Respir J. 2020 Dec 10;2003764.
[10] Immunity. 2021 Apr 28;S1074-7613(21)00138-2.
[11] Immunity. 2016 Mar 15;44(3):450-462.
[12] Front Immunol. 2021; 25;12:627435.
[13] Intensive Care Med. 2020;46(4):727-736.
[14] JAMA. 2021 Feb 23;325(8):742-750.
[15] Lancet Respir Med. 2021 Feb;9(2):186-195.
[16] Cell. 2020 Oct 15;183(2):315-323.e9.
[17] Crit Care. 2020 Jul 16;24(1):441.
专家介绍

解立新
中国人民解放军总医院 主任医师、教授,博士研究生导师,呼吸与危重症医学部主任,中国医师协会呼吸医师分会危重症专业委员会副主任委员;中华医学会呼吸病分会全国委员、呼吸治疗学组组长、危重症学组顾问,中国康复协会呼吸康复专委会副主委,中国医师协会急救复苏和灾难医学专业委员会副主委。
本文由《呼吸界》编辑 Asiya 整理,感谢解立新教授的审阅修改!
本文完,排版:Jerry
未经许可,请勿转载


