编者按:
世界卫生组织(WHO)发布的《WHO肺部肿瘤组织学分类》(第5版,2021年),对肺部肿瘤类型的划分作出了新的调整,这将对今后医疗工作产生深刻影响。在CACP 2021年会中,陈良安教授就新版WHO肺腺癌分类的内容作出介绍,尤其是对肺腺癌分类的临床病理做出了详细分析,并对由新版分类衍生的几个临床问题作出精彩的分析和解答。
以下是《呼吸界》小编整理的陈良安教授的演讲,在此分享给大家!
我今天与大家分享的题目是《2021 WHO肺腺癌新分类解读》,第5版WHO肺部肿瘤病理学分类自今年问世以来,对我们临床大夫以及患者都有很大的影响。WHO(世界卫生组织)是非常权威的机构,新版分型当然有其理论依据,也标志着我们将从病理角度对肺癌的理解和研究的不断深入。下面,我将从以下三个方面作以介绍:
一、2021 WHO肺腺癌新分类简介
(一)肺癌的病理学分类
在过去的20年里,肺癌的诊断和治疗决策过程已经被几个突破性的发现所改变。从病理上,肺癌大致分为非小细胞肺癌和小细胞肺癌,如果是非小细胞肺癌的,我们基本上以“培美曲塞+铂类+贝伐单抗”为主来治疗,如果是小细胞肺癌的,我们选择EP方案治疗。后来,由于EGFR-TKIs的问世,我们就要做病理的基因分子测序,看是否有驱动基因的突变,根据驱动基因的突变来指导我们进一步的治疗。
肿瘤的组织学分类是肺癌诊断和治疗的依据,如今除了给患者做驱动基因的检测以外,我们还要给患者做一个免疫学的检测(PD1/PD-L1),这标志着我们从组织病理到分子病理再到免疫病理的不断深入。如果我们拿到一个病理标本,而患者未做这三方面的检测,这会给我们的临床治疗决策造成很大的困难。因此,现在肺腺癌在病理学研究的进步为临床的精准治疗提供了很大的帮助。
(二)肺上皮性肿瘤的分类
2021年肺腺癌的分类,肺部的上皮性肿瘤(Epithelial Tumours)分成的良性肿瘤、前驱病变(Precursor Lesions)和腺癌(Adenocarcinoma)。
1.良性肿瘤
良性肿瘤,包括乳头状瘤和腺瘤。腺瘤还包括黏液性囊腺癌和黏液腺腺瘤等,这是良性病变。
2.前驱病变
前驱病变,包括腺体前驱病变(Precursor glandular lesions)、鳞状细胞前驱病变(Squamous precursor lesions)、肺神经内分泌肿瘤前驱病变(Precursor lesions)。
腺体前驱病变,即非典型腺瘤样增生(Atypical adenomatous hyperplasia, AAH)和原位癌(Adenocarcinoma in situ, AIS),在2015版的WHO分类中,称为浸润前病变(Preinvasive)。
3.腺癌
腺癌,包括微浸润腺癌、浸润性非黏液性腺癌、浸润性黏液腺癌等,因此,肺癌的前期就是前驱性病变,再前期是良性病变,肺癌发生发展的不同阶段会对临床治疗产生很大的影响。
思 考
如果患者是一位原位癌(AIS)患者,能否诊断为肺癌?
不能,因为它不属于肺腺癌。
怎么办?是不是就写个前驱病变呢?
显然,也不行,不够具体。
(三)WHO肺癌分类的新旧版本的对比
我们再动态的看一看肺癌的病理分类,WHO的肺癌分类从2004年→2015年→2021年都有一个逐步的变化,从2004年到2015年的变化花了11年的时间,而从2015年至今仅仅花了6年的时间就完成更新,在未来,随着我们基因分子、免疫及临床系列的研究,肯定不止于今天这个版本,还会再次更新。
1. 在2004年版中,WHO肺癌分类中不再使用支气管肺泡癌这个概念,提出原位腺癌(AIS)和微浸润腺癌(MIA)概念;AIS 被正式认定为肺腺癌的浸润前病变;2004版分类中提倡对浸润性腺癌的组织学进行详细诊断模式;同时,也提出晚期非小细胞肺癌癌一定要做EGFR基因检测。
2. 到2015年时,WHO提出气腔扩散的理论。肿瘤不只通过血管、淋巴道进行转移,还可以通过气道转移,即气腔转移。气腔转移为最新确认的一种肺癌的扩散方式,推荐肺叶切除。同时,WHO强调所有的患者都要做分子分型的分析,尤其是晚期的患者。WHO同时也强调了免疫组化确定组织学分型。
3. 2021年版,原位癌(AIS)和非典型腺瘤样增生(AAH)定为前驱病变,这是2021年这一版里的最大的变化。概括的来讲,2015年,肺腺癌分为浸润前病变和浸润性病变。浸润前病变,包括AAH和AIS,浸润性病变,包括微浸润腺癌(MIA)和浸润性腺癌(IA)。
4. 2021年版腺体前驱病变代替了浸润前病变,这将对我们的治疗、患者的诊断造成新的问题。肺原位癌患者是否是肺癌?患者的医保能否报销?已成为新的问题。这些都需要临床医生深入的理解,毕竟WHO是非常权威的机构,其做新版分类是有理由的。
因此,现在就出现一个问题了,从病理角度来讲,原位癌(AIS)属于前驱病变,那临床上它到底是不是癌呢?
这会使临床医生对患者的诊断、治疗决策、甚至后续治疗过程中,产生深刻的影响。
二、2021 WHO肺腺癌新分类的临床病理解析
(一)相关概念
1. 从临床病理角度分析
不典型腺瘤样增生或非典型腺瘤样增生(AAH, Adenomatous atypical hyperplasiar),非典型腺瘤性增生通常是≤5mm的病灶,局部的肺泡上皮细胞呈轻度到中度的非典型增生[1]。(图1)
原位腺癌(AIS, Adenocarcinoma in situ),通常是≤30mm局限性的病灶,肿瘤细胞沿着肺泡内壁框架生长,且没有基底膜的浸润,也就是没有突破基底膜[1]。(图2)
微浸润腺癌(MIA, Minimally invasive adenocarcinoma),微浸润腺癌是≤30mm的孤立的腺癌,以上皮结构为主,已有基底膜的突破[1]。(图3)
浸润性腺癌(AI, invasive adenocarcinoma),是一种恶性上皮肿瘤,具有腺体分化、粘蛋白产生或肺细胞标志物表达。肿瘤表现为腺泡状、乳头状、微乳头状、鳞状或实体状生长方式[1]。(图4)
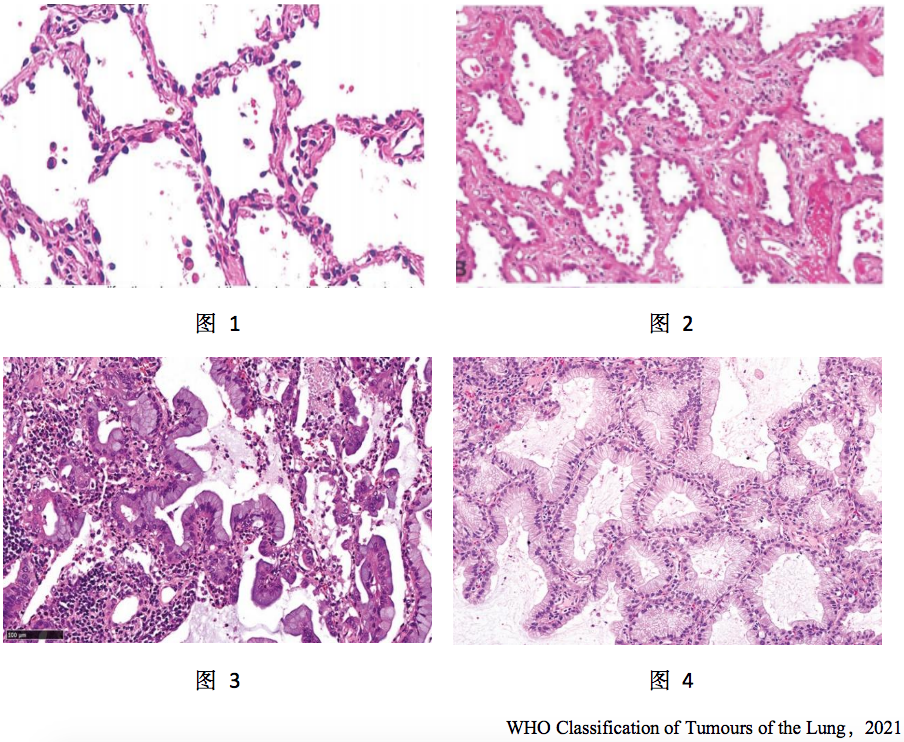
以上是从病理学来定义AAH、AIS、MIA、IA的概念,我们要熟悉。
2. 新旧版概念的对比
肺腺癌中的概念有腺体前驱病变(Precursor Glandular Lesion)、癌前病变(Precancerous Lesion)、浸润前病变(Preinvasive Lesion)。目前没有明确这三个概念是否有重叠,下面我从临床大夫的角度做一个解析。
腺体前驱病变(Precursor Glandular Lesion),特指肺腺癌中存在的癌前病变,是病变向肺腺癌发展的一种过渡阶段。2021年WHO肺部肿瘤组织学分类中,首次将AAH和AIS均归为腺体前驱病变一类,将其从肺腺癌中剔除。从理论上讲,因为AIS不再是肺癌范畴,AIS的患者是否手术切除治疗需要我们慎重思考。
癌前病变(Precancerous Lesion),指某些具有癌变潜能的病变。肺腺癌中的癌前病变等同于腺体前驱病变的概念,但癌前病变的定义较腺体前驱病变更广。
浸润前病变(Preinvasive Lesion),按照肺腺癌细胞是否突破基底膜,分为浸润前病变和浸润性病变。2015年WHO分型中,浸润前病变包括AAH和AIS。2021年WHO新分型中,取消了浸润前病变的概念,以腺体前驱病变替代。浸润前病变生长缓慢,预后较好。
2015年肺腺癌分类中,腺体前驱病变叫浸润前病变,也就是AAH和原位癌,与2021年比较,原位癌的病理定义没有太大的变化,只是把它挪了位置。“浸润前病变”和“腺体前驱病变”中的原位癌的定义均为“异常细胞未突破基底膜”。名称不同,无本质变化。
(二)临床影像的对比
临床上,手术做完,被切下来的不论是AAH、微浸润腺癌、还是原位癌,完整切除病灶后,5年生存率都很好。最重要的是,临床大夫如何在手术前能够甄别这是AAH,还是原位癌,还是微浸润腺癌,还是浸润腺癌?这是非常重要的。
临床影像分析提示:AAH体积小,密度低。当密度增高,而且体积增大时,就可能发展成AIS。当出现实性成分比小于50%时,就可能是MIA。如果实性成分比大于50%,则可能是IA。所以临床大夫一定在临床影像学上做深刻地分析,这样能够为患者后面的治疗决策提供帮助。(图5[1])
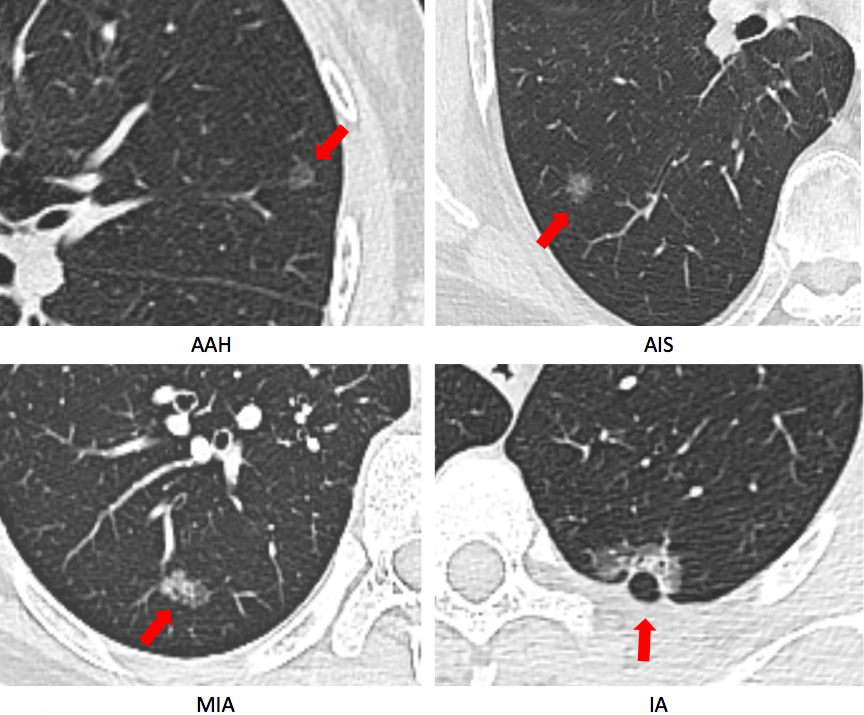
WHO Classification of Tumours of the Lung,2021
图5
(三)原位癌临床病理特征
思考:“原位癌”还是原来的”原位癌“?
我们从定义及诊断标准、临床特征、发病机制,组织病理学、细胞学和预后,把原位癌给大家做一个简要的解析。
1. 定义及诊断标准
原位癌定义(2015版):原位腺癌是≤3cm的局限性的腺癌,生长仅限于肿瘤细胞沿着原有的肺泡结构生长,无间质、血管或胸膜浸润。无气腔播散,不可见肿瘤细胞浸润。原位腺癌多为非粘液性,很少有粘液性的病例发生。
原位癌定义(2021版):直径≤30mm,基底膜内生长,无间质、血管或胸膜侵犯,未见浸润性腺癌,不通过空域扩散,细胞类型多为非黏液性,很少为黏液性,细胞壁间隔增生是常见的,特别是在非粘液腺原位癌中。
两版基本上是无变化,即大于或等于30mm,有肿瘤细胞,但没有突破基底膜,很少为黏液性的。
思考:如果有黏液性的病理,你是不是要诊断为原位癌?这要慎重!
2. 临床特征
2021年,强调手术切除的完整标本用于诊断;与CT影像结合,对于含有实性成分的病灶须仔细评判;对于mGGN须排除转移[1]。如果是做一个介入、导航或CT穿刺的小标本,如此就诊断为原位癌是非常有风险的,这在2021版是不被接受的。另外,在做临床病理诊断的时候,病理大夫也要跟临床结合。如果临床的病灶不是一个单纯性的磨玻璃结节,而是混合性结节时,做出原位癌的诊断还要谨慎。(图6)
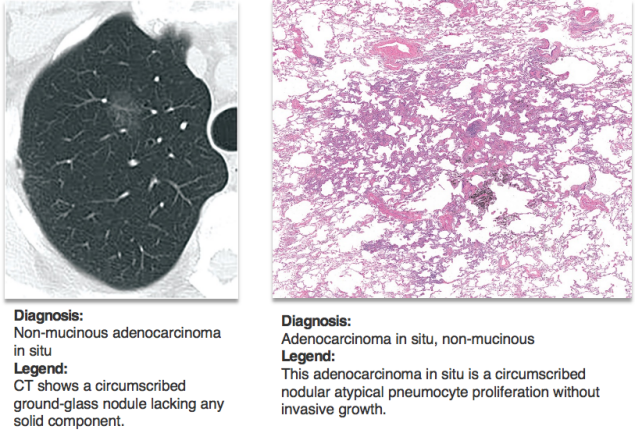
图6
因此,从临床特征上,原位癌主要是有两个特点,一是发展比较缓慢,体积倍增时间大概是800多天的,二是完全切除的手术效果很好,5年生存率为100%。
3. 分子生物学特征(genetic profile)
从AAH到原位癌,其实分子生物学特征有一系列的变化,比如说从AAH到AIS,再到MIA,EGFR等驱动基因突变发生率逐渐增高。EGFR、KRAS突变与GGN增长正相关,而驱动基因野生型GGN增长相对缓慢[2]。
从分子生物学上来讲,AIS是一个介于AAH和MIA之间的一个类型,是一个过渡阶段。这个过渡阶段有的停留时间长一点,有的停留时间短一点。
4. 免疫组化
从免疫组化的角度分析,原位癌的一些免疫组化特征跟微浸润腺癌(MIA)高度相似。因此,不能单纯地认为它是一个良性病变,有恶性的微浸润腺癌的方向发展的潜能或者特征。
(1)组织病理描述
AIS ≤30mm,肿瘤细胞沿着肺泡结构生长,没有间质、血管、胸膜浸润。
(2)AIS分为非黏液型和黏液型
①几乎所有AIS病例都是非黏液性的;
②黏液性AIS的异常罕见,其由高柱状细胞与基底核和丰富的胞浆粘蛋白组成;有时这些细胞类似于杯状细胞;
③对于黏液性AIS的诊断要非常谨慎,排除MIA,再次强调小标本不适宜为AIS诊断标本。
(3)MPLCS
多原发AIS须排除转移性病灶。
5. 细胞学
新版分类亦对AIS细胞进行了描述,但更明确指出了小标本细胞学对AIS诊断的局限性,强调AIS的病理诊断标本应为手术全切病灶的大标本。
经皮细针吸出组织学证实的原位腺癌。扁平的腺癌细胞,上皮细胞均匀,细胞异型性小,细胞核染色质细小,分布均匀,核仁呈针状。可见核内包涵体。
6. 预后
(1)AIS完整的切除,DFS和RFS均为100%,基本上是可以治愈的,这是毋庸置疑的。
(2)AIS 的CT表现为<10mm的GGN。
(3)关于手术应怎么做?国际上也有非常深入地探讨,如日本学者根据病灶的大小和实性成分情况选择手术方式的RCT研究。
(4)实性成分增加,应考虑手术,肺段切除、楔形切除都是有效的术式。完全切除病灶即可获得相同的预后。
因此,现在外科大夫的手术越做越小的,是有临床依据(Clinical evidence)的。
7. 预后研究
(1)下图是一项多中心的肺结节的研究,从影像学上符合原位癌的一个动态的结果。在影像学上的判定是符合原位癌的,实际手术中有一定概率是微浸润腺癌。用影像学来判断是否是原位癌这种准确性不是100%,因此这会给临床大夫的术前诊断带来一定的风险。
(2) 单纯性的肺部磨玻璃结节(PGGNs),也就是我们影像上的原位癌,它的2年和5年的增长速率是2%~14%,并且是不断变化的[3]。
PGGNs出现实性成分的概率是1%~6%,男性、初始病灶大于10mm,尤其是有驱动基因突变的单纯性的肺部磨玻璃结节的患者,PGGNs向浸润性方面发展的危险因素会更强烈,我们把它定位高风险[4]。
如果第一次诊断,GGNs中的实性成分达到3mm以上,也是非常危险的,将其判断为原位癌会有很大的风险。此研究发现影像学上的原位癌的体积倍增时间是811天,这将是个缓慢的过程,甚至达到2~4年。
在吸烟、初始直径大于10mm的,或是实性成分大于3mm的,有驱动基因突变的男性患者,诊断原位癌,往往是有高度的有风险的[5]。
8. 小结
原位癌的基本定义是没有变化的,无论从临床研究还是分子生物学,我们对原位癌有了更深一步的理解,所以 WHO才把它归到体前驱病变。
目前我们对原位癌和磨玻璃结节的研究的越来越多,影像预测的研究也越来越多,因此从影像学上来做一个术前的判断,是非常重要的。如今的研究,从影像特征到定量影像再到影像组学、大数据、模型、神经网络、AI等,都将为临床识别提供更多的依据。当然病灶的完全切除是标准,基本上预后应该是非常理想的。
三、基于2021 WHO肺腺癌新分类的几个临床问题与思考
(一)肺原位癌是不是“癌”?
这个问题很有难度,下面探讨一下。
1. 肺癌原位癌病理特征
AAH、AIS和MIA是有区别的。AAH的细胞只是增生,还不具备肿瘤细胞的特征。AIS具备癌细胞的特征,但未突破基底膜。达到MIA时,具备癌细胞特征,且突破基底膜。临床大夫从病理上看,AIS的癌特征还是十分明确的。
2. 肺原位腺癌的生物学特征
AIS和MIA的免疫组化是非常相似的。因此,从免疫组化和分子生物学特征来看,AIS应该是MIS的前期表现,或有向MIS发展的趋势。
3. 肺原位腺癌的驱动基因突变特征
驱动基因也是随着AAH到MIA,基因突变的频率是明显增加的,从分子生物学角度来讲,这也是一个发展的过程[6~7]。驱动基因虽然是治疗的靶点,但驱动基因一旦有突变,肿瘤的恶性增生是非常明显的。
4. 肺原位腺癌的其他基因表达特征
除驱动基因改变外,伴随着AIS→MIA→IA还可能存在其他基因的表达及突变差异,目前尚无统一结论[8]。
5. 肺原位腺癌的临床及影像特征
①可动态随访观察;
②若手术切除,则五年生存率为100%;
③前提是治疗,若始终不予处理,则AIS可能继续发展为MIA甚至IA,降低患者生存率。
6. 肺腺癌的自然进程与异质性
AIS是肺腺癌发生发展中的关键环节;AIS存在异质性,某些AIS可数年保持稳定,但某些AIS具有快速发展为MIA的潜力。
临床上经常看到患者单纯性的磨玻璃结节,半年乃至一年都不消失,患者总问怎么办?我说:“恐怕你最终逃不了外科手术这一刀”,一旦启动了这个程序,或早或晚的都向浸润性方向发展?手术终究是不可避免的,但只不过是手术处置未必都需要那么积极,合理把握手术时机。
为什么手术效果很好?是因为需要把握手术的时机,在发展成浸润性病变之前手术切除病灶都会获得很好的预后。不管怎么样,我个人认为AIS是介于AAH和MIA之间的一个类型。
7. 原位癌是“温柔”的癌症
原位癌到底是不是“癌”?大家自己来做判断,但我认为腺体前驱病变并不就是一个良性病变,这一点大家应该都有共识。
因此,我个人认为原位癌应该是“温柔”的癌,或者是“沉默”的癌。有的外科大夫说它是惰性癌。原位癌是否变化发展,这取决于它的生物学特征和异质性,以上是关于AIS是不是癌的问题。
(二)临床如何对待,“摘帽”?手术?观察?
1. “摘帽”
①支持的理由
摘掉了“癌症患者”的帽子,极大的缓解心理压力;依据来源:完整切除AIS,患者的DFS和RFS均为100%。
②反对的理由
原位癌是缓慢增长的癌,其已呈现出浸润性腺癌相同的免疫组化特征,彻底放任会导致其向浸润性病变进展;原位癌得以实现治愈,是因手术切除了病灶。
我个人认为,摘掉帽子,是有很大的风险的。第一个风险就是,如何在临床影像上来识别?能百分百的肯定它就是原位癌?不能。因此,AIS临床识别有风险,另外,原位癌的生物学特征的各方面不一样,它是有异质性的,有些是变化的,有些是沉默的,另外小标本的结果还不能代表整个病灶的结果,因此,为AIS彻底“摘帽”有风险。
2. 手术
如果还不是癌,那么手术就没有依据了。但是手术对高危因素的患者,比如:缓慢发展的、男性、驱动突变的、初始直径在10mm以上、实际成分大于3mm,要不要考虑手术?这值得考虑。
另外,患者的磨玻璃结节持续存在,患者终究是要做手术的。我认为就让“子弹飞一会儿”,不要着急做手术,可以观察,但是不是说不管,关键是如何合理把握手术时机。
3. 观察
一般情况下,80%以上的患者在一年以内不会有太大的变化,因此可以观察。观察的指南有Fleischner指南、NCCN指南、ACCP指南、肺结节诊治中国专家共识(2018年版)。
(三)非手术治疗方法与可能性
能不能做微创治疗?能不能做放射治疗?能不能做靶向治疗?能不能做免疫治疗[9] ? 目前尚不能确定。需要很多的临床研究来进一步证实,至少在未来,这些很有可能成为我们的治疗手段和方法。
(四)临床风险有哪些?
①影像诊断风险。影像识别不是100%,有些肺结节影像诊断是原位癌,而病理诊断是微浸润腺癌。
②小标本活检风险。2021年版分类亦对AIS细胞进行了描述,但更明确指出了小标本或细胞学对AIS诊断的局限性,强调AIS的病理诊断标本应为手术全切病灶的大标本。因此,小标本活检是不可靠的。
③手术风险。纯磨玻璃结节出现实性成分后再行手术,仍可获得很好预后;纯磨玻璃结节直径增大,但未出现实性成分,未必不是手术指征;对于老年患者,预计寿命+10年,可行微创手术[10]。
术中冰冻病理很重要,术中冰冻病理与最终病理有很好的吻合率。以下图为例,术前HRCT显示结节分叶、毛刺、胸膜牵拉,拟行肺叶切除及淋巴结清扫术,术中冰冻病理提示为AIS,随即行楔形切除,最终病理为AIS,避免了大范围的切除操作。(图7)
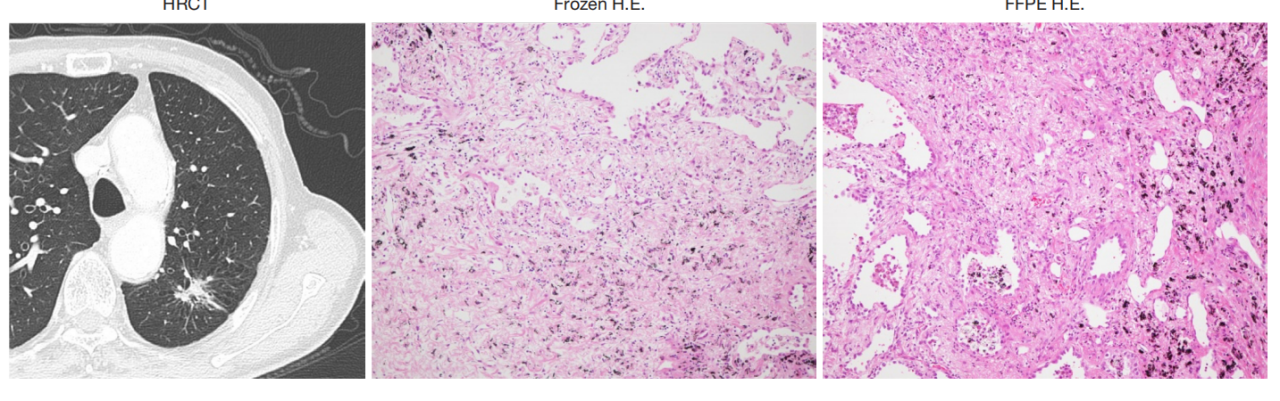
冰冻后 大清理后
图7
④观察风险。AIS并非匀速生长,甚至个别病例先缩小,再增长,且有观察成本,患者有放射损伤等。(图8)
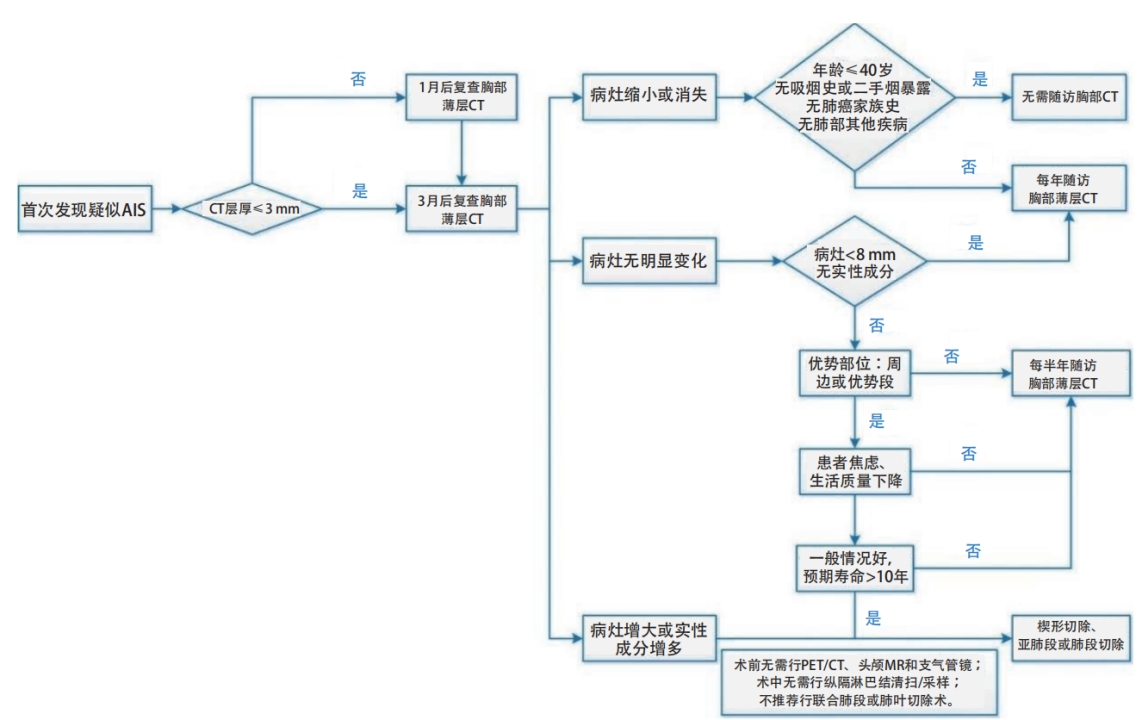
上海市肺科医院磨玻璃结节早期肺腺癌的诊疗共识(第一版). 中国肺癌杂志. 2018
图28
综上所述,我个人认为对原位癌的处理策略是:
①AIS不是癌,但也不可归为纯粹的良性病变;
②规律随访,“静观其变”
③新分型下,合理把握手术时机;
四、展望
未来,一定将会有更精致、精准的分类方法,会让我们的临床治疗更加有的放矢。在临床和科研上的观察、随访,收集、积累信息和数据,为将来能够反推病理分类起到积极作用。
参考文献:
[1] WHO Classification of Tumours of the Lung, 2021.
[2] Genetic features of pulmonary adenocarcinoma presenting with ground-glass nodules: the differences between nodules with and without growth[J]. Annals of Oncology, 2015, 26(1): 156-161.
[3] Natural History of Pulmonary Subsolid Nodules: A Prospective Multicenter Study. J Thorac Oncol. 2016 Jul;11(7):1012-28. doi: 10.1016/j. jtho.2016.04.006.
[4] Ground-glass nodules of the lung in never-smokers and smokers: clinical and genetic insights. Transl Lung Cancer Res. 2018 Aug; 7(4): 487-497.
[5] The Natural Growth of Subsolid Nodules Predicted by Quantitative Initial CT Features: A Systematic Review,Front. Oncol, 2020.
[6] Clinicopathologic Features and Genetic Alterations in Adenocarcinoma In Situ and Minimally Invasive Adenocarcinoma of the Lung: Long-Term Follow-Up Study of 121 Asian Patients. Ann Surg Oncol. 2020; 27(8): 3052-63.
[7] Distinctive clinicopathological features of adenocarcinoma in situ and minimally invasive adenocarcinoma of the lung: A retrospective study. Lung Cancer. 2019; 129: 16-21.
[8] Elucidating Genomic Characteristics of Lung Cancer Progression from In Situ to Invasive Adenocarcinoma. Sci Rep. 2016 Aug 22; 6: 31628.
[9] Immune evasion before tumour invasion in earlylung squamous carcinogenesis,Nature,2019
[10] 上海市肺科医院磨玻璃结节早期肺腺癌的诊疗共识(第一版). 中国肺癌杂志 (2018).
专家介绍:

陈良安
解放军总医院呼吸与危重症医学部学术主任,全军呼吸病研究所所长,主任医师、教授,博士生导师。中华医学会呼吸病学分会副主任委员,中华医学会内科分会候任主任委员,中国医师协会呼吸分会副会长,全军呼吸病专业委员会主任委员,北京医学会呼吸病分会候任主任委员。


