通过对循环肿瘤细胞进行分子检测来识别化疗敏感和化疗耐药的小细胞肺癌患者明显不同的基因拷贝数分布

液体活检相对于传统组织活检而言,具有无创、取材方便、可重复性强的特点,在疗效评估、预后判断、病情监测方面具有的得天独厚的优势。小细胞肺癌恶性程度高、生存率低,大部分患者无法手术治疗,活检取得样本也十分有限,难以获得充分的基因组学研究。本文通过利用循环肿瘤细胞的分子标志来预测患者的化疗反应,也为小细胞肺癌的新疗法研究提供了新视角。
由于小细胞肺癌(SCLC)外科手术治疗少见,同时活检样本小或质量不满意,小细胞肺癌的基因组学研究不充分。然而,有重要研究提示,小细胞肺癌基因水平的改变和突变频率高,仅次于黑色素瘤。作为一种可行、可重复且相关性好的“液体活检”,循环肿瘤细胞(CTCs)检测可用于小细胞肺癌生物学特性及控制化疗反应的机制研究。本文主要探索基于对CTC的分子标志物分析是否可以预测患者的化疗敏感或化疗耐药(图1—图4).
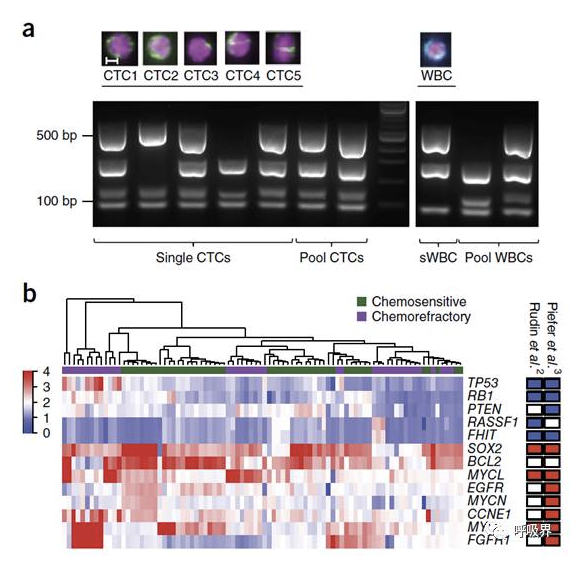
图1 13例小细胞肺癌患者的初始CTCs分子分析
(a)图为小细胞肺癌患者外周血CTCs的DEPArray图像(CK+染为绿色,CD45+染为蓝色,DAPI+染为紫色)。在分离和全基因组扩增后,通过QC-PCR来确定每个样本的基因组完整性。使用同样的操作流程来处理单个CTCs、总CTCs(10个CTCs)、单个外周血白细胞、总外周血白细胞。(b)图示小细胞肺癌中有13个基因发生了明显的拷贝数增加或缺失。(红色代表拷贝数的增加,蓝色代表拷贝数的缺失)
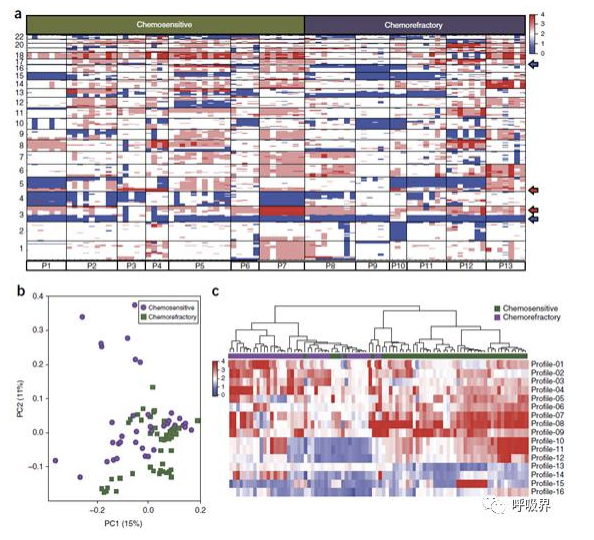
图2 基于CTC拷贝数变异(CNA)的化疗反应分类
(a)图为7位化疗敏感(绿色)和6位化疗耐药(紫色)患者的88个CTCs的CNA分析。在小细胞肺癌里(3p, 5q)的增加和(3p,17p)的缺失较为常见,分别用红色和蓝色箭头标识。(b)图为化疗敏感和化疗耐药患者所有单个CTCs的CNA数据的主成分分析。(c)图为从13例患者的88个基线CTC样本中获得的16种基于CNA预测模块的热图分析。对所有样本进行聚类分析提示化疗敏感和化疗耐药的样本差异明显。
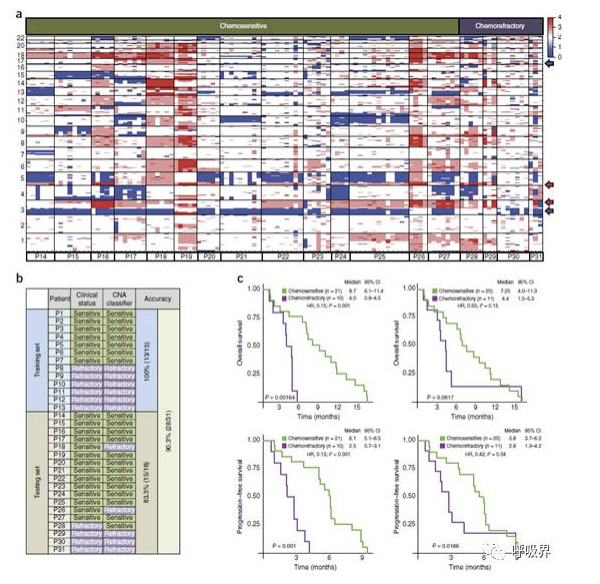
图3 基于CTC的拷贝数变异(CNA)进行临床预后的比较
(a)图为14位化疗敏感(绿色)和4位化疗耐药(紫色)患者的112个CTCs的CNA分析。在小细胞肺癌中(3p, 5q)的增加和(3p,17p)的缺失较为常见,分别用红色和蓝色箭头标识。图底部一行是患者编号,左侧显示的是染色体定位。(b)图为31位小细胞肺癌患者的临床特征和CNA分类。这31位患者被分为两组,一组为试验组(n=13人),一组为验证组(n=18人)。通过CNA特点来分类,试验组准确性为83.3%(15/18),总体准确性为90.3%(28/31)。(c)图为这31位小细胞肺癌患者在化疗反应比较方面的总生存期(OS)、无进展生存期(PFS)的Kaplan–Meier曲线。左上方及左下方的曲线是基于临床预后来进行患者化疗反应的分组。化疗耐药患者的中位PFS为2.5个月,而化疗敏感患者为6.1个月;化疗耐药患者的中位OS为4.0个月,而化疗敏感患者为8.7个月。右上方和右下方的曲线是基于基础CTCs的CNA分类来进行化疗反应的分组。化疗耐药患者的中位PFS为2.8个月,而化疗敏感患者为5.8个月;化疗耐药患者的中位OS为4.4个月,而化疗敏感患者为7.25个月。
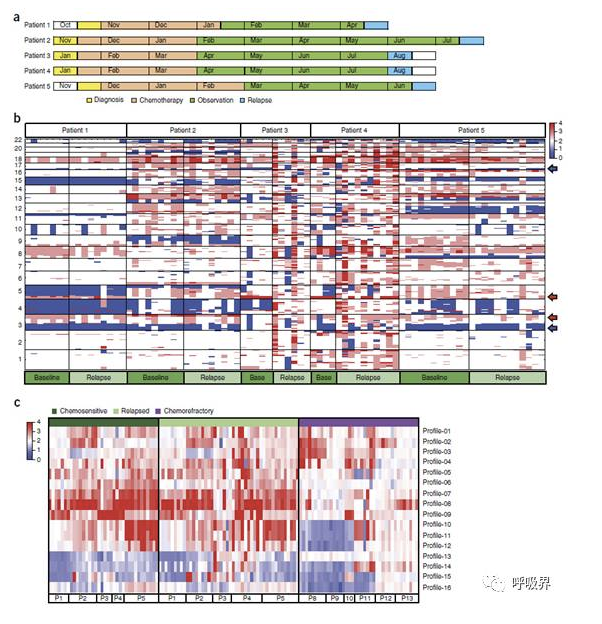
图4 配对的基线和复发样本的CTC的拷贝数变异(CNA)分析
(a)图为5位初始化疗敏感的治疗情况时间轴。分别收集了治疗前的基线(即被诊断时)CTCs(黄色方框)和复发时的CTCs(蓝色方框)。具示橘色方框代表化疗时间,绿色方框代表观察时间。(b)图为5位初始化疗敏感治疗前(深绿色方框)和复发时(浅绿色方框)CTCs的CNA分析。在小细胞肺癌中(3p, 5q)的扩增和(3p,17p)的缺失较为常见,分别用红色和蓝色箭头标识。图示顶部显示的是患者编号,左侧显示的染色体定位。(c)图为16种CNA预测模式在5位化疗敏感的36个基线CTC和46个复发CTC样本,6位化疗耐药的39个基线CTC样本中的热图分析。化疗敏感的基线(治疗前)CTC样本标识为深绿色,从初始化疗敏感到复发时的化疗耐药标识为浅绿色,化疗耐药的基线(治疗前)CTC样本标识为紫色。图示底部为患者编号,右侧显示的是16种基于CNA的分子模块
本研究结果提示基线CTCs的基因改变与临床结局相关。这项研究意味着对小细胞肺癌患者治疗前化疗敏感性分子标志物的探索已经起航,也为小细胞肺癌精准治疗的研究提供线索。
(中日医院 童润 陈文慧)
参考文献:
[1]Carter L , Rothwell DG , Mesquita B, et al. Molecular analysis of circulating tumor cells identifies distinct copy-number profiles in patients with chemosensitive and chemorefractory small-cell lung cancer.Nat Med, 2017,23(1): p. 114-119.


