谈到肿瘤的免疫治疗,特别是小细胞肺癌的免疫治疗。首先我想分享的是我们团队在十几年前曾经治愈过的一个案例:
我们中心曾采取造血干细胞移植治疗过小细胞肺癌患者……也许对方案进行改良,将来可用造血干细胞联合PD-L1单抗改变小细胞肺癌患者的免疫状况,能够进一步提高PD-L1的疗效
2004年,我们中心和医院血液科一起合作,对两例广泛期小细胞肺癌在常规EP方案化疗1疗程后,进行大剂量化疗联合自体造血干细胞移植术+TBI治疗。其中一例未做PCI,于移植后3个月出现多发脑转移放弃治疗;而另一例则做了PCI后长期随访均无出现SCLC复发情况,直到2016年死于其他疾病。但由于这种技术比较复杂,而且需要跨学科合作,临床推广困难,后来没有进一步开展。现在回想起来,患者的治愈除了大剂量化疗的作用,和干细胞支持下的造血恢复外,大剂量化疗+造血干细胞移植术+TBI+PCI可能还起到了免疫重建的作用。结合现在的免疫治疗,该方案可以在改良后进一步探讨。
我们对小细胞肺癌的治疗观念是「一线标准治疗功夫要做足」,就是强调治疗强度,但副反应会比较明显。特别是对于年轻且PS评分好的小细胞肺癌患者要想获得更好的疗效,就要「置之于死地而后生」。一线治疗一定要规范、标准,强度要够,这是我的个人观点,来自于长期的经验总结。
免疫系统通过固有免疫和适应性免疫识别和清除「非已」,这些「非己」包括肿瘤细胞……近年针对逃逸机制的免疫治疗有所突破
回到肿瘤的免疫治疗的相关话题,从肿瘤的免疫原理说起,我想主要围绕最近研究成果有效的、目前可应用于临床治疗的基本原理展开,即免疫逃逸的T细胞PD-L1、CTLA-4这两个靶点。因为肿瘤免疫治疗的过程复杂、靶点众多,研究起来自然也就进展缓慢。
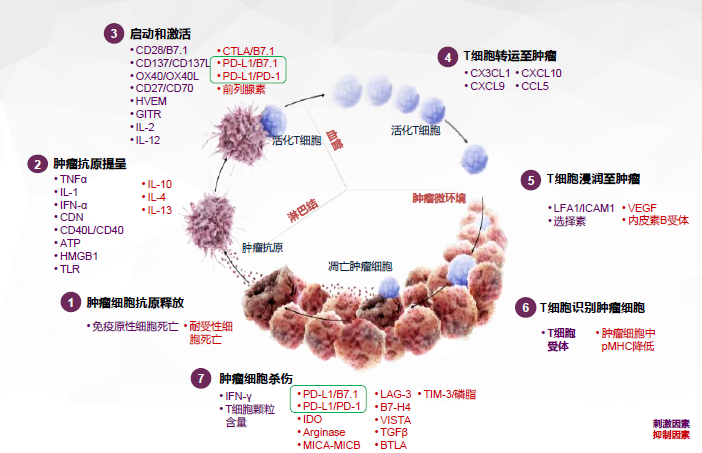
肿瘤的免疫原理大体上讲范围较广,我们经常讲肿瘤的「免疫逃逸」问题,就是自身免疫系统不能识别所谓的这些异已的、突变的恶性细胞。这种现象可能是肿瘤细胞自身的一种自然淘汰和进化过程,在突变的过程中,只有那些能够表达某些特殊蛋白,从而成功逃逸自身免疫系统攻击的恶性细胞才能存活下来,最终导致恶性肿瘤这种疾病在患者的发生。
对免疫治疗的研究过去其实也有很多,早期有肿瘤疫苗,以及增强自身免疫系统的治疗,如NK细胞、LAK细胞、DC-CIK等,通过这些细胞去杀灭肿瘤细胞,都属于免疫治疗过去的研究范畴。但以前这些治疗方法并没有得到循证医学的证实。
现阶段成功的免疫治疗主要针对逃逸机制,相当于「封闭这种伪装系统」,把「伪装的帽子」揭掉,把它识别出来,再通过激活自身的免疫细胞将其杀伤。这是目前我们所说的针对免疫检查点的治疗,也是最近这些年免疫治疗的重点突破。
免疫检查点抑制剂是如何发挥抗肿瘤作用的呢?它主要有哪些类型?最近这两年,通过免疫逃逸的「checkpoint」的检查点的抗体治疗比较成功,结合临床治疗取得了一定突破。免疫检查点目前研究比较透彻的就是两类:一类是针对这种细胞毒性T淋巴细胞的CTLA-4;另一类就是PD-1和PD-L1的途径。最早是应用于黑色素瘤的CTLA-4,后来是应用于肺癌,PD-1/PD-L1对于肺癌效果更好一些,CTLA-4相对没那么多的阳性证据,现在也有联合应用的。但显然还不够,以后还会有更多的靶点的免疫药物研究,我认为更多的、更广泛的免疫靶点研究是未来一段时间免疫治疗热点。
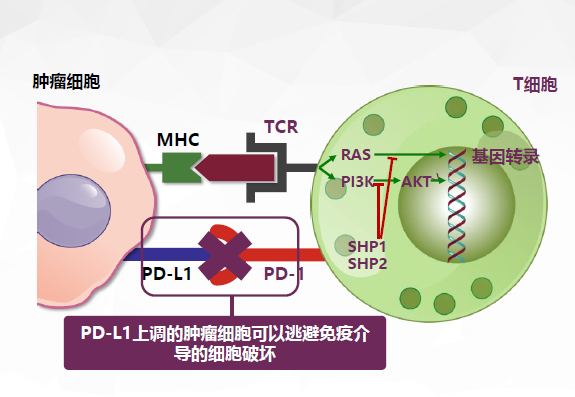
PD-1/PD-L1抑制剂通过阻止PD-L1与T细胞表面PD-1结合,从而阻止免疫逃逸,最终使T细胞重新恢复对肿瘤细胞的攻击能力
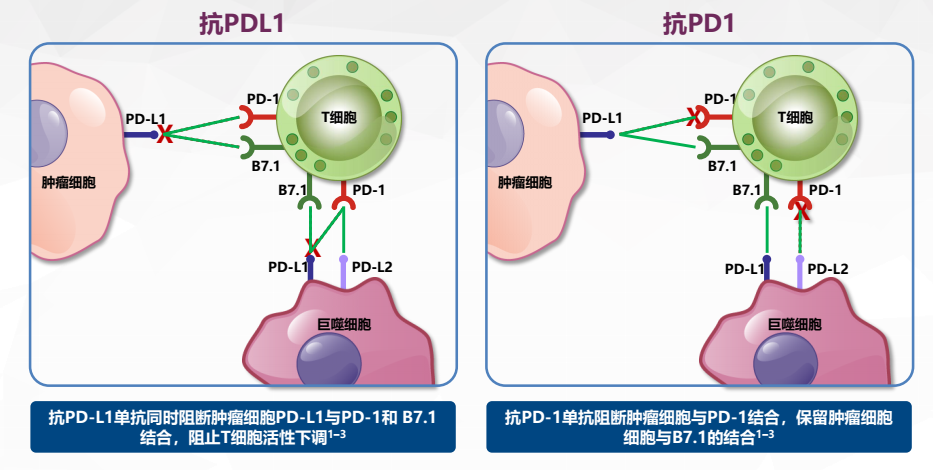
PD-1和PD-L1的区别又在哪呢?简单理解,PD-1抗体作用于受体,而PD-L1单抗作用于配体。其阻断的途径也不一样,PD-L1单抗只阻断PD-L1,而PD-1抗体除了阻断PD-L1,还阻断了PD-L2。所以效果也不一样,临床疗效和不良反应也就有所区别。我们从上图中也可看到两者的区别。
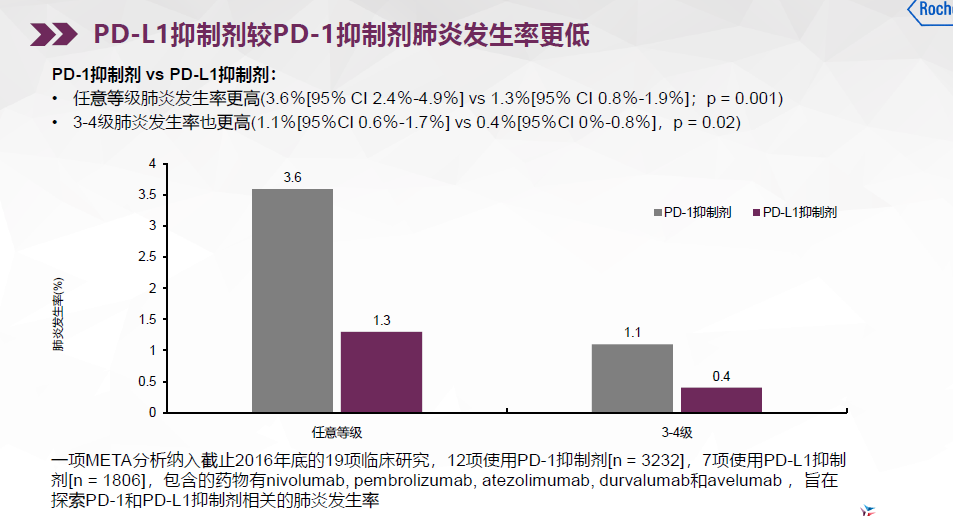
可概括为几个要点加深理解:
1、免疫检查点抑制剂是阻断免疫细胞上免疫检查点的一类单抗类药物;
2、现在研究比较成熟的有细胞毒性T淋巴细胞相关蛋白4(CTLA-4) 抑制剂和程序性死亡蛋白1(PD-1) 极其配体(PD-L1)抑制剂等;
3、以PD-1/PD-L1抑制剂为例:在肿瘤中,PD-1/PD-L1通路可通过阻断淋巴结中新T细胞的启动和活化以及抑制肿瘤微环境中细胞毒性T细胞活性,从而抑制抗肿瘤免疫应答。而PD-1/PD-L1抑制剂则通过阻止PD-L1与T细胞表面PD-1的结合,阻止了免疫逃逸。其结果是:T细胞重新恢复对肿瘤细胞的攻击能力。
换个角度打比喻,现有的免疫治疗药物相当于「把汽车上的刹车系统松了两个点」,至于这两个点,到底是「手刹」还是「脚刹」?现在还不十分明了。
免疫治疗起效较慢,要经过较长的循环过程,更注重长期效果,它是通过身体的免疫重塑间接地杀灭肿瘤细胞
免疫治疗注重的是长期效果,这是它与化疗,以及靶向治疗最不一样的特点。免疫治疗较为复杂,它是通过药物间接地去激活免疫系统,再反过来通过一系列的循环,最终杀灭肿瘤细胞,因此,它有一个较长的循环过程,起效较慢。如按疗程算,免疫治疗可能平均需要两到三个疗程(2个月左右)之后,才能慢慢看到效果,一个疗程很快见效的案例相对较少。而化疗和靶向治疗可以直接针对肿瘤细胞,见效较快。靶向治疗对于靶向人群可以立刻起效,甚至一度被称为「神药」。虽然化疗对肿瘤细胞的杀伤也很快,但由于它的不良反应较多,掩盖了疗效,往往会让病人在治疗初期「感觉不到疗效」。只能在病情进一步变好的时候,病人才能慢慢感觉到效果。

在疗效方面,免疫检查点抑制剂具有应答持久机制,主要表现在两个方面:
一、免疫应答循环:抗肿瘤免疫应答通过持续识别和记忆肿瘤抗原,随着时间不断增强和扩大。
二、免疫记忆:随着免疫应答的扩大,一些细胞毒性T细胞分化为成熟的记忆T细胞。即使在原始抗原刺激不存在时,这些细胞依然能够提供长期免疫记忆保护。
从临床实验的角度看:
1、在CM 003中在经过Nivo2年治疗后,有7个患者停止治疗,86%停药后反应持续;
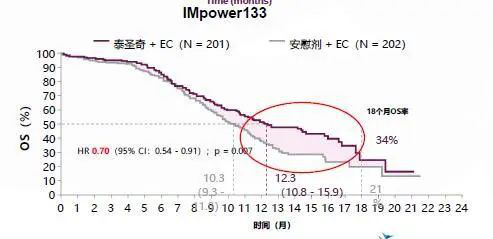
2、在IMpower133实验中我们看到随着时间的推移,治疗曲线分开,这也进一步证实了免疫治疗的拖尾效应。(IMpower133研究:阿替利珠单抗+化疗vs.单纯化疗,显示阿替利珠单抗联合化疗一线治疗广泛期小细胞肺癌,OS显著延长,死亡风险降低30%,这是近30年来广泛期小细胞肺癌一线治疗的首次重大突破。)
这些没有驱动基因的肿瘤,往往可能是免疫治疗的优势人群,反而对免疫治疗比较敏感……PD-L1恰好适用于小细胞肺癌的免疫治疗,是近二三十年来取得的突破
回过头来看现在最近两年在做的PD-1和PD-L1方面的研究。我们现在通过抗体把肿瘤细胞伪装的「帽子」给他揭掉,它就能暴露出来。现在不仅仅是肺癌,所有的癌症都可能存在「免疫逃逸」的问题,只是不同的肿瘤可能侧重点和逃逸的通路不一样。现阶段我们发现有不少肿瘤有PD-L1这个「帽子」,通过相应免疫药物揭掉这个「帽子」,从而发现它的真实身份。所以机体的平衡不光是要增强免疫为主,可能更多的是要把这些肿瘤的「免疫逃逸」识别出来,这是很重要的。
以前对于很多肿瘤可能只有化疗的治疗方式,化疗可能对所有肿瘤都有一定效果,但整体效果不是特别好。到了后来的靶向治疗时代,虽然效果确实很好,但并非所有肿瘤都有靶。我们经常会把肿瘤分为两大类:一类是有靶点的肿瘤。就是能够找到靶点的,有驱动基因突变的,用相应的靶向治疗效果很好;另一类是没有靶点的肿瘤。无论如何都找不到驱动基因,没有基因突变,对这类肿瘤就没有特别有效的、有针对性的治疗,只能采取化疗。现在,我们发现这些没有驱动基因的肿瘤,往往可能是免疫治疗的优势人群,反而对免疫治疗比较敏感。这些患者通过现有的免疫治疗技术,如应用PD-1或PD-L1的单抗免疫治疗之后,能够起到很好的效果。这些人群是免疫原性较高的、直接暴露在外的情况较多的肿瘤。如:皮肤、呼吸道、消化道等部位的肿瘤。在免疫治疗方面,现在很多肿瘤基本都有适应症,如黑色素瘤、皮肤癌等,而肺癌是第一大癌种。用PD-1和PD-L1对肺癌进行免疫治疗的效果也不错。
小细胞肺癌一直是肺癌里比较特殊的类型,它特殊在既对化疗很敏感,但有效时间又并不长,很快复发、耐药,对靶向治疗基本无效。既然它对靶向治疗不敏感,那对免疫治疗是不是效果比较好?前期有人做了很多实验,应用PD-1进行免疫治疗,效果一直不好,直到最近一两年发现,PD-L1单抗对小细胞肺癌免疫治疗的效果非常好,阿替利珠单抗发现对小细胞肺癌的免疫治疗有效。这也是近二三十年以来终于在小细胞肺癌免疫治疗领域取得的一大突破。
讲到这里不得不提到陈列平教授。多年来国际上在肿瘤免疫治疗方面的研究都没有多大的效果,直到最后在免疫逃逸方面出现了PD-1、PD-L1和CTLA-4,发现免疫治疗的特殊靶点。陈列平教授最早在国际上发现了「共刺激因子B7」,实际上,无论是PD-1还是PD-L1,它们都在同一条通路上。
PD-L1是小细胞肺癌免疫治疗的一个「靶点」,它对小细胞肺癌免疫治疗效果的最大优势和亮点主要体现在长期疗效
小细胞肺癌(SCLC)一直是肺癌治疗的一个难点,它是以多基因变异、突变负荷(TMB)高表达为特征。从化疗时代(上世纪八九十年代)开始,关于小细胞肺癌确定的治疗方案就一直没有变过。后来非小细胞肺癌出现了靶向治疗、抗血管生成治疗,但临床上把它们用于小细胞肺癌的治疗均无效果。对于小细胞肺癌只有化疗,且只有一线化疗效果好。
1999年,the lancet杂志首次发表文章表明免疫与小细胞肺癌患者生存的关系。回顾性研究显示,SCLC-LEMS患者OS远高于SCLC患者(17.3 vs.10个月)。4例SCLC-LEMS患者在肿瘤发现/治疗后的6年中位时间(1.5-8.5年)无复发迹象。
2006年,疫苗治疗后免疫反应为阳性的SCLC患者对后续化疗的缓解率高,且这部分患者的总体生存率高于对疫苗无反应的患者。29例晚期复发广泛期小细胞肺癌患者每2周一次接受疫苗治疗。多数患者进行了三次免疫治疗。评估P53特异性应答与患者疗效之间的相关性。结果显示,对疫苗免疫反应阳性的患者,总体生存率(中位数12.1个月)略高于对免疫无反应的患者(中位生存期,9.6个月),该研究提示免疫治疗在SCLC上或许也有一定的长尾效应。
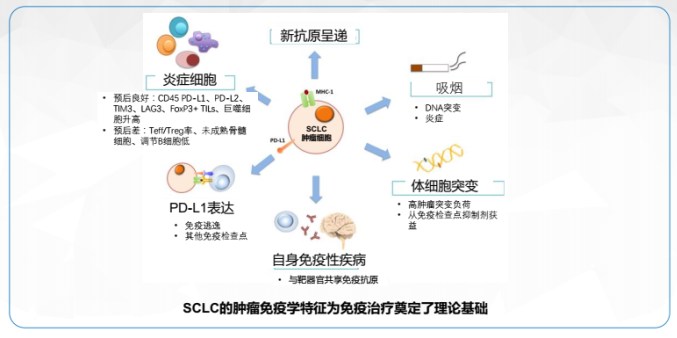
随着这些研究的不断深入,发现小细胞肺癌的免疫原性(TMB)很高。目前,我们发现PD-L1是小细胞肺癌免疫治疗的一个重要靶点。但这也只是目前研究的结论,并不意味它是唯一的靶点,可能以后还会有更多的发现。
PD-L1对小细胞肺癌免疫治疗的优势主要体现在哪里呢?它并不是体现在近期的疗效好,而是体现在对远期的疗效好。因为近期的疗效,化疗对于小细胞肺癌的效果已经很好了,但是很快出现耐药。我们加上PD-L1的单抗后发现,在近期效果同样好的基础上,会看到更好的远期疗效,就是指控制的时间可以延长更多,即「拖尾现象」,这与单纯化疗的效果完全不一样。所以,长期期疗效体现是PD-L1对小细胞肺癌最主要的优势和亮点所在。
我在临床中遇到的小细胞肺癌患者在肺癌患者人群中的占比率约为15-20%左右,广泛期为主,通常都是在化疗的基础上联合放疗或其他的局部治疗手段。虽然肺癌的TNM分期常规分为四期,但小细胞肺癌的临床分期更常见分为局限期和广泛期,这是一种特殊分期法。对于小细胞肺癌患者,只有TNM分期中的部分I期的病人才适合手术,其他一般都不适合,因此小细胞肺癌患者能接受手术的非常少。以前对于小细胞肺癌的治疗,我们的印象是一线治疗非常重要,一旦错过机会,就很难再有好的效果。现在,对于小细胞肺癌广泛期的患者,可以用化疗联合免疫治疗取得很好的效果。因为目前大陆地区还拿不到PD-L1的药物,由于地域原因,我们离港澳地区比较近,有不少病人会直接到港澳地区使用PD-L1抗体免疫药物治疗,通过对这些病人的随访,只能说初步感觉疗效和不良反应尚可。而对于晚期非小细胞肺癌的免疫治疗,我们近两年在临床上应用得较多,总体效果较好。同时,我们也参与了不少免疫治疗方面的临床研究,比如PD-1对非小细胞肺癌以及其他肿瘤的免疫治疗。以后也会在这方面进行更多的探索。
作者介绍

周承志
主任医师、教授、硕士生导师,广州医科大学附属第一医院肿瘤中心主任助理、呼吸五区(肿瘤一区)病区主任。兼任中华医学会呼吸分会肺癌学组委员,中国医师协会呼吸分会肺癌工作组委员,中国临床肿瘤学会(CSCO)患教分会及青年委员会委员,广东省精准医学应用学会肺癌分会主委,广东省胸部疾病协会肿瘤危重症分会主委,广东省医学会精准医学与分子诊断专委会副主委,广东省医学会呼吸病学分会肺癌学组副组长。


