临床工作中我们常遇到患者发生血流感染事件,阅读近两年国际上发表的学术综述以及急诊、危重症方面文献后有一些思考,关于常见革兰阴性杆菌血流感染的机制、起源与诊断方面的内容与大家一起分享。
血流感染病原主要包括细菌与真菌,细菌性≥90%……血流感染死亡率占27%左右,各科室数据有差距
血流感染死亡率较高,占27%左右,各科室数据差距较大。血流感染病原主要包括细菌与真菌,细菌性≥90%;血流感染呈现的趋势通常是较少的菌种引起较多的感染,尤以革兰阴性杆菌为主。病原非常集中,常见于大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌以及鲍曼不动杆菌等。
患者很明显是脓毒血症,但病原并未验出,又或者怀疑为血流感染,却难以得到阳性结果,原因是多种多样的,比如抗生素的广泛使用以及血流感染的有些患者血液中病原量很低。

从多个文献可知,血流感染时培养阳性结果较低的原因是血流感染的菌量(Bacteria/fungus loading)较少。因此,临床上要解决该问题通常是提高采血量。之所以说各科室数据有差距,以新生儿的培养阳性率为例,约为1-2%阳性率,但在急诊可达20-30%阳性率。值得注意的是,新生儿中68%的患儿血液里菌量非常少,因此要解决这个问题通常采用增加采血瓶、提高采血量的方法,但又受限于新生儿/儿童的采血量限制,从而造成该人群培养阳性率低。
血流感染通常分类
原发性血流感染、一过性血流感染和继发性血流感染。目前认为肠道是原发性血流感染的重要来源,特别是大肠埃希菌与肺炎克雷伯菌;一过性血流感染通常被人体快速清除,临床意义不明确;继发性血流感染病原来自于 肺部感染、尿路感染、医疗器械使用。肺炎是肺炎克雷伯菌与铜绿假单胞菌的继发性血流感染的主要来源。
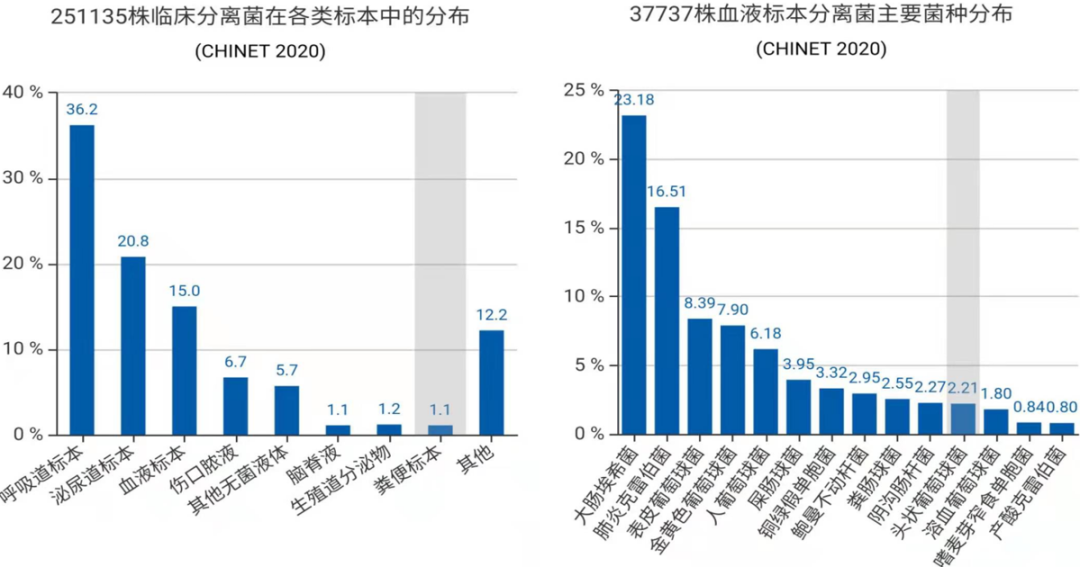
根据国内血培养现状可见,血液占总体样本比例并不是很高,约为15%左右,有的医院可能会更高,总体来看「痰样本」占比较高,我们认为这是不理想的情况。此外,以上数据看分离菌种,大肠埃希菌、肺炎克雷伯菌占前两位,有的医院可能金黄色葡萄球菌多一些,比如儿童医院。
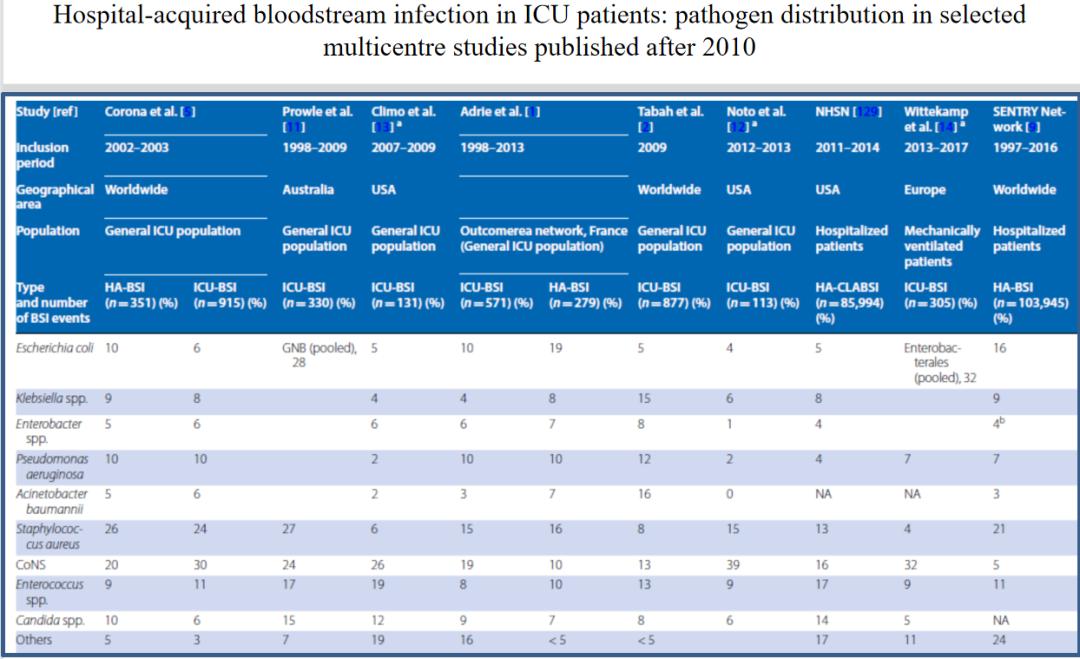
引起血流感染的阴性杆菌中,大肠埃希菌和肺炎克雷伯菌在不同流调、不同年代里所占比例均较高。
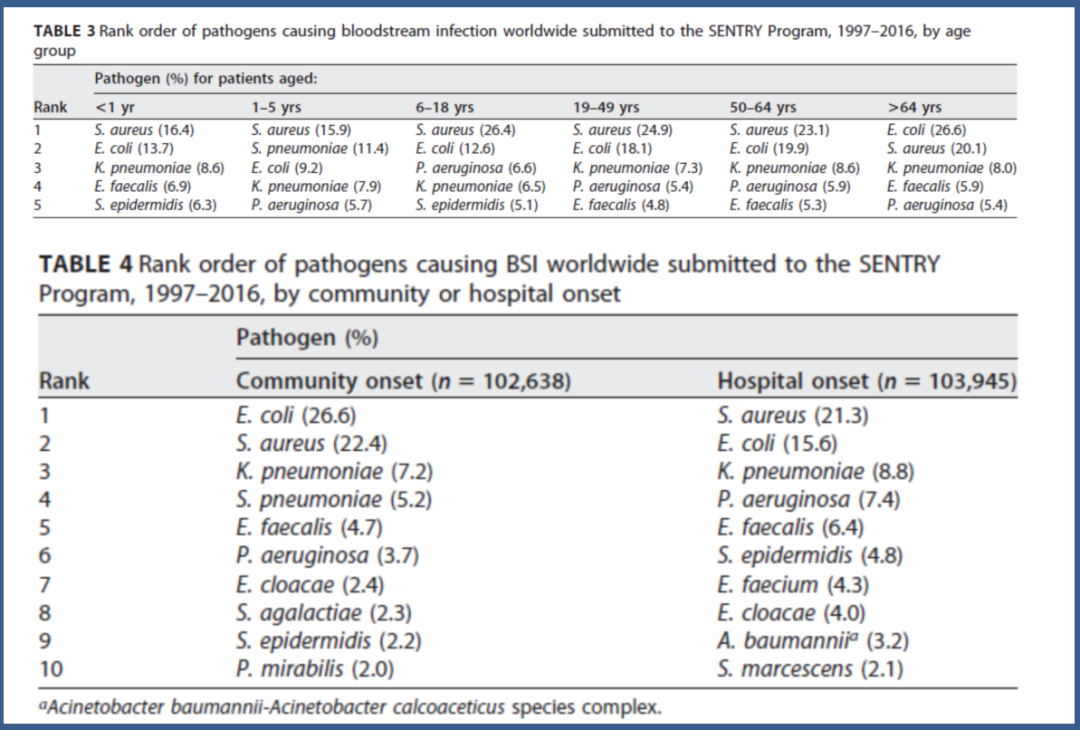
很多情况下,阴性杆菌里排在最前位的就是大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌。
不同科室、不同感染部位引起血流感染的情况,以及主要病原学特征如何?以尿路感染后继发血流感染为例,通常以大肠埃希菌为主,但要注意到的是,医院与社区感染情况有区别。医院感染除了考虑肠杆菌目以外,还要考虑铜绿假单胞菌和肠球菌。
临床中常见到的现象,为何在终末器官形成脓肿,「血培养」却往往是阴性?……解读血流感染非常关键的三个阶段
就血流感染的机制而言,血流感染分为三个非常关键的阶段,首先是初步感染部位的定植或侵袭,其次是侵入血液,最后是血流中存活。如果没有第一个阶段,没有在局部累积一定的菌量,便很难突破上皮细胞的屏障,很难入血;入血后,由于血液里含有丰富的细胞免疫和体液免疫机制,很多吞噬细胞、中性粒细胞等,因此进入血液的病原菌要想存活下来非常艰难,通常很快会被人体血流系统里的免疫机制清除。
但在,有个问题值得大家注意,在这个过程中,有可能菌入血,随血液循环已经到达终末器官,比如到达肝脏(当然肝脓肿也可以有其他来源,如胆道)、肾脏、肺,形成小脓肿,往往此时我们再回头去查血流感染,血液样本里已经检测不到存活的菌株,这都是临床中可能遇到的情况。我们往往会想,
某个部位是一个脓肿,但它是不是从血液来的?如果是从血液来的,为什么血培养是阴性?一个非常重要的原因就是,在血液里菌很快就被清除了,而在局部器官时可能免疫能力没那么强,于是在局部器官菌繁殖下来,形成脓肿或局部感染。
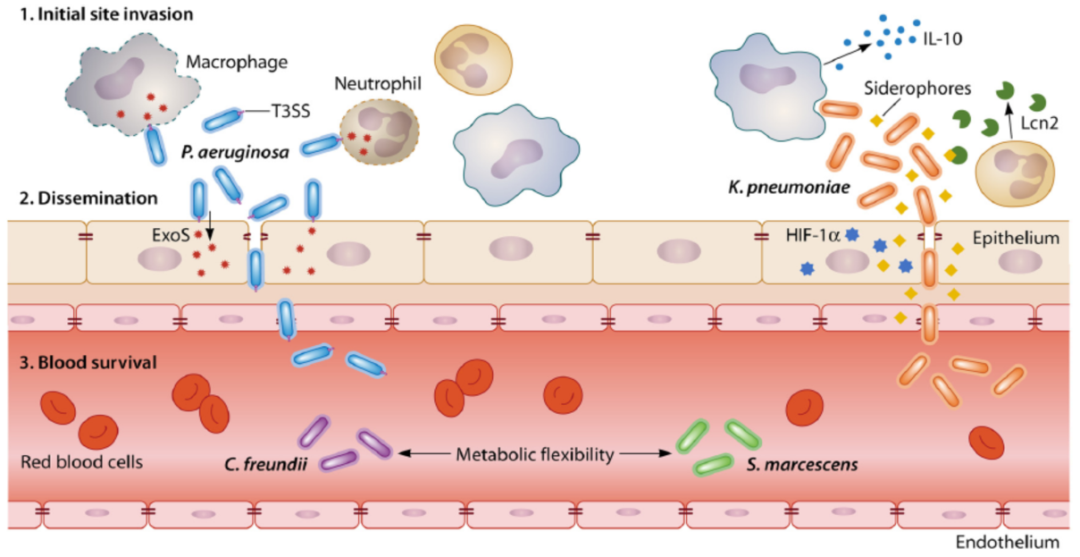
不同细菌(如铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯菌)侵袭入血,内在机制有很大差异。进入血流后能够存活下来,不同菌之间也有很大差别。
社区获得性血流感染最常见的菌种,大肠埃希菌仍然牢牢占据首位。并且大肠埃希菌在医院获得性感染中也排名第二位。从大肠埃希菌分类看,通常为肠道入血(如通过食物入肠道,在肠道定植)、肠道外(如污水),以及尿路感染。尿路感染的大肠埃希菌致血流感染,文献的数据显示死亡率偏低。
通常我们理解通过肠道入血的菌,有可能是一些患者食用过受污染的蔬菜,接触环境污水,菌进入肠道定植,这也很好地解释了一些患者从来没有在医院环境就诊住院,但血培养出了特别耐药(如产碳青霉烯酶KPC/NDM等)的大肠埃希菌,说明很可能与农业有关。或者患者食用了在农业中投喂大量抗生素的鸡、猪等,导致抗生素压力下耐药,再被患者摄入。肠道定植以后,可能在某些情况下,① 引起尿路感染,然后通过尿路入血,或者 ② 通过感染胆道,胆道入血,还可以 ③直接通过破损的肠壁入血,这些均有可能。
但是,细菌入血要想在血液里存活下来非常艰难。因此通过侵犯血管壁进入血液存活下来的细菌的毒力通常是比较强的。如果是通过静脉插管或尿路入血的,毒力偏弱,患者死亡率偏低。例如:大肠埃希菌先引起尿路感染,通过尿路感染再入血,形成尿源性血流感染,通过这个途径一般来讲大肠埃希菌的毒力也会偏低,文献的数据显示这类患者死亡率偏低。以上看法大家可以在实践中进行考证。
肺炎克雷伯菌占社区与医院血流感染第三位。主要来源于肠道定植(约一半的院内血流感染为原发感染,与肠道定植有关)、环境。医院获得性血流感染可源自尿路感染、胆道感染、原发部位感染(如肺炎后引起继发血流感染),社区获得性血流感染则多与尿路感染或胆道感染有关。
曾见一例医疗纠纷的病例,患者是胆道手术后高度耐药的阴沟肠杆菌血流感染,但由于患者很年轻,临床中没有往这方面考虑,实际上也很难考虑到,结果发现感染了产金属酶(NDM)的阴沟肠杆菌,术后的抗生素预防与治疗所用的三代头孢无效。随着抗生素在农业或临床的广泛应用还会累积很多类似的「无辜者」,即指患者从未使用过抗生素,但他获得这些高耐药的菌的几率会越来越多
血流感染中高毒力肺炎克雷伯菌与耐碳青霉烯肺炎克雷伯菌的比例越来越多见……这将成为我们面临的难题和噩梦

导管相关性血流感染的肺炎克雷伯菌常为非HV-KPN(高毒力的肺炎克雷伯菌)。高毒力的肺炎克雷伯菌和普通的肺炎克雷伯菌有很多文献均已有描述,这也是现在我们特别关注的一个问题。现有很多专家教授、很多团队都做出了很好的研究结果,临床中出现高毒力的肺炎克雷伯菌引起感染的比例越来越多见。比如急诊科会经常遇到一些患者,如肝脓肿,有血流感染的糖尿病患者,都会引起很严重的感染。
高毒力肺炎克雷伯菌最高见于台湾的报道(1986年)。近年来的研究越来越多。


现在还出现一些情况,检出的肺炎克雷伯菌既是高毒力的,又是高耐药的。我们曾经遇到一个患儿,属于肺炎克雷伯菌血流感染,但是这个患儿在12岁时因白血病做了造血干细胞的骨髓移植,由于移植后出现免疫抑制方面的情况变化,导致该患儿后来肺部又出现了纤维化,因此又做了肺移植。肺炎克雷伯菌感染就是在肺移植后发生的,属于高毒力、粘液型的、产金属酶的肺炎克雷伯菌。同时患儿对替加环素也耐药,后续治疗效果不佳。
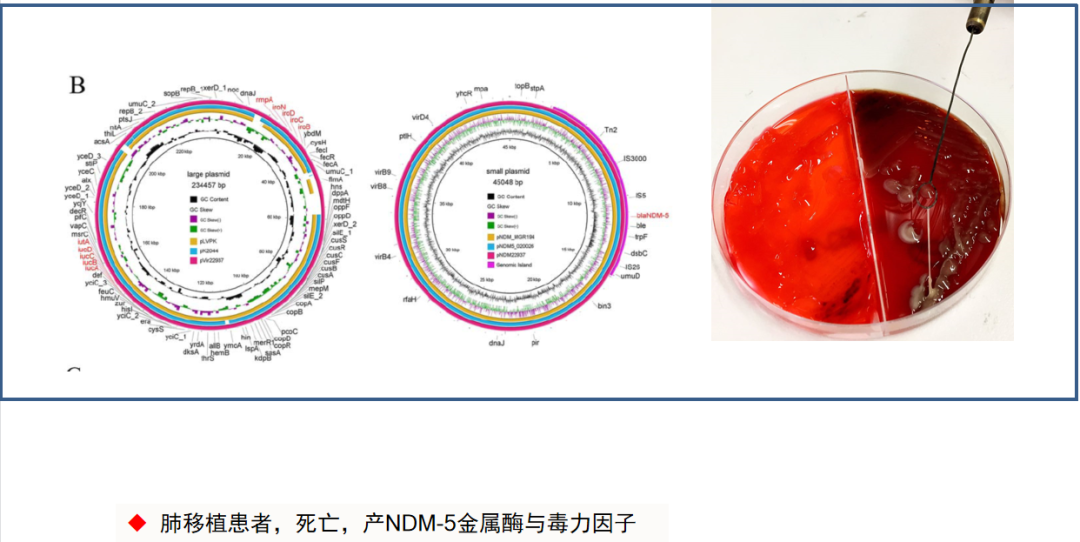
因此,我举这个例子是想告诉大家,对于肺炎克雷伯菌这种阴性杆菌引起的血流感染,毒力与耐药都是值得我们以后加以关注的方向。
铜绿假单胞菌入血意味住院时间延长,死亡率增加……铜绿假单胞菌入血对住院患者死亡率的影响,我院一项多中心研究结果说明什么
铜绿假单胞菌血流感染与前述大肠埃希菌与肺炎克雷伯菌有个明显不一样的地方,它来源于肠道的几率并不是很多。它的来源多为环境,少见人体定植(当然呼吸道有可能定植)。社区血流感染少见,来源不明,继发性血流感染多见于肺炎。但值得注意的是,如果是继发性血流感染,尤其是院内感染,常常与肺部感染有关。
铜绿假单胞菌的主要问题就是严重耐药。经常会遇到移植或ICU的患者(肺移植、肾移植多见),非常担心的就是肺炎克雷伯菌和铜绿假单胞菌的感染。这种感染常常是高耐药的,抗生素治疗手段有限。其耐药机制在很多场合介绍过,比如它有MexAB-OprM的机制,以及产MPC酶,以及有blaKPC丝氨酸酶和blaNDM、blaVIM的金属酶产生,因此一旦铜绿假单胞菌入血,就意味着住院时间延长,死亡率大增。
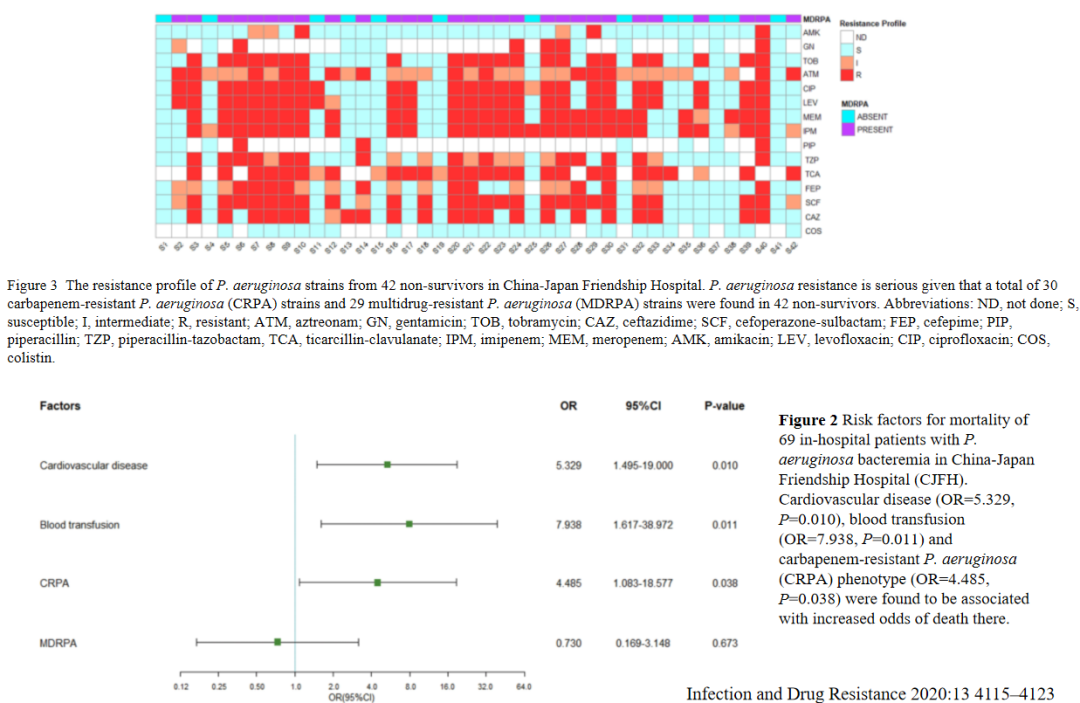
因此,对于铜绿假单胞菌入血对住院患者死亡率的影响,组织了一项多中心的研究,结果发现,患者铜绿假单胞菌血流感染死亡率较高,这有可能与很多重症患者较多有关,还与多重耐药有关。
鲍曼不动杆菌入血的情况并不多见,血流感染多见于医院感染,少见于社区感染。怀疑社区感染的健康人群,血培养检出耐药的鲍曼不动杆菌,有必要排除一下污染。当然,住院的患者,鲍曼不动杆菌血流感染主要与肺部感染有关,与环境有关,与尿路感染或医疗器械侵入性使用有关。
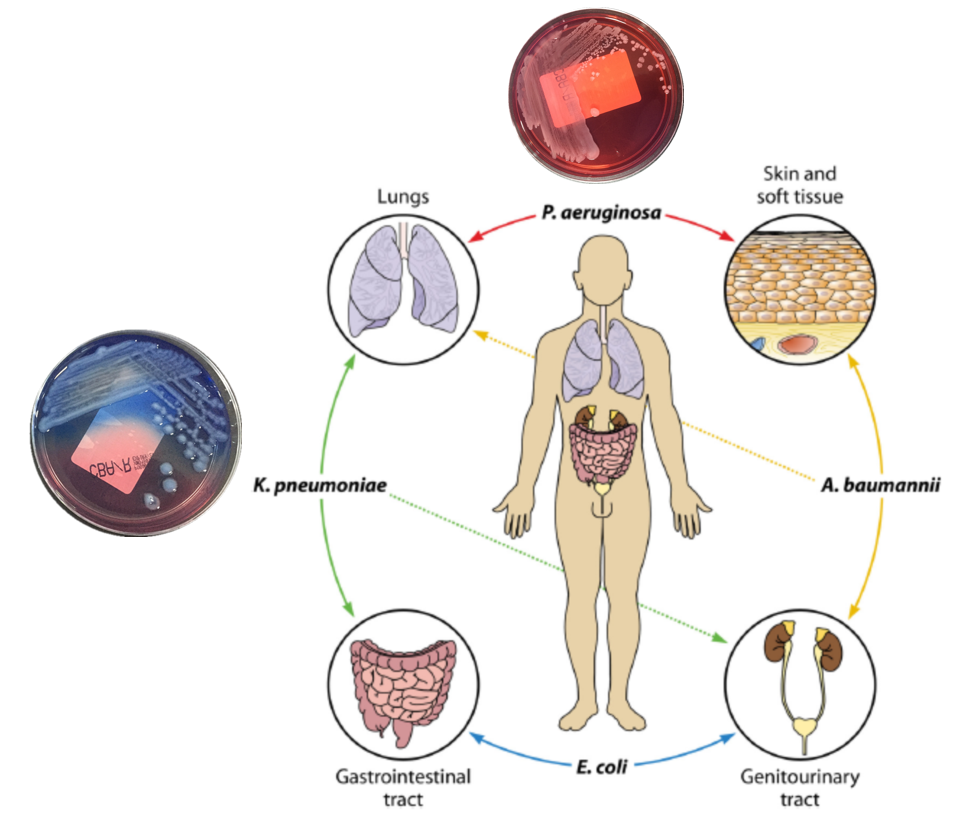
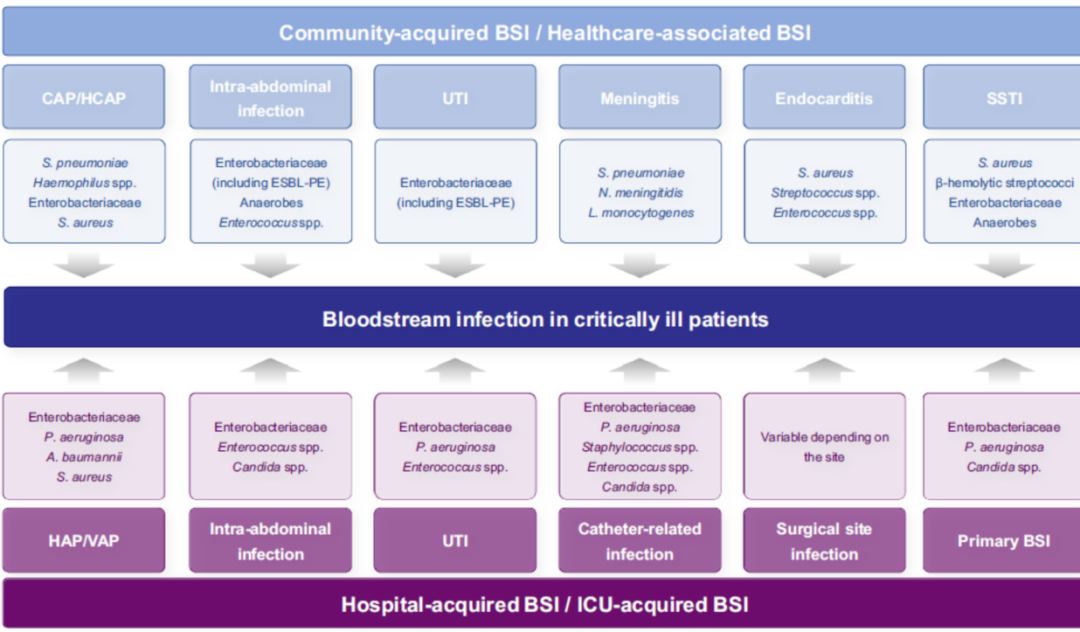
归纳一下,铜绿假单胞菌主要与肺部感染有关,与皮肤软组织有关,主要包括静脉插管、侵袭性操作、医疗器械的使用;鲍曼不动杆菌则不同,它可能与尿路感染、、侵袭性的医疗器械的操作、肺部感染有关;大肠埃希菌则很少与肺部感染有关,所以肺部呼吸道检出的大肠埃希菌很少会引起血流感染。请注意解读这张示意图。
未来分子生物学在血流感染方面的应用如何?短板在哪?我们应当思考什么?
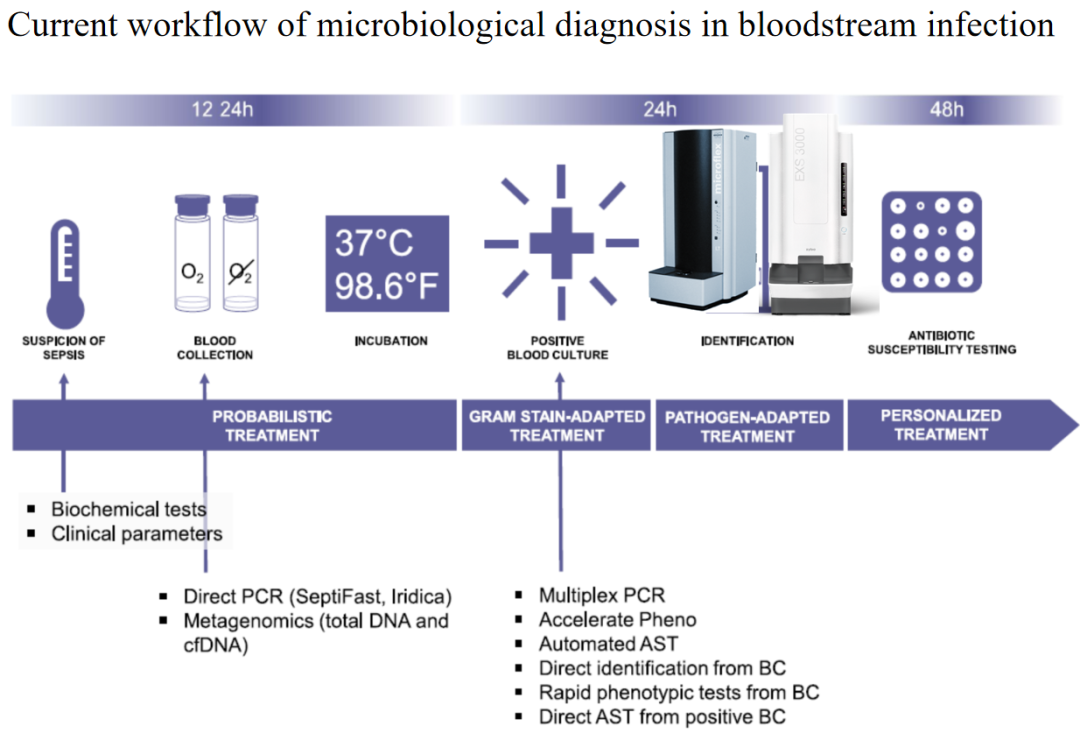
常规的流程大家应该都比较熟悉,实验室设备的改进,如质谱的应用,给血流感染快速诊断提供了非常有价值的帮助。

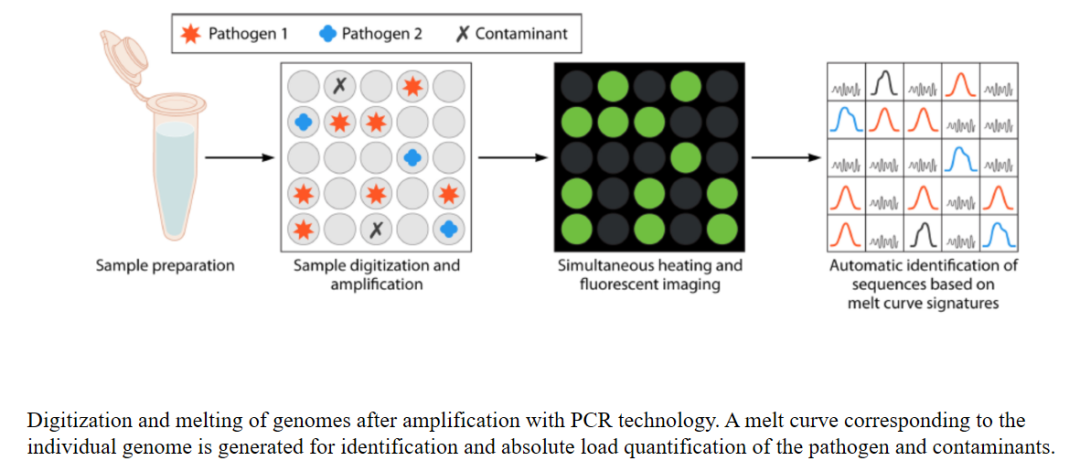
还有一些很好的设备,比如分子生物学。未来,分子生物学将会在这方面有很广泛的应用。比如像FilmArray等这样的产品,在培养阳性的样本里可以快速地检出细菌。还可以用同时检测不同靶点的方法,能检出不同的病原,可以用来做快速检查。
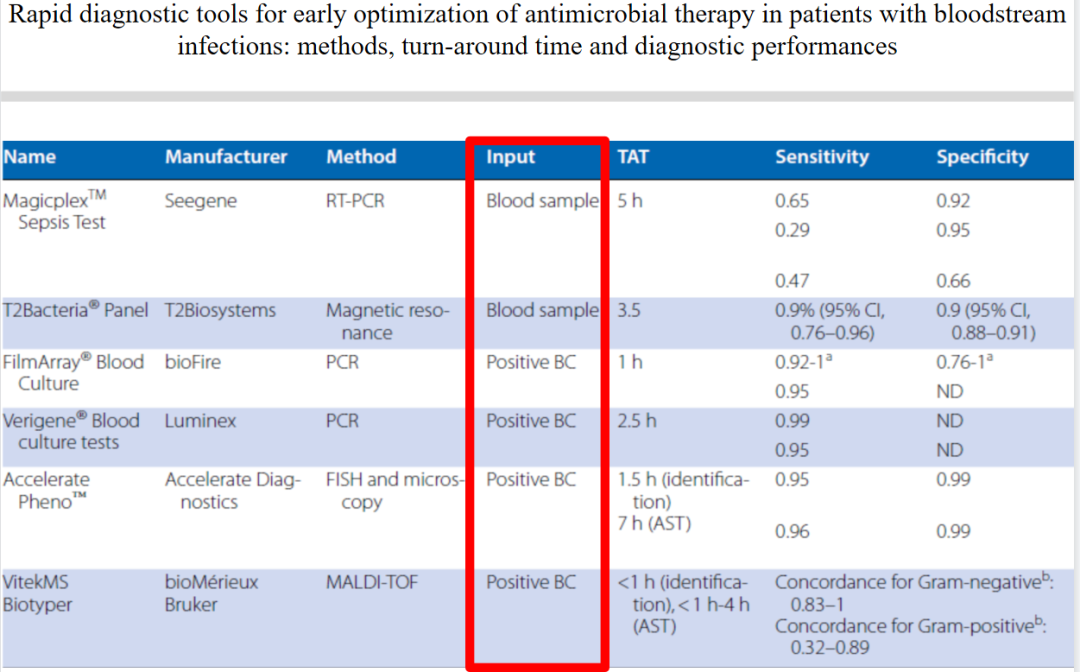
但是,回过头来我们也应当看到,即使现在分子生物学开展得十分红火,也很难、很少直接通过血液样本去检测病原,大家都还是通过阳性培养瓶出来以后快速地完成鉴定。为什么很少通过血液样本拿到特别好、特别准确的结果?我想主要原因依然是我们的灵敏度不够。灵敏度不够的原因在于血流感染的菌量太少。
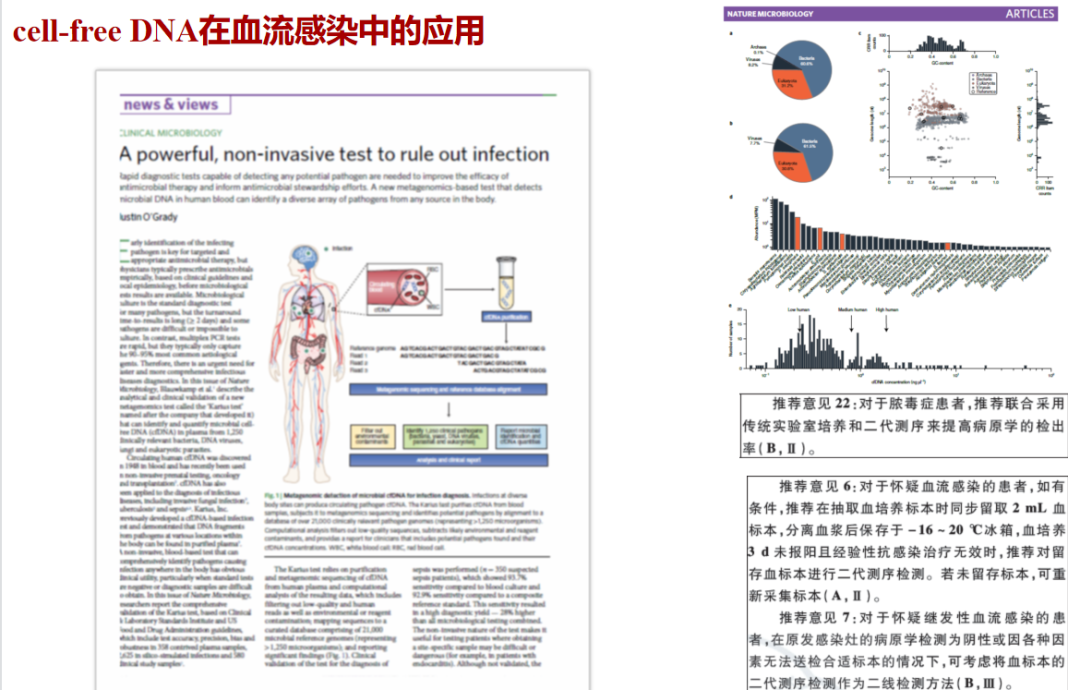
最近几年宏基因组测序(mNGS)应用较多,给很多血流感染的患者带来曙光。但是对血样本mNGS的解读是非常困难的事情,因为宏基因组测序里面的游离核苷酸(游离DNA,cell-free DNA)的来源非常广泛,包括 ① 侵入血液的病原所引起的感染;②其他部位感染的病原释放入血的DNA片段(如肺部感染可释放曲霉的DNA入血而被检出);③ 呼吸道、口咽部、肠道定植细菌释放入血的DNA片段。因此,对血浆样本cfDNA进行mNGS检测时,建议从临床的角度鉴别检出序列属于致病微生物、样本污染、死亡微生物裂解,还是定植菌群所致的一过性菌血症。不能简单将疑为血流感染患者的mNGS结果与血培养结果同等看待。
专家介绍

鲁炳怀
中日医院,呼吸与危重症医学科临床微生物与感染实验室。主任医师,医学博士,北大医学部教授与硕士研究生导师。社会兼职:中华医学会检验分会微生物学组委员,中国医促会临床微生物与感染分会常委。研究方向:临床微生物与感染病原学诊断,耐药机制。主持多项国家级与省部级科研项目。发表SCI收录专业文章近30篇。
本文由《呼吸界》编辑 冬雪凝 整理自「帅府园论坛」,感谢鲁炳怀教授的审阅修改!


