侵袭性真菌病是肺移植术后患者出现肺部浸润性病变的主要原因,对于如何防控肺移植术后侵袭性真菌病、如何界定普遍预防和抢先治疗的时机、如何确定肺移植支气管灌洗液GM试验的cut-off值以及耐药真菌的防控策略等问题仍需深入探讨。
实体脏器移植感染的时间轴
当我们谈到真菌感染就无法绕开免疫抑制患者,而肺移植患者是最经典的免疫抑制患者。所有的实体脏器移植(包括心、肝、肺、肾)在不同时期都有不同的感染源。在围手术期(移植后1个月内),大部分患者仍在医院内,以院内获得性感染为主,病原菌通常为各种细菌,其中以耐药革兰氏阴性杆菌感染最突出。移植术后1个月至1年,这一时期机体的免疫抑制较强,无论是肺移植还是其他实体脏器移植患者,都更容易出现各种机会性感染,而真菌感染就处于这一阶段,其发病率最高,致病菌包括曲霉、毛霉、新生隐球菌及肺孢子菌等。肺移植术后1年以上,机体免疫抑制强度逐渐下降,此时可能出现社区获得性感染,成为肺移植术后突出问题之一。无论如何,肺移植患者需要终身服用免疫抑制剂,所以这些患者是终身免疫抑制患者,也是感染的易发人群。
肺移植术后真菌感染特点
肺移植术后真菌感染有其自身特点。首先,因为存在免疫抑制,所以细胞和体液免疫均存在异常,临床症状和影像学不典型,与非免疫抑制宿主的影像学存在差异。其次,因为所有实体脏器移植患者都要服用各种排异药,尤其是CNI类免疫抑制剂,其与常见的抗真菌药尤其是经典的三唑类抗真菌药存在相互作用,所以在这一阶段,治疗药物监测(TDM)至关重要。此外,肺移植术后还存在耐药真菌和罕见真菌感染问题。
肺移植术后真菌感染的流行病学
不同中心报道的真菌感染发病率波动在8.1%~16%,3个月内的死亡率总体较高。肺移植术后真菌感染可能通过一定的免疫机制损伤移植的供肺,进而导致肺移植物功能障碍,真菌感染与慢性肺移植物功能障碍的风险增加有关,这是需要我们关注的问题。
移植后的不同时期,真菌感染类型也不同。例如,肺移植术后1个月内,各种酵母菌属感染较为突出,主要为深部无菌体液的感染,如胸腔酵母菌感染或血液酵母菌感染。侵袭性念珠菌病通常发生在肺移植术后的第1个月。曲霉感染高发于肺移植术后1个月至1年,是引起肺移植术后侵袭性真菌病(IFD)的最常见真菌。侵袭性曲霉病通常发生在移植术后3.2个月(中位时间),发病率为3%~15%。肺移植患者多为终末期肺病,包括常见的肺纤维化和慢阻肺患者,这些患者术前曾使用大量免疫抑制剂及反复抗感染治疗,所以是真菌感染的高危人群,手术前后曲霉定植率相对较高。国外一项大型临床研究在12.5%(65/519)和18.3%(95/519)的肺移植患者中观察到移植前和移植后曲霉菌属的定植,54例肺移植患者出现与曲霉病相关的临床综合征,1年累计发生率为10.6%。
相关概念
定植(colonization):呼吸道分泌物(痰或BALF)通过培养、PCR或生物标志物(GM试验或隐球菌抗原)检测到真菌,但无症状、影像学和内镜下表现。加拿大多伦多学者的一项综合文献分析结果显示,大部分研究的真菌定植率为30%~40%。
普遍预防(universal anti-fungal prophylaxis):移植术后在分离出任何真菌病原之前对所有受者给予抗真菌药物。
靶向预防(targeted anti-fungal prophylaxis):移植术后在分离出任何真菌病原或血清真菌标志物阳性之前对有IFD风险的高危受者给予抗真菌药物。
抢先治疗(preemptive anti-fungal therapy):移植术后在分离出真菌病原或血清真菌标志物阳性之后,同时缺乏IFD证据时给予抗真菌药物。
单肺移植、早期气道缺血、CMV感染、出现急性排斥反应需要上调免疫抑制剂用量、需要免疫诱导治疗、肺移植前后曲霉定植、CF患者术中曲霉培养阳性、获得性低免疫球蛋白血症等,都属于肺移植术后曲霉感染高危受者。部分文献或中心会建议对这些高危受者进行普遍预防。加拿大多伦多是现今全球最大的移植中心,他们对抢先治疗开展了相关研究,以BALF培养或GM试验阳性为导向的抢先治疗显著降低了侵袭性曲霉病的风险;与普遍预防相比,可将抗真菌暴露量减少50%,且不会影响患者1年的死亡率。
侵袭性真菌病(IFD)
呼吸道分泌物(痰或BALF)通过培养、PCR或生物标志物(GM试验或隐球菌抗原)检测到真菌,同时有症状、影像学和内镜下表现或组织病理学提示真菌侵袭的证据。
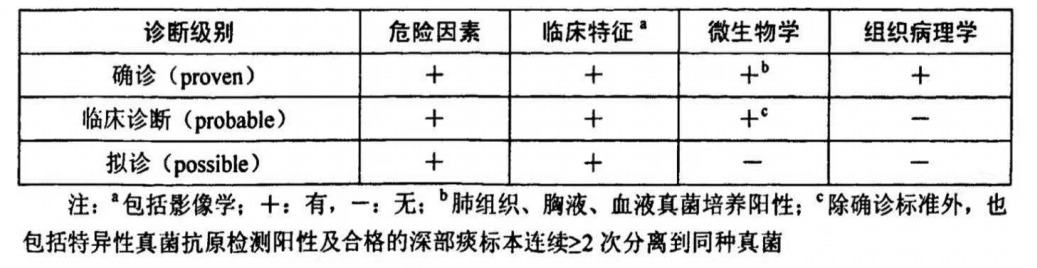
在诊断方面依旧沿用经典的IFD诊断标准,但对于肺移植术后会有相应特点。首先,肺移植术后患者的气管-支气管曲霉病(TBA)发生率显著高于侵袭性肺曲霉病(IPA)。血清GM敏感性不高,所以一般不将该方法作为诊断参考。相比之下,BALF GM的诊断意义更大。但对BALF GM的临界值仍存在争议。国际上将cut off值定为1.0,但受灌洗液的量及有无出血等因素影响,结果存在差异,可能出现假阳性结果。对于肺移植患者,不建议常规使用PCR进行真菌感染的诊断和监测,可与其他诊断方式联合用于诊断IA,但均无确切证据。
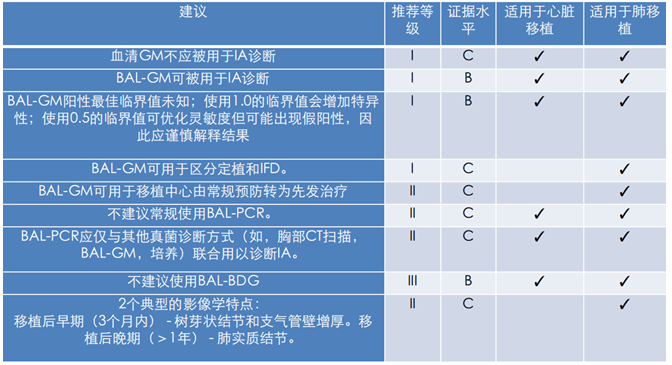
注:国际心肺移植协会(International Society for Heart and Lung Transplantation,ISHLT)关于IFD的诊断建议
ISHLT关于IFD治疗建议:①移植中心采取普遍预防/抢先治疗与流行病学、移植术后时间、真菌诊断措施和TDM有关;②移植术后2~4周内预防酵母菌属感染;③移植术后2~4周后实施具有抗霉菌活性的普遍预防或抢先治疗;④普遍预防4~6个月;⑤抢先治疗3~4个月;⑥伏立康唑使用不长于6~9个月。
肺移植术后侵袭性真菌病(IFD)
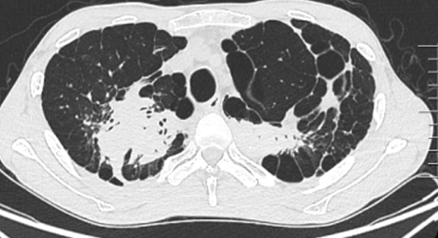
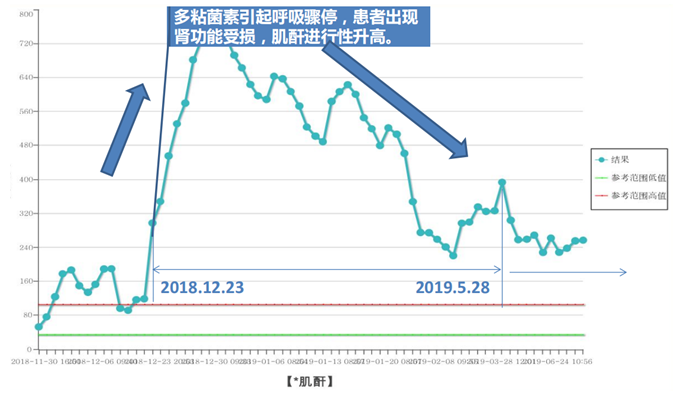
病例1
一般情况:患者,男性,30岁,终末期尘肺。
现病史:2018年11月30日,于我院在气管插管全麻下行双肺移植术,术后第4天返回普通病房。2018年12月5日,查BALF结核分枝杆菌X-pert阳性,BALF抗酸杆菌涂片阳性,予左氧氟沙星、异烟肼、乙胺丁醇、吡嗪酰胺四联抗结核。2018年12月15日,患者出现发热,体温最高38.5℃,反复CRAB培养阳性(BALF),多黏菌素B+替加环素或舒巴坦抗感染治疗,患者热退、白细胞恢复正常,考虑治疗有效,但患者出现头面部麻木症状。2018年12月23日,出现呼吸、心跳骤停,考虑多黏菌素B引起呼吸骤停。因患者感染重,停用霉酚酸酯类抗排异药,予他克莫司及甲泼尼龙抗排异治疗。
患者存在多黏菌素B引起的肌酐升高。移植后半年,间断调整免疫剂抑制剂。半年复查时,肾功能持续减退,eGFR基本上维持在25 ml/(min·1.73m2)左右。2019年5月28日,有咳嗽、咳痰症状,胸部CT可见双肺尤其右肺分布为主的树芽征。2019年6月12日,出现痰中带血丝。2019年6月13日,支气管镜检查可见吻合口良好,支气管黏膜出现霉斑、白膜。2019年6月17日,黏膜活检大量炎性坏死物中可见曲霉菌。
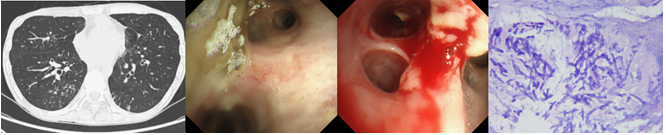
确诊:TBA。临床诊断为IPA。
根据ISHLT对肺移植术后曲霉感染的推荐策略,虽然不常规推荐联合应用,但考虑患者同时合并了TBA和IPA,感染较重,遂采取了伏立康唑和米卡芬净的联合治疗策略,疗程为2个月。
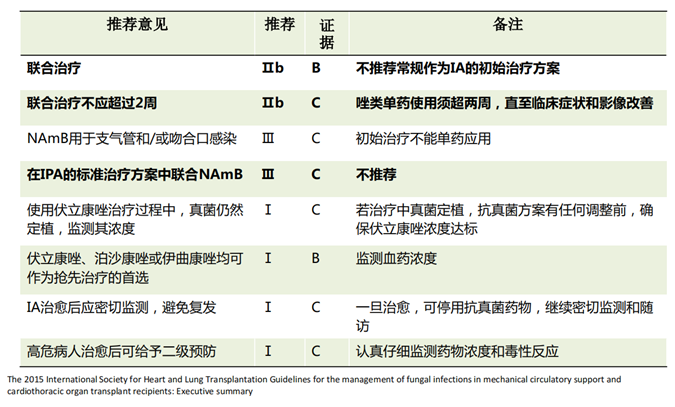
治疗期间对伏立康唑进行了治疗药物监测(TDM),尽量使其浓度保持在需求范围内。
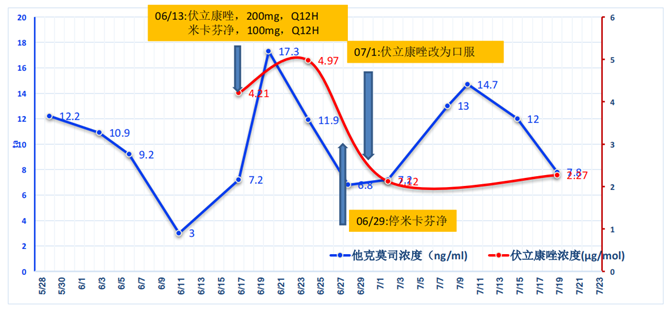
此时面临着一个非常重要的问题,即免疫抑制剂的调整。因为患者肾功能不全,所以我们将他克莫司改为西罗莫司。在有TDM监测条件的中心,可以很好地进行西罗莫司和伏立康唑的监测,也可以考虑两药联用。经过我们的努力,患者肾功能有所恢复,肌酐清除率有所上升。考虑长期治疗的问题,结合患者当时的情况,我们又将抗排异药物由西罗莫司调整为他克莫司,同时继续给予伏立康唑治疗IPA。
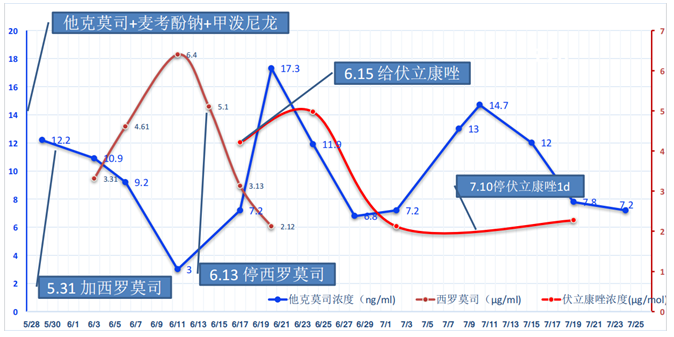
经过上述治疗后,支气管镜下可见霉斑和出血坏死明显好转,时长将近1个月,总疗程约3个月。该患者目前是术后3年,随访生活质量较好。
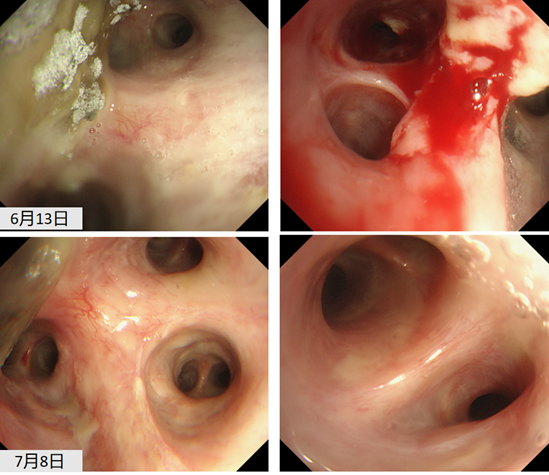
侵袭性帚霉感染
病例2
一般情况:患者,女性,40岁,氧化铝厂工人,BMI 21.5 kg/m2。15年前开始有「铝粉」接触史,无规范防护措施,5年前停止接触。
主诉:活动后气短5年,加重1年,双下肢水肿4个月。
术前病史:5年前无明显诱因出现气短,活动后明显,于当地诊断为「尘肺」。此后气短症状进行性加重,初仅爬2~3楼后出现,逐渐表现为平路稍快走即可出现气短。1年来平均每2个月住院1次,每次给予醋酸泼尼松口服(35 mg/d,每2周减量10 mg,服药约1个月后停药)。利尿、西地那非降肺动脉压,家庭氧疗。4个月来气短症状进一步加重,需持续氧疗,双下肢水肿,伴少尿、纳差、反酸、烧心、腹胀等症状。
胸部CT:双侧胸膜弥漫性磨玻璃影,支气管扩张,肺动脉极度增宽。患者是因长期尘肺导致重度肺动脉高压和心功能不全。
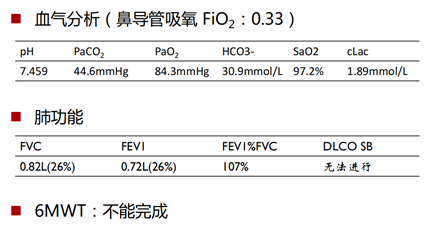
术前肺功能评价:患者术前肺功能提示限制性通气功能障碍、重度弥散功能障碍。
术前心功能评价:心电图示右室肥大,BNP升高(931.8 pg/ml);心脏超声示右室壁运动减低,呈D字征。右心导管提示肺动脉平均压已达43 mmHg,提示肺心病非常严重。
手术评估:
- 手术指征:诊断「尘肺(氧化铝)」明确,病变类型不可逆,合并呼吸衰竭、肺动脉高压、右心衰竭,符合肺移植指征,完善心肺、肿瘤、感染、免疫等方面评估无禁忌证,于2010年12月24日在VV-ECMO辅助下行双肺移植术。
- 术前情况:鼻导管吸氧4~5 L/min,SpO2 90%~95%;针对原发病,给予甲泼尼龙15 mg qd;针对心功能不全,给予西地那非20 mg tid、托拉塞米10 mg qd、螺内酯20 mg qd、地高辛0.125 mg qd、那曲肝素0.4 ml。
手术情况:
- 手术时间:7小时50分钟。
- 循环:出血1500 ml,尿量2200 ml,入量8500 ml。
- 术中循环障碍:血压最低70/45 mmHg,去甲肾上腺素[0.5~1.0 μg/(kg·min)]、肾上腺素[0.05~0.10 μg/(kg·min)]、米力农泵入。
- 移植肺冷缺血时间:R 295 min,L 500 min。
- 免疫诱导:巴利昔单抗20 mg+甲泼尼龙750 mg。
- 术中预防用抗生素:头孢哌酮舒巴坦。
术后情况:
(1)原发性移植物功能不全(PGD)1~2级,心功能不佳,利尿脱水困难,CRRT脱水治疗。术后第3天撤除VV-ECMO,第4天拔除气管插管,序贯NIPPV。由于患者术前合并重度肺动脉高压和左心功能障碍,故术后最突出的问题是心源性休克,我们采取了多种治疗手段,最终使其逐渐恢复。术后1.5个月,患者出院。首次出院时,基本可以恢复正常生活,常规抗排异和预防感染,肺功能有所恢复,此时主要症状是胃肠道反应,并无太多呼吸道症状。出院前复查胸部CT可见肺野比较清晰。
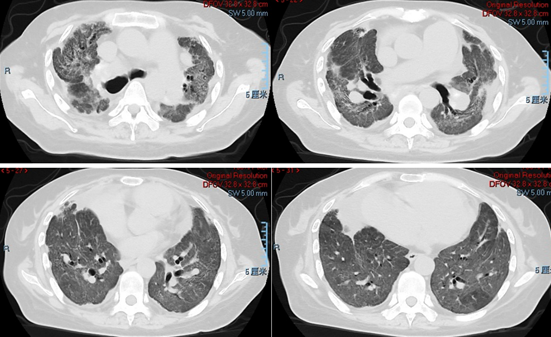
(2)术后3个月再次复查,右上肺新发结节,双肺较多弥漫磨玻璃影。
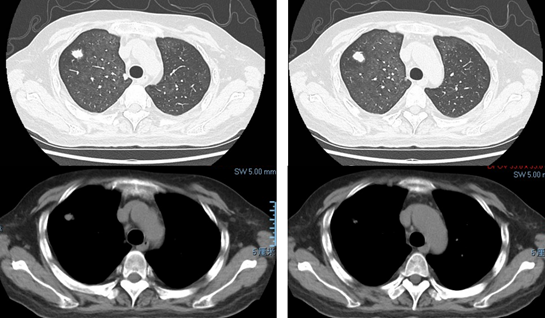
无发热、咳嗽、咳痰、咯血、胸痛、呼吸困难等症状;双肺未闻及干/湿啰音,下肢轻度水肿,心腹无其他异常。感染指标正常。细胞免疫和体液免疫功能低下,同时合并心肾功能不全。对于常规心肾功能不全,采取利尿和肾脏保护治疗。
(3)支气管镜下可见轻度充血,无明显脓性分泌物。
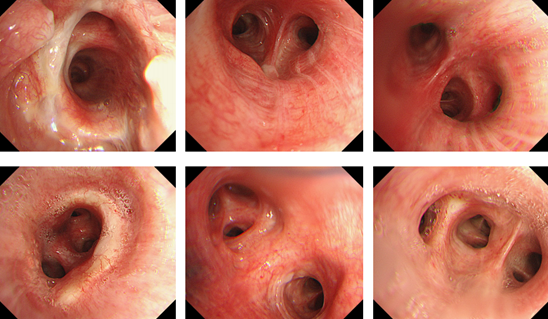
(4)BALF病原学:细菌培养鲍曼不动杆菌;真菌涂片可见丝状真菌;未培养出真菌;BALF GM 0.6;病毒、抗酸涂片Gene-Xpert、T-SPOT、结核抗体、PPD试验、隐球菌抗原均阴性,给予左氧氟沙星治疗2周。
(5)影像学:病变进展,结节仍在生长,同时在右上肺后段又出现新发结节。
(6)行CT引导下穿刺同时送病理,病原可见丝状真菌,考虑帚霉可能。病理提示两端肺泡结构消失,增生的纤维组织内可见大量中性粒细胞浸润,脓肿形成,小血管增生,组织细胞聚集,可见灶状坏死,特殊染色PAS、银染可见阳性真菌。
治疗情况:根据实体器官移植感染治疗策略,评估患者处于免疫高风险还是免疫低风险阶段。该患者目前属于免疫低风险,但感染问题较为突出(确诊帚霉肺炎),遂停用霉酚酸酯类药物,同时加用丙种球蛋白,加强免疫功能调节;针对帚霉肺炎,采取三联治疗,米卡芬净150 mg qd,2周;泊沙康唑200 mg q6h+特比萘芬250 mg qd,3个月。
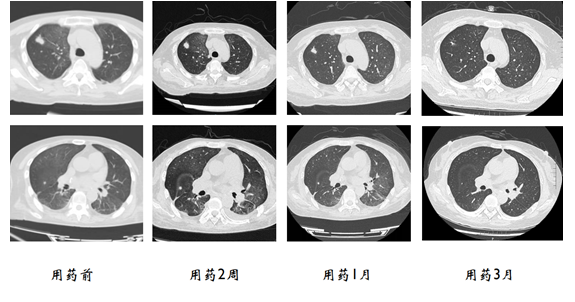
随访:用药2周后,病变缩小,但不明显;用药1个月后,病灶明显缩小;用药3个月后,上肺后段结节消失,上肺间段的结节明显缩小。治疗效果较好。
帚霉感染以呼吸困难为主要临床表现,其危险因素可能与既往真菌感染和系统抗真菌治疗有关。
总结
肺移植术后真菌感染仍有很多问题亟待解决,包括如何防控IFD、如何选择和界定普遍预防/抢先治疗方案、哪类患者适合普遍预防/抢先治疗、肺移植BALF GM的cut off值以及耐药真菌防控策略等,这些问题仍需要我们深入探讨。
作者简介

陈文慧
副主任医师,中日友好医院肺移植科副主任;2006年毕业于首都医科大学,2016年在美国杜克大学习肺移植;国家卫健委肺移植专业质控中心副主任、中华医学会器官移植分会肺移植学组副组长、中国康复医学会呼吸康复专业委员会委员、围手术期学组副组长、中国医师协会呼吸医师分会肺癌工作委员会委员、中华医学会呼吸危重症学组委员、THORAX中文版副主编。
本文由重症肺言根据「重症肺言之ICU内侵袭性支气管肺曲霉菌病论坛」整理,感谢陈文慧教授审阅修改!
本文转载自订阅号「重症肺言」


