近日,中日友好医院曹彬教授联合牛津大学Peter Horby教授在Science Bulletin发表了题为「COVID-19 can be called a treatable disease only after we have antivirals」的述评,对COVID-19小分子抗病毒药物的发展进行了总结与展望。该述评的中文版本介绍如下。
文章原文
https://www.sciencedirect.com/science/article/abs/pii/S2095927322000718
How to cite: Xueyang Zhang, Peter Horby, Bin Cao. COVID-19 can be called a treatable disease only after we have antivirals. Science Bulletin. 2022. https://doi.org/10.1016/j.scib.2022.02.011.

自COVID-19疫情暴发以来,人们就一直期待着将其变成可防可治的疾病。虽然疫苗的研发成功地降低了COVID-19的发病率、重症率、死亡率,但是疫苗在免疫抑制人群(也正是重症COVID-19高危人群之一)中的保护力有限 [1] ,且其效力不断受到新变异株的挑战 [2] ,另外,部分地区、国家能获取的疫苗资源十分有限。因此,在提高疫苗接种率的同时,寻找有效的治疗手段是必须的。其中,糖皮质激素等抗炎药物在COVID-19住院患者中的疗效得到了广泛验证 [3] ,而抗病毒药物的研发直到近几个月才取得了突破性的进展。
理论上讲,抗病毒药物在SARS-CoV-2感染的多个阶段均具有潜在的临床应用价值,包括:暴露前预防,暴露后预防,COVID-19早期治疗以及晚期治疗等。近期发表的数个临床试验显示了早期应用小分子抗病毒药物在门诊高危COVID-19患者中的疗效与安全性 [4-6]。在此之前,已有多个单克隆中和抗体被获批用于COVID-19治疗,其中包括中国主导研发的BRII-196/BRII-198。然而,中和抗体只能静脉给药,成本通常较高,并且变异株可对其耐药 [7],这些劣势限制了中和抗体的临床应用。与之相比,小分子抗病毒药物更容易大规模生产,对运输及储存条件的要求较低,并且可以研发口服剂型,这些特点使得小分子抗病毒药物具有更高的可及性。
自疫情伊始,人们就试图寻找能够有效治疗COVID-19的小分子抗病毒药物,但直到近几个月才取得了突破性的进展。在小分子抗病毒药物的研发中,有三个关键问题不容忽视:(1)药物的效能及靶器官浓度;(2)合适的应用人群;(3)耐药性。
疫情暴发之初,人们迫切地需要能够有效治疗COVID-19的药物,因此很多理论上对SARS-CoV-2有效的抗病毒药物进入了临床试验,洛匹那韦/利托那韦(lopinavir-ritonavir)——一种用于治疗人类免疫缺陷病毒-1(HIV-1)感染的药物——便是其中之一。先前的体内、体外研究证明了洛匹那韦/利托那韦对包括SARS-CoV及MERS-CoV在内的多种冠状病毒具有活性,因此,人们期待洛匹那韦/利托那韦也能够有效地作用于SARS-CoV-2。然而,临床试验显示洛匹那韦/利托那韦并不能使住院COVID-19患者获益 [8, 9]。随后,体外研究发现,在Vero E6细胞中,洛匹那韦抑制SARS-CoV-2的半数有效浓度(EC50)为26.1 μmol/L,远高于洛匹那韦/利托那韦常规临床用药剂量所达到的血药浓度(9.4 μmol/L,IQR 7.2~12.1μmol/L) [10]。洛匹那韦/利托那韦在COVID-19治疗中的失败凸显了药物效能及药效动力学参数的重要性。
瑞德西韦在COVID-19患者中的临床试验最早于2020年2月启动,但直到2021年12月才有阳性结果发表。瑞德西韦临床研究的成败表明了合适的用药人群的重要性。瑞德西韦最初是为应对埃博拉(Ebola)疫情研发的,它是一种静脉使用的核苷酸类似物前药,作用于RNA依赖的RNA聚合酶(RdRp)以抑制病毒的复制。研究表明瑞德西韦具有广谱抗病毒活性,包括冠状病毒 [11]。此次疫情暴发后,瑞德西韦的临床研究主要聚焦于住院COVID-19患者。截止到2022年2月3日,已经有6项在住院患者中进行的随机对照试验(RCT)发表了研究结果,均表明瑞德西韦无法降低住院COVID-19患者的死亡率(https://covid19evidence.net.au/)。与之相反,直到2021年12月,才有了瑞德西韦在非住院COVID-19患者中的数据。PINETREE是一项3期RCT,共招募了562名门诊COVID-19高危患者,这项RCT的结果显示,在症状出现后7天内应用瑞德西韦,可以显著降低受试患者的28天住院率(0.7%(2/279)vs. 5.3%(15/283); 降低87%;P = 0.008) [4]。病毒复制在COVID-19病程早期达峰,所以抗病毒药物的潜在疗效可能会随着病程的进展而衰减,部分解释了瑞德西韦在住院及门诊患者中疗效的差异。
上述研究证明了瑞德西韦在门诊COVID-19患者中的应用价值,但是瑞德西韦只能静脉给药,降低了门诊患者用药的便捷性。不过,令人鼓舞的是,近期有两个口服小分子抗病毒药物(即莫努匹韦(molnupiravir)和paxlovid)发表了临床试验的结果。默沙东(Merck Sharp and Dohme)研发的莫努匹韦是作用于SARS-CoV-2 RdRp的核苷酸类似物,而辉瑞(Pfizer)研发的paxlovid作用于主蛋白酶(Mpro,即3CLpro或nsp5蛋白酶)。Paxlovid是由奈玛特韦(nirmatrelvir)和利托那韦构成的复合制剂,其中,奈玛特韦通过结合主蛋白酶以干扰蛋白质前体的加工,从而抑制病毒复制。奈玛特韦通过CYP3A代谢,而利托那韦则是一种CYP3A抑制剂,可以更好地维持奈玛特韦的血药浓度。莫努匹韦的3期RCT(MOVe-OUT) [5]以及paxlovid的2/3期RCT(EPIC-HR) [6]均纳入了症状出现不超过5天的、未接种疫苗的、门诊高危成年COVID-19患者。MOVe-OUT试验中,与对照组相比,莫努匹韦组29天的住院率显著降低(6.8%(48/709,包括1例死亡患者)vs. 9.7%(68/699,包括9例死亡患者);差值 -3.0%;95% CI -5.9%~-0.1%)。类似的,EPIC-HR试验中,paxlovid显著降低了患者的28天住院率(0.8%(8/1039,无死亡患者)vs. 6.3%(66/1046,包括12例死亡患者);差值 -5.6%;95% CI -7.2% ~-4.0%;P < 0.001)。根据上述两项RCT的结果,2021年12月,美国食品药品监督管理局(FDA)给莫努匹韦(https://www.fda.gov/media/155054/ download)和paxlovid(https://www.fda.gov/media/155050/download)发布了紧急使用授权(EUA),批准用于门诊高危成年患者。2022年2月12日,中国国家药监局批准了paxlovid在中国的紧急使用(https://www.nmpa.gov.cn/yaopin/ypjgdt/20220212085753142.html)。
虽然我们期待着小分子抗病毒药物会便宜于中和抗体等药物,但是,整体来说,已上市的抗病毒药物价格较高。好消息是,默沙东(https://www.merck.com/news/merck-and-ridgeback-announce-supply-agreement-with-unicef-for-molnupiravir-an-investigational-oral-antiviral-covid-19-medicine/)以及辉瑞(https://www.pfizer.com/news/press-release/press-release-detail/pfizer-provide-us-government-additional-10-million)均做出声明:将根据各国经济发展水平对莫努匹韦或paxlovid进行定价,即行使分层定价策略,从而促进全球对这两种药物的平等获取。另一个关于莫努匹韦的担忧是它对于人体细胞的潜在致突变性。截至目前,动物实验并未证实莫努匹韦具有致突变性(https://www.fda.gov/media/155054/download)。我们需要对使用过莫努匹韦的人群进行持续监测以判断它的长期影响,同时,莫努匹韦在生殖细胞中的致突变能力是一个需要重点探索的问题。
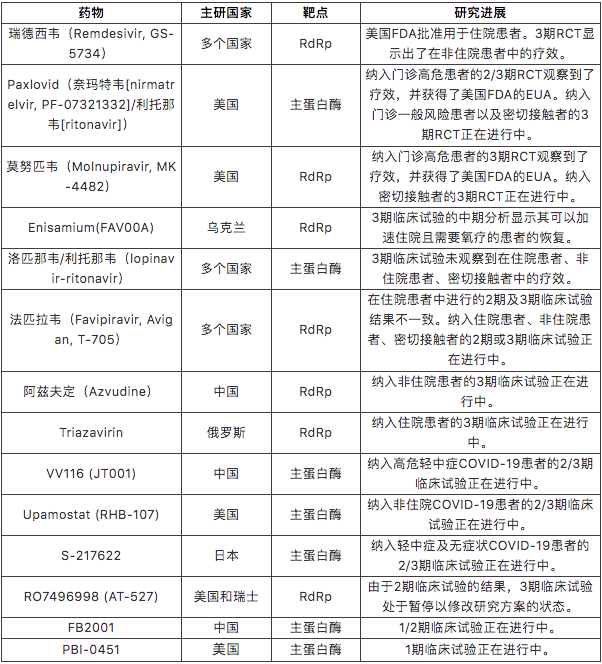
对COVID-19小分子抗病毒药物的探索从疫情初期就拉开序幕,但是鉴于小分子药物研发周期长的内在特点,现在已进入临床试验阶段的小分子抗病毒药物十分有限。我们在COVID-NMA数据库中检索了相关的RCT信息,整理后的检索结果见表1。其中,中国主导了其中三个药物的研发(即VV116,FB2001和阿兹夫定)。大部分进入临床试验的小分子抗病毒药物是已经上市的药物或者是在COVID-19大流行出现前即开始研发的药物,我们仅检索到了5个针对SARS-CoV-2研发的新药物,即paxlovid、VV116、S-217622、FB2001和PBI-0451。尽管数量有限,我们相信这些药物仅仅是冰山一角,在其背后的是诸多正处于临床前研究阶段的药物。除了数量外,这些药物的种类也十分有限:它们或是作用于RdRp,或是作用于主蛋白酶。随着对SARS-CoV-2基因组、结构、生命周期等的认识不断加深,我们期待着作用于其它靶点的药物进入临床。除了上文集中讨论的靶向于病毒的抗病毒药物之外,宿主靶向抗病毒药物的快速发展也将为我们提供更多的治疗选择 [13]。
瑞德西韦、莫努匹韦、paxlovid的临床试验证实了早期使用小分子抗病毒药物在门诊高危患者中的疗效,但对它们临床应用价值的探索不应止步于此。流感相关临床试验表明,预防性地使用奥司他韦(oseltamivir)或扎那米韦(zanamivir)可以降低症状性流感的发病率 [14]。这提示着我们,在暴露前或暴露后预防性地应用小分子抗病毒药物也许可以降低症状性COVID-19的发病率。我们检索到了数个正在进行中的纳入了COVID-19密切接触者的临床试验,其中包括探索莫努匹韦(ClinicalTrials.gov编号NCT04939428)或paxlovid(ClinicalTrials.gov编号NCT05047601)能否预防症状性COVID-19的两项RCT。
病毒复制在COVID-19病程早期达峰,所以抗病毒药物的潜在疗效可能会随着病程的进展而衰减。然而,即使在COVID-19病程的晚期,依旧能够检测出病毒复制,且病毒复制的存在与不良预后相关,而近期发表的一项RCT也显示出了中和抗体在住院患者中的疗效 [15]。这提示着后续研究可以进一步探索小分子抗病毒药物在住院患者中的疗效与最佳用药策略。随着抗病毒药物的广泛应用,耐药性的产生将成为一个难以避免的问题,联合应用靶点不同的药物可能是一个解决方案。
即使我们可能无法完全将COVID-19从世界上抹去,小分子抗病毒药物的蓬勃发展给我们带来了将COVID-19变为可治疾病的希望。也许在不远的将来,确诊为COVID-19将不再是一件可怕的事情,我们的日常生活也可以恢复成疫情前的样子。最后,对COVID-19小分子抗病毒药物研发的投入将不仅使我们能够更好地赢得与SARS-CoV-2的战役,它还可以使我们更好地为未来许多偶然出现的新发传染病做好准备,就像瑞德西韦和莫努匹韦之于今天的我们。
该文章得到了国家自然科学基金及中国医学科学院医学创新基金的资助。
表1:进入临床试验的COVID-19小分子抗病毒药物
参考文献
[1]Boyarsky BJ, Werbel WA, Avery RK, et al. Immunogenicity of a single dose of SARS-CoV-2 messenger RNA vaccine in solid organ transplant recipients. JAMA, 2021, 325: 1784-1786
[2]Lopez Bernal J, Andrews N, Gower C, et al. Effectiveness of COVID-19 vaccines against the B.1.617.2 (Delta) variant. N Engl J Med, 2021, 385: 585-594
[3] Sterne JAC, Murthy S, Diaz JV, et al. Association between administration of systemic corticosteroids and mortality among critically ill patients with COVID-19: a meta-analysis. JAMA, 2020, 324: 1330-1341
[4]Gottlieb RL, Vaca CE, Paredes R, et al. Early remdesivir to prevent progression to severe COVID-19 in outpatients. N Engl J Med, 2022, 386: 305-315
[5]Jayk Bernal A, Gomes da Silva MM, Musungaie DB, et al. Molnupiravir for oral treatment of COVID-19 in nonhospitalized patients. N Engl J Med, 2022, 386: 509-520
[6] Hammond J, Leister-Tebbe H, Gardner A, et al. Oral nirmatrelvir for high-risk, nonhospitalized adults with COVID-19. N Engl J Med, 2022. https://doi.org/10.1056/NEJMoa2118542
[7]Planas D, Veyer D, Baidaliuk A, et al. Reduced sensitivity of SARS-CoV-2 variant Delta to antibody neutralization. Nature, 2021, 596: 276-280
[8]Cao B, Wang Y, Wen D, et al. A trial of lopinavir-ritonavir in adults hospitalized with severe COVID-19. N Engl J Med, 2020, 382: 1787-1799
[9]Horby PW, Mafham M, Bell JL, et al. Lopinavir-ritonavir in patients admitted to hospital with COVID-19 (RECOVERY): a randomised, controlled, open-label, platform trial. Lancet, 2020, 396: 1345-1352
[10]Choy KT, Wong AY, Kaewpreedee P, et al. Remdesivir, lopinavir, emetine, and homoharringtonine inhibit SARS-CoV-2 replication in vitro. Antiviral Res, 2020, 178: 104786
[11]Sheahan TP, Sims AC, Graham RL, et al. Broad-spectrum antiviral GS-5734 inhibits both epidemic and zoonotic coronaviruses. Sci Transl Med, 2017, 9: eaal3653
[12]Wang Y, Zhang D, Du G, et al. Remdesivir in adults with severe COVID-19: a randomised, double-blind, placebo-controlled, multicentre trial. Lancet, 2020, 395: 1569-1578
[13]Chitalia VC, Munawar AH. A painful lesson from the COVID-19 pandemic: the need for broad-spectrum, host-directed antivirals. J Transl Med, 2020, 18:390
[14]Jefferson T, Jones MA, Doshi P, et al. Neuraminidase inhibitors for preventing and treating influenza in adults and children. Cochrane Database Syst Rev, 2014, 2014: Cd008965
[15]RECOVERY Collaborative Group. Casirivimab and imdevimab in patients admitted to hospital with COVID-19 (RECOVERY): a randomised, controlled, open-label, platform trial. Lancet, 2022, 399: 665-676
张雪杨1, Peter Horby2, 曹彬3, 4, 5*
1清华大学医学院
2牛津大学传染病科学中心
3中日友好医院呼吸与危重症医学科,国家呼吸疾病临床研究中心,国家呼吸医学中心
4中国医学科学院呼吸病学研究院
5清华大学-北京大学生命科学联合中心
*通讯作者
作者介绍

张雪杨
清华大学临床八年制医学博士在读,曾赴美国匹兹堡大学进行两年访学,现在北京协和医院临床学习。


