摘要
γ-干扰素释放试验(IGRA)是世界卫生组织推荐的用于诊断结核分枝杆菌感染的体外免疫学方法,也是我国肺结核诊断标准中用于活动性结核辅助诊断的手段之一。近年,IGRA的方法和技术不断发展和更新,在国内的临床应用中也积累了丰富的经验。本专家意见在中华医学会结核病学分会2014年编写的《γ-干扰素释放试验在中国应用的建议》基础上,根据最新发展和临床经验进行修订和完善,从原理和技术进展、质量控制、结核潜伏感染诊断的应用、活动性肺结核辅助诊断应用、特殊人群中的应用以及常见药物对IGRA结果的影响六个部分提出专家意见,以期为IGRA在中国的临床应用提供指导。
γ-干扰素释放试验(interferon-γ release assay,IGRA)是检测结核分枝杆菌(Mycobacterium tuberculosis,MTB)特异性抗原刺激T细胞产生的γ-干扰素(IFN-γ),以判断是否存在MTB感染。IGRA适应证主要包括结核潜伏感染(latent tuberculosis infection,LTBI)的诊断和活动性结核(active tuberculosis,ATB)的辅助诊断,与结核菌素皮肤试验(tuberculin skin test,TST)相比具有明显优势:特异度高,不受卡介苗接种及大多数非结核分枝杆菌(nontuberculous mycobacteria,NTM)的干扰;使用单一阈值作为阳性判断标准;作为体外诊断方法,更适用于疫情检测和流行病学调查。IGRA作为世界卫生组织(world health organization,WHO)推荐的用于诊断MTB感染的体外免疫学方法,2017年我国肺结核诊断行业标准(WS 288-2017)增加了IGRA作为免疫学检查的手段之一 [1] 。
近年来,随着国内学者在IGRA临床应用方面经验的积累,方法和技术的不断发展和更新,我国原有的专家建议不能更好地指导目前IGRA临床应用。鉴于此,2021年1月16日,中华医学会结核病分会组织国内结核病防治领域有经验的专家讨论制定了本意见的总体框架并进行了细致分工。2021年4月底编写组完成了意见草案,并于2021年5月8日在北京召开了审稿会;于5月27—31日以函审方式,对意见进行逐条讨论、修改和完善。在获得所有编写组成员确认后进行发表。
一、IGRA简介和技术进展
(一)IGRA的原理和主要方法
MTB感染者体内致敏的T细胞,在体外再次接受结核特异性抗原刺激后,激活的效应T细胞能够产生抗原特异性IFN-γ,通过对IFN-γ的检测可以反映机体是否存在MTB感染。根据这一原理,选取存在于MTB,但在卡介苗和大部分NTM中普遍缺失的差别1区(region of difference 1,RD1)基因编码的早期分泌抗原靶6(early secreted antigenic target 6-kDa protein,ESAT-6)和培养滤液蛋白10(culture filtrate protein 10,CFP-10)作为特异性抗原(重组蛋白或者多肽),与新鲜采集的全血或外周血单个核细胞(peripheral blood mononuclear cells,PBMC)充分混合孵育,应用酶联免疫吸附试验法(enzyme linked immunosorbent assay,ELISA)检测IFN-γ的释放水平,或应用酶联免疫斑点法(enzyme-linked immunospot assay,ELISPOT)检测释放IFN-γ的效应T细胞频数 [2, 3]。
根据检测技术和操作程序的不同,目前IGRA有2种:(1)以基于ELISA方法检测全血中对致敏T细胞再次受到MTB特异性抗原刺激后释放的IFN-γ水平;(2)采用ELISPOT方法检测在MTB特异性抗原刺激下,PBMC中释放IFN-γ的效应T细胞频数 [4, 5] 。两者均以ESAT-6和CFP-10重组蛋白或混合多肽作为特异性抗原,也有些产品增加RD13区编码的Rv2654c(TB7.7)等特异性抗原。
(二)IGRA技术进展
目前IGRA使用的抗原ESAT-6和CFP-10也存在于几种NTM中,无法区分这几种NTM与MTB感染;并且,即便对于病原学阳性的结核病患者,IGRA的敏感度也达不到100%,换言之,IGRA阴性也不能完全排除LTBI和ATB。另一方面,IGRA检测阳性无法区分LTBI和ATB。
因此,国内外研究人员不断地筛选替代或者补充ESAT-6/CFP-10的抗原组合。比如分泌抗原Rv3615c [6, 7]、Rv3879c [8]、EspC(aa54-103)/EspF(aa9-44) [9]、Rv3615c和Rv3879c的抗原组合,EsxA和EsxB组合 [5],以及基于肝磷脂结合红血球凝集素(HBHA)建立的HBHA-IGRA [10]。但仍未能有效解决区分LTBI和ATB的关键问题 [11]。
此外,国内研究者发现,基于IGRA衍生指标如TBAg/PHA比值,即ELISPOT试验中抗原A孔(ESAT-6)和抗原B孔(CFP-10)两者中的较大者与阳性对照植物血凝素(PHA)孔的比值,具有提高区分ATB与LTBI的性能 [12],但仍需要多中心大样本的临床验证。
最后,在IGRA原理基础上衍生产品方面,我国近年批准的产品有:(1)基于ELISA方法同步检测IFN-γ和IL-2的产品;(2)基于PCR方法检测IFN-γ诱导因子10(IP-10);(3)基于人体皮肤试验的重组结核杆菌融合蛋白(EC)。由于这些新产品不是本意见定义的以检测IFN-γ为结果的IGRA,因此不在后文中讨论。
二、IGRA质量控制
准确报告结果是解读IGRA临床意义的前提。但IGRA涉及活细胞体外功能检测,尚无可行的全流程室内质控及室间质评方案。因此,严格按照厂家说明书规定的标准化操作规程进行试验是保证IGRA质量的关键。应用时应注意以下3点。
1. 标本采集。对于ELISPOT:外周血采集后应置于室温,且需在4~6 h内分离PBMC进行试验,标本放置时间过长会导致细胞活性降低,从而影响试验结果。对于ELISA:国内实验室一般采用先采集血液然后分装至培养管的模式,应选择肝素抗凝采血管。全血标本采集后应尽快在常温条件下运送至实验室,冷冻标本会导致溶血而影响试验结果,运输过程中避免样本剧烈摇晃。全血标本短暂静置(1 h左右)即明显分层,在将全血转移至培养管前要缓慢轻柔充分混匀采血管。
2. 在保证样本质量的基础上,实验室应制定详细的标准化操作规程并遵照执行。试验操作需要的设备,如离心机、细胞计数仪、细胞培养箱、斑点计数仪等,需要定期进行检定与校准。
3. 不论何种IGRA,在某些关键步骤如ELISA方法中引入商品化质控品进行室内质控是保证结果稳定的重要举措。现阶段,各实验室可以通过定期比对的方式保证本室结果的准确性。
三、IGRA在LTBI诊断的应用
LTBI是指机体感染MTB后,对其抗原刺激产生持续性免疫应答反应但没有发生结核病临床表现和影像学改变的持续性感染状态 [3,13]。LTBI有发展为ATB的风险。
(一)LTBI诊断的应用
1.健康人群的筛查:结合WHO指南和我国卡介苗普遍接种的实际情况,建议如下。(1)IGRA和TST均可用于LTBI检测,在条件允许的前提下可优先选择IGRA。(2)在资源有限的情况下,可优先应用TST进行初筛。针对TST阳性者,如不能排除卡介苗接种或NTM的影响时,可进一步采用IGRA进行复查。
2.LTBI发病高危人群的检测:(1)LTBI发病高危人群包括人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染者、免疫抑制剂使用者、肺结核患者的密切接触者、透析患者、器官移植患者、矽肺患者等。羁押人员、医务人员、来自结核高负担国家的移民、无家可归者和药物滥用者等也被列为LTBI管理的重要目标人群。IGRA和TST均可用于高危人群的LTBI检测。(2)考虑到以上部分高风险人群可能因合并的免疫抑制问题(包括HIV感染、类风湿性关节炎或其他全身性炎症性免疫介导的疾病治疗、使用生物或非生物改良制剂、皮质类固醇等情况)而影响免疫学检测结果,可考虑同时使用IGRA和TST以提高检测的敏感度,任何一个检测阳性均判定为感染状态。
(二)IGRA检测的结果解读
1. 阳性结果支持MTB感染状态的判定。但IGRA阳性结果的判定需结合临床表现,排除少数几种NTM(如堪萨斯分枝杆菌、海分枝杆菌、苏尔加分枝杆菌、转黄分枝杆菌、胃分枝杆菌)感染的影响 [14]。
2. 阴性结果不支持感染状态的判定。但要结合临床表现排除免疫功能缺陷或低下、接受免疫抑制剂治疗等情况下可能出现的假阴性结果 [15, 16, 17]。
3. 不确定结果为该检测的应用局限性之一,主要与患者处于免疫抑制状态有关,此时需结合临床表现、肺结核患者的密切接触史和暴露程度等具体情况进行临床综合评估,做出不支持感染状态的判定或建议进行结核病检查或医学观察。
四、IGRA在ATB辅助诊断的应用
(一)肺结核
IGRA应用于肺结核辅助诊断时应注意如下情况(图1)。
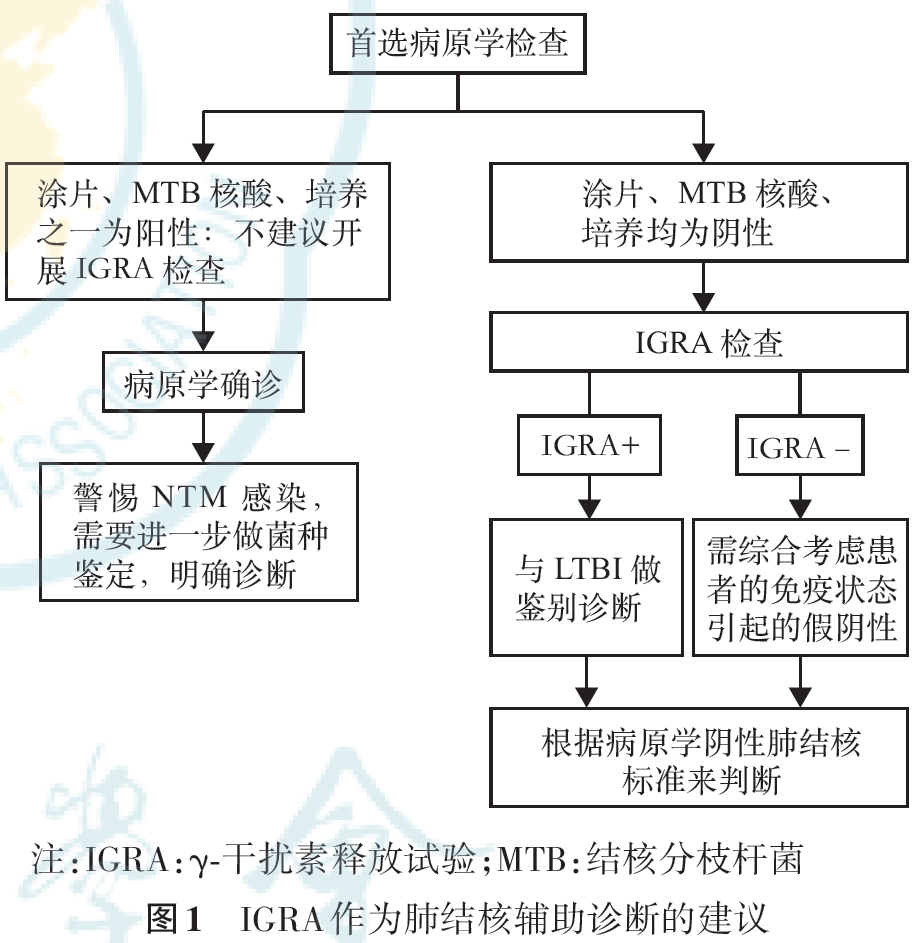
1. 病原学检测为金标准,其结果优于IGRA。对于病原学检查,包括涂片、MTB培养或MTB核酸检测,只要其中一项结果为阳性,不建议再开展IGRA检查。
2. 如同时开展IGRA检测,当病原学检查结果为阳性、IGRA为阴性时,应根据病原学检测结果来判断。
3. 当病原学检查结果为阴性,根据以下情况进行考虑。(1)对于病原学阴性肺结核患者,当IGRA结果为阳性时,只能提示MTB感染,中国作为高结核感染的国家之一,必须与LTBI做鉴别诊断。(2)需要综合考虑患者的免疫状态引起的假阴性。当IGRA为阴性时,必须排除患者是否患有自身免疫性疾病、重大血液系统疾病、严重营养不良、HIV感染等免疫功能受损的疾病(见第五部分);是否接受激素治疗、全身免疫抑制剂、生物制剂等的治疗(见第六部分)。另外,尽管排除上述情况,IGRA阴性只能提示机体没有感染MTB;但对于ATB的诊断,需要结合其他检查及临床症状综合考虑。
(二)肺外结核
肺外结核通常由MTB从呼吸道传播至肺外组织引发,也可通过皮肤、消化道直接感染引发,可能与免疫状态有关。由于临床表现不典型、菌量少、取材困难等原因,肺外结核病的诊断是实验室面临的严峻挑战。IGRA在肺外结核诊断上有一定的应用价值,但敏感度及特异度欠佳,且不同部位的肺外结核IGRA性能有差异 [18]。相比较ELISA来说,ELISPOT运用于体液标本,是目前用于诊断活动性肺外结核病合适的免疫学方法。
1. 胸腔积液ELISPOT:目前ELISPOT方法是基于外周血的检测,胸腔积液IGRA的检测流程还需要进一步探讨及规范:(1)同样条件下胸腔积液IGRA检测斑点形成细胞的数量明显高于外周血,需要实验室根据自身情况确定反应孔中加入的细胞数 [19]。国内学者提出基于10万个胸腔积液单个核细胞的改良胸腔积液ELISPOT诊断性能明显提高 [2
0]。(2)胸腔积液ELISPOT的判读标准有待进一步确定。胸腔积液ELISPOT的反应水平比外周血高,设立判断阈值时不能以外周血的判断水平作为参考,需要实验室根据自身情况确定阳性阈值。(3)非结核性胸膜炎患者IGRA也出现阳性结果。这可能是由于炎症或出血导致结核特异性细胞从血液进入胸腔所致 [20]。
建议:(1)不同实验室通过条件摸索,优化胸腔积液ELISPOT的操作流程和判断标准;(2)条件允许时,建议胸腔积液和外周血ELISPOT检测同时进行,起补充或辅助性诊断的作用。(3)由于 IGRA检测步骤繁琐、价格昂贵,不建议常规以IGRA取代其他免疫检测试验对肺外结核进行辅助诊断。(4)由于存在实验室操作及不同地域患者差异,各实验室需重新验证胸腔积液ELISPOT的最佳临界值。
2. 其他非血标本:应用时需注意:(1)腹腔积液及心包积液ELISPOT操作及临床意义可参考胸腔积液。(2)对于其他如脑脊液、关节液、肺泡灌洗液等非血标本,以脑脊液为例,由于很难分离到足够数量的淋巴细胞,会造成脑脊液ELISPOT敏感度及特异度均明显降低 [21]。
建议:(1)IGRA在结核性腹膜炎及脑膜炎的应用缺乏大样本数据的支持,其性能还有待评估。但是对于证据不足的肺外结核患者,有一定的补充和辅助性诊断的作用。(2)腹腔积液及脑脊液等临床样本缺乏统一的操作流程和判断标准。
五、特殊人群中的应用
(一)IGRA在儿童LTBI诊断和治疗中的应用
儿童LTBI发展为ATB的风险高于成人。因此,重视儿童LTBI的管理,早期发现和预防性治疗儿童LTBI者对于控制结核疫情以及保障儿童生命健康都具有重大的意义。建议如下。
1. IGRA结果阳性不能有效区分LTBI和ATB。临床需要结合症状、体征、影像学检查等进行综合判断。其中5岁以下且存在肺结核可疑症状的儿童,如IGRA阳性可诊断为疑似结核病;儿童如果胸部影像学提示存在肺结核相符的表现,并伴有肺结核可疑症状,如IGRA阳性可诊断为临床结核病。
2. IGRA阳性结果对以下儿童人群的预防性治疗具有指导意义:(1)与病原学阴性ATB患者密切接触或无明确肺结核患者接触史的儿童;(2)与病原学阳性ATB患者密切接触的≥5岁儿童;(3)LTBI高风险儿童如免疫功能受损、免疫功能抑制、准备进行器官或骨髓移植、血液透析的儿童;(4)需要指出的是,以下儿童不论IGRA检测结果阳性、阴性或未做者,均要进行预防性治疗:与病原学阳性ATB患者密切接触的<5岁儿童;≥1岁的HIV感染者,无论是否具有ATB患者接触史;<1岁的HIV感染婴儿,有ATB患者密切接触史者;ATB母亲所娩出的新生儿,排除ATB者。
3. IGRA在儿童中检测结果的不确定率相对较高,北京儿童医院的数据显示其不确定率为8.6%,且年龄越小,IGRA不确定率越高 [22]。有研究指出,IGRA在儿童中的不确定结果可能与低龄、免疫缺陷、营养不良和寄生虫感染 [23, 24]等相关。因此,应重复检测或结合儿童的流行病学情况、临床病史和症状体征综合判断。
4. IGRA不能用于儿童结核病治疗效果的评价。
(二)高危人群
免疫受损(immunocompromised)人群是LTBI进展为ATB的高危人群,因为处于潜伏状态的MTB是否再活动与宿主的免疫状态,尤其是获得性免疫反应有直接相关性 [25]。免疫受损人群包括:HIV感染者、免疫介导的炎症性疾病(immune- mediated inflammatory diseases,IMID)患者尤其是使用生物制剂者、移植患者等。在不同类型的免疫受损人群中,IGRA的表现有很大异质性,取决于患者免疫受损的机制和程度,仍需要更多的研究证实IGRA在该人群中的诊断和预测价值。
1. HIV感染者:HIV感染者是LTBI再活动风险最高的人群,估计结核再活动的年发病风险接近10% [26],接受抗HIV治疗可以降低结核病风险,但仍高于普通人群的2倍 [27]。应用时应注意如下情况。(1)IGRA的诊断敏感度(可以作为LTBI诊断敏感度的替代指标)存在异质性,ELISPOT受免疫抑制的影响更小,建议优先使用ELISPOT方法的IGRA。(2)对初始IGRA阴性且CD4+ T细胞计数<200/mm³的HIV患者在接受抗HIV病毒治疗且CD4+ T细胞≥200/mm³之后,应再次进行IGRA检测 [28]。(3)不确定结果。结核病高发地区则更高,ELISA和ELISPOT的不确定结果分别可高达12.0%和7.7%;另外,对于CD4+ T细胞计数<200/mm³的患者,ELISA和ELISPOT的不确定结果分别可高达11.6%和11.4% [29],可多次进行检测。
2. IMID患者:IMID包括类风湿性关节炎、强直性脊柱炎、炎症性肠病等,可能因为疾病本身或者相关的治疗导致免疫受损,相比一般人群结核再活动风险升高。接受不同生物制剂的ATB风险不同(表1 [30, 31]),但总体来说倾向联合使用IGRA与TST,以尽量减少LTBI的漏诊。

3. 移植患者:实体器官移植患者的结核病风险是一般人群的20~74倍,而骨髓移植者的风险则是一般人群的2倍 [32],所以筛查和治疗LTBI的干预措施效果显著。应用时需注意如下情况。(1)对于接受实体器官移植的患者来说,不同IGRA之间的一致性较好 [33, 34, 35]。IGRA不确定结果在实体器官移植患者中比例较低,约1%~7% [36]。(2)对于骨髓干细胞移植的患者来说,IGRA的不确定结果比例相对较高。目前推荐对有危险因素(如结核暴露史)的患者进行ATB筛查;并联合IGRA/TST进行LTBI筛查以增加检测敏感度,之前化疗可能会影响LTBI筛查试验的敏感度 [37]。
六、常见药物治疗对IGRA结果的影响
IGRA是通过检测受试者外周血中效应T细胞受MTB特异性抗原刺激后产生IFN-γ来鉴定其结核感染状态,其结果受机体基础免疫状态和药物作用共同影响。
(一)常规抗结核治疗药物
1. 结核患者治疗过程中结核特异性的IFN-γ反应降低,但个体反应差异很大。由于存在非结核特异IFN-γ反应,在最初抗结核治疗的8周内,IFN-γ浓度下降,至24周中仍存在稳定但可检测的IFN-γ;只有10.2%患者治疗后IGRA转变为阴性 [38, 39]。因此,IGRA不能很好地反映与结核菌载量(治疗效果)的关系,临床实践中不建议用于监测抗结核治疗效果 [40]。
2. 在肺外结核患者中,IFN-γ浓度不会随治疗时间变化。在抗结核治疗成功的ATB患者中,低于15%的IGRA结果为阴性,需要谨慎使用IGRA测试结果逆转作为疗效指标 [41]。
(二)免疫抑制剂
1. 在LTBI风险较低的自身免疫性疾病患者中,IGRA阴性的结果十分具有说服力 [42]。在结核病中度负担地区,自身免疫性疾病患者在接受免疫抑制剂的早期易出现IGRA测定值进一步升高。
2. 有研究报道,IMID在使用免疫抑制疗法时,与TST假阴性和ELISA不确定性有关,但不影响ELISPOT结果 [43]。炎症性肠病患者在行免疫抑制治疗(特别是泼尼松)会显示ELISA假阴性 [44]。
3. 自身免疫性疾病患者在使用类固醇激素、硫代嘌呤及生物制剂时也会显示IGRA假阴性 [44],而且存在患者个体差异性 [45, 46]。
4. 使用英夫利昔单抗(Inflectra)可引起IGRA测定值小幅度降低 [45],同时仍存在结核感染风险 [47],这可能是由于其对IFN-γ应答的有抑制作用 [48]。IGRA测定值可随着治疗而下降,但多项研究之间差异较大 [49]。
5. 既往有LTBI病史但完成预防性抗结核治疗的银屑病患者,若IGRA基线阳性时,如不及时再次予异烟肼治疗,在生物治疗期间IGRA可发生巨大改变 [46]。若LTBI基线阴性时,生物治疗期间可出现短暂的IGRA转化,最终多次检测仍提示阴性 [49]。
(三)其他疾病和药物治疗
1. 对于免疫检查点抑制剂(immune checkpoint inhibitors,ICI)治疗患者,初期出现的症状和影像学表现可能无法区分肿瘤进展的患者、MTB感染和免疫疗法介导的结节病。在急性感染期间进行IGRA筛查,用于排除潜在的MTB感染,且需在ICI使用前进行 [50, 51]。
2. 若接受全身生物疗法的患者从进行初次IGRA筛查后发生或接触了任何新的ATB患者,应考虑再次进行IGRA筛查 [52]。
3. 使用多发性硬化症(multiple sclerosis,MS)的疾病改良疗法(disease modifying therapies,DMT),包括皮质类固醇、抗TNF-α抑制剂和其他免疫抑制疗法可能会增加IGRA反应和结果的不确定性。在治疗前,对潜在的LTBI进行筛查对某些DMT的安全性至关重要 [53]。
七、结语
与其他方法相比,IGRA在诊断结核菌感染上具有更好的特异度和敏感度;随着方法的改进及新抗原的应用,IGRA将会成为新一代的结核免疫学诊断方法。因此,在现有的研究数据和使用经验基础上,并结合WHO同类指南,提出现阶段我国应用IGRA的建议。而随着研究证据更加充分,应及时调整应用建议,以便于更好地指导IGRA在我国的应用。
执笔人(按姓氏笔画排序):
申阿东(首都医科大学附属北京儿童医院)、杨倩婷(深圳市第三人民医院)、余方友(同济大学附属上海市肺科医院)、汪峰(华中科技大学同济医学院附属同济医院)、张文宏(复旦大学附属华山医院)、陈心春(深圳大学)、逄宇(首都医科大学附属北京胸科医院)、高孟秋(首都医科大学附属北京胸科医院)、高磊(中国医学科学院病原生物学研究所)
编写组专家(按姓氏笔画排序):
邓云峰(山东省胸科医院)、石大伟(中国食品药品检定研究院)、卢水华(上海市公共卫生临床中心)、申阿东(首都医科大学附属北京儿童医院)、毕利军(中国科学院生物物理研究所)、刘宇红(首都医科大学附属北京胸科医院)、刘晓清(北京协和医院)、李亮(首都医科大学附属北京胸科医院)、杜娟(贵州医科大学附属医院)、杨倩婷(深圳市第三人民医院)、吴妹英(苏州市第五人民医院)、吴雪琼(解放军总医院第八医学中心)、余方友(同济大学附属上海市肺科医院)、汪峰(华中科技大学同济医学院附属同济医院)、张文宏(复旦大学附属华山医院)、陈心春(深圳大学)、郭述良(重庆医科大学附属第一医院)、逄宇(首都医科大学附属北京胸科医院)、都伟欣(中国食品药品检定研究院)、徐苗(中国食品药品检定研究院)、高孟秋(首都医科大学附属北京胸科医院)、高磊(中国医学科学院病原生物学研究所)、黄曦(中山大学)、彭丽(重庆医科大学附属第一医院)、谭守勇(广州市胸科医院)、谭耀驹(广州市胸科医院)
编写组秘书:张惠华(深圳大学)
作者:中华医学会结核病学分会
通信作者:陈心春,广东省区域免疫与疾病重点实验室 深圳大学基础医学院病原生物学系;李亮,北京市结核病胸部肿瘤研究所 首都医科大学附属北京胸科医院
本文转载自订阅号「中华结核和呼吸杂志」
原链接戳:【诊疗方案】结核分枝杆菌γ-干扰素释放试验及临床应用专家意见(2021年版)
引用本文: 中华医学会结核病学分会. 结核分枝杆菌γ-干扰素释放试验及临床应用专家意见(2021年版) [J] . 中华结核和呼吸杂志, 2022, 45(2) : 143-150. DOI: 10.3760/cma.j.cn112147-20211110-00794.


