摘要
嗜酸粒细胞增多相关性肺疾病(EPD)是指以气道和(或)肺(实质、间质、肺泡)和(或)胸膜腔嗜酸粒细胞(EOS)增多为特征的一组异质性临床疾病,伴或不伴外周血EOS增多。EPD的临床评估和诊断决策是具有挑战性的问题,我国尚无EPD诊疗专家共识。广州医科大学附属第一医院国家呼吸医学中心、国家呼吸系统疾病临床医学研究中心联合中华医学会呼吸病学分会哮喘学组广泛征求国内外多学科专家意见,借鉴和参考现有的国际EPD诊疗指南和临床研究,结合我国EPD诊治经验,制定了本共识,系统介绍了EPD的发病机制、诊断标准、分类、病因、评估与治疗等,旨在帮助临床医师从寻找EPD病因的角度,根据可利用的医疗资源,制定全面合理的诊治策略。
第一部分 概述
嗜酸粒细胞增多相关性肺疾病(eosinophilic pulmonary diseases,EPD)是指以气道和(或)肺(实质、间质、肺泡)和(或)胸膜腔嗜酸粒细胞(eosinophilic,EOS)增多为特征的一组异质性临床疾病,伴或不伴外周血EOS增多。EPD可单发于肺或是全身系统性疾病的肺部表现,是呼吸学科疑难疾病诊治难点。国内外文献报道曾用多种名称,以嗜酸粒细胞性肺病(eosinophilic lung diseases,ELD)为最常用[1-2]。本共识采用EPD而非ELD命名,是由于本共识涵盖了嗜酸粒细胞性胸腔积液(eosinophilic pleural effusions,EPE),而文献描述的ELD均不包括EPE。因此,经专家共同讨论,本文采用EPD命名。
EPD的临床评估和诊断决策是具有挑战性的临床问题。为指导临床评估EPD的病因和建立疾病队列提供参考,广州医科大学附属第一医院国家呼吸医学中心、国家呼吸系统疾病临床医学研究中心联合中华医学会呼吸病学分会哮喘学组,组织国内的呼吸科、风湿科、血液科、肿瘤科、变态反应科、感染科、耳鼻喉科、影像科和病理科等多学科专家联合讨论,形成了本共识。在撰写本共识的过程中,力求“从常见到少见,从简易到复杂”,以便避免“撒大网式检查”,尽可能节约医疗资源。其目的是帮助临床医师从寻找EPD病因的角度,根据可利用的医疗资源,制定全面合理的诊治策略。
一、推荐强度与证据质量
本共识采用推荐分级的评估、制定与评价(grading of recommendations assessment,development and evaluation,GRADE)分级系统来评价推荐强度与证据分级[3-4],推荐强度分为强、弱2级(表1),证据质量分级分为高、中、低、极低4级(表2)。由于缺乏多中心、随机、对照试验,本共识所有建议均为有条件性推荐,指导建议的证据水平普遍较低。


二、文献来源和检索方式
根据EPD相关临床问题确定对应的检索策略。通过Pubmed/Medline、Embase、Cochrane Library、中国生物医学文献数据库、中国知网、万方数据库、中文科技期刊数据库等数据库检索文献,检索时间截至2021年8月30日。
第二部分 EPD发病机制
总的来说,EPD是体内外多种刺激因素导致机体以EOS为主的炎症细胞浸润肺部的疾病群。近年来,随着对EOS的生物学研究的进展,对EOS的分化、产生和募集等环节的调节因子认识加深,从而促进了对EPD的发病机制的认识。机体受到内、外界相关因素刺激时,在粒-单核系集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)、白细胞介素(interleukin,IL)、嗜酸粒细胞趋化因子-1等多种细胞因子介导下,骨髓中的共同髓系祖细胞(common myeloid progenitors,CMP)定向分化为粒-单核系祖细胞(granulocyte-monocyte progenitor cells,GMP),再分化发育为EOS祖细胞(progenitors of eosinophil,EoP),最终发育为成熟的EOS,成熟的EOS在嗜酸粒细胞趋化因子-1、2、3(分别也称为CCL11、CCL24、CCL26)介导下,穿过血管及气道上皮屏障进入肺组织(图1),通常伴随其他炎性细胞(如淋巴细胞、浆细胞和中性粒细胞等)浸润。在众多的细胞因子中,IL-5对促进EOS的分化、增殖、募集和存活起重要的作用,IL-5升高与以EOS增多为特征的几种疾病发病有密切相关性。针对EOS调节相关靶点的药物研发是研究的热点。其中抗IL-5药物美泊利珠单抗分别在2015年、2017年及2020年先后被FDA批准用于12岁及以上儿童及成人重度嗜酸粒细胞性哮喘(eosinophilic asthma,EA)、成人嗜酸性肉芽肿性多血管炎(eosinophilic granulomatosis with polyangiitis,EGPA)及持续≥6个月12岁及以上儿童及成人的高嗜酸粒细胞增多综合征(hypereosinophilic syndrome,HES)的治疗[5-6]。2021年11月美泊利珠单抗已正式获得中国国家药品监督管理局批准,适用于EPGA成人患者治疗。
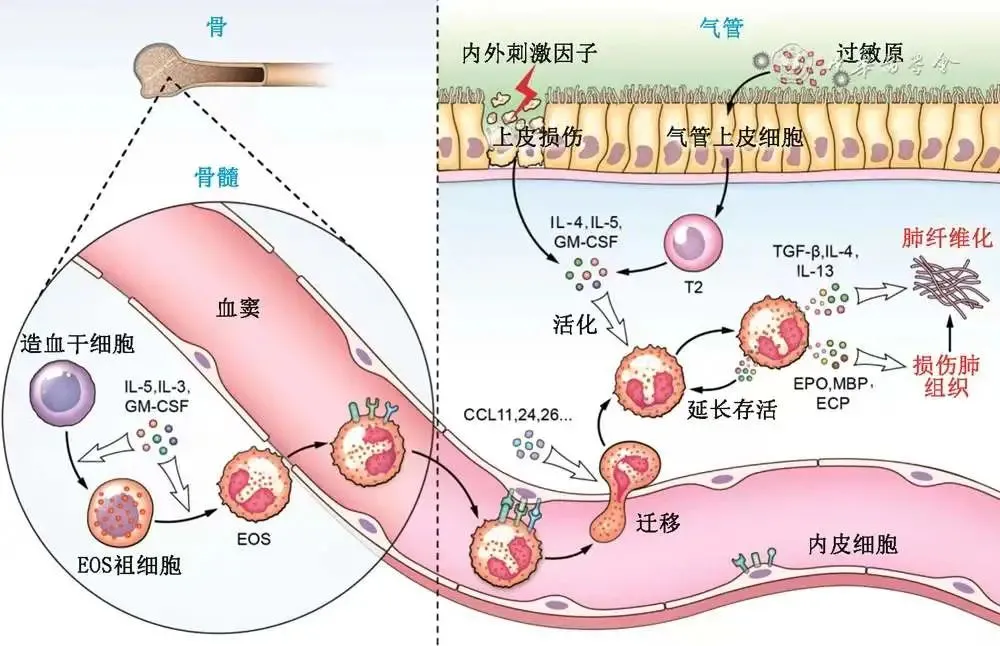
图1 EPD相关的发病机制
关于EOS致病的机制,目前认为EOS通过其特异性的嗜酸粒细胞过氧化物酶(eosinophil peroxidase,EPO)及主要碱性蛋白(major basic protein,MBP)产生氧化应激,破坏细胞外基质的结构组织,通过颗粒蛋白(如嗜酸阳离子蛋白)或通过抗体依赖细胞介导的细胞毒作用,引起组织损伤。EOS浸润还可能通过释放转化生长因子-β、IL-4和IL-13来直接促进纤维化,或通过EPO或MBP刺激组织上皮细胞表达纤维化介质而间接促进纤维化。
第三部分 EPD诊断标准及分类
推荐意见1:EPD的诊断标准[7-9]:EPD作为一类疾病的总称,满足以下4条标准中任何1条即可诊断(1C):(1)肺部浸润伴外周血EOS增多(>0.5× 10 9/L);(2)支气管肺泡灌洗液(broncho-alveolar lavage fluid,BALF)中EOS增多(>10%);(3)外科活检或经支气管镜活检证实组织EOS浸润;(4)胸腔积液中EOS增多(≥10%)。
推荐意见2:EPD病因分类包括病因明确的EPD(继发性)与起因不明的EPD(特发性)两大类(1C)。继发性EPD最多见,以变态反应、感染和风湿性疾病为最常见的基础疾病,但亦可见于多种疾病中,包括肿瘤、血液病、药物相关疾病、间质性肺疾病(interstitial lung disease,ILD)等(1C)。
目前国外尚无公认的EPD分类标准[2,7,10]。本共识按病因学分为继发性与特发性EPD两大类的目的,是强调病因学评估在EPD管理中的重要地位。继发性EPD的基础病较多(表3),与感染相关的包括寄生虫、病毒、细菌、结核、真菌感染等;变态反应性疾病多见EA、变应性支气管肺曲霉病(allergic bronchopulmonary aspergillosis,ABPA)等;风湿性疾病包括EGPA、IgG4相关性疾病(IgG4 related disease,IgG4-RD)、木村病(Kimura′s disease,KD)、嗜酸粒细胞增多-肌痛综合征(eosinophilia-myalgia syndrome,EMS)和嗜酸性筋膜炎(eosinophilic fasciitis,EF)等;肿瘤性疾病多见于血液肿瘤、实体肿瘤;其他病因如嗜酸粒细胞性细支气管炎、支气管中心性肉芽肿病(bronchocentric granulomatosis,BG)、ILD、药物、放疗、肺移植和造血干细胞移植等亦会导致EPD。特发性EPD发病率不高,为排他性诊断,需排除继发原因后才能诊断。特发性EPD包括:特发性急性嗜酸粒细胞性肺炎(idiopathic acute eosinophilic pneumonia,IAEP)、特发性慢性嗜酸粒细胞性肺炎(idiopathic chronic eosinophilic pneumonia,ICEP)、原发性单纯性肺嗜酸粒细胞增多症(simple pulmonary eosinophilia,SPE)、特发性嗜酸粒细胞性胸腔积液(idiopathic eosinophilic pleural effusion,IEPE)、特发性高嗜酸粒细胞增多综合征(idiopathic hypereosinophilic syndrome,IHES)。此共识强调,依据病因分类来寻找病因或基础疾病,有利于提高评估的效率和改善患者的预后。

第四部分 EPD评估和诊断程序
推荐意见3:对EPD患者详细的病史询问应覆盖详细的发病过程、既往史、药物接触史、家族史和个人史,结合细致的体格检查,并按评估诊治流程规范辅助检查,根据初步评估结果,针对受累器官及继发性EPD常见病因选择特殊检查(1D)。
一、详细的病史和体格检查
详细的发病经过、既往病史、用药历史、环境因素等,结合细致的体格检查,有助于缩小诊断范围,提供病因诊断线索,甚至得出初步诊断并指导经验性治疗;也可以指导个体化选择有关检查,从而能更快地明确病因诊断。
1. 现病史:需要详细询问疾病的起病情况、主要症状及伴随症状的特点、病情发展与演变、诊疗过程、与鉴别诊断相关的阳性或阴性症状及资料等,是病因评估的基础。
2. 既往史:(1)过敏性疾病:鼻炎、哮喘、湿疹、荨麻疹等;(2)非过敏性的上下气道及肺部疾病:鼻窦炎、支气管扩张、囊性纤维化等;(3)感染性疾病;(4)风湿性疾病;(5)肿瘤及其治疗(化疗或放疗等)史;(6)实体器官或造血干细胞移植病史;(7)胸部创伤或侵入性手术病史。
3. 药物接触史:可能引起EOS增多的药物和可以降低EOS的药物,例如:激素、免疫抑制剂、含激素的药粉或药丸等。
4. 家族史:特别是过敏性疾病、风湿性疾病、恶性肿瘤及HES的家族史等。
5. 个人史:吸烟史、吸毒史、冶游史、旅游史、特殊职业、环境接触史、寄生虫接触史、动物饲养及传染性疾病接触史。
二、基本的检查
EPD患者的常规检查应包括血细胞计数、动脉血气分析、胸部影像学、肺功能、气道炎症评估和系统器官功能评估。
1. 血常规:外周血EOS增多的分度包括:正常:(0.05~0.5)×109/L;轻度:(0.5~1.5)×109/L;中度:(1.5~5)×109/L;重度:>5×109/L。需注意血EOS数值的波动和全身激素或其他药物对血EOS计数的影响。
2. 动脉血气分析。
3. 胸部影像学检查:胸部X光摄片和CT检查是评估肺部是否受累的主要方法,起始诊断时优先推荐胸部高分辨CT(high resolution CT,HRCT)。
4. 肺功能检测:常用肺通气功能和弥散功能检测。有气流受限的患者,需要增加支气管舒张剂吸入试验和动态监测肺功能的变化。考虑有哮喘或气道高反应性者,增加支气管激发试验。
5. 评估气道炎症类型和程度的检查:诱导痰细胞学分类、呼出气一氧化氮(fractional exhaled nitric oxide,FeNO)等。
6. 常规重要器官功能评估:所有患者必须同时行尿常规、粪常规、肝肾功能、电解质、心肌酶学、凝血功能、红细胞沉降率、C反应蛋白、心电图、鼻窦CT、肝胆脾胰彩超、泌尿系彩超及心脏彩超检查等。
推荐意见4:全身激素的使用可以快速降低血EOS水平,掩盖相关症状和体征,影响EPD的评估(1C)。对于未明确诊断的患者,如病情许可,可在密切监测条件下停用或逐渐递减全身激素,当出现症状反复或完全停用1~2周后,再次复查上述1、2、3、4、5项检查(1D)。
三、进一步的受累器官针对性检查
通常根据患者受累的器官以及相应的临床症状、体征及初步评估结果,选择下列的针对性检查。
1. 气管镜检查:可以评估患者气道情况,获取BALF进行细胞学等检查,还可以进行肺活检获取病理学诊断。
2. 鼻腔镜检查:可以评估鼻黏膜的情况和获取鼻黏膜活检进行病理检查。
3. 胸腔积液的检查:有胸水的患者可以胸腔穿刺抽液进行细胞学和常规、生化等检测。有适应证的患者还可以进行经皮闭式胸膜针刺活检、B超或CT引导的胸膜活检或者经胸腔镜胸膜活检。
4. 皮肤活检:对有皮肤受累的患者是首选的活检和病理检查方法,相对创伤少,病理诊断率高。
5. 淋巴结评估:浅表淋巴结肿大可以通过详细的体查发现;B超、CT、MRI和全身正电子发射计算机断层显像(positron emission computed tomography,PET-CT)有助于发现未能触及的淋巴结,包括深部淋巴结。淋巴结活检病理检查有助于部分疾病的诊断,例如淋巴瘤等。
6. 神经系统检查:头颅MRI可以更加敏感地评估头颅情况;肌电图检查可以评估周围神经功能。
7. 胃肠镜检查:怀疑消化系统受累的患者建议行胃肠镜评估消化道病变,行胃肠黏膜活检评估消化道病变性质及有无EOS消化道浸润。
8. 外周和肺血管的检查:怀疑血栓形成的患者推荐行血管加压彩超或CT血管造影评估有无局部血栓形成;肺CT增强扫描或核医学肺通气/灌注检查可以评估肺血管和肺部血流灌注与通气是否匹配;全身红外显像可以无创评估四肢的血供情况。
9. 肾脏检查:怀疑肾脏受累可行肾活检明确,具体肾活检指征参照文献[11]。
10. 肌肉:可选择肌电图、肌炎抗体谱和(或)肌肉活检。
11. PET-CT检查:经无创检查未提示相关EPD继发病因患者,如果血EOS≤1.5×109/L或血EOS>1.5×109/L但血液相关检查阴性者,建议行PET-CT检查,有助于发现全身受累的器官,指导病理活检的部位,协助病因诊断。
四、针对不同病因的相关检查
1. 感染:针对寄生虫、真菌、病毒、细菌、结核的血清学(如:粪镜检、寄生虫血清学检查,真菌G试验、GM试验,病毒血清学,降钙素原,结核菌素试验、结核感染T细胞检测、结核杆菌抗体检测等)、病原学进行检查,若考虑免疫功能受损所致感染,检查血HIV及T细胞亚群评估免疫状态。
2. 变态反应疾病:血清总IgE、特异性IgE、过敏原皮肤点刺试验等。当怀疑有哮喘时,行肺通气功能检查,按指征选择支气管激发试验,最大呼气峰流速动态监测等检查。
3. 风湿性疾病:血清风湿性疾病相关自身抗体谱、补体、免疫球蛋白(含血清IgG4/IgG)、蛋白电泳、肌炎抗体谱等检查。
4. 血液肿瘤:(1)外周血涂片及骨髓穿刺涂片细胞学分类计数;(2)骨髓活检病理学;(3)血清维生素B12;(4)血液或骨髓行荧光原位杂交技术(fluorescence in situ hybridization,FISH)或聚合酶链反应(polymerase chain reaction,PCR)检测FIP1L1-PDGFRA融合基因(如FIP1L1-PDGFRA融合基因阳性,则进一步检测PDGFRA,PDGFRB,FGFR1或PCM1-JAK2基因重排);(5)血液或骨髓行PCR检测T细胞受体基因重排;(6)血液或骨髓行流式细胞术测定免疫表型;(7)骨髓染色体核型分析(如染色体提示有5q31~33或8p11~12或9p24,则需进一步FISH检测PDGFRB,FGFR1或JAK2基因重排);(8)骨髓基因的二代测序(next generation sequencing,NGS);(9)血清类胰蛋白酶水平(如血清类胰蛋白酶水平升高,则需进一步行骨髓CD117、类胰蛋白酶及CD25免疫组化检测)。
5. 实体肿瘤:血肿瘤标志物、全身多器官影像学检查、病理活检等。
推荐意见5:EPD的诊治流程遵循以下原则:先覆盖常见病,再考虑少见病;先简单,后复杂;依据患者特征进行个体化的EPD病因筛查;特发性EPD必须行全面排查后诊断;病情允许时,先诊断,后治疗;建立“治疗-随访-再评估-调整”的诊疗策略(2D)。具体见图2。
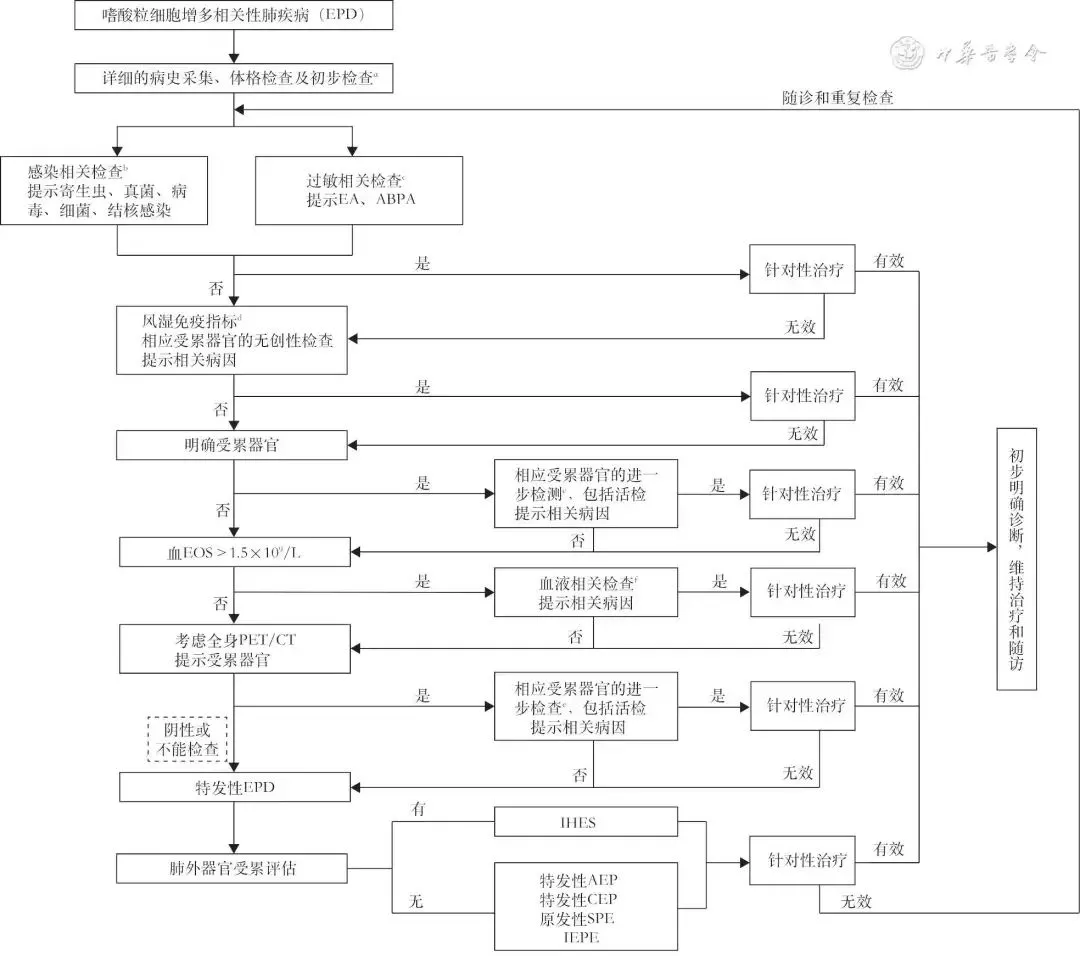
图2 EPD诊治流程图
第五部分 EPD的病因、诊断与鉴别
一、病因明确的EPD(继发性)
(一)感染相关EPD
感染相关EPD,包括寄生虫、真菌、病毒、细菌相关EPD,其中,寄生虫及真菌较为多见。
1. 寄生虫感染:是EPD的常见原因之一,尤其是可侵入肠道黏膜的多细胞的蠕虫(含吸虫、钩虫、蛔虫、粪类圆线虫等)感染[12-13]。
寄生虫的流行病学史和生活史对诊断非常重要,常见的危险因素包括有疫区生活史及疫水或污染土壤接触史[14-16],进食生或不熟的水生动物(如:虾、蟹、蝲蛄、鱼类)、爬行类及两栖类动物(如:蛇、青蛙等)、家畜(猪、狗、羊等)、野生动物(如:狼等)。
寄生虫病临床表现轻重不一,从无症状到多器官受累,甚至器官功能衰竭都可能发生[17-18],但多呈亚急性或慢性病程,症状较为轻微。并发EPD的寄生虫病分类、危险因素及临床特征见附录1(见文后)。
实验室检查:除了EPD常规的检查以外,寄生虫感染相关的检查包括:(1)血清免疫学检测寄生虫抗体:是诊断寄生虫感染的重要检查,在弓首线虫、裂头蚴、肺吸虫等的诊断意义相对较高,但是由于抗体的特异性不高,存在交叉阳性的可能,要结合流行病学资料和临床判断。(2)病原学检查:患者的大便、痰液、BALF或病理标本找到虫卵、囊孢子、滋养体、幼虫等,可作为确诊依据。(3)NGS:可检测BALF、病变组织等,对寄生虫种类进行鉴别,对不能找到病原体的寄生虫病的诊断有重要的临床价值[19]。
影像学检查:不同寄生虫感染的肺部影像表现不一,肺部的病变多呈多形性和游走性,可表现为游走性的肺实变影、网格状或结节状影、粟粒影、支气管扩张、空气潴留以及纵隔淋巴结增大和胸腔积液等[17]。
病理学改变:可见肉芽肿病灶,常常有EOS浸润,可直接找到寄生虫虫体、虫卵或虫体组织器官等。
治疗:寄生虫的治疗包括病原治疗、对症治疗和手术治疗。针对不同的寄生虫,可采用不同的抗寄生虫药物及治疗方法[18,20],见表4。在病原治疗的同时可以使用糖皮质激素以减轻或预防寄生虫所致的组织水肿,但免疫功能缺陷者激素慎用。
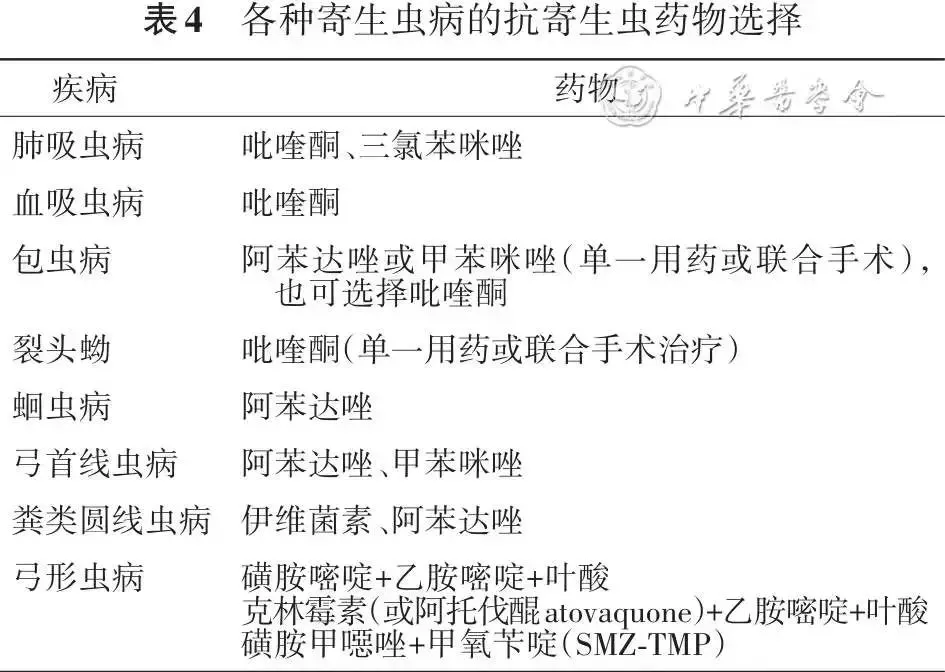
推荐意见6:寄生虫感染相关EPD诊断必须结合寄生虫流行病学资料与生活史、寄生虫病的临床表现、实验室检查、影像学检查和病理检查综合判断(1D)。尽管检测到病原体是确诊的依据,但阳性率低。对于病原体检查阴性,但临床又高度怀疑此疾病时,可根据所怀疑的寄生虫种类进行诊断性驱虫治疗(2D)。
2. 真菌感染:能引起EPD的常见真菌病有球孢子菌、副球孢子菌、马尔尼菲篮状菌。其他有报道的真菌包括有多育赛多孢子菌[21]、曲霉(侵袭性肺曲霉病)[22]、隐球菌(播散性隐球菌病)[23]、毛霉[24]。相应的临床表现和诊断标准请参照真菌病相关的专著。
3. 病毒感染:可引起EPD的常见病毒包括呼吸道合胞病毒、A型流感病毒、副流感病毒、腺病毒、EB病毒、鼻病毒、嗜肺病毒、巨细胞病毒等。其发病机制可能与病毒感染后激活内源性宿主免疫反应,引起T细胞、EOS、中性粒细胞等多种炎症细胞在肺内募集,继发一系列的炎症反应和组织损伤等有关。
4. 细菌感染:尽管细菌感染引起EPD的发生率不高,但有报道肺炎链球菌、分枝杆菌、溃疡棒状杆菌、肺炎支原体、葡萄球菌等感染可并发EPD。其发病机制可能与细菌感染所致的机体适应性免疫反应相关[7]。EOS局部浸润、增多,并与T细胞相互作用,诱导了气道内T2型炎症反应。同时,EOS分泌T2型细胞因子IL-4和IL-13,进一步放大肺内T2型炎症反应。
(二)变态反应性疾病相关EPD
主要包括EA和ABPA等。
哮喘具有多种临床和炎症表型,EA是其中最为常见的哮喘表型,其诱导痰中EOS增高,支气管黏膜、黏膜下及肺组织中可见EOS浸润[25]。重度EA是重度哮喘2型炎症表型[正使用高剂量吸入糖皮质激素或最低剂量口服糖皮质激素维持治疗者,且血EOS计数≥150/μl和(或)FeNO≥20 ppb和(或)痰EOS≥2%和(或)哮喘症状由过敏原诱发[26]]中的常见类型。许多EPD最初表现为EA,需注意鉴别。EA的治疗根据2021年哮喘全球防治创议(Global Initiative for Asthma,GINA)[26]阶梯治疗方案,重度EA可从针对2型炎症通路生物靶向治疗如抗IL-5/5R药物和抗IL-4R/13药物中获益。
ABPA是烟曲霉致敏引起的一种变应性肺部疾病,2013年国际人类和动物真菌学会提出的ABPA诊断标准:(1)有相关基础肺疾病:常见于哮喘、支气管扩张症或囊性纤维化,偶见于慢阻肺。(2)必备条件:①烟曲霉特异性IgE升高(>0.35 kUA/L)或烟曲霉皮试速发反应阳性;②血清总IgE升高(>1 000 U/ml),如果<1 000 U/ml,但符合ABPA诊断的其他全部标准时,也可诊断为ABPA。(3)其他条件(至少符合2项):①外周血EOS>0.5×109/L(可以是既往或目前的检查结果);②血清烟曲霉特异IgG抗体或沉淀素阳性;③影像学符合ABPA的表现,包括中心性支气管扩张、黏液痰栓、“指套征”“牙膏征”、游走性肺实变及结节影等[27-28]。ABPA的病理学特征包括:(1)支气管腔内黏液栓塞,EOS等炎症细胞浸润,可见夏科-莱登结晶;(2)富含EOS的非干酪性肉芽肿,主要累及支气管和细支气管;(3)嗜酸粒细胞性肺炎;(4)支气管扩张。有时病变肺组织中可见曲霉菌丝。ABPA的治疗目标包括控制症状,预防急性加重,防止或减轻肺功能受损。在抑制机体曲霉变态反应的同时,清除气道内曲霉定植,防止支气管及肺组织出现不可逆损伤。
推荐意见7:对于伴外周血EOS和总IgE异常升高的所有哮喘患者,均应及时检测曲霉特异性IgE,排查ABPA的可能性(1C)。曲霉特异性IgE及胸部CT上高密度黏液栓分别是诊断ABPA高敏感性和高特异性的指标[29-30](1C)。ABPA的治疗包括避免接触变应原、口服激素、抗真菌治疗等;口服激素是ABPA的基础治疗,激素的剂量、疗程取决于临床分期[28](1C)。
(三)风湿性疾病相关EPD
可引起EPD的风湿免疫性疾病,常见的包括EGPA,IgG4-RD、KD、EMS、EF等,其中最常见的是EGPA。其他风湿免疫性疾病,例如肉芽肿性多血管炎、系统性红斑狼疮等肺部也可见EOS浸润。
1. EGPA:EGPA是一种少见的可累及全身多个系统的自身免疫性疾病,主要表现为外周血及组织中EOS增多、浸润及中小血管的坏死性肉芽肿性炎症,属于抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibodies,ANCA)相关性血管炎[31]。EGPA临床表现多样性,以重度哮喘样表现、鼻-鼻窦、肺浸润和血EOS增多为特征。EGPA全身症状主要表现为全身不适、发热、乏力、食欲缺乏、体重减轻等,可持续数月至数年不等,无特异性。与其他血管炎不同,EGPA最早且最易累及呼吸道和肺,绝大多数首发表现为喘息样发作和鼻-鼻窦炎症状,常被误诊为难治性哮喘。随着病情进展,全身多系统均可受累并造成不可逆的器官损害。因此,EGPA早期诊断十分重要。文献报道BALF中EOS比例常高达25%以上。ANCA可阳性。EGPA诊断参考1990年美国风湿病学会(American College of Rheumatology,ACR)提出的分类标准:(1)哮喘样表现;(2)外周血EOS增多(>10%);(3)单发或多发性神经病变;(4)肺非固定性浸润影;(5)鼻窦病变;(6)活检提示血管外EOS浸润。符合4条或以上可诊断。EGPA和哮喘鉴别的要点为:哮喘极少出现累及其他器官的表现、外周血EOS比例一般为轻度增高或正常、弥散功能多正常,无游走性肺部浸润影等影像学表现;ANCA阴性;活检多以支气管黏膜及黏膜下EOS浸润为主、偶可见肺组织少量EOS浸润、无血管EOS浸润特征的表现。难治性哮喘,长期糖皮质激素的使用常常会掩盖其外周血EOS升高的特点,因此,临床实践时需要提高警惕。临床偶可见EGPA合并ABPA患者。治疗方面,根据2021年ACR/血管炎基金会制定的ANCA相关性血管炎的治疗指南[32],通过对EGPA的活动性、重症、非重症、缓解、难治性、复发等疾病状态进行定义,予以相应治疗。诱导缓解治疗方案主要包括激素和(或)免疫抑制剂或生物靶向治疗;对于非重症EGPA,优先推荐激素联合美泊利珠单抗。诱导缓解后予以维持治疗。中西医结合治疗有一定优势,EGPA属“肺络痹”,活动期应搜风逐邪、通络宣痹,缓解期应扶正通络、祛风化痰活血。
推荐意见8:难治性哮喘伴鼻窦炎、外周血EOS>10%或绝对值>1.5×109/L的EPD患者,要警惕EGPA可能,应注意评估肺外器官是否受累(1C)。长期全身激素的应用可以掩盖EGPA的表现,在停用全身激素后评估血EOS、肺部渗出病变和肺外病变,有助于鉴别难治性哮喘与EGPA(1C)。
2. IgG4-RD[33-35]:IgG4-RD为多器官受累的自身免疫疾病,常累及泪腺、唾液腺、胰腺、胆道系统、腹膜后软组织、肾脏、肺、主动脉、淋巴结等,呼吸系统受累患者可无症状,或出现鼻塞、失嗅、咳嗽、喘息、气短等。影像学可表现为:肺门/纵隔淋巴结肿大、支气管壁/支气管血管影增厚、肺小叶间隔增厚、结节影、浸润性阴影、胸膜增厚和(或)胸腔积液。血清学检查提示血清IgG4水平>1 350 mg/L,IgG4/IgG升高伴低补体血症。受累器官组织由于大量淋巴细胞和IgG4阳性浆细胞浸润伴纤维化而有肿大或结节/硬化性病变,肺部病理肺间质支气管血管周围、小叶间隔和(或)胸膜内大量淋巴浆细胞浸润,IgG4+/IgG+浆细胞比例>40%和(或)IgG4+浆细胞数>10个/高倍视野;伴闭塞性静脉炎或闭塞性动脉炎;且席纹状纤维化或浸润的淋巴细胞周围有纺锤状细胞增生。推荐参考2019年ACR/欧洲风湿病联盟制定的分类标准[36-37]进行诊断。治疗方面:糖皮质激素是一线药物,联合免疫抑制剂可更有效控制疾病,减少复发,难治性或复发性IgG4-RD可选用生物制剂(如利妥昔单抗)。复发者需根据复发器官、既往用药情况制定治疗方案。
3. KD[38]:KD亦称嗜酸粒细胞增多性淋巴肉芽肿,主要临床表现为头颈部无痛性皮下软组织肿块,大涎腺和周围淋巴结常受累。98%患者外周血EOS增高,血清IgE升高。确诊需依据病理组织学检查:(1)病变位于皮下深处,侵犯真皮层和肌肉;(2)炎症细胞增生与浸润,各病变组织中形成广泛淋巴滤泡样结构,大量EOS、淋巴细胞及肥大细胞充斥于滤泡间,多形成嗜酸性微脓肿;(3)血管增生反应;(4)不同程度的纤维化。淋巴滤泡及嗜酸性微脓肿是重要特征。治疗方面,小剂量放疗、手术切除及加用糖皮质激素治疗。
4. EMS[39]:EMS是与环境因素相关的多系统受累的罕见疾病,86%~97%患者有左旋色氨酸接触史,以亚急性起病,外周血EOS升高和全身弥漫性肌痛为主要特征,肺主要为肺间质病变或纤维化,血管周围炎性细胞浸润,肺泡渗出物中见单核和(或)EOS浸润,肺泡炎,血管周围炎,纤维增生。诊断方面,2001年修订:(1)自发病起6个月内出现以下3个表现(可同步或先后出现):①EOS增多;②肌痛;③皮疹、水肿、肺部受累或神经病变至少其中之一。(2)起病前可有或无诱因,自发病起24个月内出现以下综合征之一:①筋膜炎、神经病变、肌痛或肌肉痉挛;②发病起6个月出现筋膜炎、肌病、神经病变或EOS增多中至少3项。(3)诊断时需注意排除:旋毛虫病、血管炎以及任何可解释临床表现的感染、过敏、肿瘤、结缔组织病或其他疾病等。当满足条目1或条目2时,可诊断EMS。治疗上,暂停可引起疾病的药物,糖皮质激素治疗。
5. EF[40-41]:EF是罕见结缔组织病,以皮肤硬皮病样改变但缺乏雷诺现象、毛细血管扩张和内脏受累为主要特征。典型表现为疼痛性、对称性水肿伴进行性皮肤和软组织硬化,主要累及四肢和躯干。内脏少受累,少数患者可因胸廓受限导致轻度肺功能受限。2014年Pinal-Fernandez等提出:(1)主要标准:①对称或不对称性,弥漫性(如四肢、中线或腹部)或局限性(如四肢)肿胀、硬化,皮肤和皮下组织增厚;②受累部位皮肤的全层楔形活检提示筋膜增厚,伴淋巴细胞、巨噬细胞,伴或不伴EOS浸润。(2)次要标准:①外周血EOS>0.5× 10 9/L;②血清高丙种球蛋白血症>1.5 g/L;③肌肉乏力或血清醛缩酶水平升高;④“沟槽征”和(或)橘皮样皮肤表现;⑤T2加权磁共振提示筋膜高信号。(3)排除标准:已诊断系统性硬化症。符合全部主要诊断标准,或符合一条主要标准及两条次要标准,可诊断EF。糖皮质激素是一线治疗药物。联用免疫抑制剂能提高疗效。光疗可改善EF皮肤硬化。
(四)肿瘤性疾病相关EPD
1. 血液肿瘤相关EPD:(1)非克隆性EOS增多:许多B系和T/NK系淋巴细胞增殖性肿瘤,包括淋巴瘤、白血病、肥大细胞增多症等可发生反应性EOS增多,尤其是CD4+的T细胞淋巴瘤。IL-5增加可能是EOS增多的重要机制。(2)血液肿瘤克隆性EOS增多[42]:包括:①髓系和淋系肿瘤伴PDGFRA、PDGFRB、FGFR1重排或PCM1-JAK2、ETV6-JAK2或BCR-JAK2融合基因表达阳性;②慢性嗜酸粒细胞白血病-非特指型,包括那些伴ETV6-ABL1、ETV6-FLT3或其他激酶融合基因;③不典型慢性髓性白血病伴EOS增多;④慢性粒单核细胞白血病伴EOS增多;⑤慢性髓性白血病加速期或急变期(偶见);⑥其他骨髓增殖性肿瘤急变期(偶见);⑦急性髓系白血病伴EOS增多,特别是伴t(8;21)(q22;q22)或inv(16)(p13;1q22)(仅偶见);⑧急性淋巴细胞白血病,且证实EOS为恶性白细胞克隆的一部分;⑨系统性肥大细胞增多症(EOS证实为克隆性)。血液肿瘤相关EPD诊治流程见图3。
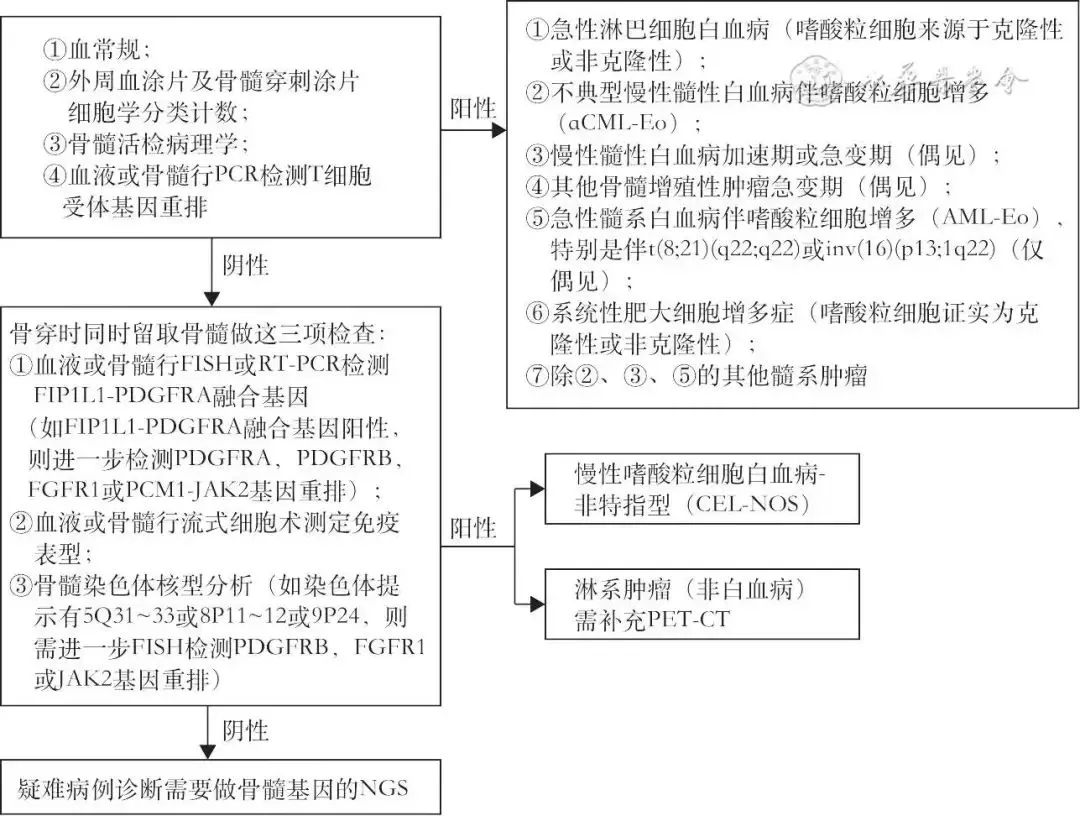
图3 血液肿瘤相关EPD诊治流程
推荐意见9:外周血EOS>1.5× 10 9/L,经常规排查未找到明确病因时,需进行血液肿瘤相关EPD排查(1C)。外周血和骨髓涂片、骨髓活检及相关基因重排和染色体检查有助于病因诊断,NGS检查血液肿瘤相关基因突变可提高病因诊断率(1D)。
2. 实体肿瘤相关EPD:多种实体肿瘤均有并发EPD的报道,可发生在肿瘤的各个阶段,通过影像学及病理学对肿瘤进行诊断。实体肿瘤相关EPD的治疗主要针对原发肿瘤的治疗。
(五)其他少见继发性EPD
其他少见继发性EPD包括:嗜酸粒细胞性细支气管炎、BG及ILD、药物、放疗、肺移植、异基因造血干细胞移植相关EPD等。ILD并发EPD以肺朗格汉斯细胞组织细胞增生症(pulmonary Langerhans cell histiocytosis,PLCH)最为常见,结节病、特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)等也有并发EPD的报道。
1. 嗜酸粒细胞性细支气管炎[43-44]:以慢性咳嗽、呼吸困难为主要表现,血及BALF中EOS增高,CT检查示:双肺弥漫的小叶中心结节、广泛的细支气管管壁增厚。诊断标准:(1)血EOS>1× 10 9/L[和(或)BALF EOS>25%];(2)肺通气功能提示持续的气流阻塞及其他闭塞性细支气管炎的特征改变:用力呼出气量为25%~75%肺活量时的平均流量(forced expiratory flow 25%~75%,FEF25%-75%)与用力肺活量(forced vital capacity,FVC)的比值降低或残气量(residual volume,RV)与肺总量(total lung capacity,TLC)比值升高;(3)肺活检提示细支气管炎并细支气管壁EOS浸润[和(或)HRCT中显示小叶中心性支气管结节影等细支气管炎的征象]。治疗方面,吸入支气管扩张剂和吸入糖皮质激素效果不理想,全身激素治疗疗效迅速并显著,能有效缓解症状,完全逆转气道阻塞。
2. BG[45-50]:临床上以中青年发病居多,起病较急,常有发热,咳嗽,喘息,呼吸困难,痰多为黏液脓性,有时可见棕黄色黏液栓痰;血EOS增高,曲霉属皮试呈立即强阳性,痰培养曲霉阳性。CT示浸润性阴影,单发或多发结节,边缘可有毛刺,肺不张,多发生于肺上部,单侧为主。确诊需依赖于肺组织活检:病灶内可见大量EOS的非干酪性肉芽肿分布于细支气管及肺泡内,小支气管内可见黏液栓,特殊染色还可发现真菌菌丝。治疗主要采用糖皮质激素,激素无效者可采用硫唑嘌呤治疗,必要时可加用抗真菌药物。病理诊断明确后可手术切除病灶。
3. PLCH[51-52]:以20~40岁的男性患者多见,>90%有吸烟史,表现咳嗽和呼吸困难,部分患者可出现气胸,可伴肺外系统受累(包括垂体、肺、骨、皮肤、前列腺、肝脏、淋巴结和胸腺等),垂体受累时表现为尿崩症。CT示:多发的不规则囊腔,囊壁厚薄不等,伴有细支气管周围结节,结节边缘不规则呈星芒状,结节可演变为囊腔灶;病灶主要分布于上、中肺野,肺底部及肋膈角区少见。确诊需结合临床与肺组织活检,病理组织学见:细支气管中心分布的朗格汉斯细胞增生,并向肺间质浸润形成“星形”纤维化病灶,伴囊腔形成为病理改变特征,伴淋巴细胞、EOS等炎症细胞渗出,免疫组化CD1a、S-100、CD207(Langerin)以及CD68染色阳性。BAIF CD1a阳性的细胞数≥5%提示为PLCH。治疗应戒烟;对于严重或进行性加重的患者,需应用糖皮质激素治疗;激素联合细胞毒药物适用于弥漫性PLCH及进展性的PLCH;终末期PLCH或合并肺动脉高压是肺移植适应证。对BRAF基因突变者,可考虑BRAF抑制剂维罗非尼、达拉非尼等治疗,或选用BRAF下游MEK1/2抑制剂曲美替尼等靶向药物治疗[53]。
4. 药物相关EPD[54-55]:多种药物可以引起EPD,药物引起呼吸系统疾病网站(www.pneumotox.com)列出了大量能引起EPD的药物。临床表现呈多样性,从轻微的SPE样表现到爆发性急性嗜酸粒细胞性肺炎(acute eosinophilic pneumonia,AEP)样表现,也可以表现为逐渐进展的CEP样表现。常见临床表现有呼吸系统症状及发热、皮疹、疲乏、关节痛等全身症状。伴EOS增多和系统症状的药疹(drug rash with eosinophilia and systemic symptoms,DRESS)综合征是一种严重药物不良反应,表现为发热、皮疹、EOS增多和淋巴结肿大,可以累及肝、肾、肺等多器官。临床上没有明确的诊断标准,诊断的关键是相关用药史与临床表现的时序性以及外周血EOS计数,停用相应药物后缓解。治疗原则是停用相关的药物,大部分患者停用相应药物后可以缓解;如病情严重可短期使用糖皮质激素,有助于病情恢复。DRESS综合征对全身糖皮质激素反应良好。
5. 放疗继发EPD[56-57]:临床少见,常出现在放疗结束之后3~5个月,多发生于既往有哮喘或过敏史的患者,多见于女性,几乎所有报道病例均为乳腺癌,主要症状是咳嗽和呼吸困难,文献报道血EOS常在1× 10 9/L以上、BALF中EOS多>40%,肺部放疗区域可见阴影,也有双肺受累,表现为游走性阴影。诊断应根据病史,血、BALF中EOS增高及影像学表现,排除其他疾病。口服激素可迅速缓解,多无后遗症。有少部分患者在停药之后会复发。
二、起因不明的EPD(特发性)
包括IAEP、ICEP、原发性SPE和IHES等。
(一)IAEP[7, 58-59]
临床特征为:起病急,常有呼吸困难和并发呼吸衰竭,血EOS通常不高,BALF中的EOS显著增高(>25%),无复发。胸部影像学表现为:快速进展,大片肺磨玻璃密度影及实变影、肺小叶间隔增厚、“铺路石”征,多伴胸腔积液。诊断标准:(1)呼吸症状≤1个月;(2)影像学显示肺部浸润性病灶;(3)BALF中EOS的比例>25%,伴或不伴淋巴细胞和中性粒细胞比例升高,或肺组织活检见EOS浸润性肺炎;(4)排除其他EPD,如EGPA、HES、ABPA。治疗原则:(1)必须脱离可疑致敏原;(2)糖皮质激素治疗:起始治疗通常需要较大剂量(如甲泼尼龙60~125 mg,每6小时1次,维持24~48 h),通常数小时内呼吸系统症状就能缓解,呼吸衰竭纠正后在2~4周内逐渐减量并停用;1个月内影像学即可完全吸收。
(二)ICEP[60-61]
又称迁延型嗜酸粒细胞增多症,临床表现为慢性病程,通常为2~6个月,甚至超过1年;症状主要为慢性呼吸困难、咳嗽、发热和喘息;约1/3到1/2患者有过敏性鼻炎或鼻息肉等病史,2/3有哮喘病史;伴血及BALF中EOS增高。影像学表现为弥漫性肺泡实变伴支气管气相和(或)磨玻璃影,尤其以外周分布为主,呈“反向肺水肿”征,复发常在原来的部位。诊断标准:(1)呼吸系统症状>2周;(2)BALF中可见较多的EOS(>25%)、血EOS增多和(或)肺部EOS浸润的证据;(3)典型的胸部影像学表现;(4)排除已知引起EPD的原因(如药物、感染)。对于已接受糖皮质激素治疗的患者,临床评估时外周血或BALF中EOS可能无明显升高,在诊断时应尤其注意。糖皮质激素是最主要的治疗药物,常用初始剂量为泼尼松40 mg/d。待症状好转和肺部病变吸收后逐渐减量,疗程4~6个月。在激素减量过程或停药后,患者病情易复发,但多对再次使用激素治疗反应良好。
(三)SPE[61-63]
又称吕弗勒综合征(Löffler′s syndrome),常见继发于寄生虫感染、药物等因素,约1/3为原发性。呼吸系统症状常较轻微,包括咳嗽、咳少许黏液痰等,偶可有喘息、呼吸困难等;全身症状较少和较轻,可有轻微不适感、一般不发热或仅有低热;血及BALF中EOS增高,病程呈自限性,3~4周内自行痊愈。胸部影像学表现为密度较低、边缘模糊的小片或大片阴影,呈非节段性分布,下肺野较多见,可呈游走性。阴影通常在1~2周内消失,可在其他部位出现新病灶,但一般不超过1个月。诊断依据包括临床表现、影像学特征、外周血和BALF中EOS增多、病程演变规律和排他性诊断。治疗上应去除病因及诱因,对症治疗,一般不考虑使用糖皮质激素。
(四)IHES[42, 64-66]
典型的临床表现包括隐袭出现的全身症状(衰弱、疲乏)、咳嗽及呼吸困难,常有皮肤、消化道、心脏、神经系统等多器官系统受累表现,伴血及BALF中EOS明显增高。影像学方面,肺部病变可有不明显,可出现一过性肺实变,偶见双肺结节影。当有心功能不全时,可出现继发的肺水肿和(或)胸腔积液。诊断时,需要:(1)特别重视除外血液系统疾病、家族性高嗜酸粒细胞增多、反应性嗜酸粒细胞增多症等;(2)血EOS绝对计数>1.5×109/L持续≥6个月;多器官组织受累的证据。HES一般以重要器官受累和功能障碍作为主要治疗指征。此外,推荐外周血EOS 1.5~2.0×109/L开始治疗。如有心脏、神经、血栓并发症等,或EOS显著增多(>100×109/L)或快速升高,需立即治疗。治疗可参照中华医学会血液学分会《嗜酸粒细胞增多症诊断与治疗中国专家共识》给予相应处理。
推荐意见10:特发性EPD的诊断原则是先进行排他性诊断,再根据疾病缓急、累及的器官和相关的病理结果,通过综合分析来诊断不同类型的特发性EPD(2D)。初步诊断后,还需要纵向随访治疗反应来论证或调整诊断(2D)。
三、EPE
EPE,也称胸水嗜酸粒细胞增多症(pleural fluid eosinophilia,PFE),是一组胸水中EOS比例≥10%的临床综合征,可伴或不伴血EOS增多。EPE可单发于胸腔或者是其他EPD的胸膜腔的表现,多为渗出性胸腔积液,约占渗出性胸腔积液的5%~16%[67]。EPE临床表现主要为胸痛、呼吸困难、咳嗽、发热或其他原发病症状,因病因不同而各有差异。若呼吸困难程度与胸水量不相称,应高度怀疑肺栓塞[68],绝大多数未确诊的EPE患者应对肺栓塞进行排查,如果血D-二聚体增高,应进一步做肺CT增强扫描或核医学肺通气/灌注检查。胸水性质为漏出液时,需注意心力衰竭、肝硬化继发的漏出性EPE。
EPE诊断后需进一步明确病因,与以下疾病鉴别:恶性嗜酸粒细胞性胸腔积液(malignant eosinophilic pleural effusion,MEPE)、血液肿瘤相关EPE、气胸、血胸、结核性胸膜炎、寄生虫相关性胸腔积液(pleural parasitic infestations,PPI)[69]或其他感染性疾病所致胸膜受累、风湿性疾病伴发胸腔积液、肺栓塞继发胸腔积液、心肝肾胰等基础疾病所致胸腔积液、良性石棉胸腔积液、药物或特殊物质接触引起的EPE[70]等。对于无其他疾病相关证据的患者可排除性诊断为IEPE[71-73]。
EPE的治疗主要包括对症治疗和原发病治疗,对症治疗如胸腔穿刺抽液引流、缓解症状、预防胸膜肥厚;原发病治疗包括抗寄生虫、抗细菌、抗肿瘤等原发疾病;全身性糖皮质激素对AEP、CEP、HES、IEPE及创伤相关的EPE有效[74]。
推荐意见11:胸腔积液中EOS比例≥10%即可诊断EPE。EPE可由多种病因引起,需要积极寻找病因,并针对病因治疗。对于无其他疾病相关证据的患者可排除性诊断为IEPE(2D)。
第六部分 展望
EPD涉及多个不同学科,病因复杂。目前我国尚缺乏详尽的EPD的流行病学报道,人们对此类病还有很多方面认识的不足。本文是经过多学科专家组反复讨论,形成建议的临床排查流程。期盼能够给临床工作提供参考的同时,也能为建立疾病队列的病例资源库提供参考。同时,希望能够提高学界对EPD的关注,激励更多学者从多学科的角度,共同努力探索EPD的发病机制和优化诊治流程。展望未来,在探索EPD发生机制、EOS在各疾病过程所起的作用和临床诊治标准方面,任重道远。
附录1 继发EPD的寄生虫病分类、危险因素及临床特征
1. 继发性EPD的寄生虫病分类:(1)以肺脏为主要寄生场所的寄生虫病,如卫氏并殖吸虫病、斯氏狸殖吸虫病等;(2)以其他部位为主要寄生场所的寄生虫病,有时也可以侵犯肺脏,如粪类圆线虫病、阿米巴性肺脓肿、包虫病、裂头蚴病、弓形虫病等;(3)寄生虫的幼虫(包括某些动物蠕虫幼虫)在其发育过程中需在肺脏内停留并发育,引起肺部的病变,如血吸虫、丝虫、蛔虫、犬(猫)弓首线虫等;(4)寄生其他部位的寄生虫如华支睾吸虫可引起肺部的过敏反应,表现为过敏性肺炎。
2. 寄生虫的流行病学史和生活史:(1)肺吸虫因进食生或不熟的虾、蟹、蝲蛄感染;(2)裂头蚴则是饮用桡足类动物如剑水蚤等污染的水源或食用感染裂头蚴的鱼类、爬行类及两栖类动物(如:蛇、青蛙等)感染;(3)血吸虫感染者一般均有疫区生活史及疫水接触史,尾蚴进入体内后逐渐发育成童虫,可短暂在肺部停留,导致Katayama综合征[10-11],表现为EOS增多和肺部的病变;(4)肺包虫病患者多有牧区生活史,误吃感染包虫的狗、羊(细粒棘球绦虫终宿主)及狼等(多房棘球绦虫终宿主)排出的虫卵而感染;(5)蛔虫病通过粪口传播,误吃虫卵而感染;犬(猫)弓首线虫是寄生在狗、猫的蛔虫的幼虫,经常接触狗、猫等宠物者,不慎误食其排出的虫卵后,在人体发育成幼虫,常常导致蠕虫蚴移行症,穿行在皮肤及其他器官,包括肺脏,导致EOS增高;(6)粪类圆线虫病患者多因接触虫卵污染的土壤而感染,幼虫通过血流穿入肺脏,导致肺部感染,并发育成成虫,之后通过支气管逆行入食道,寄生在肠道,如果免疫力低下,可以导致大量的虫体在肺脏繁殖、产卵,导致重感染综合征 [12],病死率极高;(7)弓形虫的传播途径比较多样,可通过进食未煮熟含有嚢孢的肉类,猫粪污染的食品或水源,土壤,输血或者器官移植以及母婴传播等,一般正常人没症状,免疫缺陷患者可有临床表现。
3. 临床表现:(1)呼吸系统:卫氏并殖吸虫病表现为咳嗽、咳铁锈色痰、咯血;斯氏狸殖吸虫病则常见表现为渗出性胸膜炎;部分寄生虫感染,如蛔虫、十二指肠钩虫和美洲板口钩虫可引起SPE,出现短暂的EOS增高,肺部症状轻微,仅表现为轻咳,病程呈自限性;肺脏血吸虫可表现为发热,咳嗽,呼吸困难,肺内游走性结节,多发生在感染后的14~84天,又称Katayama综合征;肺部粪类圆线虫病轻者仅表现咳嗽,重者可出现呼吸困难、咳血、呼吸窘迫综合征,呼吸衰竭,甚至多器官衰竭导致死亡,多发生在免疫功能低下重症感染患者;肺脏弓首线虫病多表现为咳嗽,肺部移行性结节[13]。(2)其他系统症状:根据寄生虫累及的脏器不同可出现发热及相关部位的症状,如肝区疼痛、腹泻、皮疹、中枢神经系统表现等[14]。
4. 肺部影像学表现:(1)由蛔虫、十二指肠钩虫和美洲板口钩虫引起的SPE,影像学主要表现为游走性的肺实变影,此外还可出现网格状或结节状影、粟粒影和胸腔积液。(2)粪圆线虫感染时还会表现为肺脓肿形成,出现肺部空洞。(3)热带性肺EOS浸润症,主要由线虫感染引起,如班氏线虫和马来线虫,影像学表现常为网格状或结节状影、支气管扩张、空气潴留以及纵隔淋巴结增大。(4)包虫病,主要由包虫引起,如细粒棘球绦虫,影像学常表现为单个或多个明显的圆形或椭圆形阴影,病灶规则,表现为液性囊肿,也可并发气胸或脓胸。(5)肺吸虫病,主要由卫氏并殖吸虫引起,早期肺吸虫病可因幼虫的游走而出现气胸、液气胸,部分病灶融合形成实变影及线状阴影等表现,随着病情的进展,可出现薄壁囊肿、胸膜下结节、支气管扩张和胸膜增厚等表现,与其他寄生虫感染疾病相比,更容易出现肺内空洞和周围小叶中心结节。(6)弓首线虫病,主要由狗弓蛔虫和猫弓蛔虫引起,影像学常表现为磨玻璃样影、实性结节、实变影、胸膜下线等[13]。
共识制定专家组
顾问:钟南山(广州医科大学附属第一医院国家呼吸医学中心、国家呼吸系统疾病临床医学研究中心、呼吸疾病国家重点实验室、广州呼吸健康研究院呼吸与危重症医学科);黄晓军(北京大学人民医院、北京大学血液病研究所);Kian Fan Chung(钟建桓,英国帝国理工大学心肺疾病研究所)
组长:周新(上海交通大学附属第一人民医院呼吸与危重症医学科)
副组长:沈华浩(浙江大学医学院附属第二医院呼吸与危重症医学科)
执笔人:张清玲(广州医科大学附属第一医院国家呼吸医学中心、国家呼吸系统疾病临床医学研究中心、呼吸疾病国家重点实验室、广州呼吸健康研究院呼吸与危重症医学科)
成员(以姓氏拼音排序):蔡绍曦(南方医科大学南方医院呼吸与危重症医学科);曾庆思(广州医科大学附属第一医院放射科);陈淮(广州医科大学附属第一医院放射科);陈荣昌(广州医科大学附属第一医院国家呼吸医学中心、国家呼吸系统疾病临床医学研究中心、呼吸疾病国家重点实验室、广州呼吸健康研究院呼吸与危重症医学科;深圳市人民医院、深圳市呼吸疾病研究所);陈志华(浙江大学医学院附属第二医院呼吸与危重症医学科);崇雨田(中山大学附属第三医院感染性疾病科);代华平(中日友好医院呼吸与危重症医学科);戴冽(中山大学孙逸仙纪念医院风湿免疫科);傅应云(深圳市人民医院、深圳市呼吸疾病研究所呼吸与危重症医学科);顾莹莹(广州医科大学附属第一医院国家呼吸医学中心、广州呼吸健康研究院呼吸病理中心);郭雪君(上海交通大学医学院附属新华医院呼吸内科);姜林娣(复旦大学附属中山医院风湿免疫科);巨春蓉(广州医科大学附属第一医院国家呼吸医学中心、广州呼吸健康研究院呼吸与危重症医学科);孔灵菲(中国医科大学附属第一医院呼吸与危重症医学科);赖宁(广州医科大学附属第一医院国家呼吸医学中心、广州呼吸健康研究院呼吸与危重症医学科);李靖(广州医科大学附属第一医院国家呼吸医学中心、广州呼吸健康研究院呼吸与危重症医学科);李雯(浙江大学医学院附属第二医院呼吸与危重症医学科);梁振宇(广州医科大学附属第一医院国家呼吸医学中心、广州呼吸健康研究院呼吸与危重症医学科);林炳亮(中山大学附属第三医院感染性疾病科);刘先胜(华中科技大学同济医学院附属同济医院呼吸内科);穆荣(北京大学第三医院风湿免疫科);彭军(山东大学齐鲁医院血液科);邱晨(深圳市人民医院、深圳市呼吸疾病研究所);沈虹(浙江大学医学院附属第二医院肿瘤内科);孙永昌(北京大学第三医院呼吸与危重症医学科);谭获(广州医科大学附属第一医院血液科);陶爱林(广州医科大学附属第二医院过敏反应科、呼吸疾病国家重点实验室、广东省过敏反应与免疫重点实验室);田新平(北京协和医院风湿免疫科);汪金林(广州医科大学附属第一医院国家呼吸医学中心、广州呼吸健康研究院呼吸与危重症医学科);王春燕(广州医科大学附属第一医院血液科);王秋萍(中国人民解放军东部战区总医院耳鼻咽喉科);吴德沛(苏州大学附属第一医院血液科);谢佳星(广州医科大学附属第一医院国家呼吸医学中心、广州呼吸健康研究院呼吸与危重症医学科);叶枫(广州医科大学附属第一医院国家呼吸医学中心、广州呼吸健康研究院呼吸与危重症医学科);叶珊慧(广州医科大学附属第一医院风湿科);应颂敏(浙江大学医学院附属第二医院呼吸与危重症医学科);喻清和(广州医科大学附属第一医院中医科);张清玲(广州医科大学附属第一医院国家呼吸医学中心、广州呼吸健康研究院呼吸与危重症医学科);张文(北京协和医院风湿免疫科);张筱娴(广州医科大学附属第一医院国家呼吸医学中心、广州呼吸健康研究院呼吸与危重症医学科);周露茜(广州医科大学附属第一医院国家呼吸医学中心、广州呼吸健康研究院呼吸与危重症医学科)
秘书处成员(以姓氏拼音排序):邓振安、董聪、黄培楷、黄伟华、李游、廖永康、林慧敏、欧昌星、丘敏枝、苏小芬、王璐琳、魏书珊、文俊杰、吴鹏辉、薛玲娜、杨晓婧(广州医科大学附属第一医院国家呼吸医学中心、国家呼吸系统疾病临床医学研究中心、呼吸疾病国家重点实验室、广州呼吸健康研究院呼吸与危重症医学科);马健娟(广州医科大学附属第一医院国家呼吸医学中心、广州呼吸健康研究院呼吸与危重症医学科;贵州医科大学附属医院儿科血液专科)
参与讨论专家(以姓氏拼音排序):曹会娟、揭育胜(中山大学附属第三医院感染性疾病科);陈乐锋(中山大学孙逸仙纪念医院风湿免疫科);陈启宪(珠海市人民医院、暨南大学附属珠海医院呼吸与危重症医学科);陈伟、施涛(中国人民解放军东部战区总医院耳鼻咽喉科);冯琦(山东大学齐鲁医院血液科);付悦(中国医科大学附属第一医院呼吸与危重症医学科);胡秋蓉、马冉、沈盼晓、时旭、王万钧、杨峰、朱政(广州医科大学附属第一医院国家呼吸医学中心);梁世秀、赵海金(南方医科大学南方医院呼吸与危重症医学科);马莉莉(复旦大学附属中山医院风湿免疫科);王婧(北京大学人民医院、北京大学血液病研究所);王娟(浙江大学医学院附属第二医院肿瘤内科);王荧(苏州大学附属第一医院血液科);夏旸(浙江大学医学院附属第二医院呼吸与危重症医学科);张霞(北京协和医院风湿免疫科)
利益冲突
所有作者均声明不存在利益冲突
参考文献
[1] PriceM, GilmanMD, CarterBW, et al. Imaging of eosinophilic lung diseases[J]. Radiol Clin North Am, 2016, 54(6):1151-1164. DOI: 10.1016/j.rcl.2016.05.008.
[2] BernheimA, McLoudT. A review of clinical and imaging findings in eosinophilic lung diseases[J]. AJR Am J Roentgenol, 2017, 208(5):1002-1010. DOI: 10.2214/AJR.16.17315.
[3] GuyattG, OxmanAD, AklEA, et al. GRADE guidelines: 1. Introduction-GRADE evidence profiles and summary of findings tables[J]. J Clin Epidemiol, 2011, 64(4):383-394. DOI: 10.1016/j.jclinepi.2010.04.026.
[4] 黄笛, 黄瑞秀, 郭晨煜, 等. 临床实践指南制定方法——证据分级与推荐强度[J]. 中国循证心血管医学杂志, 2018, 10(7):769-776. DOI: 10.3969/j.issn.1674-4055.2018.07.01.
[5] WechslerME, AkuthotaP, JayneD, et al. Mepolizumab or placebo for eosinophilic granulomatosis with polyangiitis[J]. N Engl J Med, 2017, 376(20):1921-1932. DOI: 10.1056/NEJMoa1702079.
[6] RoufosseF, KahnJE, RothenbergME, et al. Efficacy and safety of mepolizumab in hypereosinophilic syndrome: a phase Ⅲ, randomized, placebo-controlled trial[J]. J Allergy Clin Immunol, 2020, 146(6): 1397-1405. DOI: 10.1016/j.jaci.2020.08.037.
[7] CottinV. Eosinophilic lung diseases[J]. Clin Chest Med, 2016, 37(3): 535-556. DOI: 10.1016/j.ccm.2016.04.015.
[8] Fernández PérezER, OlsonAL, FrankelSK. Eosinophilic lung diseases[J]. Med Clin North Am, 2011, 95(6):1163-1187. DOI: 10.1016/j.mcna.2011.08.006.
[9] FerreiroL, San JoséE, González-BarcalaFJ, et al. Eosinophilic pleural effusion: incidence, etiology and prognostic significance[J]. Arch Bronconeumol, 2011, 47(10):504-509. DOI: 10.1016/j.arbres.2011.06.011.
[10] BhattNY, AllenJN. Update on eosinophilic lung diseases[J]. Semin Respir Crit Care Med, 2012, 33(5):555-571. DOI: 10.1055/s-0032-1325164.
[11] MacGinleyR, Champion De CrespignyPJ, GutmanT, et al. KHA-CARI Guideline recommendations for renal biopsy[J]. Nephrology (Carlton), 2019, 24(12):1205-1213. DOI: 10.1111/nep.13662.
[12] 全国人体重要寄生虫病现状调查办公室. 全国人体重要寄生虫病现状调查报告[J]. 中国寄生虫学与寄生虫病杂志, 2005, 23(z1):332-340. DOI: 10.3969/j.issn.1000-7423.2005.z1.004.
[13] TorgersonPR, DevleesschauwerB, PraetN, et al. World Health Organization estimates of the global and regional disease burden of 11 foodborne parasitic diseases, 2010: a data synthesis[J]. PLoS Med, 2015, 12(12):e1001920. DOI: 10.1371/journal.pmed.1001920.
[14] KapoorS. Katayama syndrome in patients with schistosomiasis[J]. Asian Pac J Trop Biomed, 2014, 4(3):244. DOI: 10.1016/S2221-1691(14)60239-2.
[15] RossAG, VickersD, OldsGR, et al. Katayama syndrome[J]. Lancet Infect Dis, 2007, 7(3):218-224. DOI: 10.1016/S1473-3099(07)70053-1.
[16] DillonR, RiedelDJ. Strongyloides hyperinfection[J]. Am J Med, 2018, 131(10):e411-e412. DOI: 10.1016/j.amjmed.2018.05.033.
[17] RanasuriyaG, MianA, BoujaoudeZ, et al. Pulmonary toxocariasis: a case report and literature review[J]. Infection, 2014, 42(3):575-578. DOI: 10.1007/s15010-014-0587-3.
[18] CarpioA, RomoML, ParkhouseRM, et al. Parasitic diseases of the central nervous system: lessons for clinicians and policy makers[J]. Expert Rev Neurother, 2016, 16(4):401-414. DOI: 10.1586/14737175.2016.1155454.
[19] HinoA, MaruyamaH, KikuchiT. A novel method to assess the biodiversity of parasites using 18S rDNA Illumina sequencing; parasitome analysis method[J]. Parasitol Int, 2016, 65(5Pt B):572-575. DOI: 10.1016/j.parint.2016.01.009.
[20] HongST. Albendazole and praziquantel: review and safety monitoring in Korea[J]. Infect Chemother, 2018, 50(1):1-10. DOI: 10.3947/ic.2018.50.1.1.
[21] Mejia-ZuluagaM, RosasS, Posada VélezV, et al. Hypereosinophilia secondary to disseminated paracoccidioidomycosis[J]. Am J Case Rep, 2017, 18:1114-1117. DOI: 10.12659/ajcr.904520.
[22] KudoF, OhtaH, NagaiY, et al. A young immunocompetent patient with spontaneous aspergillus empyema who developed severe eosinophilia[J]. Respir Med Case Rep, 2017, 22:220-223. DOI: 10.1016/j.rmcr.2017.08.022.
[23] JoostenSA, HannanL, HeroitG, et al. Penicillium marneffei presenting as an obstructing endobronchial lesion in an immunocompetent host[J]. Eur Respir J, 2012, 39(6):1540-1543. DOI: 10.1183/09031936.00156911.
[24] KimDW, HeoST, JeonSY, et al. Invasive paranasal mucormycosis with peripheral eosinophilia in an immunocompetent patient[J]. Med Mycol, 2010, 48(2):406-409. DOI: 10.1080/13693780903177790.
[25] 奥马珠单抗治疗过敏性哮喘专家组, 中华医学会呼吸病学分会哮喘学组. 奥马珠单抗治疗过敏性哮喘的中国专家共识[J]. 中华结核和呼吸杂志, 2018, 41(3):179-185. DOI: 10.3760/cma.j.issn.1001-0939.2018.03.007.
[26] Global strategy for asthma management and prevention[EB/OL].[2021-07-08]. https://ginasthma.org/.
[27] GreenbergerPA, BushRK, DemainJG, et al. Allergic bronchopulmonary aspergillosis[J]. J Allergy Clin Immunol Pract, 2014, 2(6):703-708. DOI: 10.1016/j.jaip.2014.08.007.
[28] 中华医学会呼吸病学分会哮喘学组. 变应性支气管肺曲霉病诊治专家共识[J]. 中华医学杂志, 2017, 97(34): 2650-2656. DOI: 10.3760/cma.j.issn.0376-2491.2017.34.003.
[29] SehgalIS, AgarwalR. Specific IgE is better than skin testing for detecting aspergillus sensitization and allergic bronchopulmonary aspergillosis in asthma[J]. Chest, 2015, 147(5): e194. DOI: 10.1378/chest.15-0069.
[30] AgarwalR, MaskeyD, AggarwalAN, et al. Diagnostic performance of various tests and criteria employed in allergic bronchopulmonary aspergillosis: a latent class analysis[J]. PLoS One, 2013, 8(4): e61105. DOI: 10.1371/journal.pone.0061105.
[31] 嗜酸性肉芽肿性多血管炎诊治规范多学科专家共识编写组. 嗜酸性肉芽肿性多血管炎诊治规范多学科专家共识[J]. 中华结核和呼吸杂志, 2018, 41(7): 514-521. DOI: 10.3760/cma.j.issn.1001-0939.2018.07.002.
[32] ChungSA, LangfordCA, MazM, et al. 2021 American College of Rheumatology/vasculitis foundation guideline for the management of antineutrophil cytoplasmic antibody-associated vasculitis[J]. Arthritis Rheumatol, 2021, 73(8):1366-1383. DOI: 10.1002/art.41773.
[33] UmeharaH, OkazakiK, MasakiY, et al. A novel clinical entity, IgG4-related disease (IgG4RD): general concept and details[J]. Mod Rheumatol, 2012, 22(1): 1-14. DOI: 10.1007/s10165-011-0508-6.
[34] MahajanVS, MattooH, DeshpandeV, et al. IgG4-related disease[J]. Annu Rev Pathol, 2014, 9: 315-347. DOI: 10.1146/annurev-pathol-012513-104708.
[35] MatsuiS, YamamotoH, MinamotoS, et al. Proposed diagnostic criteria for IgG4-related respiratory disease[J]. Respir Investig, 2016, 54(2): 130-132. DOI: 10.1016/j.resinv.2015.09.002.
[36] WallaceZS, NadenRP, ChariS, et al. The 2019 American College of Rheumatology/European League Against Rheumatism classification criteria for IgG4-related disease[J]. Ann Rheum Dis, 2020, 79(1): 77-87. DOI: 10.1136/annrheumdis-2019-216561.
[37] 张文, 董凌莉, 朱剑, 等.IgG_4相关性疾病诊治中国专家共识[J].中华内科杂志, 2021, 60(3): 192-206. DOI: 10.3760/cma.j.cn112138-20200803-00726.
[38] BuderK, RuppertS, TrautmannA, et al. Angiolymphoid hyperplasia with eosinophilia and Kimura′s disease-a clinical and histopathological comparison[J]. J Dtsch Dermatol Ges, 2014, 12(3): 224-228. DOI: 10.1111/ddg.12257_suppl.
[39] HertzmanPA, ClauwDJ, DuffyJ, et al. Rigorous new approach to constructing a gold standard for validating new diagnostic criteria, as exemplified by the eosinophilia-myalgia syndrome[J]. Arch Intern Med, 2001, 161(19):2301-2306. DOI: 10.1001/archinte.161.19.2301.
[40] DasJ, ChinoyH, DickJ, et al. A literature review of eosinophilic fasciitis with an illustrative case[J]. Curr Rheumatol Rev, 2017, 13(2): 113-120. DOI: 10.2174/1573397112666161007154703.
[41] Pinal-FernandezI, Selva-O′CA, GrauJM. Diagnosis and classification of eosinophilic fasciitis[J]. Autoimmun Rev, 2014, 13(4-5): 379-382. DOI: 10.1016/j.autrev.2014.01.019.
[42] 中华医学会血液学分会白血病淋巴瘤学组. 嗜酸粒细胞增多症诊断与治疗中国专家共识(2017年版)[J]. 中华血液学杂志, 2017, 38(7): 561-565. DOI: 10.3760/cma.j.issn.0253-2727.2017.07.001.
[43] CordierJF, CottinV, KhouatraC, et al. Hypereosinophilic obliterative bronchiolitis: a distinct, unrecognised syndrome[J]. Eur Respir J, 2013, 41(5):1126-1134. DOI: 10.1183/09031936.00099812.
[44] KobayashiT, InoueH, MioT. Hypereosinophilic obliterative bronchiolitis clinically mimicking diffuse panbronchiolitis: four-year follow-up[J]. Intern Med, 2015, 54(9):1091-1094. DOI: 10.2169/internalmedicine.54.3767.
[45] ÖzdemirC, SökücüSN. Bronchocentric granulomatosis in an immunocompetent patient[J]. Arch Bronconeumol (Engl Ed), 2018, 54(1):45-46. DOI: 10.1016/j.arbres.2017.05.017.
[46] KatzensteinAL, LiebowAA, FriedmanPJ. Bronchocentric granulomatosis, mucoid impaction, and hypersensitivity reactions to fungi[J]. Am Rev Respir Dis, 1975, 111(4):497-537. DOI: 10.1164/arrd.1975.111.4.497..
[47] WardS, HeynemanLE, FlintJD, et al. Bronchocentric granulomatosis: computed tomographic findings in five patients[J]. Clin Radiol, 2000, 55(4): 296-300. DOI: 10.1053/crad.1999.0380.
[48] WesthoffM, WelimB, MüllerKM. Bronchocentric granulomatosis[J]. Pneumologie, 2005, 59(11):804-810. DOI: 10.1055/s-2005-915590.
[49] DanilaE, ZurauskasE. Diagnostic value of epithelioid cell granulomas in bronchoscopic biopsies[J]. Intern Med, 2008, 47(24): 2121-2126. DOI: 10.2169/internalmedicine.47.1452.
[50] FrechenD, SmithJ, CornelissenC, et al. Differential diagnosis and therapy of pulmonary diseases with angiitis and granulomatosis[J]. Pneumologie, 2011, 65(11): 675-683, 684. DOI: 10.1055/s-0030-1256896.
[51] Luis CrialesJ, PalominoLE, Sandoval-ZárateJ. Langerhans cell histiocytosis. Pulmonary parenchyma involvement[J]. Gac Med Mex, 2000, 136(4):387-388.
[52] JouenneF, ChevretS, BugnetE, et al. Genetic landscape of adult Langerhans cell histiocytosis with lung involvement[J]. Eur Respir J, 2020, 55(2). DOI: 10.1183/13993003.01190-2019.
[53] RadzikowskaE. Update on Pulmonary Langerhans Cell Histiocytosis[J]. Front Med (Lausanne), 2020, 7:582581. DOI: 10.3389/fmed.2020.582581.
[54] CooperJA, WhiteDA, MatthayRA. Drug-induced pulmonary disease. Part 1: Cytotoxic drugs[J]. Am Rev Respir Dis, 1986, 133(2):321-340. DOI: 10.1164/arrd.1986.133.2.321.
[55] CooperJA, WhiteDA, MatthayRA. Drug-induced pulmonary disease. Part 2: Noncytotoxic drugs[J]. Am Rev Respir Dis, 1986, 133(3):488-505. DOI: 10.1164/arrd.1986.133.3.488.
[56] CottinV, FrognierR, MonnotH, et al. Chronic eosinophilic pneumonia after radiation therapy for breast cancer[J]. Eur Respir J, 2004, 23(1): 9-13. DOI: 10.1183/09031936.03.00071303.
[57] ChaabanS, SalloumV. Chronic eosinophilic pneumonia in a breast cancer patient post-radiation therapy: a case report[J]. Respir Care, 2014, 59(5): e81-e83. DOI: 10.4187/respcare.02458.
[58] De GiacomiF, VassalloR, YiES, et al. Acute eosinophilic pneumonia. causes, diagnosis, and management[J]. Am J Respir Crit Care Med, 2018, 197(6):728-736. DOI: 10.1164/rccm.201710-1967CI.
[59] De GiacomiF, DeckerPA, VassalloR, et al. Acute eosinophilic pneumonia: correlation of clinical characteristics with underlying cause[J]. Chest, 2017, 152(2):379-385. DOI: 10.1016/j.chest.2017.03.001.
[60] MarchandE, CordierJF. Idiopathic chronic eosinophilic pneumonia[J]. Orphanet J Rare Dis, 2006, 1:11. DOI: 10.1186/1750-1172-1-11.
[61] CottinV, CordierJF. Eosinophilic pneumonias[J]. Allergy, 2005, 60(7):841-857. DOI: 10.1111/j.1398-9995.2005.00812.x.
[62] JeongYJ, KimKI, SeoIJ, et al. Eosinophilic lung diseases: a clinical, radiologic, and pathologic overview[J]. Radiographics, 2007, 27(3):617-639. DOI: 10.1148/rg.273065051.
[63] CamposLE, PereiraLF. Pulmonary eosinophilia[J]. J Bras Pneumol, 2009, 35(6):561-573. DOI: 10.1590/s1806-37132009000600010.
[64] OgboguPU, BochnerBS, ButterfieldJH, et al. Hypereosinophilic syndrome: a multicenter, retrospective analysis of clinical characteristics and response to therapy[J]. J Allergy Clin Immunol, 2009, 124(6):1319-1325. DOI: 10.1016/j.jaci.2009.09.022.
[65] WellerPF, BubleyGJ. The idiopathic hypereosinophilic syndrome[J]. Blood, 1994, 83(10):2759-2779.
[66] GotlibJ. World Health Organization-defined eosinophilic disorders: 2017 update on diagnosis, risk stratification, and management[J]. Am J Hematol, 2017, 92(11):1243-1259. DOI: 10.1002/ajh.24880.
[67] FerreiroL, San JoséE, González-BarcalaFJ, et al. Eosinophilic pleural effusion: incidence, etiology and prognostic significance[J]. Arch Bronconeumol, 2011, 47(10):504-509. DOI: 10.1016/j.arbres.2011.06.011.
[68] KalomenidisI, LightRW. Pathogenesis of the eosinophilic pleural effusions[J]. Curr Opin Pulm Med, 2004, 10(4):289-293. DOI: 10.1097/01.mcp.0000127902.37822.13.
[69] WangJ, LuoW, ShenP, et al. Retrospective study of pleural parasitic infestations: a practical diagnostic approach[J]. BMC Infect Dis, 2019, 19(1):576. DOI: 10.1186/s12879-019-4179-9.
[70] HugginsJT, SahnSA. Drug-induced pleural disease[J]. Clin Chest Med, 2004, 25(1):141-153. DOI: 10.1016/S0272-5231(03)00125-4.
[71] MitrovićJ, AnićB, VerglesJM. Idiopathic eosinophilic pleural effusion--case report[J]. Lijec Vjesn, 2012, 134(7-8):215-217.
[72] 李虹, 殷少军. 嗜酸细胞增多性胸腔积液诊断和病因鉴别诊断[J]. 中国实用内科杂志, 2016, 36(12):1082-1085.DOI: 10.7504/nk2016110601.
[73] LuoW, ZengY, ShenP, et al. Diagnostic procedure for idiopathic eosinophilic pleural effusion: a single-center experience[J]. BMC Pulm Med, 2020, 20(1):82. DOI: 10.1186/s12890-020-1108-z.
[74] HarrowEM. Eosinophilic pleural effusion in a patient with chronic eosinophilic pneumonia[J]. J Maine Med Assoc, 1980, 71(8):241-243.
版权归中华医学会所有。
通信作者:周新,上海交通大学附属第一人民医院呼吸与危重症医学科,Email:xzhou53@163.com;陈荣昌,广州医科大学附属第一医院国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心 深圳市人民医院 深圳市呼吸疾病研究所,Email:chenrc@vip.163.com
引用本文:广州医科大学附属第一医院国家呼吸医学中心, 国家呼吸系统疾病临床医学研究中心, 中华医学会呼吸病学分会哮喘学组. 嗜酸粒细胞增多相关性肺疾病诊疗中国专家共识 [J] . 中华医学杂志, 2022, 102(1) : 21-35. DOI: 10.3760/cma.j.cn112137-20210929-02187.
本文转载自订阅号「中华医学杂志」
原链接戳:标准与规范丨嗜酸粒细胞增多相关性肺疾病诊疗中国专家共识


