慢阻肺被认为是一种系统性疾病,与多种合并症密切相关,如骨骼肌功能障碍/肌少症、骨质疏松、心血管疾病和代谢综合征等。慢阻肺及其合并症相互影响,在病情发展和预后方面具有重要意义。其中,肌少症和骨质疏松是慢阻肺常见的重要的合并症,其发生机制均被认为与系统性炎症相关。肌肉和骨骼在空间上紧密相连,两者除了机械联系,还能分别作为内分泌器官分泌肌源性因子和骨源性因子参与调节肌肉-骨骼功能。近年来肌肉-骨骼交互机制在骨骼肌功能障碍/肌少症和骨质疏松中发生发展中的作用,引起极大关注;这种肌骨交互是否在慢阻肺合并肌少症和骨质疏松中发挥作用值得深入研究。
一、慢阻肺肌骨合并症及其不良影响
骨质疏松是慢阻肺患者的重要合并症,以骨密度减低和骨组织微结构改变为特征,引起骨骼脆性和骨折风险增加,导致活动能力降低和姿势平衡改变。文献分析表明慢阻肺患者骨质疏松患病率为38% ,其中BMI<18.5kg/㎡和肌少症是骨质疏松的显著危险因素。慢阻肺患者的骨质疏松通常是无症状的,往往是骨折后才被诊断,因此存在骨质疏松患病率被低估的可能。文献报道大约40%的慢阻肺患者至少发生过一次椎体骨折,以胸椎骨折患病率最高;而椎体骨折可引起背部疼痛、胸部畸形、脊柱后凸和身高下降,导致肺功能受损。此外,慢阻肺患者的骨密度(BMD)减低/骨质疏松及其相关骨折还与肺气肿、频繁急性加重、住院率和死亡率升高以及生活质量下降相关。
肌少症是一种与年龄相关的进行性和全身性的骨骼肌疾病,与跌倒、骨折、身体残疾、住院率和病死率等不良后果相关。一项荟萃分析报道了慢阻肺患者中肌少症的患病率为27.5%, 目前,多项研究已证实慢阻肺合并骨骼肌减少与更严重的气流阻塞、肺气肿、呼吸困难指数评分(mMRC)、生活质量和运动能力下降、频繁急性加重和病死率升高相关。
总之,肌少症和BMD减低/骨质疏松均是慢阻肺的重要肺外合并症,与不良预后密切相关。两者存在较多共同的危险因素或相关机制,如全身炎症(TNF-α、IL-6等)、吸烟、低氧血症和/或高碳酸血症、营养不良、氧化应激和活动减少等。在合并骨质疏松症的慢阻肺患者中,高达70%的患者也表现出肌肉萎缩迹象,而肌少症又是慢阻肺患者骨质疏松的独立危险因素。因此推测慢阻肺肌骨合并症之间存在相互影响,亦即肌骨交互(mucle-bone crosstalk)机制在两种合并症的发生发展中发挥作用。
二、慢阻肺中肌骨交互机制
肌肉-骨骼之间的生物力学研究已较深入,近些年还发现肌肉和骨骼能分别作为内分泌器官分泌肌源性因子(myokine)和骨源性因子(osteokine)作用于肌肉-骨骼单元(muscle-bone unit)从而产生交互作用。
肌肉和骨骼分泌的细胞因子能通过自分泌、旁分泌或内分泌的方式作用于其他器官,产生器官间交互作用。目前已发现多种肌源性因子和骨源性因子在肌骨交互中发挥作用,也就是说,肌源性因子除了在肌肉中的作用外,对骨代谢的影响;骨源性因子除了对骨代谢本身的影响外,还对骨骼肌生长产生的影响。
慢阻肺患者普遍经历衰老、慢性炎症、不活动、卧床等病理情况,导致肌肉、骨量丢失和功能损害,并在肌肉-骨骼之间形成恶性循环,因此慢阻肺患者的肌少症和骨质疏松尤为严重。目前慢阻肺肌骨交互作用研究较少,主要集中于Irisin(鸢尾素)、myostatin(肌生成抑制蛋白)和RANKL(核因子-κB受体活化因子配体)通路。众所周知,慢阻肺是一种慢性炎症性疾病,IL-6作为关键促炎细胞因子,在慢阻肺患者的全身炎症中发挥作用。循环IL-6水平升高与慢阻肺患者FEV1、股四头肌力量和运动能力降低相关。然而, IL-6也属于肌源性细胞因子,其在骨骼肌中能发挥抗炎和促炎双重作用;能调节破骨细胞的分化,还能增加运动适应性;提示我们应该重新审视IL-6在慢阻肺中的作用。
目前部分研究关注了慢阻肺中Irisin的表达异常及其与肺气肿和运动能力的相关性,但并未研究Irisin在慢阻肺中的肌骨交互作用。相比健康对照,慢阻肺患者血清Irisin水平降低,并且Irisin水平与体力活动呈显著正相关;在慢性烟草烟雾(CS)暴露诱导的慢阻肺小鼠模型中,运动训练可促进循环Irisin升高。还有几项研究报道了Irisin与慢阻肺肺气肿的关系。在慢阻肺患者中,血清Irisin水平与一氧化碳弥散/肺泡体积(DLCO/VA)和低衰减区域百分比(LAA%)显著相关。
Myostatin是骨骼肌生长和发育的负调节因子,部分研究报道了慢阻肺中myostatin的表达异常且与骨骼肌功能障碍相关。慢阻肺患者的血清myostatin水平升高,并且男性慢阻肺患者血清myostatin水平与总肌肉量呈负相关;同时慢阻肺患者骨骼肌中myostatin mRNA表达也升高。较近的研究发现,合并肌少症的慢阻肺患者股外侧肌的myostatin含量、活化卫星细胞、混合纤维比例、TUNEL阳性细胞(反映凋亡细胞)和肌肉损伤标记显著升高;而股四头肌肌力、Pax-7+/Myf-5-数量(肌肉卫星细胞自我更新和分化指标)和肌纤维面积下降;提示慢阻肺合并肌少症患者的骨骼肌具有较低的肌再生潜能以及显著的肌肉表型和损伤改变。临床上,肺康复是慢阻肺患者目前最有效的非药物治疗措施。研究发现肺康复能提高慢阻肺患者股四头肌力量和运动能力,降低股四头肌中myostatin的表达。而且,阻力训练不仅能降低骨骼肌myostatin表达还能上调myogenin/MyoD比例,安全有效地抵消慢阻肺急性加重期的骨骼肌功能障碍。
近年的研究证实骨源性因子确实在慢阻肺肌骨交互中发挥作用。我们以往的研究发现慢阻肺患者外周血RANKL/OPG失衡及系统性炎症与BMD相关;此外,在IL-17A基因敲除小鼠中,慢性CS暴露诱导的BMD减低得到改善,RANKL表达下调,表明在该模型中IL-17通过诱导RANKL促进骨质吸收。我们最近发表的一项研究发现,慢性CS暴露能诱导小鼠骨骼肌萎缩和肌力减退,伴RANKL及其受体RANK表达上调,给予RANKL抗体干预可改善骨骼肌功能障碍,同时减低myostatin和MuFR1/Atrogin1表达;在体外实验中,CS提取物可诱导骨骼肌细胞RANKL/RANK上调,阻断RANKL能下调骨骼肌myostatin表达。这表明RANKL/RANK通路在慢性CS暴露诱导的骨骼肌萎缩中发挥关键作用。
基于目前已有的研究证据,我们提出慢阻肺中肌骨交互机制及其在合并骨骼肌异常和骨质疏松中的作用,见图1。
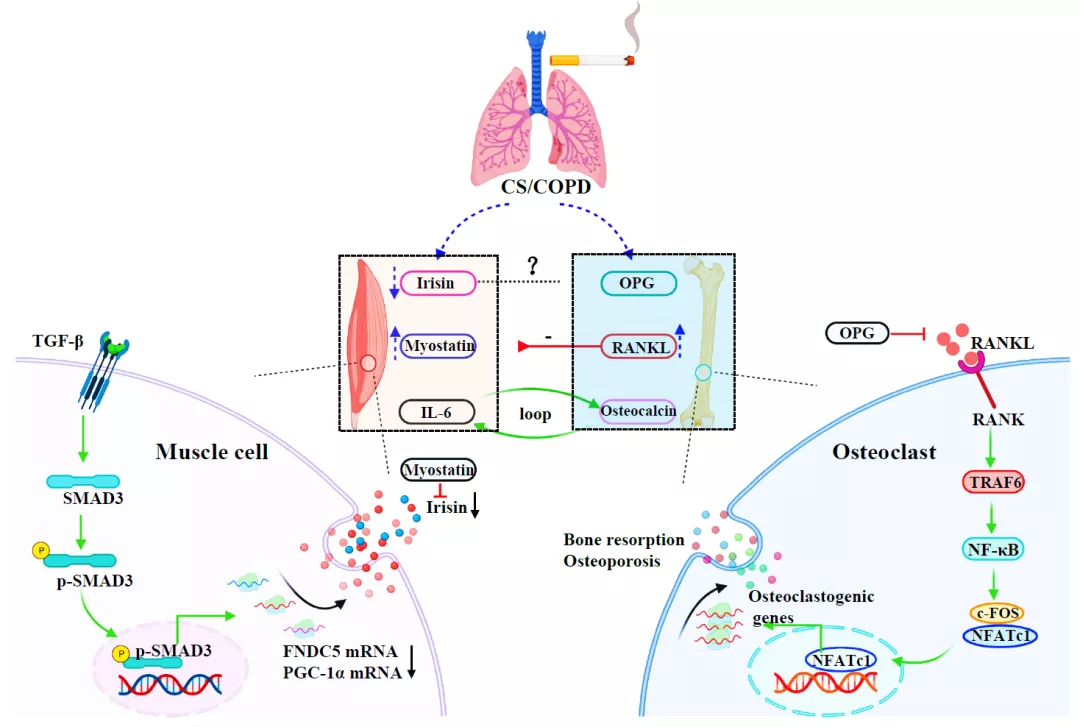
图1.慢阻肺中肌骨交互作用模式图
注:CS=烟草烟雾;COPD=慢性阻塞性肺疾病;Irisin=鸢尾素;Myostatin=肌生成抑制蛋白;IL-6=白介素-6;OPG=骨保护素;RANKL=核因子-κB受体活化因子配体;Osteocalcin=骨钙素;muscle cell=肌肉细胞;TGF-β=转化生长因子-β;SMAD3=SMAD同源物3蛋白;p-SAMD3=磷酸化SMAD同源物3蛋白;FNDC5=包含III型纤连蛋白结构域蛋白5;PGC-1α=过氧化物酶体增殖物激活受体γ共激活因子1α;osteoclast=破骨细胞;TRAF6=肿瘤坏死因子受体联合因子6;NF-κB=核因子-κB;NFATc1=活化T细胞核因子1蛋白;osteoclastogenic genes=破骨细胞基因;bone resorption/osteoporosis=骨吸收/骨质疏松;中间部分为慢阻肺患者或烟草烟雾诱导慢阻肺小鼠模型中的细胞因子变化:Irisin降低,Myostatin和RANKL升高;RANKL对慢阻肺小鼠模型的肌肉量和功能起负调控作用。运动过程中,IL-6和osteocalcin之间存在反馈环。左下部分为骨骼肌细胞中Irisin已知的上游调控环节;右下部分为破骨细胞中RANKL/RANK/OPG已知的信号通路。
部分参考文献 (可上下滑动浏览)
1. Zhang L, Sun Y. Muscle-bone crosstalk in chronic obstructive pulmonary disease. Front Endocrinol,2021,12,724911
2.Xiong J, Tian J, Zhou L, et al. Interleukin-17A deficiency attenuated emphysema and bone loss in mice exposed to cigarette smoke. Int J Chron Obstruct Pulmon Dis, 2020, 15(301-10.10.2147/copd.s235384.
3. Xiong J, Le Y, Rao Y, et al. RANKL mediates muscle atrophy and dysfunction in a cigarette smoke-induced model of COPD [J]. Am J Respir Cell Mol Biol, 2021, 10.1165/rcmb.2020-0449OC.
作者:孙永昌 - 北京大学第三医院呼吸与危重症医学科


