摘要
患者男,25岁,因「胸痛9 d,加重1 d」入院,胸部影像学提示双肺多发以上肺为主的磨玻璃结节,数天内影像学变化快,原磨玻璃影渐变实,且病灶范围增多。以「双肺多发磨玻璃结节、类结节影」作为鉴别切入点,完善病原学检查、气管镜、经皮肺穿刺活检、胸腔镜下肺活检等,最终病理证实为结节病。使用糖皮质激素治疗2个月后病灶明显吸收。
患者男,25岁,9年前从事「厨师」职业,近5年从事IT行业。因「胸痛9 d,加重1 d」于2020年10月9日入院。患者入院前9 d无明显诱因出现胸痛、呼吸困难,胸痛位于双侧肋部,呈撕裂样,尚可忍受,无放射至他处,与呼吸活动无关,持续约数分钟至数小时,在当地医院查血常规、C反应蛋白(CRP)、凝血全套、降钙素原(PCT)、cTnI、B型钠尿肽(BNP)阴性;胸部CT(图1)回报双肺感染性病变;给予「莫西沙星」(2020年10月1—6日)抗感染,病情无改善,复查胸部CT(图2)可见双肺病变较前进展。1 d前无明显诱因上述症状加重。既往史:2个月前因「阵发性室上性心动过速」就诊外院行「经导管心脏射频消融术+术中心脏电生理检查」,术中见旁道邻近希氏束,暂缓消融术。术后出现右侧腹股沟疼痛,诊断「右侧股动脉假性动脉瘤」,于外院行「超声引导下假性动脉瘤凝血酶注射术」,术后规律口服「阿司匹林肠溶片」(0.1 g,1次/d)抗凝至入院时。个人史:吸烟5年,平均20支/d,戒烟9 d;机会性饮酒史。否认粉尘及特殊毒物接触史,否认静脉药瘾史,否认过敏史。
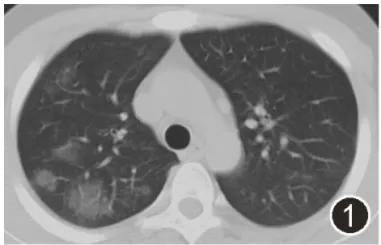
图1:2020年10月1日胸部CT平扫示双肺多发类磨玻璃结节样密度增高影,纵隔小淋巴结增大
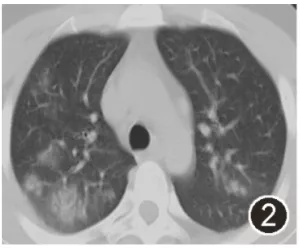
图2:2020年10月5日胸部CT平扫肺窗示双肺可见多发斑片状密度增高影,病灶较前增多、病灶密度较前增高
入院体检:体温36.8 ℃,脉率73次/min,呼吸频率18次/min,血压 117/78 mmHg(1 mmHg=0.133 kPa),SPO2 99%(FiO2 21%),意识清楚,双肺呼吸音稍低,双侧肺未闻及明显干、湿性啰音。心腹均无明显异常。无杵状指。
实验室检查:血白细胞为6.6×109/L,中性粒细胞为0.64,血红蛋白为140 g/L,血小板为269×109/L;CRP为8.64 mg/L↑;PCT、ESR均正常;真菌感染检测:真菌D-葡聚糖检测(G试验)105.5 ng/L↑(正常参考值<100 ng/L);尿常规:蛋白微量,红细胞阴性;生化全套、DIC+凝血全套、NT-proBNP、cTnI、抗核抗体、抗双链DNA抗体、抗可提取核抗原抗体、抗中性粒细胞胞质抗体(ANCA)、呼吸道病毒感染原抗体检测、隐球菌荚膜抗原、粪便常规+潜血均正常;肿瘤标志物:癌胚抗原、NSE、CYFRA21-1、SCC均正常。72 h PPD阴性。心电图示窦性心律,左心室综合高电压。心脏彩色多普勒超声示心脏结构和功能未见明显异常。胸部CT平扫+增强(图3,4):(1)双肺多发斑片状、片状密度增浓影及磨玻璃影,以上肺为著,首先考虑为感染性病变,特殊感染(真菌)可能;(2)纵隔内及双侧肺门多发小及肿大淋巴结,考虑炎性反应性淋巴结可能。支气管镜下各叶段支气管黏膜未见明显异常,BALF细菌真菌涂片、培养、抗酸染色、分枝杆菌培养、结核分枝杆菌及利福平耐药快速检测(x-pert)均阴性,BALF(右上叶后段)细胞分类:中性分叶核粒细胞31%,淋巴细胞22%,嗜酸粒细胞4%,嗜碱性粒细胞2%,巨噬细胞41%,可见吞噬含铁血黄素。
给予「红霉素(0.25 g,2次/d)」口服1个月,复查胸部CT:病灶较10月份大致相仿(图5)。行CT引导下右上肺病灶穿刺活检术病理示:实变,其内见上皮样细胞肉芽肿,及多核巨细胞,未见坏死,符合肺肉芽肿性疾病,需结合临床进一步鉴别感染或非感染性。特殊染色结果:PAM(-)、PAS(-)、抗酸染色(-)。分子检测:未检测到结核分枝杆菌复合群核酸。
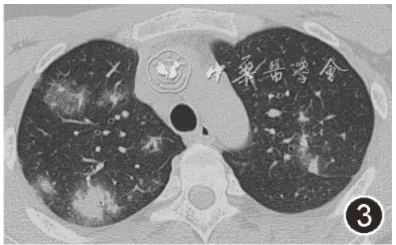
图3:2020年10月12日胸部CT平扫肺窗示双肺多发斑片状、片状密度增浓影及磨玻璃影,以上肺为著,较前增多、变实
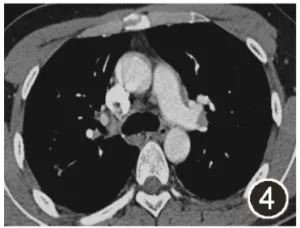
图4:2020年10月12日胸部CT增强扫描纵隔窗示纵隔内及双侧肺门多发小及肿大淋巴结
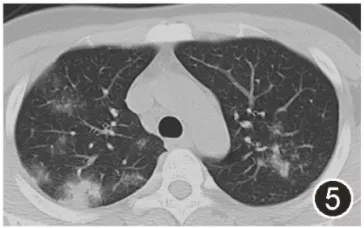
图5:2020年11月12日口服红霉素1个月后复查胸部CT示病灶较10月12日相仿
讨论
李小钦(呼吸与危重症医学科):
(1)青年男性,病程短,主要症状为胸痛,无咳嗽、咳痰、发热;(2)既往体健;(3)胸部CT示初为双上肺为主的磨玻璃结节灶,部分周围见晕征,短时间内病灶局灶变实、变多,伴纵隔及双侧肺门多发小及肿大淋巴结;(4)实验室检查CRP、G试验轻度升高,血常规、PCT、ESR均正常;BALF X-pert阴性,72 h PPD阴性;肿瘤标志物无异常;自身免疫及ANCA阴性,肺穿刺病理提示肺肉芽肿性病变。
本例患者症状无特异性,主要鉴别点在于影像学双上肺磨玻璃结节的肺肉芽肿性病变。肉芽肿性肺疾病(granulomatous lung disease,GLD)的临床症状、影像学表现无特异性,有时病理学也难做出明确诊断,因此临床上对于GLD的诊断及鉴别诊断很困难。临床上能引起GLD的病因很多,包括:
(1)感染性疾病: 结核或非结核分枝杆菌(nontuberculosis mycobacteria,NTM)、真菌和寄生虫感染:该患者病灶在上肺为主,但无结核中毒症状,ESR正常,结核感染T细胞斑点试验阴性、72 h PPD试验均阴性,BALF分枝杆菌培养、涂片及X-pert阴性,短时间内CT病灶变化快,不符合肺结核特征;NTM为条件致病菌,有基础性疾病或免疫功能低下时易发病,该病引起的多发性肺结节相对罕见 [1] ,BALF分枝杆菌培养阴性,NTM证据不足;患者血G试验轻度升高,但年轻男性,无免疫抑制基础,无感染症状,未前往相关地方病流行区,血隐球菌荚膜抗原试验阴性,BALF真菌培养阴性,进一步查BALF半乳甘聚糖(GM)阴性,送曲霉抗体IgG阴性,无组织胞浆菌、芽生菌、球孢子菌、隐球菌、曲霉感染证据;最易引起肺部疾病的寄生虫包括原生动物(阿米巴病)、线虫(蛔虫和类圆线虫属)、绦虫及吸虫(血吸虫和肺吸虫):典型影像学多位于肺中下叶的多发结节或空洞,CT还可能显示临近结节或实变区域的线状阴影,即「隧道」征,患者近期否认生食食物史,外周血嗜酸粒细胞正常,病变主要位于上肺,不支持该病。
(2)外源性过敏性肺泡炎:该患者虽未追溯到过敏原,但该患者病灶以中上肺磨玻璃、类结节样病灶为主,仍需考虑该病,在我国,在不明原因的间质性肺炎中,通过外科肺活检的方式,有24.4%(33/135)的患者确诊为外源性过敏性肺泡炎,位居各种病因首位 [1],过敏源很难追溯,需病理进一步明确。
(3)无机粉尘或异物沉积:无相关职业及接触史。
(4)血管炎性肉芽肿病:患者为年轻男性,双上肺磨玻璃结节为主,病程中曾咯血,尿蛋白微量,需警惕该病,但无合并哮喘,无皮肤、心脏、神经系统损害的临床证据,血ANCA阴性,不支持变应性血管炎性肉芽肿病,但仍需病理进一步排除肉芽肿性多血管炎、嗜酸性肉芽肿性多血管炎、淋巴瘤样肉芽肿病及坏死性结节性肉芽肿病。
(5)结缔组织疾病如类风湿结节:无证据支持。
(6)其他原因不明的肉芽肿:如朗格汉斯组织细胞增生症(pulmonary langenhans cell histiocytosis,PLCH)、肺结节病。二者均为中上肺为主的肉芽肿性病变,需进一步鉴别。
(7)遗传性疾病:患者无反复感染,且皮肤、肝脏等部位未发现肉芽肿样病灶,遗传因素及免疫缺陷导致的肺肉芽肿性病变可能性小。
(8)恶性肿瘤:如淋巴瘤、肺癌,有时病理也可以出现肉芽肿性病变,患者短期内影像性质变化快,与恶性肿瘤不符。
(9)药物相关的肉芽肿性疾病:如正在进行干扰素、检查点抑制剂、抗肿瘤坏死因子等治疗:无相关病史,可排除。建议患者进一步行大标本组织活检。
姚秀娟(呼吸与危重症医学科):
肺多发磨玻璃结节(glound-glass nodules,GGNs)是指肺内多发的淡薄的稍高密度影,不掩盖血管和支气管。可发生在炎症的早期阶段、肺出血、肺水肿和小气道相关疾病。(1)炎症早期:患者无发热、咳痰、咳痰,血象、PCT阴性,感染性病变可能性小。(2)肺泡出血:如肺结核、支气管扩张、肺癌、肺挫裂伤、血管畸形、肺肾综合征、流行性出血热等。无外伤病史,肾功能正常,胸部CT未见支气管扩张征象,可排除肺挫裂伤、肝肾综合征及支气管扩张;病理提示肉芽肿性病变,可排除血管畸形、流行性出血热、肺癌。患者入院前2个月开始口服「阿司匹林肠溶片」,2016年Otoshi等 [2]报道抗血小板药物引起的肺泡出血,回顾39例抗血小板药物引起的出血中,25例(64%)口服拜阿司匹林抗血小板,且胸部CT表现为磨玻璃结节为主,但与病理不符。(3)小气道相关疾病:呼吸性细支气管炎(respiratory bronchiolitis,RB)、过敏性肺炎(hypersensitivity pneumonitis,HP)和PLCH等,也可见于结节病、同期多原发肺癌、感染性疾病和粟粒性转移瘤等。RB是吸烟相关性疾病,上肺多见,但通常发生在重度吸烟者(吸烟量≥30包年),影像主要表现多发性小叶中心性微小结节、磨玻璃结节,直径<5 mm,患者烟龄及结节直径与该病不符,BALF未检出色素沉积巨噬细胞,该病可能性小;PLCH多表现不规则囊腔(71%~100%)和磨玻璃结节(60%~82%),主要分布在中上肺 [3],可仅表现为肺内多发磨玻璃小结节,但因该病主要累及终末呼吸性细支气管,因此以小叶中心型微小结节多见,患者病灶大小及结节分布与之不符,且未见不规则囊腔,该病可能性小;纤维化性HP和非纤维化性HP均可表现为中上肺野为主的小叶中心性磨玻璃样或结节样不透光区(<5 mm)伴空气潴留征,患者中上肺为主的磨玻璃结节,BALF提示淋巴细胞比例增高,但非小结节病灶,无空气潴留征,需进一步病理协助诊断;患者双中上肺野分布为主的肺实变渗出影,BALF细胞分类提示混合细胞型,但结节非沿淋巴管周围分布,纵隔及肺门淋巴结肿大不明显,且病灶性质变化快,与结节病多为亚急性或慢性过程不符,需进一步病理明确。
李解珍(病理科):
该患者肺活检标本显微镜示:病变主要由上皮样组织细胞及多核巨细胞形成的肉芽肿性结节,结节大小不一,部分区域可见融合,未见干酪样坏死,结节外周境界清楚,由纤维组织包绕,伴少量慢性炎症细胞(主要为淋巴细胞)浸润。高倍镜下结节内组织细胞呈短梭形、上皮样,细胞边界不清,呈合体样,核呈圆形、卵圆形,染色质细腻。病变主要位于肺间质,部分区域伴有肺实质的破坏,在肺泡腔内融合。与常见形态不同,多表现为胞质较宽,边界不清、合体状,细胞核长圆形的上皮样细胞,及多核巨细胞。进一步行特殊染色(特染)PAM(-)、PAS(-)、抗酸染色(-)。分子检测:未检测到结核分枝杆菌复合群核酸。肉芽肿性肺疾病的病理诊断,需结合病变的分布特点、肉芽肿形态及伴随病变三方面考虑 [4]。不同肉芽肿疾病在肺组织内的分布不同,如外科切除标本在低倍镜下观察,可发现肉芽肿沿气道分布、淋巴道分布或是随机分布。但本例患者为经皮肺穿刺活检的标本,由于组织较小,病理难以评价肉芽肿的分布特征。另外,该例肉芽肿无明显伴随病变,如坏死、炎症细胞浸润、纤维组织增生、包涵体、异物等,病理镜下无法进一步诊断及鉴别诊断。针对肉芽肿性病变,我们还可以利用病原学的理化特征行特殊染色,用组织化学方法更好显示病原菌,利于观察。但该例患者组织培养阴性,行病理切片组织化学特染PAM、PAS、抗酸染色均为阴性。若临床怀疑感染性病变,可行组织切片PCR及宏基因测序等分子生物学方法检测病原菌,提高诊断率。建议该患者进一步活检行病理检查。
陈正伟(呼吸与危重症医学科):
由于经皮肺穿刺属于小标本,很难观察本例患者肉芽肿分布特点,目前性质仍不明确。考虑主要病变在于肺内,建议胸腔镜下肺活检。右上肺手术活检病理:肺组织内见上皮样细胞肉芽肿结节,伴小灶纤维素性坏死及钙化小体,病变位于肺间质,部分结节融合伴纤维细胞增生,考虑为结节病(图6,7)。最终诊断为结节病(Sarcoidosis)。
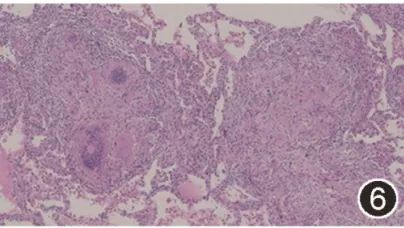
图6:2020年12月29日口服激素前胸部CT平扫示肺实变范围进一步增多
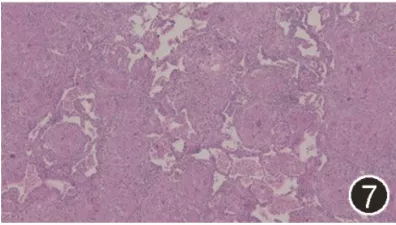
图7:2021年3月5日口服激素2个月后胸部CT平扫可见肺部实变明显减少,部分磨玻璃结节吸收
肖桂卿(放射科):
典型的结节病胸部CT的肺窗主要表现为增粗的中轴血管束,可见多发、弥漫性的小结节,小结节多沿淋巴管周围分布的、直径 2~5 mm、边界清晰或模糊。约 80%~100%的肺结节病患者胸部HRCT可见上中肺野分布为主的肺内小结节,部分患者可表现为肺内实变、「星云征」「反晕征」、空洞、广泛的磨玻璃影、大小不一的实性结节及上肺纤维化。不典型的胸部影像学表现占25%~30% [5],表现为小叶间隔增厚引起的网格影、孤立性空洞影、单纯的磨玻璃影、马赛克征(累及气道)、累及胸膜的患者可出现胸腔积液、气胸及胸膜局灶性增厚等表现。其中,磨玻璃病灶是肺泡不完全充盈、肺泡壁增厚或间隔间质或两者兼而有之。广泛的镜下肉芽肿也会形成磨玻璃影,但结节病中的磨玻璃病灶通常是弥漫性或片状的边界不明确的,并与间质结节有关,而像该患者的胸部CT特点,具有类圆形的和相对明确界限的磨玻璃结节是罕见的 [6]。
姚秀娟:
结节病是一种影响多器官的炎症性疾病,起源不明,与非干酪性肉芽肿-上皮样细胞和淋巴细胞性肺泡炎有关,确诊结节病后,需全面评价结节病患者的病情,明确结节病患者的受累范围、受累脏器的病情程度等,全面评估疾病是否活动及严重程度 [7]。因3个月前出现心律失常,复查动态心电图示窦性心律,房早10个,有7个单发房早和1次阵发性房速。心脏磁共振:二尖瓣、三尖瓣及主动脉瓣轻度反流。肝肾彩超未见明显异常。因患者明显胸痛,多次复查胸部CT提示肺部阴影持续进展(图8),因此,需要系统性激素治疗 [6],初始给予0.5 mg·kg-1·d-1泼尼松龙口服,辅以补钙治疗。
谢宝松(呼吸与危重症医学科):
出院后患者口服泼尼松龙40 mg/d,渐减量。1个月后随访,胸痛好转,胸部CT平扫示肺部实变有所吸收。2个月后随访胸部CT示肺部实变明显吸收,部分磨玻璃结节亦吸收(图8)。
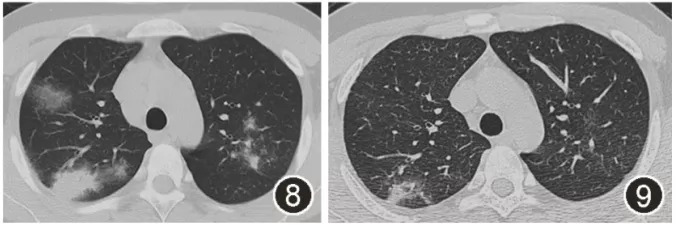
图8,9:右上肺活检组织HE染色可见小灶性坏死(图8,低倍放大),及上皮样细胞肉芽肿结节(图9,低倍放大)
回顾本病例的特点,青年男性患者因胸痛就诊,期间曾出现咯血,胸部影像学初为双中上肺为主多发的磨玻璃结节灶,非结节病常见影像学表现,且纵隔及肺门淋巴结增大不明显,胸部影像学性质变化快,数天后部分磨玻璃结节渐变实,病灶部位不断增多,血液学检查未见明显异常,经皮肺穿刺提示肉芽肿性病变。以肉芽肿性病变为切入点进行鉴别诊断,因患者年轻男性,病程中曾有咯血,BALF见含铁血黄素,病灶以磨玻璃结节为主的肉芽肿,未见典型结节病影像学表现,曾一度考虑「肺出血」。经过外科胸腔镜下肺活检确诊为肺结节病,从该病例吸取了不少经验和教训。结节病是一种病因不明的特发性系统性肉芽肿病,以非干酪样坏死性上皮样细胞性肉芽肿的组织学为特征。该病诊断是基于正确的临床-放射学评估和非干酪样坏死性上皮样细胞性肉芽肿的组织学证明。典型影像学改变为双侧对称性的肺门或纵隔淋巴结肿大,伴或不伴肺内病灶。虽然结节病的诊断通常需要组织病理,但在可疑的结节病患者中,确定肺是否受累时,胸部高分辨率CT(HRCT)起了重要的作用,比胸部X线具有更高的敏感性和特异性 [8]。但非典型的HRCT表现对临床医生和放射医师都是一个很大的挑战,结节病在HRCT成像上可以模拟不同的肺疾病,被认为是「伟大的模仿者」 [9]。这种影像学的多变性提醒临床医师在像该患者的磨玻璃结节样病灶的鉴别诊断中需考虑到结节病可能。
参考文献(略)
作者:李小钦 姚秀娟 陈正伟 李解珍 肖桂卿 陈愉生 谢宝松
单位:福建省立医院呼吸与危重症医学科 福建医科大学省立临床医学院
引用本文: 李小钦, 姚秀娟, 陈正伟, 等. 胸痛伴双肺多发磨玻璃影 [J] . 中华结核和呼吸杂志, 2021, 44(12) : 1131-1134. DOI: 10.3760/cma.j.cn1112147-20210325-00196.
本文转载自订阅号「中华结核和呼吸杂志」(ID:cmjlung)


