
引言
慢性阻塞性肺疾病(慢阻肺)与肺癌是呼吸系统危害严重的两大疾病,均位列全球五大呼吸疾病。其中慢阻肺是世界上第四大死亡原因,而肺癌是最常见的癌症死亡瘤种[1]。在我国,肺癌的年龄标化后发生率约(ASIR)为36.71/10万人,年龄标化后死亡率(ASMR)为28.49/10万人,且发生率呈上升趋势[2]。而肺癌与慢阻肺有着密切的联系,如均有吸烟作为风险因素,了解两者的联系对临床诊疗和管理将大有裨益。
慢阻肺与肺癌的发病息息相关
相比存在其他肺部疾病的吸烟者,患有慢阻肺的吸烟者罹患肺癌的风险高达5倍[3]。无论在吸烟还是不吸烟的人群中中,慢阻肺都是肺癌最重要的风险因素。肺部炎症以及肺基质重构可能是肺癌发生的重要前兆。

吸烟、慢阻肺和肺癌之间的联系
慢阻肺与肺癌之间的联系可以说是千丝万缕,从病因上而言,两者都是发生于老化肺部的疾病。此外,两者都可由氧化应激引起,每口香烟中含有大约10^15的自由基,包括活性氮和活性氧(RNOS),氧化应激可通过损伤DNA引起肿瘤增殖,也可引起炎症造成慢阻肺。此外,慢阻肺与肺癌在端粒缩短、遗传易感性和表观遗传学等方面享有多个交叉的病理因素[4]。
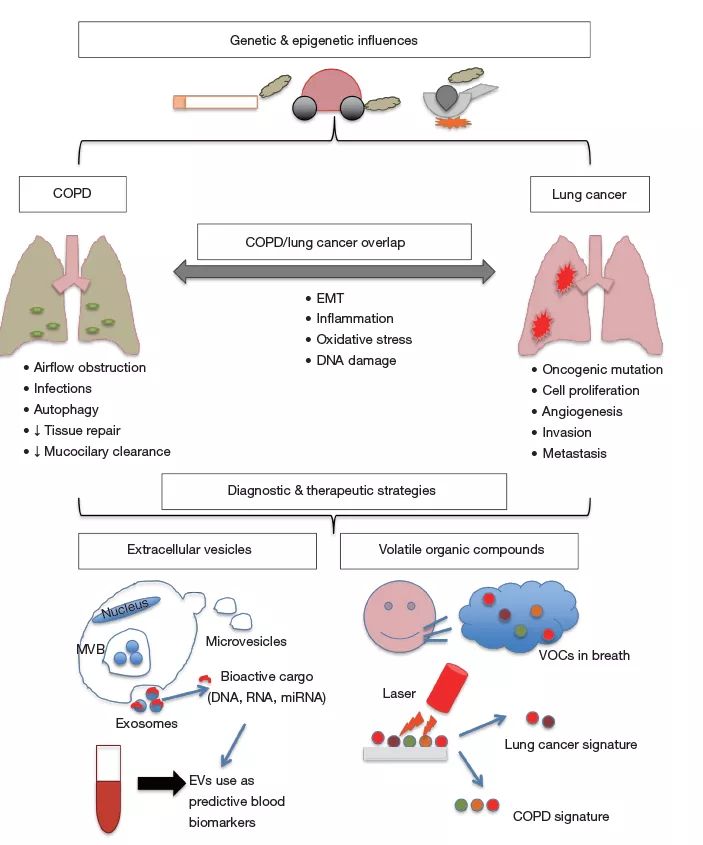
导致肺癌和慢阻肺的遗传及表观遗传因素
此外,肺癌与慢阻肺还有这共同的遗传易感性,这一重合不仅仅表现在烟草诱发的病理进程上。全基因组关联分析(GWAS)通过对肺功能和肺癌进行研究,发现多个共有的位点,说明一些决定慢阻肺易感性的位点对于吸烟者的肺癌易感性也很重要。上皮间质转化 (EMT) 是 慢阻肺 和肺癌以及炎症的致病特征,VEGFR1中的rs7326277TT基因型促进这些过程以及肿瘤生长,是这两种疾病的易感位点[5] 。
与肺功能正常的吸烟者相比,存在轻中度慢阻肺可是10 年内发生肺癌的几率增加3倍,重度慢阻肺者这一几率可上升至10倍。这其中与慢阻肺疾病的炎症环境也有关系。慢阻肺的炎症环境可引起慢性有丝分裂,加重内源性DNA损伤转化为突变的可能。气道阻塞所引起的慢性炎症对肺癌可能有重要作用,也可能是场效应现象的重要组成部分。慢阻肺中存在气道的慢性炎症,尤其在小气道中,表现为巨噬细胞、CD4+和CD8+ T细胞、树突细胞和中性粒细胞的聚集。有人认为下气道的慢性炎症可诱发癌变,这些微环境中的炎症介质加强细支气管肺干细胞,诱导促肿瘤突变、增殖、抵抗细胞凋亡、血管生成、侵袭、转移和免疫抑制因子分泌[6] 。
慢阻肺可影响肺癌的病情
除了在发病过程中的密切关系,慢阻肺也影响这肺癌的病情。根据一项纳入了105304例肺癌患者的研究显示, 慢阻肺的存在属与生存更差呈独立相关(HR1 .20,95% CI 1.19-1.22) [7] 。在另一项纳入了902例IA-IB期NSCLC患者的回顾性研究中,伴有慢阻肺的患者5年总生存(OS)为54.4%,显著低于不伴有慢阻肺的患者的69.0%(p=0.0002)。伴有慢阻肺患者的5年PFS分别为50.1%和60.6%(p=0.007)[8]。

伴和不伴慢阻肺肺癌患者OS的KM曲线
此外,慢阻肺的严重程度也会影响肺癌的发生,一项针对5402例慢阻肺患者历时22年的随访显示,中重度慢阻肺的存在会使得患者肺癌发生的风险上升至2.8倍(95% CI,1.8-4.4)[9]。
慢阻肺对肺癌的治疗产生影响
慢阻肺的存在同样也影响肺癌的管理,一般来说,在术前有必要通过FEV1及弥散功能(DLco)对肺功能进行评估。近年来的指南推荐如果术前预测术后(PPO)FEV1和/或PPO DLco<30% pred.,则需要进行心肺锻炼测试以计算手术风险,这使得有严重慢阻肺(术前FEV1<50% pred.)的患者被认定为高风险组,在许多情况下这是手术的禁忌症[10]。
我国一项真实世界研究则对比了接受和未接受慢阻肺规律治疗肺癌患者的临床结局,结果显示,两组之间尽管客观缓解率(ORR)和疾病控制率(DCR)无显著差异,而接受规律慢阻肺治疗的患者PFS显著长于未接受治疗的患者(6.0 vs. 3.5个月,p<0.05),OS也同样获得显著延长(18.0 vs 15.0个月,p<0.05)。提示合并慢阻肺的NSCLC患者对慢阻肺进行规范管理可延长OS及PFS[11] 。
而在预防手段上,吸入糖皮质激素(ICS)或许是一个有效的手段。2021年最新发表的一篇meta分析检索了1974年到2020年间针对ICS使用和肺癌风险相关性的研究,最终纳入10项研究234920例患者。经分析后显示,ICS使用可降低慢阻肺患者肺癌发生的风险(8项研究,1806例患者,RR=0.73,95% CI:0.61–0.87, P<0.01; I^2 = 60.0 %),此外,ICS使用还可降低哮喘患者(RR=0.44,95% CI:0.34–0.57, P<0.01)和同时存在慢阻肺和哮喘患者的肺癌发生风险(RR=0.79,95% CI:0.69–0.90, P<0.01) [12] 。
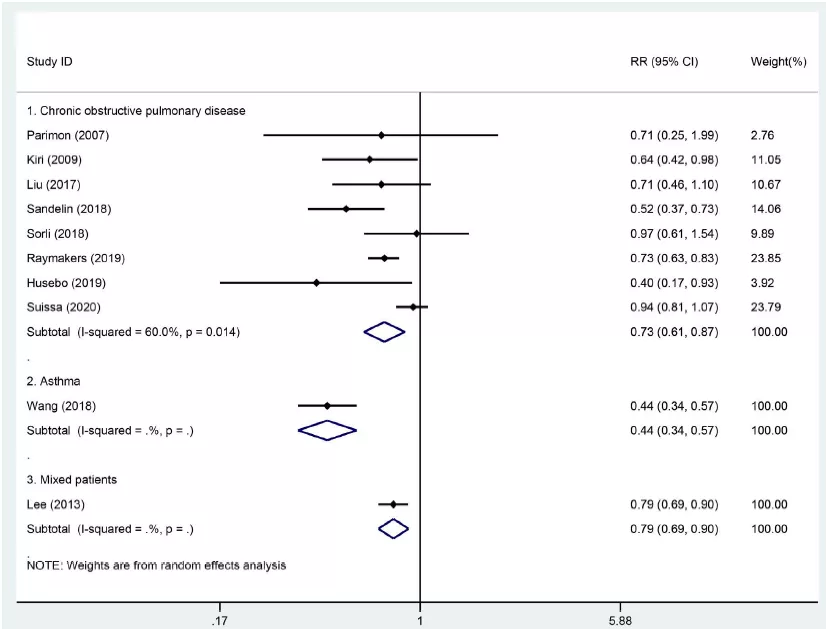
ICS使用与肺癌发生风险相关性森林图
慢阻肺患者中肺癌的筛查和早诊
尽管慢阻肺与肺癌在发病机制、预后、预防和治疗上有着千丝万缕的联系,事实上,我国肺癌患者中慢阻肺的诊断和治疗面临着严重不足。一项回顾性分析对703例肺癌患者进行了全套肺功能呢的测定,其中术前约92.5%的患者复合慢阻肺诊断,手术患者约92.7%的患者复合慢阻肺诊断。与其相对的是,住院前仅有3例(4.3‰)诊断为慢阻肺并据此规范治疗,出院时仅有5例(7‰)诊断为慢阻肺。提示了临床实践中,肺癌患者的慢阻肺远未获得足够重视[13]。
目前国际上已发展出在慢阻肺患者中应进行筛查肺癌高风险患者的工具。根据回归分析,年龄>60岁、BMI<25kg/㎡,包-年历史>60以及DLco<60%与肺癌确诊独立相关。慢阻肺-LUCSS-DLCO可用于对慢阻肺患者的肺癌风险进行评估:低风险(0-3分)和高风险(3.5-8分)。高风险患者死于肺癌的风险较低风险患者增加2.4倍(95% CI,2.0-2.7)[14] 。
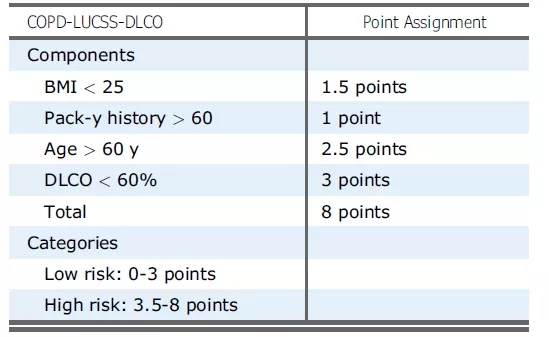
慢阻肺-LUCSS-DLCO风险分级
结尾
因此,对于慢阻肺患者来说,肺癌的风险需引起重视,不仅仅是因为两者存在多项重合的致病因素,慢阻肺的病情对于肺癌患者的诊断、预防、治疗和预后都有着重要的作用。规范治疗慢阻肺,采用大剂量ICS等手段,已被证实可减少肺癌发生的风险。
参考文献
1. Ferkol T, et al. The Global Burden of Respiratory Disease. Ann Am Thorac Soc. 2014; 11(3): 404–406
2. Cao M, et al. Epidemiology of lung cancer in China. Thorac Cancer. 2019 Jan; 10(1): 3–7.
3. Young RP, et al. Link between COPD and lung cancer. Respir Med. 2010;104(5):758–759.
4. Durham AL, et al. The relationship between COPD and lung cancer. Lung Cancer. 2015 Nov; 90(2): 121–127.
5. Parris BA, et al. Chronic obstructive pulmonary disease (COPD) and lung cancer: common pathways for pathogenesis. J Thorac Dis. 2019 Oct; 11(Suppl 17): S2155–S2172.
6. Sekine Y, et al. Early detection of COPD is important for lung cancer surveillance. Eur Respir J 2012; 39: 1230–1240
7. Goffin JR, et al. Management and outcomes of patients with chronic obstructive lung disease and lung cancer in a public healthcare system. PLoS ONE. 2021; 16(5): e0251886.
8. Zhai R, et al. The impact of coexisting COPD on survival of patients with early-stage non-small cell lung cancer undergoing surgical resection. Chest J 2014; 145: 346–353.
9. Mannino DM, et al. Low lung function and incident lung cancer in the United States: data From the First National Health and Nutrition Examination Survey follow-up. Arch Intern Med 2003; 163: 1475–1480
10. Spyratos D, et al. Chronic obstructive pulmonary disease in patients with lung cancer: prevalence, impact and management challengesLung Cancer: Targets and Therapy 2017:8 101–107
11. 王飞等. 基于真实世界数据对晚期非小细胞肺癌合并慢性阻塞性肺疾病患者治疗模式的探讨. 中华结核和呼吸杂志. 2020;43(5):450-454
12. Lin P, et al. Inhaled corticosteroids and risk of lung cancer: A systematic review and meta-analysis. Eur J Clin Invest. 2021 Feb;51(2):e13434.
13. 张荣葆等. 胸外科住院肺癌合并慢性阻塞性肺疾病的调查结果分析. 中国肺癌杂志. 2017;20(3):163-166
14. de-Torres JP, et al. Lung Cancer in Patients with Chronic Obstructive Pulmonary Disease Development and Validation of the COPD Lung Cancer Screening Score. Am J Respir Crit Care Med. 2015;191(3): pp 285–291
本文完
排版:Jerry


