病史简介
男性,66岁,职业:保安,退休。因「面部浮肿及双手指胀痛2月余,伴活动后气短加重1周」就诊。患者2月前自觉眼睛和面部浮肿,检查尿,肾功能及心脏均正常。后症状持续并出现手指肿胀,严重时不能弯曲和握手,先后骨科就诊按关节炎治疗,症状无好转。近1周来出现活动时气短、乏力,伴有双手关节痛肿胀明显加重。无发热和咯血,无明显肌痛,无口干、眼干。遂至门诊行胸部 CT 提示双肺磨玻璃改变,给予口服抗生素、抗病毒治疗后活动后气短仍旧,遂收治入院。既往体健,无烟酒嗜好。
体格检查
自然状态下氧饱和度(SpO2:90%),面部肤色暗红,双下肺可闻及Velcro 啰音,心脏、腹部体检未见异常,双下肢不肿。双上肢手指水肿,指关节压痛,四肢肌力Ⅴ级,肌张力正常,无杵状指。
实验室检查
血沉正常,血常规正常,肌酸激酶:1197u/l,免疫球蛋白E 250.00 IU/mL,肿瘤标志物:癌胚抗原 5.54 ng/mL 偏高,糖类抗原(15-3)48.90 U/mL 偏高,糖类抗原(125) 42.40 U/mL 偏高,总前列腺特异抗原 4.820 ng/mL 偏高,细胞角蛋白19片段 21.40 ng/mL 偏高,神经元特异性烯醇化酶 44.80 ng/mL 偏高,铁蛋白 560.00 ng/mL 偏高。肌炎抗体谱:ENA-Jo-1 阳性,Ro 52 阳性。其他ENA及抗核抗体谱及RF因子抗CCP均正常。入院后复查胸部 HRCT提示双下肺多发磨玻璃影增多,伴牵拉性支扩改变,病情进展。全身PET显像未见明显FDG代谢异常增高肿瘤性病变;双肺散在斑片状、大片状高密度影,FDG代谢增高;全身肌肉弥漫性放射性摄取轻度增高,两侧膝关节区域FDG代谢增高。考虑结缔组织病变累及双肺(间质性肺炎)、肌肉及关节可能大。此时患者的氧合状况恶化,需要高流量吸氧维持(SaO2 90%–92%, FiO2 60%),结合患者病史体格及实验室检查,初步诊断特发性炎性肌病。
结合肌炎抗体结果,诊断特发性炎性肌病,抗合成酶综合征,ILD,I型呼吸衰竭。
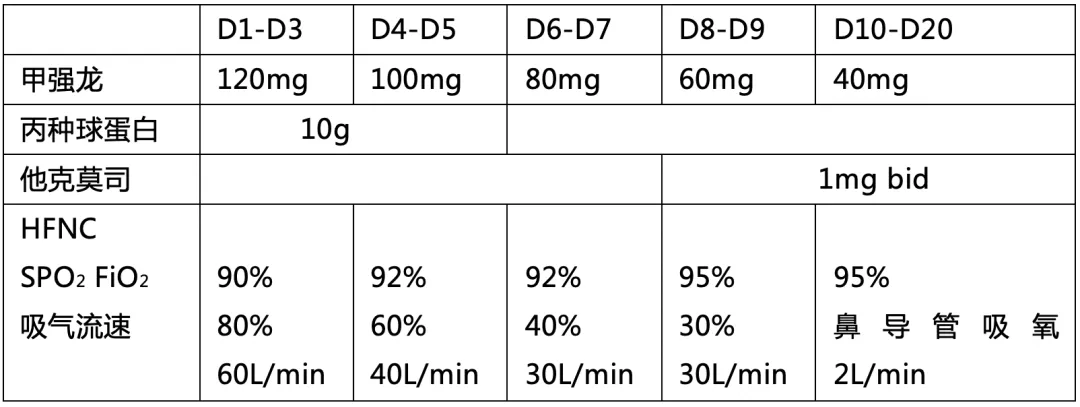
与highflow(FiO2 80%,吸气流速60L/min)立即予以丙种球蛋白10g*5天,甲强龙 120mg qd*3 天,后逐渐减至100mg*2天,80mg*2天,60mg*2天,40mg*10天后口服美卓乐32mg qd。甲强龙减量至60mg qd时加用他克莫司 1mg bid,经过2周治疗,患者氧合情况逐渐好转,可鼻导管(SaO2 95%–96%,2L/min)给氧;面部和眼睑浮肿好转,双手肿胀,和关节痛等症状明显好转,双手可以握拳。复查胸部CT双肺多发磨玻璃影较前吸收,复查肺功能弥散功能也较前好转。但双肺,尤其下肺纤维条索影改变明显。加用吡非尼酮200mg tid,并联合美卓乐32mg qd, 和他克莫司1mg bid维持治疗,每三周减1#美卓乐,2周后复查胸部CT显示双下肺渗出磨玻璃影,纤维条索影较前明显减轻。

(左:治疗前;右:大剂量皮质激素治疗7天后)
治疗前后肺功能比较:
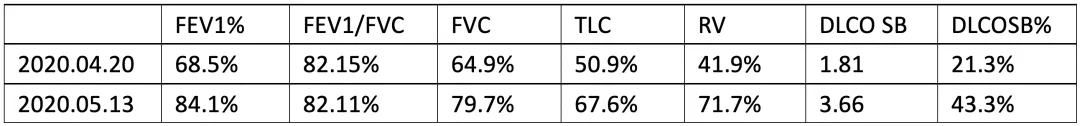
肌炎抗体谱检测结果:

胸部CT的变化:

【图1】入院前胸部CT
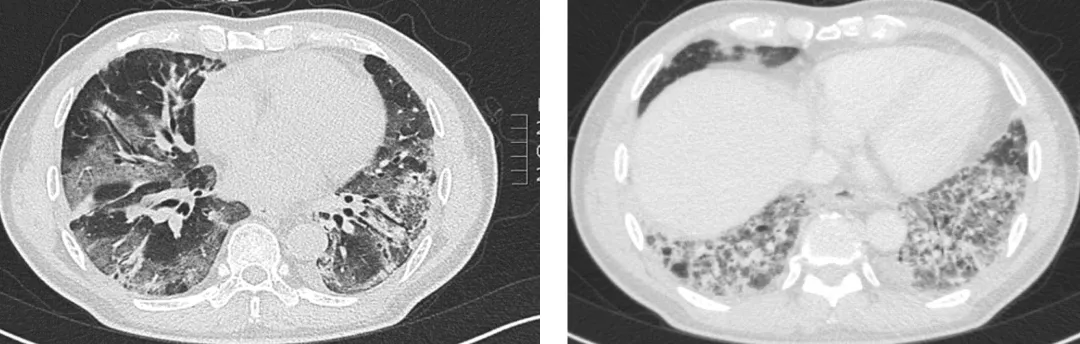
【图2】入院后一周CT。使用40-60mg甲强龙同时,呼吸困难缺氧进行性加重。双肺磨玻璃渗出明显增多,胸膜下及双下肺网格影增多。

【图3】甲强龙120mg-80mg 治疗后7天CT。双肺磨玻璃渗出明显减少,纤维条索影增多。
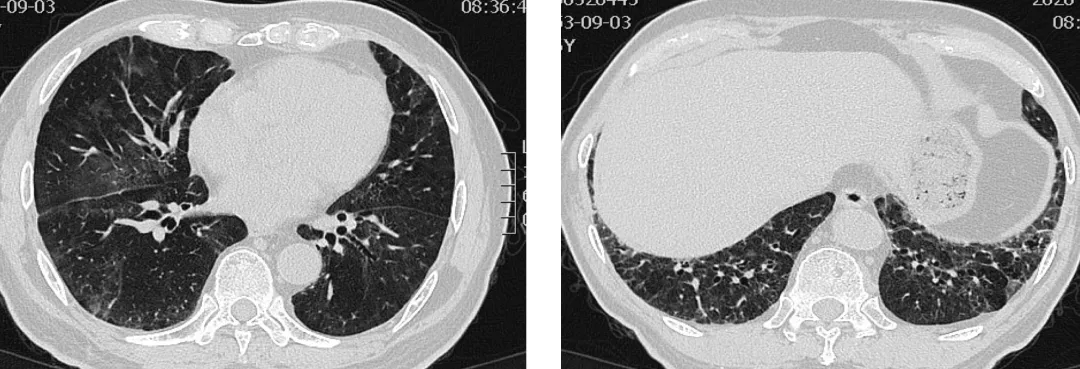
【图4】吡啡尼酮200mg tid+美卓乐32mg qd+他克莫司1mg bid 2周后CT。双肺磨玻璃渗出明显减少,纤维条索影减少小叶间隔增厚明显改善。
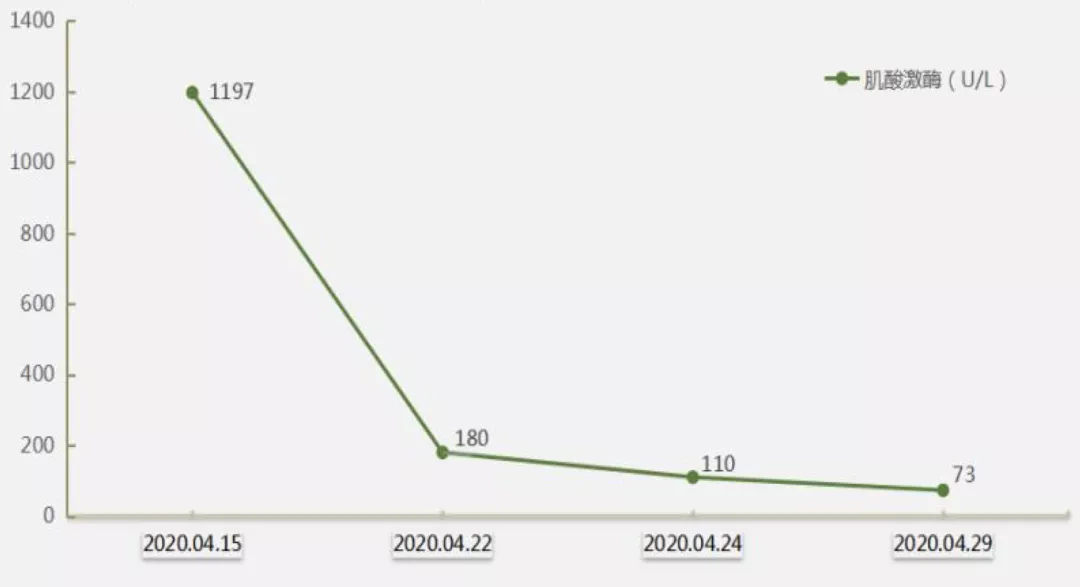
激素联合免疫抑制剂治疗后肌酸激酶的变化:
讨论
1、特发性炎性肌病(Idiopathic inflammatory myopathy, IIMs)诊断及其新分类
IIMs统称为肌炎,是一组异质性的疾病,其共同特征为骨骼肌的慢性炎症所导致肌无力。皮肤,关节,肺,胃肠道和心脏也常被累及并和死亡率相关,其中,IIMs患者ILD 发病率超过50%。目前,IIMs最常被分为多发性肌炎、皮肌炎和包涵体肌炎,虽然多发性肌炎在很大程度上被归入免疫介导型坏死性肌病(IMNM)和抗合成酶综合征等更清晰的亚型,但这种分类由于临床和病理特征常存在重叠有其局限性。
10多年前只有少数肌炎包含相关的自身抗体。新的特异性自身抗原的发现成为此领域的一个重要进展。10年来,IIM疾病谱经历了从疾病的主要特征为肌无力,部分伴皮疹到包括患有复杂,甚至致命的多器官累及的疾病的演变。近年来一类明显的亚型病人出现,其伴有明显或严重甚至致命的ILD。例如,具有抗MDA5自身抗体的IIM患者可能会出现暴发性间质性肺炎,病情危重,死亡率很高。抗合成酶抗体(anti-synthetase antibody,ARS)抗体阳性代表一种被称为抗合成酶综合征(ASS)的表型。由于新的肌炎特异性抗体(MSAs)的发现,在IIM疾病谱中鉴别这些亚型成为可能。MSAs的一个独特方面是同一个患者中极其罕见被检测到多个自身抗体。因此,MSAs是识别肌炎同类亚型的理想生物标记,是诊断和分类IIMs的关键。有文献报道已排除CTD的特发性ILD或特发性间质性肺炎根据自身抗体筛查结果8.5%~11.1%的患者需要更改最终诊断和治疗方案。
现今一些情况下,例如包涵体肌炎,癌症相关性肌炎或他汀类药物相关的肌炎的自身抗体均可识别,而以前却不能发现。相比以前的检测方法,肌炎自身抗体的存在使成人肌炎发病病例增加20%。大约60-70% IIM的患者携带可识别的自身肌炎抗体。这些MSAs的发现对肌炎早期诊断和更个体化的治疗具有相当大的意义。
2、抗合成酶综合征(Anti-synthetase,ASS)
ASS是是IIM中的一种亚型,也是最常见的肌炎相关表型。21种ARSs中的8种自身抗体与ASS有关。最常见的抗ARS抗体是在1980年首次被识别的抗组氨酰转运RNA合成酶(anti- histidyl- tRNA synthetase,抗 Jo- 1)。抗Jo1自身抗体可在多达19%的成年IIM中识别。其余的抗ARS抗体:抗PL7(抗苏氨酸-tRNA合成酶),抗PL12(抗丙氨酰-tRNA合成酶), 抗EJ(抗甘氨酰tRNA合成酶),抗OJ(抗异亮氨酰tRNA合成酶),抗Ha(抗酪氨酰tRNA合成酶),抗KS(抗天冬酰胺基tRNA合成酶)和抗Zo (抗苯丙氨酰-tRNA合成酶)抗体在3.5% IIM患者中发现。
关于ASS的诊断,2011 年Solomon 等提出比较严格的诊断标准,其中规定:必须有抗ARS 抗体的存在,具两条主要标准:(1)不明原因的ILD;(2)符合Bohan与Peter诊断的PM或DM;三条次要标准:(1)关节炎;(2)雷诺现象;(3)技工手。抗ARS 抗体再加上2条主要标准或1条主要+2条次要标准即可诊断ASS。临床中以抗 Jo-1 最多见(约占 ASS 的 68%~87%),不同亚型的ASS可有不同临床特点,雷诺现象主要与抗 PL-7、抗 PL-12 相关;向阳疹、Gottron 征与抗Jo- 1、抗EJ、抗PL- 7及抗PL-12 相关,而肌炎多见于抗 Jo- 1、抗 PL- 7、抗 EJ , 有抗Jo1抗体的人患关节炎的几率更大,而抗PL7,抗KS,抗OJ或抗PL12抗体与更普遍或更严重的ILD相关。
本例患者诊断为IIM-ASS。表现为眼部眶周皮疹,关节炎和技工手,在病程进展中出现肌力明显下降,伴有肌酸激酶升高;快速进展的ILD,同时抗- Ro52 MAA与抗 Jo- 1 ARS 抗体出现。文献报道,抗- Ro52(肌炎相关自身抗体,MAAs)与抗合成酶自身抗体出现时,这些抗合成酶综合征患者比无抗Ro52抗体者有更严重的ILD和较差的预后。尽管抗Ro-52并非肌炎特异性抗体,但其在肌肉和肺部免疫炎症反应中较高的发生率。有文献报道比较53 例抗Ro-52 阴性与36 例抗Ro-52 阳性的抗Jo-1阳性患者,发现后者肌炎更严重,关节受累发生率高,ILD进展,预后较差。
3、治疗体会
该例患者经过积极有效的治疗,关节炎,皮肌炎,尤其ILD全面好转,呼吸衰竭,肺功能及活动耐力明显改善,同时并未伴有肺部感染及其它并发症出现。体会如下。
1)早期筛查CTD相关ILD,并探寻某些抗体与ILD的关联性,这些MSAs的发现对肌炎早期诊断和更个体化的治疗具有相当大的意义。
2)重视CTD相关ILD的充分处理并实施严密监测,尽快实现并维持CTD及ILD病情持续缓解及肺功能好转,这对改善患者的远期预后至关重要。
3)根据病情严重程度及范围,早期选择恰当和足量糖皮质激素。本例患者年龄相对轻,疾病进展速度快,肺部病变严重,原发的CTD需要治疗,接受治疗的依从性很好,加以肺部以渗出实变为主,我们给与了大剂量糖皮质激素120mg连用三天后减量,有效的减轻了关节炎的症状,快速恢复肌力,逆转病情,呼吸困难和氧合情况趋于稳定。
4)避免单独使用糖皮质激素,需与免疫抑制剂联合,从而使肺间质病变处于可逆阶段时,更有效地阻止乃至逆转ILD。既往文献报道建议存在抗Jo-1抗体时,初始治疗就要联合免疫抑制剂,糖皮质激素联合吗替麦考酚酯或硫唑嘌呤是治疗的一线方案。有研究发现糖皮质激素联合他克莫司(1~3.5mg/d)治疗IIM合并ILD的方案,可使93.3%的患者肌力改善,肌酸激酶水平明显下降、80%以上肺功能改善。糖皮质激素,静脉用免疫球蛋白联合他克莫司毒副作用相对于霉酚酸酯较轻,可以作为非急进性间质性肺病的治疗选择,本例患者激素治疗一周后加用他克莫司,未见明显毒副作用,肌酸激酶明显下降至正常水平。
5)针对ILD 抗纤维化治疗,逆转ILD病变进程,最大程度地保护肺功能。ILD与IPF在发生机制上有许多共性,都存在纤维增生过度激活,在一项Ⅲ期药物临床试验治疗IPF的研究中吡啡尼酮显示出良好的作用:吡啡尼酮组相比安慰剂,可以明显减缓IPF患者FVC和6 min步行试验降低的速率,增加患者的无进展生存率。
6)避免肺部感染并发症出现:加用免疫抑制剂时机选择在皮质激素60mg时;重视营养支持治疗;尽早下床;尽早拔除各种管;早期肺康复;监测肺部感染征兆;避免无依据使用广谱甚至联合抗生素。本例患者在治疗过程中仅使用头孢西丁,后期咽部明显白斑后使用大扶康五天。得以使ILD肺部表现平稳持续好转。
参考文献
[1] Lundberg IE, Visser MD, Werth VP. Classification of myositis. Nature Reviews Rheumatology, 2018,14:269-275.
[2] Mchugh NJ, Tansley SL. Autoantibodies in myositis. Nature Reviews Rheumatology, 2018, 14:290-302.
[3] Fidler L, Doubelt I, Kandel S. et al. Screening for myositis antibodies in idiopathic interstitial lung disease. Lung, 2019, 197: 277-284.
[4] Johnson, C. et al. Assessment of mortality in autoimmune myositis with and without associated interstitial lung disease. Lung, 2016, 194: 733-737.
[5] Betteridge, Z. and McHugh, N. Myositis-specific autoantibodies: an important tool to support
diagnosis of myositis. J. Intern. Med, 2016, 280: 8-23.
[6] Shi, J. et al. Clinical profiles and prognosis of patients with distinct antisynthetase
autoantibodies. J. Rheumatol, 2017, 44:1051-1057.
[7] Moghadam-Kia S, Oddis CV, Sato S et al, Antimelanoma differentiation associated gene 5
antibody: expanding the clinical spectrum in North American patients with dermatomyositis. J. Rheumatol, 2017, 44:319-325.
[8] Mescam-Mancini, L. et al. Anti-Jo-1 antibody-positive patients show a characteristic
necrotizing perifascicular myositis. Brain, 2015,138: 2485-2492.
[9] Bohan, A. & Peter, J. B. Polymyositis and dermatomyositis (first of two parts). N. Engl. J.
Med. 1975, 292:344-347.
[10] Leah JW, James JC, and Mary ESk, The Diagnosis and Treatment of Antisynthetase
Syndrome. Clin Pulm Med. 2016, 23: 218-226
[11] 黄慧, 邵池, 李珊,等. 特发性炎性肌病相关性间质性肺疾病的诊治进展, 中华结核和呼吸杂志, 2017, 4: 625-628.
[12] 谢苗苗,邹如意,李燕等. 结缔组织病相关间质性肺病患者肌炎抗体检测的临床意义,中华结核和呼吸杂志, 2019, 42:765-770.
专家介绍

李强
教授、主任医师、博士生导师。上海同济大学附属东方医院呼吸与危重症医学中心主任,肺部肿瘤临床诊疗中心主任,大内科及内科教研室主任。世界支气管病及介入肺脏学会理事;亚太地区介入呼吸病联盟常务理事;中国介入呼吸病学创新产业联盟主席;中国医师协会呼吸分会介入呼吸病学工作委员会主任委员;中华医学会呼吸病分会介入组副组长;上海市医学会呼吸病分会主任委员。主持:国家重点研发计划 1 项;国家自然基金面上目 2 项;国家卫计委重大行业专项 1 项;上海市科委课题 1 项。发表论文 180 余篇,其中 SCI 收 录 50 篇;主编出版专著 6 部;获国家专利 14 项。

朱晓萍
荷兰Nijmegen 大学医学博士,同济大学附属东方医院本部呼吸内科病区主任,主任医师,博士生导师。中国医师协会EBUS 培训中心负责人,上海市医师协会呼吸分会委员,上海医学会呼吸分会肺间质病学组副组长,上海市医学会结核病学专科分会委员,中国医药教育慢阻肺康复委员会常委。中华肺科杂志编委,上海医药杂志编委,国家自然基金项目评议人。主持国家自然基金面上项目2 项,科技部重大新药创制项目子课题1 项,上海市自然基金等7 项科研课题。发表相关研究论著20余篇,其中第一作者和通讯作者SCI 论著7 篇(AJP 等)。获上海市浦东新区科技进步二等奖,上海市浦东新区医务工会科技创新奖一等奖,2020 年浦东新区新冠肺炎医疗专家组副组长。

冯宇
同济大学附属东方医院呼吸与危重症医学部主治医师,同济大学讲师,硕士毕业于上海交通大学医学院,2015年研修于美国UNMC;CSCO会员,上海市医学会呼吸学会成员,上海市抗癌协会会员。主要从事肺癌的生物靶向及免疫治疗,成人OSAHS诊治,擅长肺癌个体化治疗、肺癌免疫治疗不良反应的诊治。在国内外核心期刊发表论著及综述,获浦东新区科学技术二等奖,同济大学医学院教案比赛等奖项。

罗志兵
上海市东方医院呼吸与危重症科副主任医师,世界呼吸内镜协会快速精准诊断专家委员会委员,中国抗癌协会肿瘤微创治疗专业委员会粒子治疗分会委员,中国中药协会呼吸病药物研究专业委员会青年委员,上海市医学会呼吸病学分会肺间质病学组委员,硕士研究生,从医17年,擅长呼吸疑难少见病诊治、呼吸介入操作、胸部影像分析、呼吸危重症的救治。发表中英文论文11篇,获得专利3项,参编专著2本。

高少勇
主治医师,硕士毕业于中山大学,毕业后就职于福建医科大学附属第一医院呼吸与危重症医学科,2019年就职于上海市东方医院。技术特色:能熟练掌握各类常见呼吸疾病的诊治及机械通气的应用,主要工作方向为介入肺脏病学领域,擅长纵隔疾病及肺部结节、间质性肺疾病的诊断,在良恶性气道病变的处理、肺癌的介入治疗、支气管瘘的诊治方面,具有丰富的临床经验。科研方面:曾参与福建省自然科学基金、中青年骨干人才培养项目等多项科研课题,发表SCI及中文核心期刊论文近10篇。


