摘要
患者女,54岁,因「咳嗽伴胸闷、气促2个月余」入院,外院诊断肺动脉栓塞后规范抗凝治疗,效果欠佳,入院后查胸部CT示肺动脉分支充盈缺损,双肺多形性病灶,肌炎抗体、抗心磷脂抗体阳性,肌电图提示肌源性损害,考虑肺栓塞、炎症性肌病、继发性抗磷脂综合征,给予糖皮质激素及抗凝治疗后病情仍进行性加重,最后经淋巴结活检确诊为淋巴结转移性分化较差的肺腺癌。
患者女,54岁,家庭主妇,因「咳嗽伴胸闷、气促2个月余」于2018年12月26日入院。患者2个月前受凉后出现咳嗽、咳黄绿色脓痰,伴胸闷、气促,外院胸部增强CT(图1,图2,图3,图4)示左侧上下肺动脉分支内充盈缺损影,支气管疾患并双肺感染,心脏彩超示:三尖瓣少量反流,估测肺动脉收缩压约48 mmHg(1 mmHg=0.133 kPa),心包腔少量积液,外院给予抗感染、化痰及利伐沙班片(15 mg,2次/d)抗凝治疗,患者仍有活动后气促,为求进一步诊治收入我院。既往史:2004年体检时发现「肺结核」,自服抗结核药(具体不详)8个月。家族中无遗传性疾病可询。体检:体温36.7 ℃,脉率114次/min,呼吸频率25次/min,血压为103/73 mmHg,指脉氧(未吸氧)为84%。慢性面容,左锁骨上可扪及1.5 cm大小淋巴结,质韧,活动度可,右肺呼吸音低,双肺未闻及湿性啰音。心率114次/min,律齐,无杂音。腹平软,肝脾肋下未及,双下肢无浮肿。
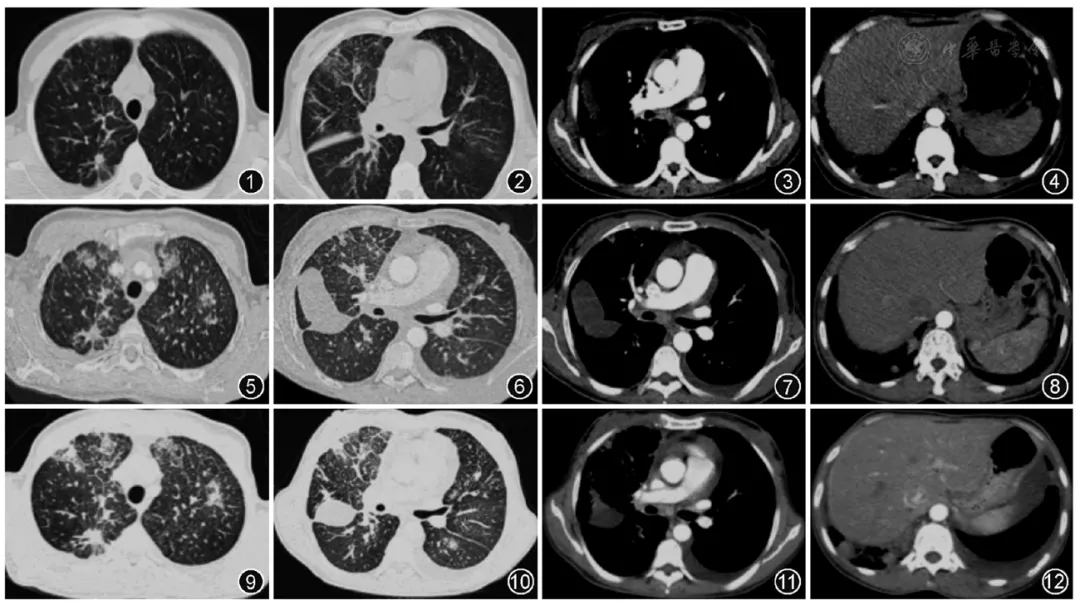
【图1~4】2018年12月6日外院胸部增强CT示右上肺尖段可见实性结节,边缘有毛刺及分叶,右下肺后基底段可见实性结节,边缘浅分叶,右肺可见小叶间隔增厚
【图5~8】2018年12月27日本院胸部增强CT可见双肺新发多发磨玻璃密度结节及斑片影、双肺小叶间隔增厚较前明显增多,新发右侧叶间胸膜积液及左侧胸腔积液
【图9~12】2019年1月11日本院胸部增强CT双肺弥漫性病变较前进一步进展,胸腔积液及心包积液较前增多
实验室检查:血气分析(未吸氧):pH值为7.50,PaCO2为31 mmHg,PaO2为53 mmHg,HCO3-为24.2 mmol/L,SaO2为90%。血、尿、便常规,ESR,C反应蛋白,肝肾功能正常;降钙素原为0.21 μg/L(正常参考值:<0.1 μg/L),D-二聚体0.6 mg/L(正常参考值:<0.5 mg/L);糖链抗原CA125为224.37 KU/L(正常参考值:0~35 KU/L);抗核抗体为1∶100(核颗粒型),抗β2糖蛋白1抗体Ig(A/G/M)为35.07 U/ml(正常参考值:0~24 U/ml),抗心磷脂抗体Ig(A/G/M)为91.20 U/ml(正常参考值:0~24 U/ml);肌炎抗体:抗血清转录中介因子1-γ(TIF1-γ)抗体IgG(+),抗Mi-2β抗体IgG(++),抗组氨酰tRNA合成酶(histidyl tRNA synthetase,Jo-1)抗体阳性,抗苏氨酰tRNA合成酶(threonyl tRNA synthetase,PL-7)抗体IgG(++)。PPD皮试、癌胚抗原、肌酶、脑钠肽、同型半胱氨酸、G试验、半乳甘露聚糖试验、补体、类风湿因子、血管炎三项、狼疮全套未见明显异常。心脏彩超示心动过速,肺动脉高压(中度),三尖瓣反流(轻度),心包积液(中量)。下肢血管、腹部彩超未见明显异常声像。神经肌电图示:四肢肌肉呈肌源性损害早期电生理改变。
初步诊断
(1)炎症性肌病,继发性抗磷脂综合征;(2)左肺动脉栓塞(中低危组),Ⅰ型呼吸衰竭;(3)双肺病变:感染?(4)陈旧性肺结核。
入院后给予鼻导管低流量吸氧(2 L/min),哌拉西林/他唑巴坦(4.5 g,1次/8 h)静脉滴注抗感染,利伐沙班(15 mg,2次/d)口服抗凝治疗。2019年1月11日开始给予甲泼尼龙80 mg(1次/d,静脉滴注3 d),后增至甲泼尼龙120 mg(1次/d,静脉滴注3 d),治疗过程中,患者活动后气促不缓解,呼吸衰竭进一步加重。
讨论
龙颖姣 /(呼吸与危重症医学科)
本例特点为中年女性,急性起病,主要表现为胸闷、气促,外院增强CT示左肺动脉分支栓塞及双肺多发病变,经抗感染及抗凝治疗,疗效不佳,入院体检左锁骨上可扪及1.5 cm大小质韧淋巴结,右肺呼吸音低,血气分析示Ⅰ型呼吸衰竭,胸部增强CT示双肺多发结节状,斑片状影病变较前增多,肺动脉栓塞面积同前,心肌酶学正常,心脏彩超示中度肺动脉高压及心包积液。该患者肺动脉栓塞诊断明确,为中低危组,经筛查,危险因素考虑有炎症性肌病,继发性抗心磷脂综合征,栓子可能来源于盆腔静脉。
患者症状与肺栓塞程度不匹配,且抗凝治疗效果不佳,需考虑以下几点:
1、肺栓塞进展
入院后立即复查肺动脉CTA(图5,图6,图7,图8)示右下肺动脉及左上肺动脉栓塞,栓塞面积不广泛,对比前片变化不大,与气促程度不匹配,故不考虑。
2、肺炎加重
患者起病初有感染的表现,胸部CT示双肺结节、斑片状病变较之前明显增多,短期内影像学进展,需考虑感染加重,于是给予抗生素治疗,但患者入院后无发热,多次查血常规及炎性指标均正常,抗感染后复查胸部CT(图9,图10,图11,图12)示双肺多形性病灶及胸腔积液较前增多,真菌及结核等特殊病原体相关检查均阴性,不支持感染性疾病。
3、非感染性疾病
患者有炎症性肌病,肺部弥漫病变呈进行性发展,抗感染治疗效果不佳,肺动脉高压与肺栓塞程度不匹配,需考虑炎症性肌病继发肺间质病变及血管病变进展。故请风湿免疫科会诊后,加用较大剂量激素治疗,但患者症状及肺部病变均无明显改善。
至此,患者抗生素及激素治疗效果不佳,是否还存在其他全身疾病?
结合患者一般情况差,有颈部无痛性淋巴结肿大,糖链抗原CA125明显升高,不排除存在肿瘤性疾病,如淋巴瘤、消化道肿瘤等,遂于2019年1月21日完善PET-CT(图13,图14)示:双肺小叶间隔增厚伴多发片状糖代谢增高影,右肺下叶后基底段见糖代谢增高结节,大小约为12 mm×11 mm,SUVmax值为5.82,形态欠规则,有分叶,边缘见毛刺征,左锁骨上窝、纵隔、肝门及腹膜后糖代谢增高的多发淋巴结影。患者经初步治疗后,效果不佳,气促加重,氧合指数进行性下降,于2019年1月23日转入呼吸重症监护室。
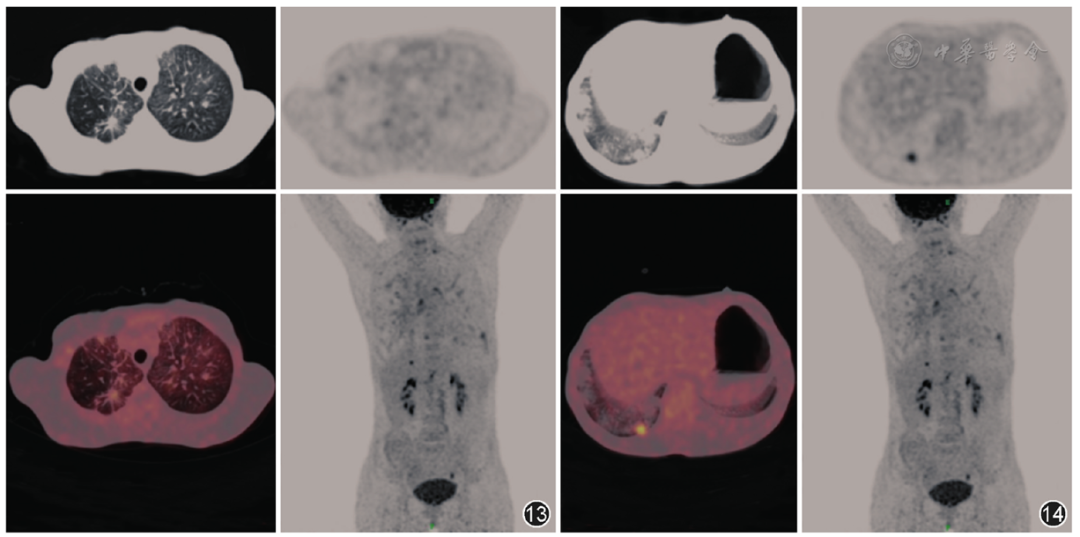
【图13,14】2019年1月21日全身PET-CT示右肺上叶后段结节,有毛刺,糖代谢无明显增高(图13);右肺下叶后基底段见糖代谢增高结节,形态欠规则,有分叶,边缘见毛刺征,大小约为12 mm×11 mm,SUVmax值为5.82(图14)
陈娟 /(放射科)
从影像学上来看,该患者胸部CT示肺动脉干增粗,提示肺动脉高压,无左心增大,无左向右分流,无慢性基础肺部疾病,亦无纵隔病变所引起肺动脉高压,虽然左下肺动脉分支内可见栓塞,肺栓塞也确实可以引起肺动脉高压,但该患者肺栓塞范围局限,与肺动脉高压程度不匹配,且患者胸部CT示双肺小叶间隔增厚,多发磨玻璃密度结节,不符合肺梗死的影像表现,肺栓塞无法解释该肺内影像学表现。肺小静脉闭塞症引起的肺动脉高压是需要考虑的,但也无法解释肺内实性结节及肺栓塞。
该患者肺部影像学上主要表现为双肺小叶间隔增厚及磨玻璃密度影,结合多个自身免疫疾病相关抗体阳性,肺间质病变需考虑继发于结缔组织疾病,但典型结缔组织疾病引起肺间质病变通常以下肺及外周明显,且双侧对称,但该患者小叶间隔增厚以右侧及中上肺明显,不符合结缔组织疾病相关肺间质病变分布规律,无法解释肺内实性小结节,且该患者激素治疗效果不佳,病变仍进行性增多,用结缔组织病继发肺间质病变无法解释。综合该患者病史,需考虑其他全身性疾病如恶性肿瘤。
卿洁 /(呼吸与危重症医学科)
患者转入监护室后,复查心脏彩超提示中量心包积液。行心包穿刺抽液,引流出220 ml血性液体,心包积液常规:颜色深红色,透明度浑浊,李凡他试验阳性,细胞总数为641 730×10^6/L,白细胞数为1 730×10^6/L,单个核细胞为0.66,多个核细胞为0.34,心包液生化:球蛋白为13.8 g/L,腺苷脱氨酶为4.7 U/L,总蛋白为36.4 g/L,急诊白蛋白为22.6 g/L,急诊乳酸脱氢酶为322.5 U/L,急诊葡萄糖为6.42 mmol/L,氯化物为101.4 mmol/L,癌胚抗原为306 μg/L。心包积液细胞学:可见少量核大异型细胞。以上均提示为恶性心包积液,影像显示右下肺部可见高代谢结节,不排除来源于肺,但患者一般情况差,右下肺糖代谢增高结节不大,近膈面,穿刺风险大。遂于2019年1月24日行床旁左锁骨上淋巴结活检,病理及免疫组织化学检查(图15,图16,图17)回报淋巴结转移性分化较差的腺癌,免疫表型提示肺来源。
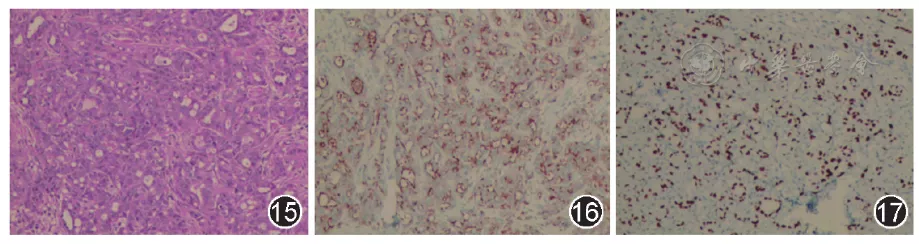
【图15~17】患者淋巴结活检组织HE染色符合分化较差腺癌(图15,低倍放大);免疫组织化学染色可见NapsinA染色阳性(图16,低倍放大),TTF-1染色阳性(图17,低倍放大)
患者呈亚急性起病,在外院初诊为肺栓塞,但未进行危险因素筛查,治疗效果不佳,入院时存在呼吸衰竭,肺部影像学示病变弥漫、广泛,进展快,给诊治带来困难。尽管如此,仔细回顾该病例,早期还是存在种种迹象提示恶性肿瘤。
首先,体格检查发现颈部有无痛性肿大淋巴结,多提示淋巴结转移性疾病;其次,患者多次彩超提示心包积液,且积液量逐渐增加;第三,仔细阅读影像学资料,可以发现掩盖在其他病变中的肺癌及癌性淋巴管炎的特征性病变;第四,该患者肌炎合并肿瘤的标志物抗TIF1-γ抗体阳性。至此,该患者诊断肺腺癌合并肺栓塞,而炎症性肌病及抗心磷脂综合征考虑为副肿瘤综合征。后患者家属放弃治疗,回当地医院行姑息治疗,电话随访已去世。
肖立志 /(PET-CT室)
该患者2019年1月21日阅片时见双肺血管增粗,双肺小叶间隔增厚伴双肺多发片状糖代谢增高影,对比既往2018年12月CT示肺部病变短时间内明显增多,考虑感染可能性大;右下肺结节较小,边缘模糊,与其他病灶混合,虽然SUV值增高,当时仍然考虑炎性病变可能性大。但回头仔细阅片该患者右肺下叶后基底段糖代谢增高结节,虽然掩盖在其他斑片和磨玻璃样等病变中,但仍可见其大小约12 mm×11 mm,SUVmax值为5.82,形态欠规则,有分叶,边缘见毛刺征;双肺支气管血管束和小叶间隔不均匀增粗,走行僵硬,可见串珠状结节,伴糖代谢稍增高,SUVmax值为2.5;右肺上叶后段和下叶背段斑片条索结节钙化灶,糖代谢无明显增高。左锁骨区、纵隔(4R、5、6、7)、肝门、腹膜后见多发糖代谢稍增高的肿大淋巴结,大者约19 mm×12 mm,SUVmax值为5.24。病变主要表现为双肺多发斑片、结节状病变,其中右肺下叶后基底段病灶糖代谢较高,故诊断考虑右肺下叶周围型肺癌并双肺癌性淋巴管炎和肺栓塞、左锁骨区和右肺门、纵隔、肝门、腹膜后淋巴结转移;鉴别诊断主要考虑双肺感染并肺栓塞(因结合临床和既往影像资料,病变变化较大)。
谢希 /(风湿免疫科)
从风湿免疫专科角度出发,该患者虽然无典型多发性肌炎或皮肌炎的临床表现,血清肌酶学无明显增高,但血清中多个肌炎特异性抗体阳性,有肌源性损害电生理改变,需要高度考虑炎症性肌病。自身抗体检测在炎症性肌病的诊断、分型、病情评估及预后等方面具有重要意义,其中又分为肌炎特异性抗体和肌炎相关性抗体。抗Mi-2β抗体是最早发现的皮肌炎特异性自身抗体,抗Jo-1抗体检出率最高,与并发肺间质病变有关,TIF1-γ也称TRIM33蛋白,该蛋白具有抑癌因子功能和转录功能,因此,抗TIF1-γ抗体与肌炎是否伴发癌症相关。
其次,患者抗磷脂抗体明显升高,有肺动脉栓塞性病变,要考虑继发性抗磷脂综合征。虽然该患者有明确自身免疫性疾病特点,但仍需高度警惕合并恶性肿瘤。首先,文献报道炎症性肌病合并肿瘤几率明显高于正常人群[1],尤其是50岁以上、肌病表现不典型、糖皮质激素治疗无效患者,且部分病例在确诊炎症性肌病后随访一年内发现恶性肿瘤,其中以肺癌、鼻咽癌、胃癌等较为多见[2],且诊断炎症性肌病5年之后的肿瘤发生率仍然高于正常人群[3]。有研究发现老龄、男性、不伴有肺间质病变和糖尿病史等临床特征与肌炎合并肿瘤相关[4]。其次,该患者抗TIF1-γ抗体阳性,该抗体是目前用于预测癌症相关性肌炎较敏感的一个生物指标[5]。Hida等[6]研究发现,抗TIF1-γ抗体阳性的肿瘤相关性肌炎具有典型的组织病理学特点。除此之外,该患者还有一些自身免疫疾病无法解释的临床表现,最终病理学证实为肺腺癌。
风湿免疫科疾病,尤其是弥漫性结缔组织病,常存在免疫自稳失衡,由于免疫系统是一个环环相扣的有机整体,免疫失衡不可避免会合并或继发免疫防御及免疫监控功能的异常,因此,风湿病与感染、肿瘤有着千丝万缕的关联,临床上要注意不要漏诊。
彭红 /(呼吸与危重症医学科)
肺栓塞是呼吸科常见疾病,除了对其进行严重程度分级外,寻找其病因非常重要,任何可致静脉血液瘀滞、血管内皮损伤和血液高凝状态的因素都可作为肺血栓栓塞症的危险因素。常见的病因有下肢深静脉血栓、恶性肿瘤、抗磷脂综合征、炎性肠病、肾病综合征、风湿免疫性疾病、易栓症、长期口服避孕药和雌激素药物等。
此病例诊疗过程中通过初步筛查发现了其易患因素有炎症性肌病、继发性抗磷脂综合征。2014年欧洲心脏病学会急性肺栓塞诊断治疗指南中补充了自身免疫性疾病作为静脉血栓栓塞症的中危因素[7],肺栓塞的预后与导致栓塞的病因及疾病早期诊断和治疗密切相关。
那是不是诊断就到此为止呢?接下来的治疗效果并不好,这就提示我们需要进一步去寻找其他病因。
该患者以肺癌常见并发症之一的肺栓塞起病,在诊治过程中筛查出炎性肌病及抗心磷脂抗体综合征,近年来临床研究结果表明,炎性肌病与恶性肿瘤密切相关,部分恶性肿瘤可以风湿病症状起病,可作为副肿瘤综合征的一种表现。副肿瘤综合征是恶性肿瘤患者伴发的一组临床症候群,是恶性肿瘤的远隔效应,常累及神经系统、关节、肌肉、血管等部位,可早于癌症出现,也可同时或者晚于癌症出现,其发病机制目前仍不清楚,认为可能与肿瘤抗原和体内某些抗原发生自身交叉免疫反应所致[8]。
该肺癌病例诊治的难点在于患者影像学表现为多发磨玻璃结节和斑片影,小叶间隔增厚,还有部分陈旧性结核性病变,且病变在短期内变化较大,右下叶后基底段结节尽管SUV偏高,但较小,近膈面,且与其他斑片影混合及被掩盖,所以在CT上易被忽略,易误诊为肺间质病变合并感染,因此诊断过程颇曲折。
综上,临床上对于诊断肺动脉栓塞患者进行易患因素排查十分重要,且在诊疗过程中,需要全面询问病史及体格检查,仔细阅读影像学资料,有无法解释的现象以及按目前诊断治疗效果不佳的时候,应仔细分析,抽丝剥茧,追根溯源,避免误诊和漏诊。另外,副肿瘤综合征临床表现多样,对于以并发症起病的肺癌患者,临床医生必须熟悉肺癌的肺外症状,做到尽早诊断,尽早治疗,以其改善肺癌患者预后。
* 参考文献(略)
作者:龙颖姣、张科、陈娟、肖立志、谢希、卿洁、张译、梁民勇、彭红(中南大学湘雅二医院 湘西自治州人民医院)
文章来源:中华结核和呼吸杂志2020,43(7):612-615
(DOI:10.3760/cma.j.cn112147-20200410-00483)
本文完
排版:Jerry


