新型冠状病毒的病原体及流行病学特征
1、从SARS到流感病毒及新型冠状病毒,病毒性肺炎从未走远
流感病毒、副流感病毒、呼吸道合胞病毒、巨细胞病毒、腺病毒、鼻病毒、冠状病毒、疱疹病毒等是导致肺炎的常见病毒。
2003年SARS:严重急性呼吸道症候群:由SARS冠状病毒感染引起的呼吸道感染性疾病,2003年爆发期,全球共确诊8098例,其中774人死亡。
2009年H1N1流感:由新型甲型H1N1流感病毒引起,2009年全世界有15.17万-57.54万人死于该病毒感染,自2009年来,每年都存在H1N1病毒播散。
2012年MERS:由中东呼吸综合征冠状病毒(MERS-cov)感染引起,平均每10例MERS患者中有3-4例死亡。
2019年新型冠状病毒肺炎:由新型冠状病毒(2019-nCoV)感染引起。
2、冠状病毒的起源及变迁
SARS-CoV和 MERS-CoV是21世纪初出现在人类体内的两种高传染性致病性病毒,这两种病毒都可能起源于蝙蝠。
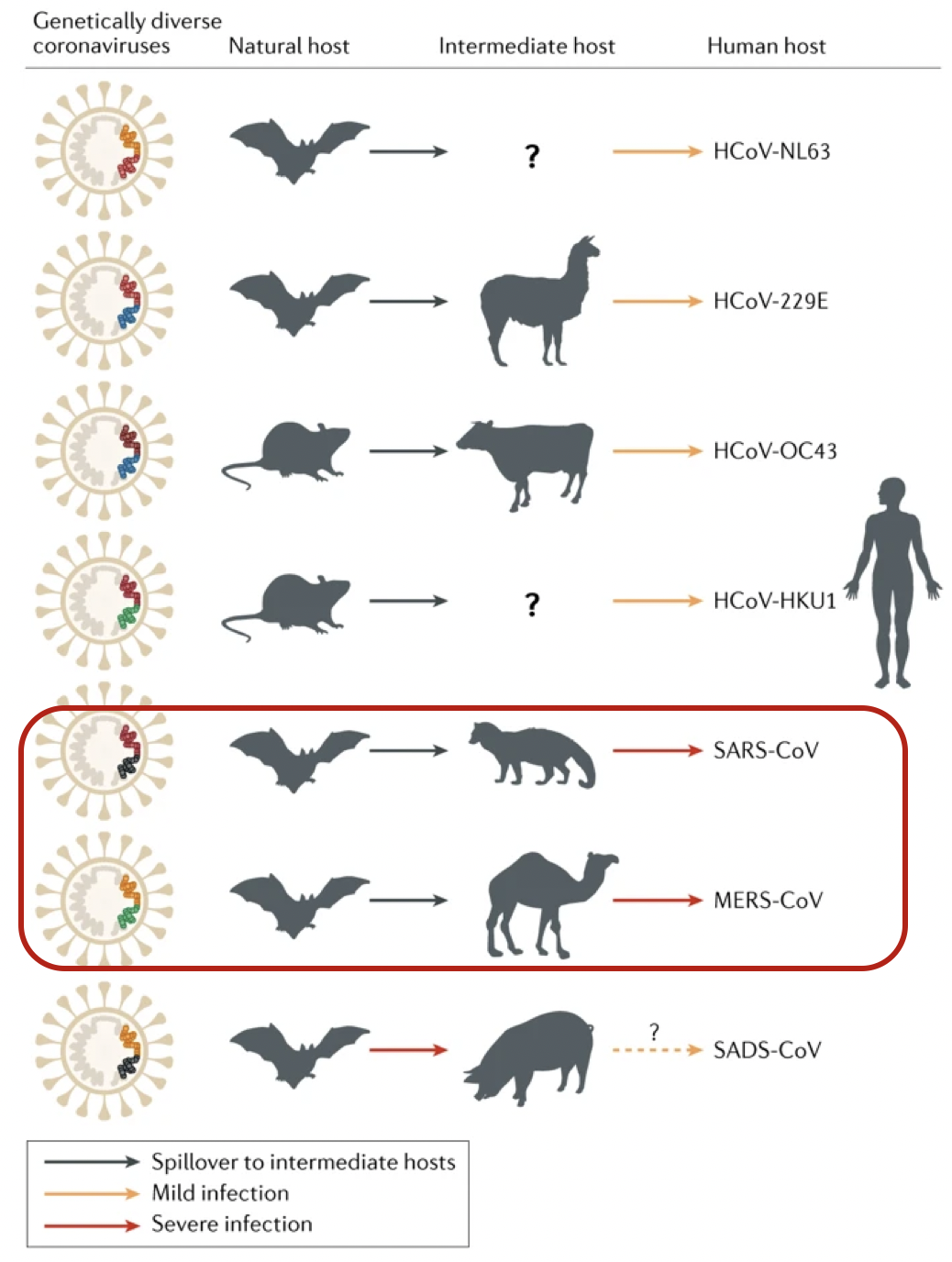
SARS-CoV和MERS-CoV分别由果子狸和单峰骆驼直接传播给人类
2019年12月以来,湖北省武汉市发现多起病毒性肺炎病例,经相关病毒分型检测,世界卫生组织正式命名为「2019新型冠状病毒(2019-nCoV)」。
目前认为所有的人类冠状病毒可能是动物源性的,而且可能确实来自蝙蝠;此外,对2019-nCoV进化与变异的研究同时还发现:1)该病毒至少有两种不同的毒株感染人类,且人类可能隐性感染该病毒但不表现症状;2)全基因组发现存在突变,但目前还不清楚这些病毒是在感染人类之前还是之后开始变异的。
3、新型冠状病毒已成为一种新的、严重的公共卫生威胁
冠状病毒是一种包膜RNA病毒,广泛分布于人类、其他哺乳动物和鸟类中;目前已知六种冠状病毒可引起人类疾病。

229E,OC43 ,NL63和HKU1四种病毒是普遍的,在具有免疫能力的个体中通常引起普通的感冒症状;严重急性呼吸综合征冠状病毒(SARS-CoV)和中东呼吸综合征冠状病毒(MERS-CoV)起源于人畜共患病,有时会引发致命的疾病。
自2019年12月8日,中国湖北省武汉市报告了几例不明病因肺炎;患者早期出现严重急性呼吸道感染症状,部分患者迅速发展为急性呼吸窘迫综合征(ARDS)、急性呼吸衰竭等严重并发症;2020年1月7日,从一例患者的咽喉拭子样本中分离了一种新型冠状病毒,随后被世卫组织命名为2019-nCoV。
新型冠状病毒与SARS病毒类似,通过S-蛋白与人血管紧张素转化酶2(ACE2)作用,从而感染人呼吸道上皮细胞。此外,与SARS一样,新型冠状病毒可能主要作用于淋巴细胞,尤其是T淋巴细胞;病毒通过呼吸道粘膜扩散感染其他细胞,在体内诱发细胞因子风暴,产生一系列免疫反应,引起外周血白细胞和淋巴细胞等免疫细胞改变。
新型冠状病毒肺炎的临床及影像学特征
1、为何与SARS等冠状病毒相比,新型冠状病毒的传播性更强?
2019-nCoV与多种蝙蝠冠状病毒及SARS冠状病毒具有高度相似性,但与SARS相比, 2019-nCoV传播能力更强。
既往研究表明,2019-nCoV病毒S蛋白和SARS冠状病毒S蛋白拥有相同功能的宿主细胞受体,即血管紧张素转换酶2(ACE2),因此研究人员通过表面等离子体共振技术来研究介导这种相互作用的动力学特性。
研究结果发现,ACE2与2019-nCoV 病毒S蛋白胞外域结构之间结合的亲和力为15 nM,是ACE2与SARS冠状病毒S蛋白胞外域结构之间结合亲和力的10-20倍。
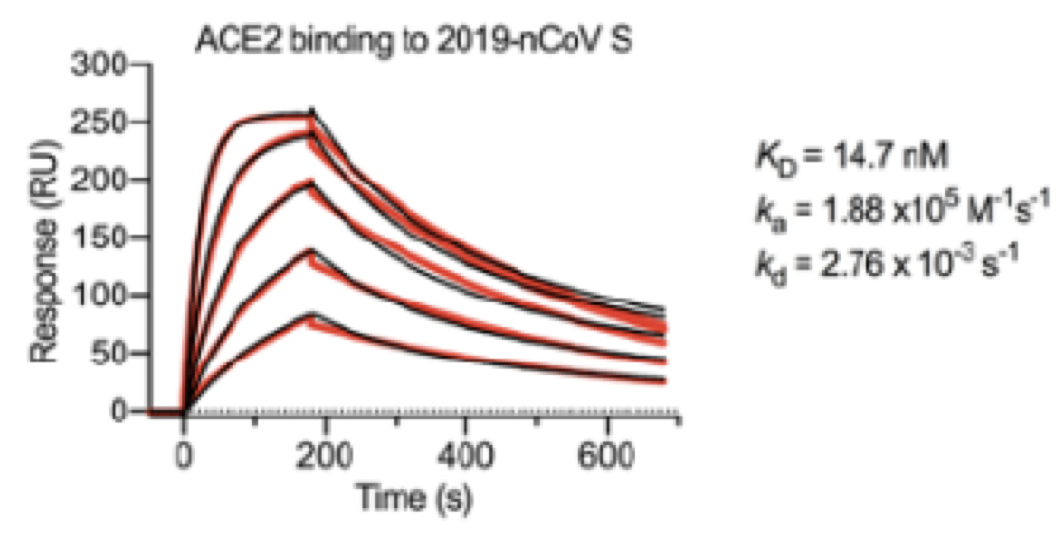
2019-nCoV与人类ACE2具有高度亲和力:SPR传感器图,人类ACE2和固定化2019-nCoV病毒S蛋白的结合动力学;黑线表示数据,红线表示最佳匹配数据与1:1绑定模型。
2、新型冠状病毒性肺炎的病理改变
> 肺部表现为弥漫性肺损伤,包括广泛的渗出及出血,肺泡上皮的破坏和反应性增生
> 下呼吸道内黏液栓的形成和肺泡腔巨噬细胞聚集活化是新冠肺炎SARS及MERS的不同之处
> 广泛的黏液分泌合并渗出使肺部的通气和换气功能受损更显著,因此低氧就更加显著
> 表达ACE2的肺泡巨噬细胞成为SARS-CoV-2感染的靶细胞
> 经典激活性的巨噬细胞和替代激活性巨噬细胞之间的转化是引起肺部炎症损伤和纤维化的原因
3、新型冠状病毒有多种临床表现

针对2019-nCoV患者流行病学
及临床特征的研究
《柳叶刀》在线发表的第一项原创性研究分析了2019年12月16日至2020年1月2日期间在武汉市入院的首批41例确诊感染病例。
由于新发感染开始时病因不明,因此武汉地区对不明原因肺炎的诊断是基于临床特征、胸部影像学,排除常见的引起肺炎的细菌和病毒病原体;疑似患者在指定医院(中国武汉金银潭医院)进行隔离,当地疾控收集呼吸道、血液和粪便标本,运送到指定的权威实验室检测病原体。
最初的调查包括全血计数、凝血功能和血清生化测试。采用经国家食品药品监督管理局批准的实时RT-PCR检测方法,对呼吸道标本进行流感、禽流感、呼吸道合胞体病毒、腺病毒、副流感病毒、SARS-CoV和MERS-CoV等常见病毒检测。同时常规进行细菌和真菌检查。
41例2019-nCoV肺炎患者研究主要结果:男性为主,常存在多种基础疾病,且患者常存在T淋巴细胞减少
这项针对41例确诊2019-nCoV肺炎患者的前瞻性研究结果发现:确诊患者中,73%为男性患者,女性患者仅占27%;且重症患者中男性患者比例更高,达85%;糖尿病、高血压、心血管疾病是常见合并症,但ICU与非ICU患者合并症构成存在一定差异。
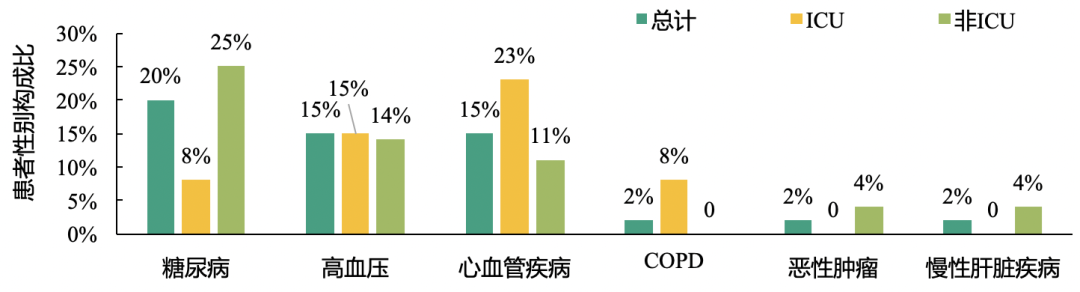
此外,63%的患者淋巴细胞计数<1×10^9/L,且ICU患者中低淋巴细胞计数患者比例尤为突出。
针对99例2019-nCoV患者
进行延续性分析
为进一步探讨2019-nCoV的流行病学和患者临床特征,研究者对2020年1月1日至1月20日在武汉金银潭医院住院治疗的99例确诊2019-nCoV肺炎患者数据进行回顾性分析,了解2019-nCoV感染患者的人口学、流行病学、临床特征、实验室特征、影像学特征及治疗和患者临床结局等。
研究纳入的所有患者均依据WHO诊断标准确诊为新型冠状病毒肺炎,且患者均随访至2020年1月25日。
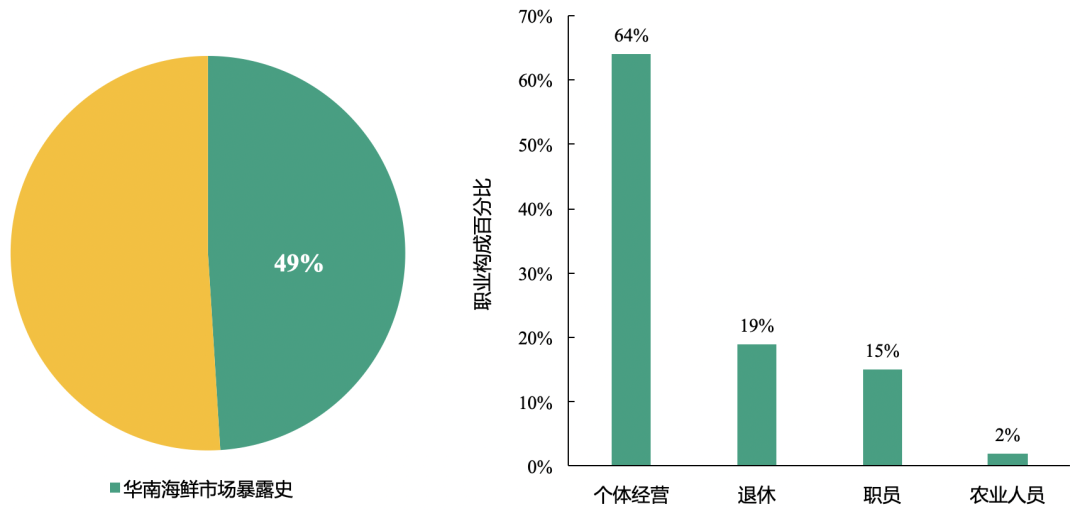
患者基础情况:本研究中半数的新型冠状病毒肺炎患者为群聚性,且有华南海鲜市场接触史
总计49%的患者为群聚且存在华南海鲜市场暴露史;其中47例患者有长期接触史,多为销售人员或市场经理;2例患者有短期接触史,为购物者。
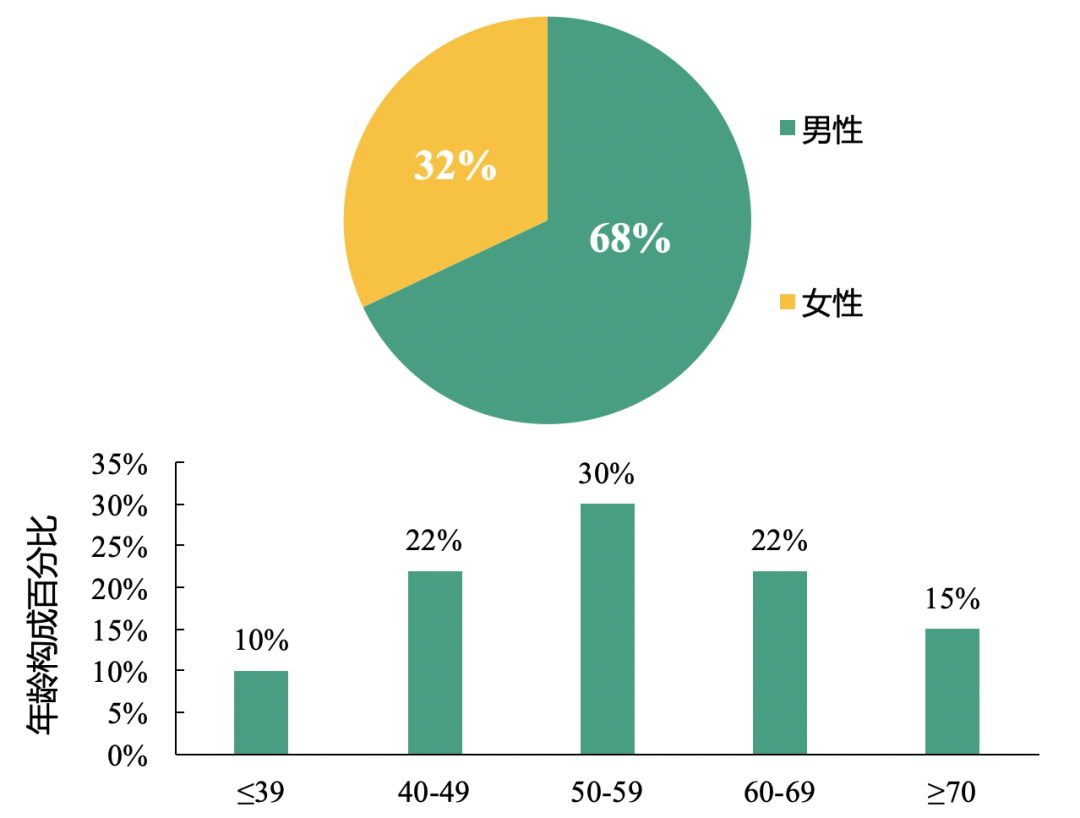
患者的基础特征及主要临床结局:与之前研究类似,新型冠状病毒肺炎患者以男性为主,且平均年龄为55.5岁。
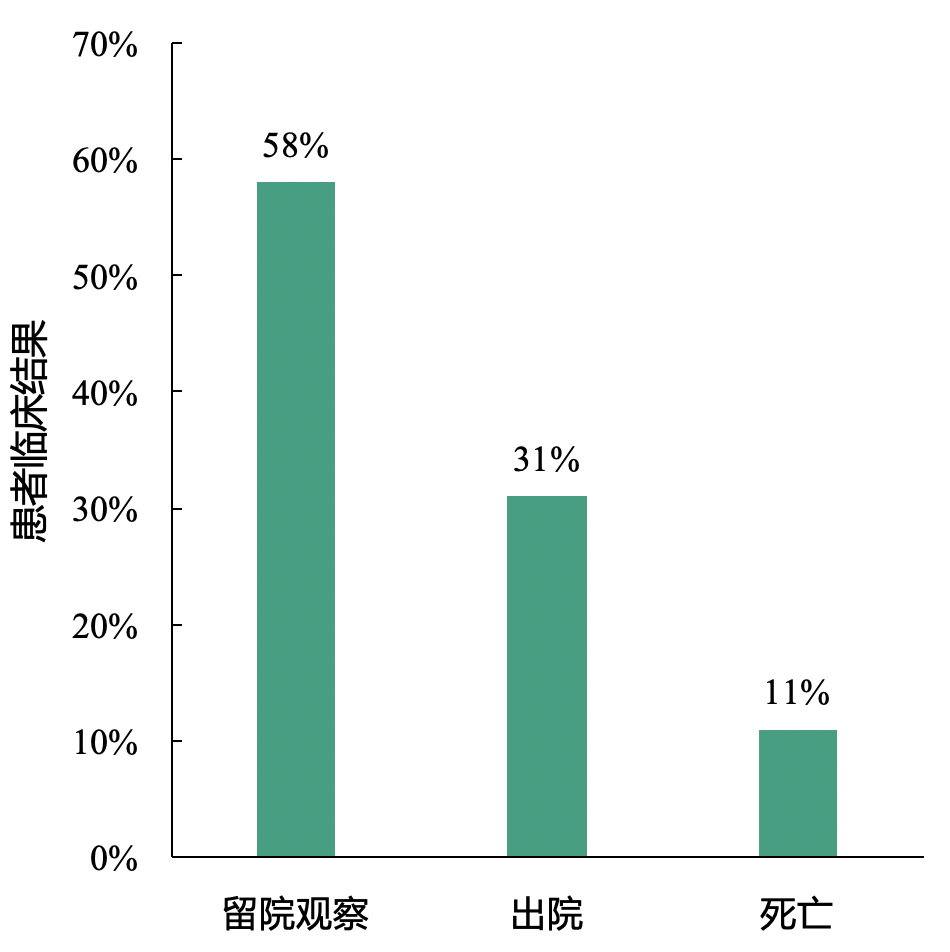
本研究中,最终11%的新型冠状病毒肺炎患者死亡。
男性表达AEC2的细胞比例高、女性X染色体及性激素的保护作用,导致男性更易发生新型冠病状病毒肺炎
与SARS一样,新型冠状病毒通过S-蛋白与人体细胞表面的血管紧张素转化酶2(ACE2)相结合,从而感染人呼吸道上皮细胞。男性表达ACE2的细胞占比高于女性,因此男性更易发生新型冠状病毒肺炎。
此外,女性对病毒感染易感性的降低可能是由于X染色体和性激素的保护,它们在先天免疫和适应性免疫中起着重要的作用。
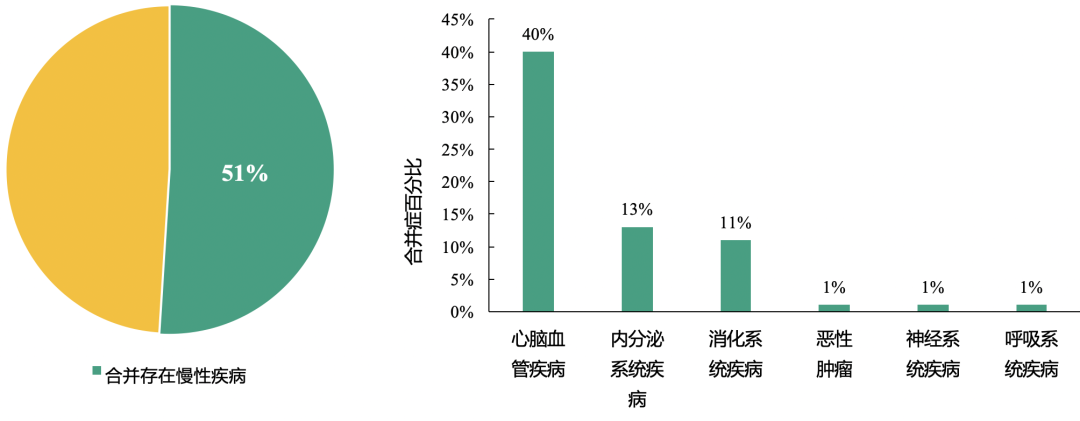
新型冠状病毒肺炎患者常存在多种基础疾病,其中以心血管疾病更为常见
51%的患者存在慢性疾病;其中,心脑血管疾病、内分泌系统疾病、消化系统疾病是常见的合并症。
由于慢性病患者免疫功能低下,因此,存在慢性共病患者相对更易发生2019-nCoV肺炎,更应引起关注。
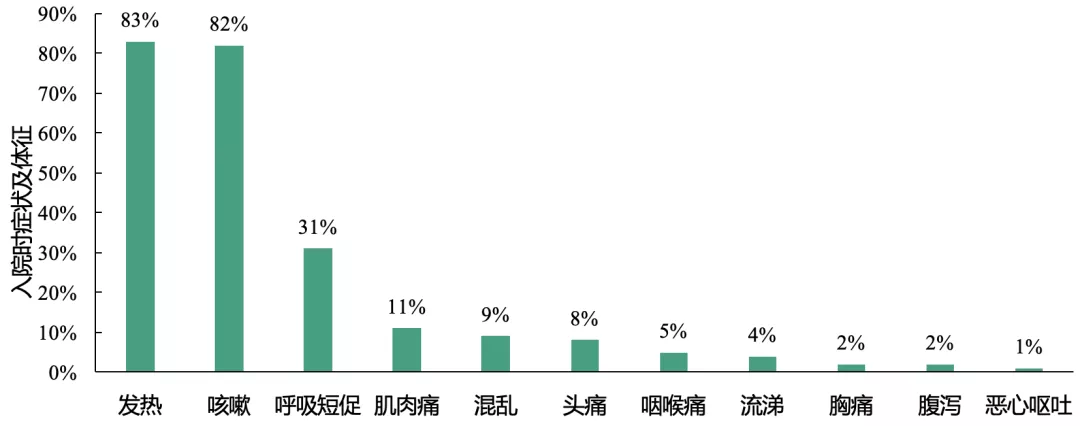
临床症状及实验室检查:发热、咳嗽是本研究中新型冠状病毒肺炎患者最常见的症状,且患者常存在T淋巴细胞计数降低
入院时,发热或咳嗽是患者最常见的症状;此外,1/3的患者存在呼吸短促;其它症状还包括肌肉疼痛、头痛、思维混乱、胸痛和腹泻。
入院时,多数患者的淋巴细胞及血红蛋白细胞计数低于正常值;因此,淋巴细胞绝对值低可以作为临床诊断新的冠状病毒感染的参考指标。
胸片及CT检查中,75%的患者表现为双侧肺炎,仅25%的患者表现为单侧肺炎。14%的患者表现出多发性斑点状和毛玻璃样阴影。
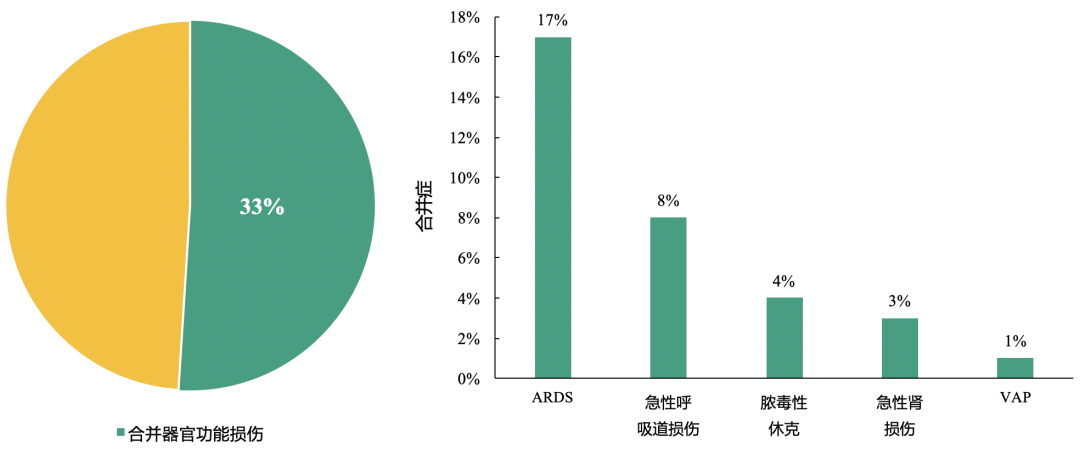
此外,多数新型冠状病毒肺炎患者合并器官功能损伤
针对99例确诊2019-nCoV肺炎患者的分析,结果显示:33%的患者存在器官功能损伤,其中ARDS是最常见并发症。
新型冠状病毒作用于T淋巴细胞,且诱发炎症风暴从而加重患者病情,增加死亡风险
与SARS一样,新型冠状病毒可能主要作用于淋巴细胞,尤其是T淋巴细胞,钟南山院士带领的医疗专家针对1099例患者的分析同样发现:重症患者中呈现血淋巴细胞减少的比例是95.5%,显著高于非重症患者组。
病毒通过呼吸道粘膜扩散感染其他细胞,在体内诱发细胞因子风暴,产生一系列免疫反应,引起外周血白细胞和淋巴细胞等免疫细胞改变。
新型冠状病毒刺激患者的先天免疫系统→体内大量释放细胞因子→细胞因子风暴和急性炎症反应→全身血管更为脆弱,引发急性呼吸窘迫症和多器官衰竭。
细胞因子风暴和免疫病理会引起气道和肺泡上皮细胞、血管内皮细胞的凋亡和血管渗漏;气道和肺泡上皮细胞凋亡是最早的后果之一。上皮细胞凋亡又危及肺微血管与肺泡上皮细胞屏障,导致血管渗漏和肺泡水肿,最终导致缺氧,严重者可致急性呼吸窘迫综合征,更严重者可发展为多器官功能衰竭、嗜血细胞综合征等。
淋巴细胞绝对值低可以作为临床诊断新的冠状病毒感染的参考指标,且T细胞亚群和细胞因子可作为预测病情由轻到重转变的依据之一。
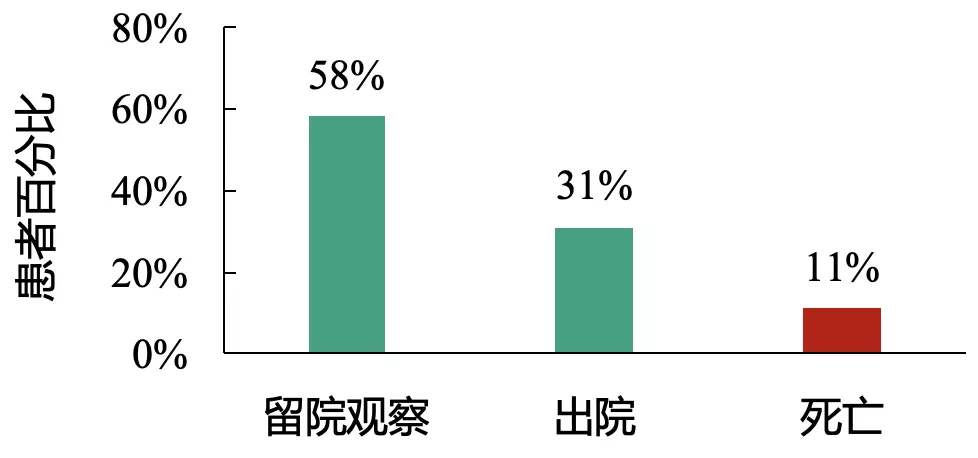
疾病严重程度、患者免疫功能等因素造成重症、淋巴细胞减少、高龄等患者死亡风险高
截止1月25日,31%的患者出院,11%的患者死亡,其它患者仍留院继续治疗。
死亡患者特点
1、61岁男性,无慢性病史,有长期吸烟史;转入金银滩医院时诊断为重症肺炎、ARDS,立即入住ICU,接受插管呼吸机辅助呼吸治疗;随后,患者出现严重呼吸衰竭、心力衰竭和败血症;入院第11天,患者出现心脏骤停,死亡。
2、69岁男性,无慢性病史,有长期吸烟史;患者入院后出现严重肺炎及ARDS,随即转入ICU,给予呼吸机辅助呼吸,入院后抗感染、ECMO治疗;患者低氧血症始终未解决;入院第九天,患者死于严重肺炎、感染性休克和呼吸衰竭。
上述两例患者病程和肺部病变进展迅速,均在短时间内发生多器官功能衰竭。此两例患者的死亡符合MuLBSTA评分,MuLBSTA评分是预测病毒性肺炎死亡的早期预警模型。
其余9例死亡患者中,8例淋巴细胞减少,7例双侧肺炎,5例60岁以上,3例高血压,1例重度吸烟者。
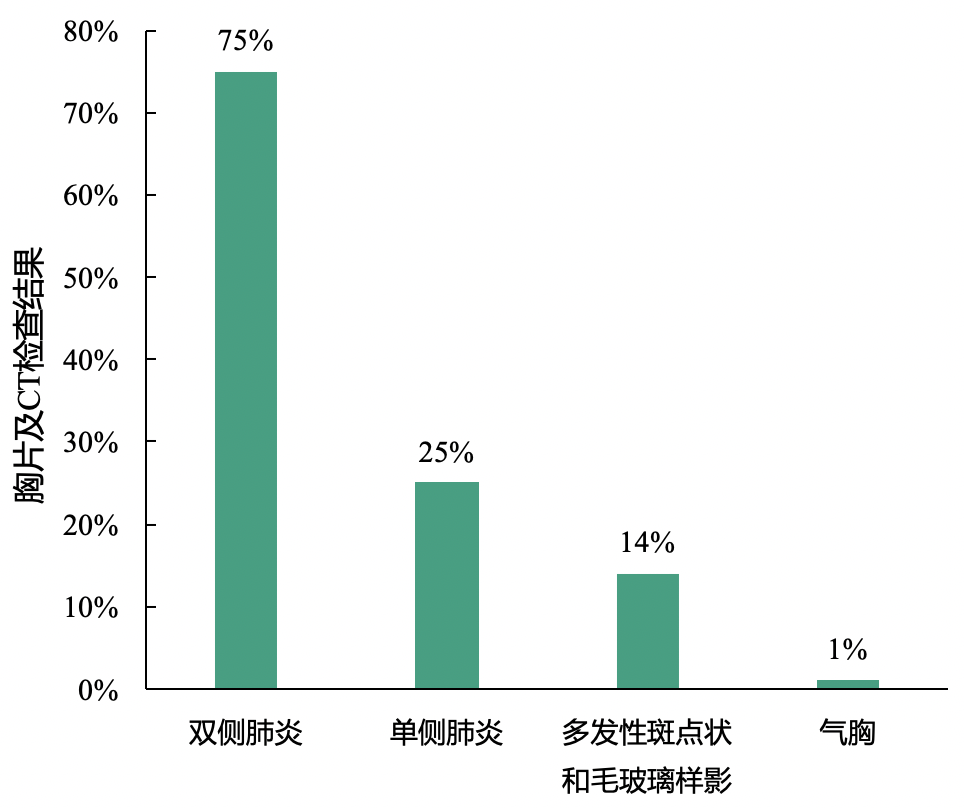
影像学表现:新型冠状病毒肺炎患者多表现为双侧肺炎
胸片及CT检查:75%的患者表现为双侧肺炎,仅25%的患者表现为单侧肺炎,14%的患者表现出多发性斑点状和毛玻璃样阴影;此外,1%的患者出现气胸。
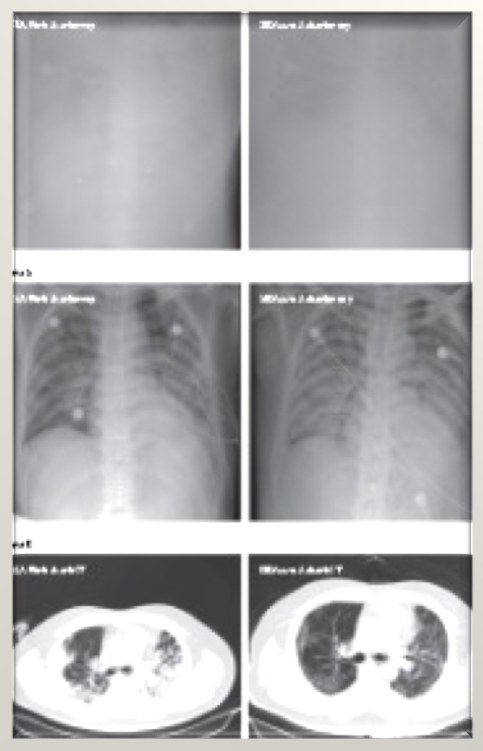
4、影像学在诊断新型冠状病毒肺炎中具有重要作用
病毒核酸检测是确诊2019-nCoV的依据,但多种因素影响导致敏感性差,且目前试剂盒不足;肺部影像表现常早于临床症状,因此,影像学检查在临床分流中具有不可替代的作用。
新型冠状病毒肺炎诊疗方案(试行第六版)指出患者影像学特点表现为:早期呈多发小斑片影及间质改变,以肺外带明显;进而发展为双肺多发磨玻璃影、浸润影,严重者可出现肺实变,胸腔积液少见。
新型冠状病毒肺炎影像分流指南(第一版)中进一步细化了影像学的分流原则:针对疑似指数高于三星的患者,双肺病变的侵犯面积和临床分型,以实用性为出发点,为患者的分流和治疗提供参考。

5、利用深度学习实现流感病毒肺炎与新冠肺炎的精准鉴别
流感病毒肺炎是冬春季节最常见的呼吸道感染性疾病,与新冠肺炎在CT影像表现上常常「异病同影」,因此,精准的鉴别诊断较为困难。
深度学习(deep learning)是当前迅速发展的新兴技术,本研究设计了一体化深度学习人工智能网络,首先通过深度学习进行病灶的自动分割,在此基础上,设计两个深度学习框架(Plain框架与Trinary框架),实现精准鉴别。
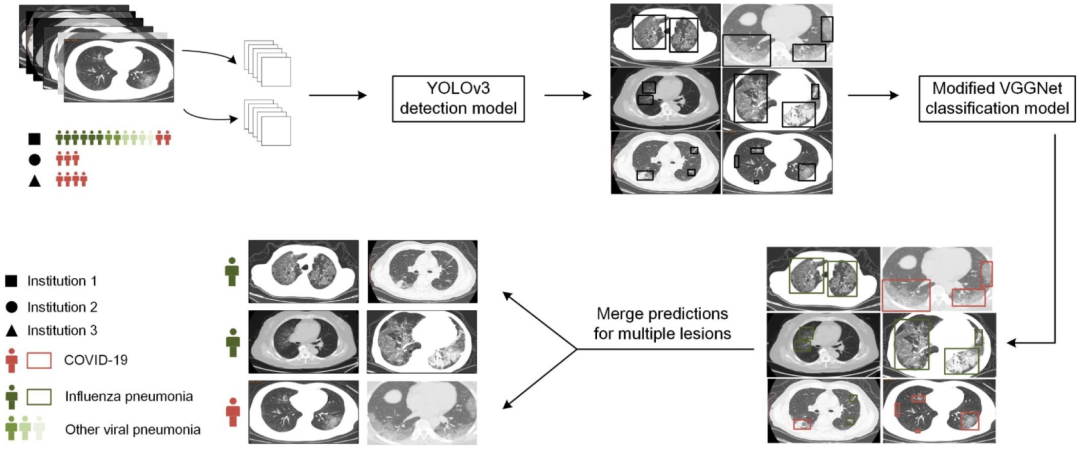
新冠肺炎患者肺部病变更为广泛,96.1%的患者表现为双侧肺侵犯,33.3%的患者表现为5个肺叶受累。
合并基础疾病的新型冠状病毒肺炎尤需关注
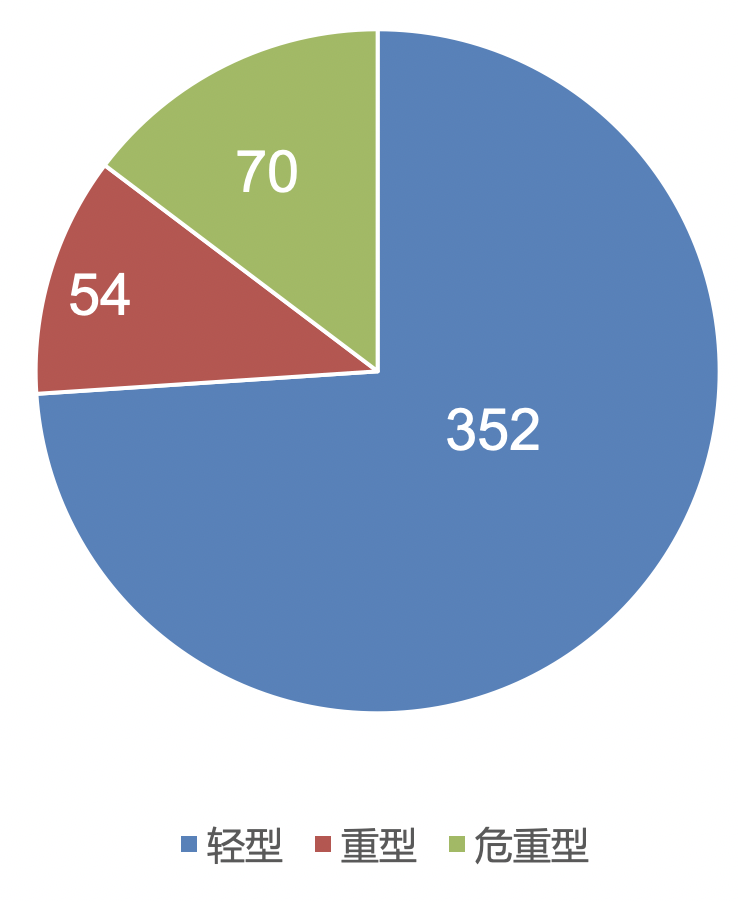
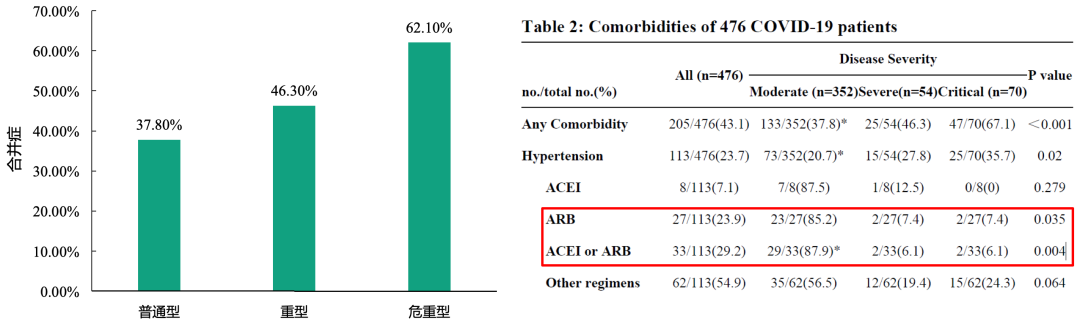
1、不同严重程度的COVID-19患者:临床特征的多中心研究
2020年1月1日至2020年2月15日,来自武汉、上海、安徽三家医院的476名COVID-19患者。按照指南分为普通型、重型、危重型三组,同时结合年龄分组分为四组,对患者的临床特征、实验室检查、CT影像及治疗多方面分析患者差异。
与普通型组(37.8%)相比,重型(46.3%)及危重型(62.1%)组患者有更高的合并症发生率。与重型及危重型组相比,普通型组患者使用ACEI/ARB的比例更高。
危重组较普通型组多见多发肺叶受累及胸腔积液。
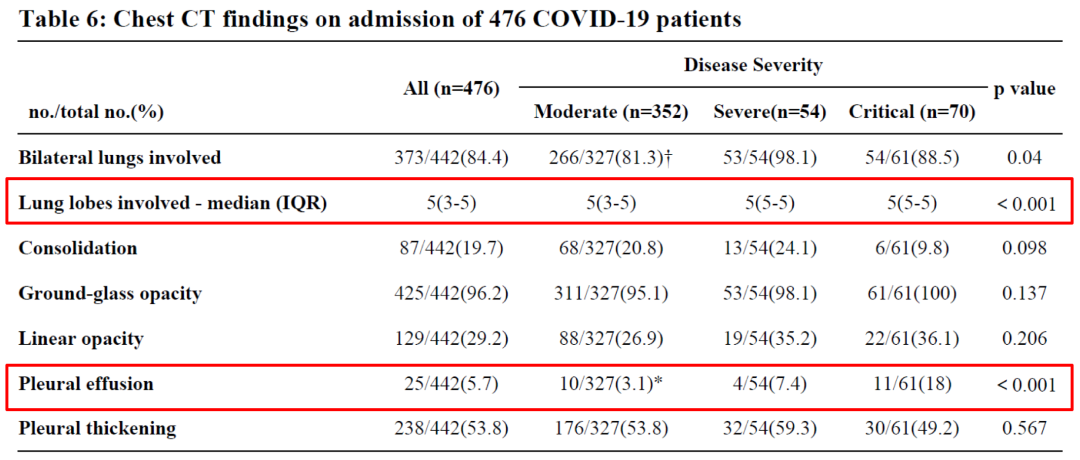
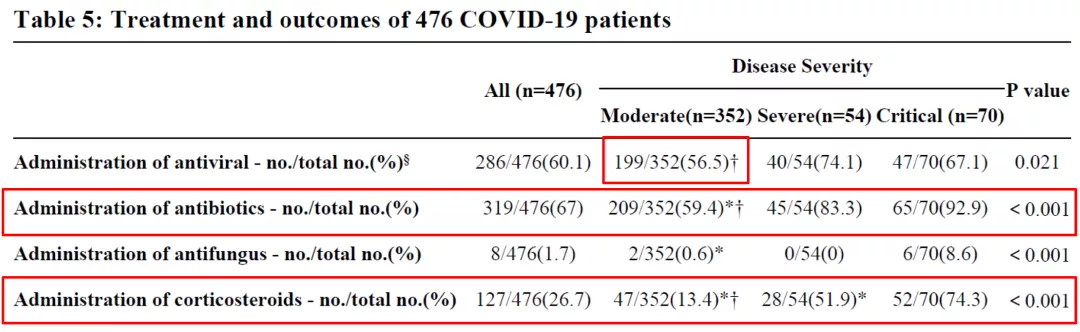
重症组和危重型组接受早期抗病毒治疗、抗生素和皮质激素治疗的患者多于普通型组。
75岁以上患者的生存率明显低于年轻患者。

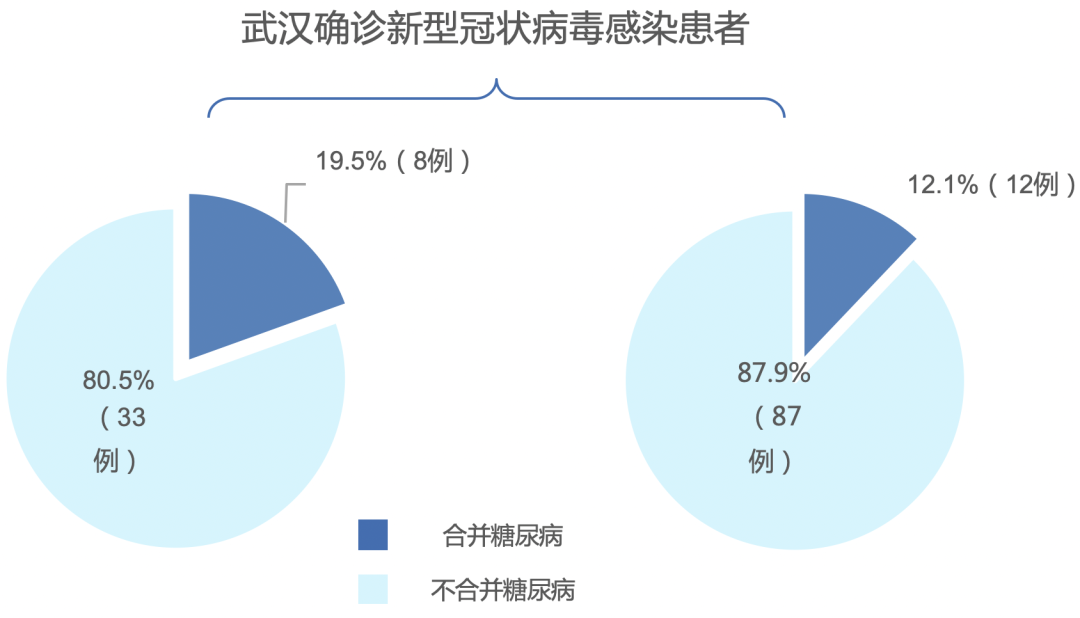
2、糖尿病是新型冠状病毒感染患者最常见的合并症之一
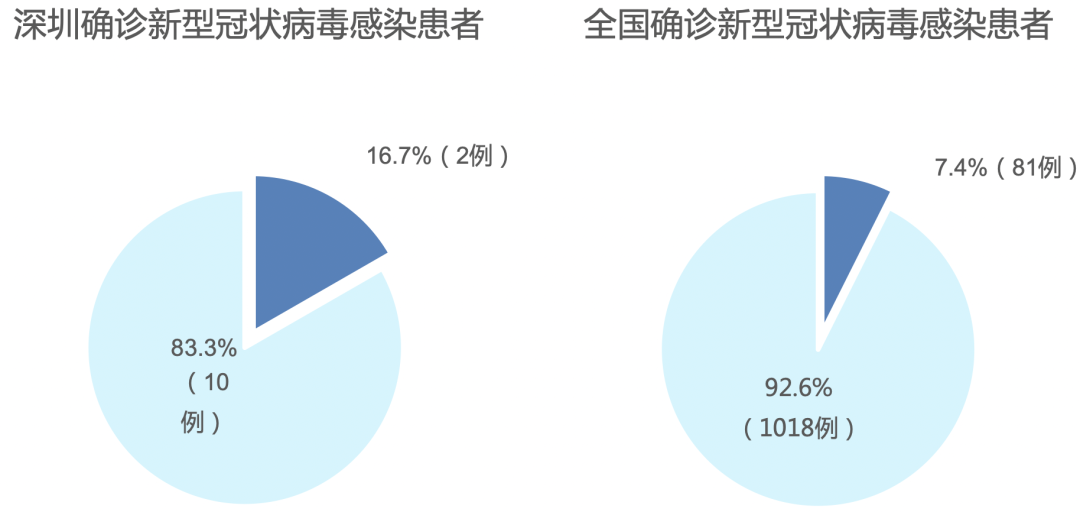
3、糖尿病与新型冠状病毒感染患者病情的加重有关
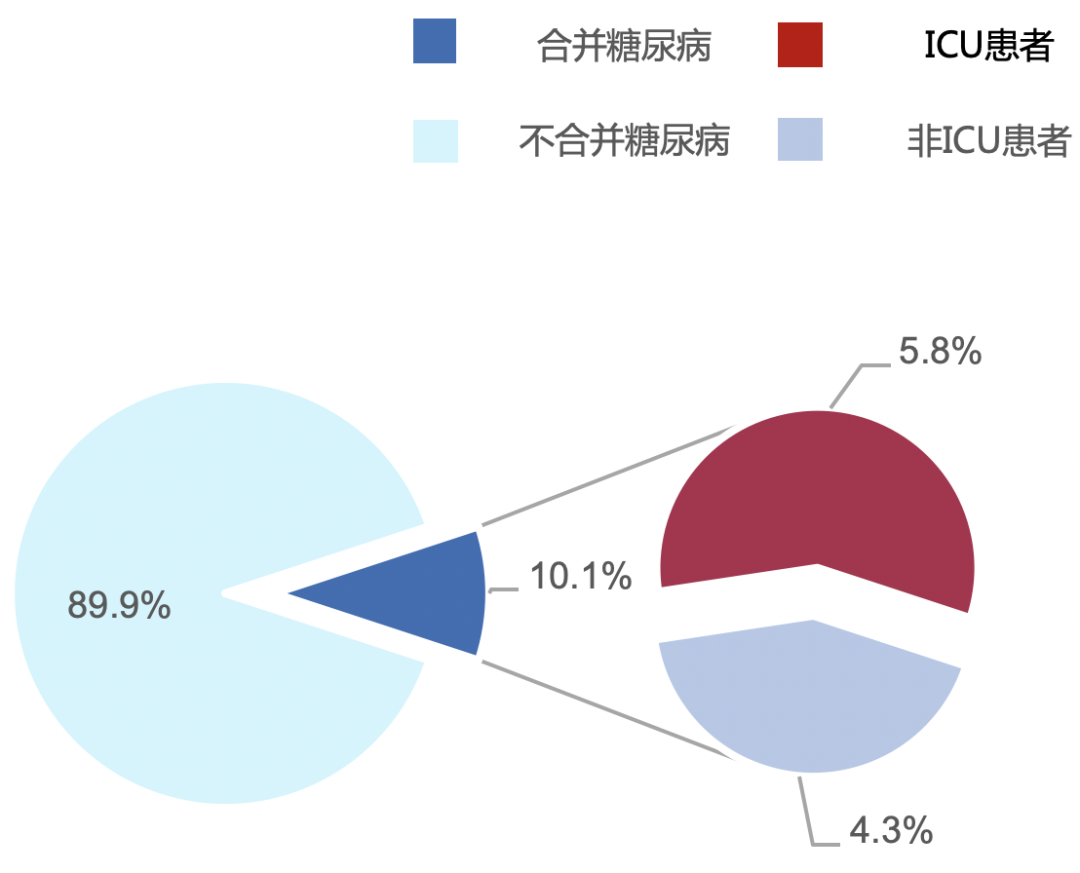
一项纳入武汉138例住院患者的临床研究显示,14例(10.1%)患者合并糖尿病,其中8例为重症监护室(ICU)患者,6例为非ICU患者(P=0.09)。
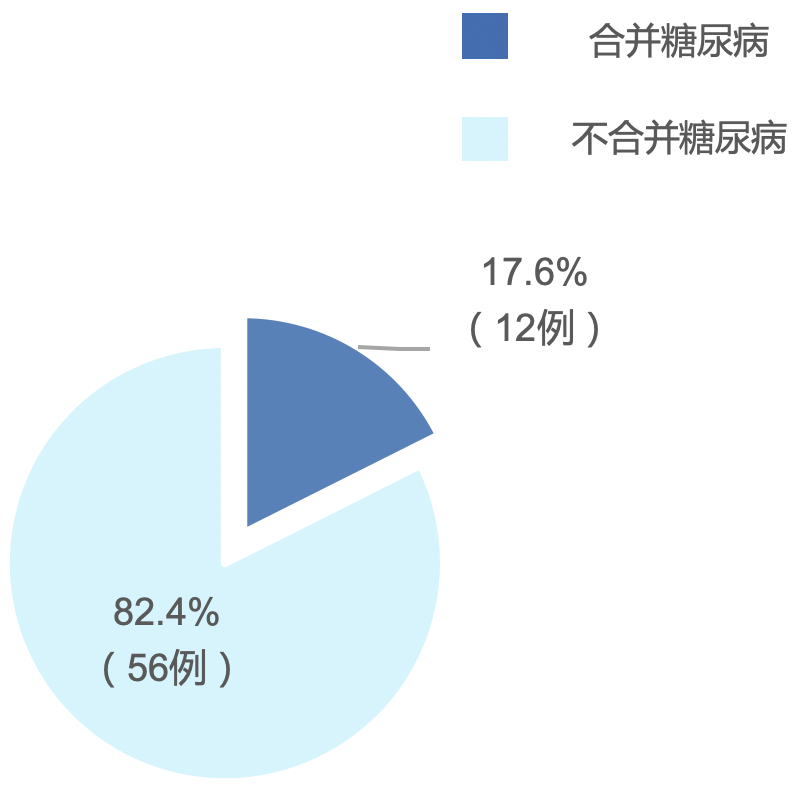
针对上海交通大学附属瑞金医院、武汉金银潭医院及上海市公共卫生中心529例确诊患者进行了分析,存在68例由轻症转为重症的患者,其中有12例(17.6%)合并有糖尿病。
可见,合并糖尿病的新型冠状病毒患者更易发展为重症。
4、死亡患者中,新冠病毒感染合并糖尿病的患者所占比例高于存活患者
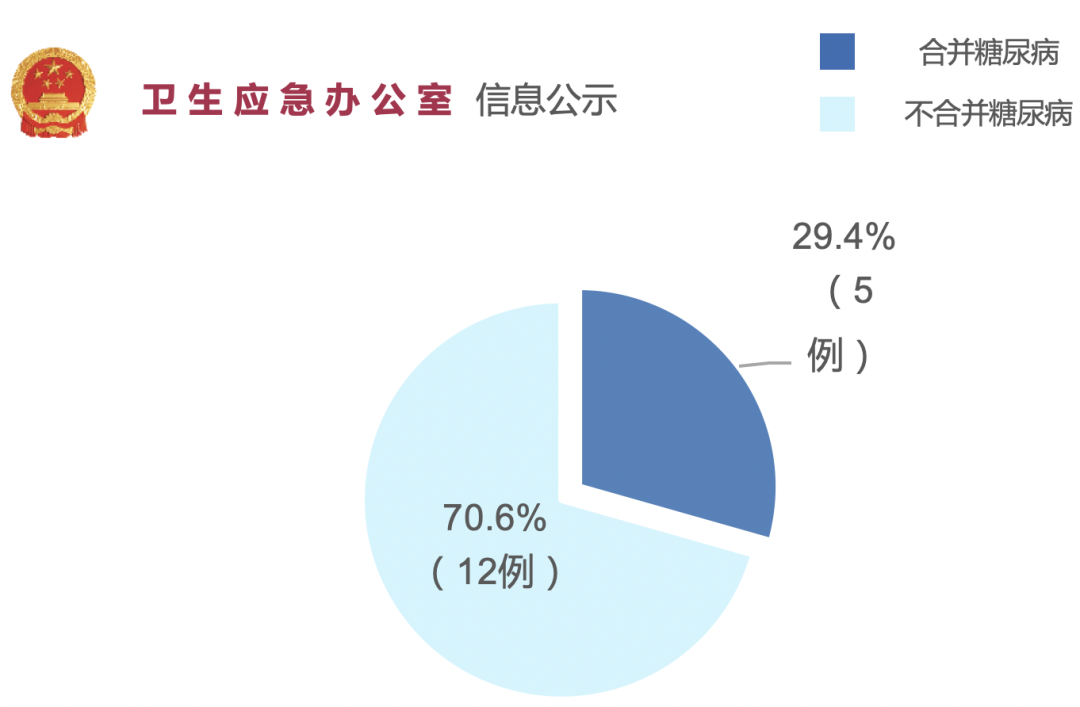
新型冠状病毒感染最初的17例死亡病例中,有5例均合并有糖尿病。
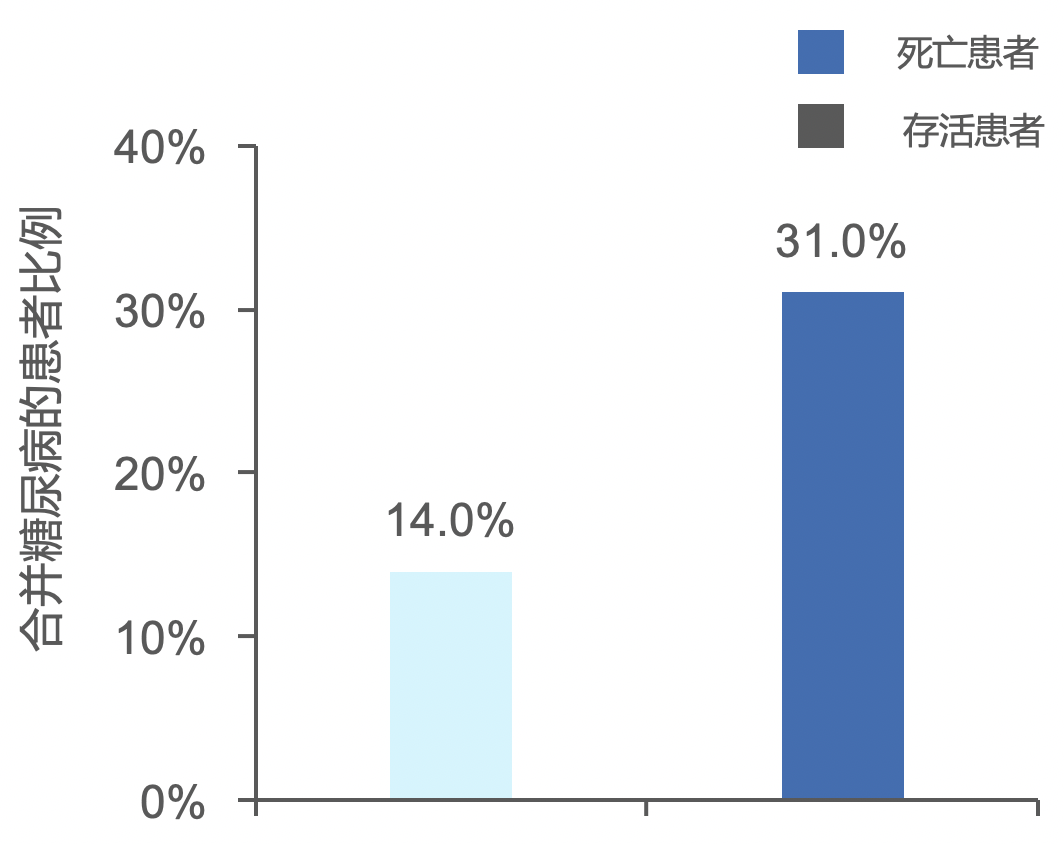
一项纳入191例确诊患者的研究2表明,相比于存活患者,死亡患者中合并有糖尿病的患者比例更高。
可见,糖尿病会增加新型冠状病毒感染患者死亡风险。
5、针对全国患者的研究同样显示,糖尿病与新型冠状病毒感染的不良预后有关

钟南山院士参与的一项针对全国31省市、552家医院的共计1099例确诊患者的研究1表明,与非重症、无需机械通气、存活患者相比,在重症、需要机械通气、死亡患者中,糖尿病合并症出现的比例更高。
可见,糖尿病与新型冠状病毒感染患者的不良预后有关。
新型冠状病毒肺炎的若干治疗问题
1、抗新冠病毒药物研究进展
洛匹那韦/利托那韦:在重症COVID-19成人住院患者中,与常规治疗相比,未观察到洛匹那韦-利托那韦治疗有益,拎出临床改善时间都是16天(P=0.09)。
根据调整的意向性分析:洛匹那韦-利托那韦和对照组在14天的改善率分别是45.5%及30%;P=0.015;次要研究终点:28天死亡率16.7%和25%,P=0.152。
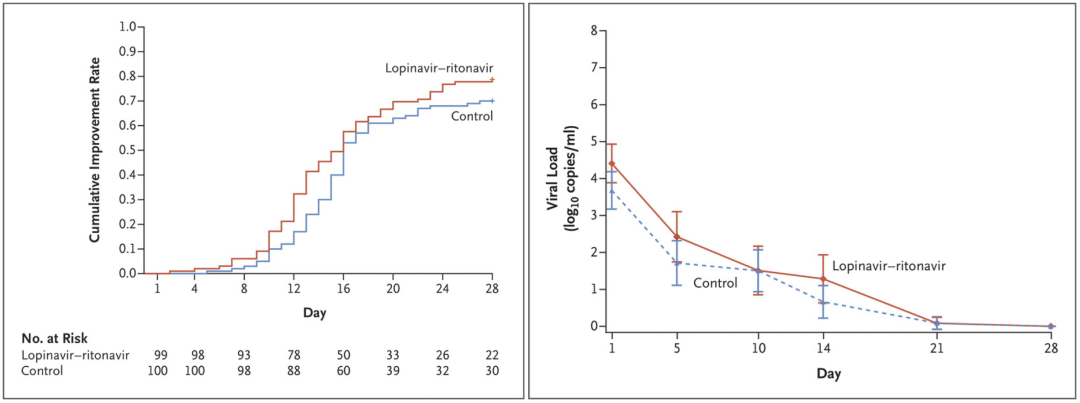
左:意向治疗人群中至临床状况改善的时间;右:通过qPCR测出的咽拭子标本SARS-CoVer-2病毒RNA载量相对于基线的平均变化
2、新型冠状病毒肺炎患者可继发细菌及真菌感染
部分患者,尤其是重症患者,同时存在细菌和真菌感染:4%的患者同时合并存在真菌感染,1%的患者同时存在细菌感染,未发现同时合并其它病毒感染患者。——1例患者培养出鲍曼不动杆菌、肺炎克雷伯菌和黄曲霉;且鲍曼不动杆菌对抗菌药物耐药性高;1例真菌感染患者分离到光滑念珠菌感染;3例分离到白色念珠菌感染。
病原体检测方法:入院时,所有患者采集上呼吸道咽拭子标本,通过RT-PCR进行病毒检测;通过吸痰或气管内吸痰,以确定可能的致病细菌或真菌。
但是,我们仍需思考,基于上述检测是否可能会存在漏诊?临床实际中是否有更多的患者存在细菌感染?
3、新型冠状病毒肺炎患者为何要关注细菌感染?
2003年SARS,2009年H1N1 到当前的新型冠状病毒肺炎,部分患者尤其是当免疫功能低下人群(如老年人、糖尿病患者、艾滋病患者、长期使用免疫抑制药物的患者及孕妇)极易合并细菌感染,严重影响患者预后。
细菌和病毒通过不同的作用方式促进感染的发生与进展;因此,病毒感染的同时应关注细菌感染。
>病毒的直接作用:病毒与特定的细菌细胞或细菌产物直接作用,从而达到浸润
>细菌的间接作用:病毒感染后产生易于细菌定植的环境,从而导致细菌感染
1、病毒通过 ① 与细菌细胞结合,② 利用细菌产物,从而促进病毒感染,而该作用对细菌没有明确的益处。
2、细菌通过以下作用而获益:
①病毒对宿主细胞的损伤有利于其他病原体感染;
②病毒感染使一个或多个宿主细胞更容易受到发生细菌定植
③协同作用:1)病毒诱导细菌细胞受体浓度增加;2)病毒对上皮细胞造成损害;3)共生细菌与病毒置换;4)病毒对宿主免疫系的抑制
4、新型冠状病毒肺炎患者的抗菌治疗不容忽视,但需要规范使用
当免疫功能低下人群感染2019-nCoV时,如老年人、糖尿病患者、艾滋病患者、长期使用免疫抑制药物的患者及孕妇,及时应用抗菌药物预防感染并加强免疫支持治疗有助于减少并发症及死亡率。
选择抗菌药物时:应覆盖一般常见病原体,部分需要覆盖非典型病原体;继发性细菌感染时,根据细菌培养结果和药物敏感性给予药物治疗。
可选择抗菌药物包括:头孢菌素类、喹诺酮类、碳青霉烯类、替加环素治疗MRSA、利奈唑胺及抗真菌药物;抗菌药物治疗时间为3-17天。
此外,北京协和医院「新型冠状病毒感染的肺炎」诊疗建议方案2.0中同样提及:根据患者临床和影像学表现,如不能除外合并细菌感染,轻症患者可口服针对社区获得性肺炎的抗菌药物,如二代头孢或氟喹诺酮类;重症患者需覆盖所有可能的病原体。
5、重症新冠状病毒肺炎患者更应重视继发细菌感染的问题
新型冠状病毒肺炎诊疗方案(试行第六版)中明确指出重型/危重型病例患者应尽早收入ICU治疗:
> 治疗原则:在对症治疗的基础上,积极防治并发症,治疗基础疾病,预防继发感染,及时进行器官功能支持
> 呼吸支持:氧疗、高流量鼻导管氧疗或无创机械通气、有创机械通气、挽救治疗
> 循环支持:充分液体复苏的基础上,改善微循环,使用血管活性药物,必要时进行血流动力学监测
> 康复者血浆治疗:适用于病情进展较快、重型和危重型患者
> 其它治疗措施:对于氧合指标进行性恶化、影像学进展迅速、机体炎症反应过度激活状态的患者,酌情知情其内使用糖皮质激素;可静脉给予血必净;可使用肠道微生态调节剂,维持肠道微生态平衡,预防继发细菌感染;有高炎症反应的危重患者,可考虑血浆转换、吸附、灌流、血液/血浆滤过等体外血液净化
6、恢复期血浆治疗概述
恢复期血浆(Convalescent plasma,CP)治疗是一种经典的适应性免疫治疗方法,在许多传染病的防治中已经应用了一个多世纪,曾成功应用于SARS、MERS和2009年H1N1大流行的治疗,取得了满意的疗效和安全性。
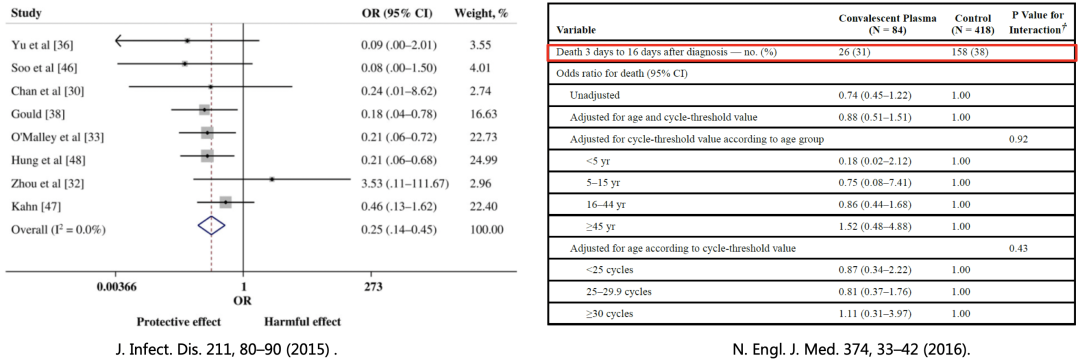
一项来自32项SARS冠状病毒感染和严重流感研究的meta分析显示,与安慰剂或无治疗组相比,CP治疗后的总死亡率有统计学意义上的显著降低(OR, 0.25; 95%置信区间,0.14–0.45);一项纳入84例恢复期血浆治疗Ebola病毒的研究显示,核酸确诊后2天内使用中和抗体滴度不明的恢复期血浆治疗对患者预后无明显获益。
基于对恢复期血浆治疗新冠状病毒疗效和安全性的争议,需对这一疗法进行试点研究。
7、恢复期血浆治疗方案
国家卫生与健康委员会《新冠肺炎康复者恢复期血浆治疗方案(试行第二版)》。流程为捐献者招募——血浆采集——血浆灭活——合格的具备中和抗体的血浆——受者血浆治疗。
适应症:病情进展较快、重症、危重症新冠肺炎患者。可以遵循以下原则:1、原则上病程不超过3周;新冠病毒核酸检测阳性或临床专家判定患者存在病毒血症。2、病情进展快的重症患者,危重症早期患者或经临床专家综合评估需要进行血浆治疗的患者。
使用禁忌和不宜使用的情形:1、使用禁忌:有血浆输注过敏史或人体血浆蛋白类制剂过敏史的;有枸橼酸钠过敏史的;有亚甲蓝过敏史的严禁使用经亚甲蓝病毒灭活血浆;其他严重过敏史的或血浆使用禁忌证的。
不宜使用的情形:危重症终末期,多器官功能衰竭无法逆转的;非中和新冠病毒目的的治疗;临床医生综合评估认为存在其他不宜输注情形的。
输注剂量:根据临床状况、患者体重等决定。通常输注剂量为200-500毫升。
8、恢复期血浆治疗重症COVID-19患者
方法:
患者:2020年1月23日至2020年2月19日期间,来自武汉市三家医院的10位重症COVID-19患者接受恢复期血浆治疗。
供者:三家参与医院的40位康复后恢复期COVID-19患者(中位年龄42y,IQR,32.5y-49y),需满足以下标准:1、体温正常超过3天;2、呼吸道症状消失;3、连续两次呼吸道痰标本SARS-CoV-2核酸检测阴性;发病3周后出院第4天采集患者血浆并进行血浆抗体中和活性检测。
血浆准备:血浆分离,分为200ml/份 4℃保存,亚甲蓝及医用血浆病毒灭活箱30min照射灭活。
治疗效果判定:1、血浆治疗的安全性;2、血浆治疗后3天内临床指标改善,包括体温正常、血氧饱和度正常、呼吸困难改善或肺内病灶不同程度的吸收。
10位重症患者,中位年龄52.5y(IQR, 45.0y-59.5y),从症状出现到入院中位时间6天,症状出现到接受CP治疗中位时间16.5天,3位患者为聚集性发病,最常见症状为发热、咳嗽、气促,4位患者有合并症。
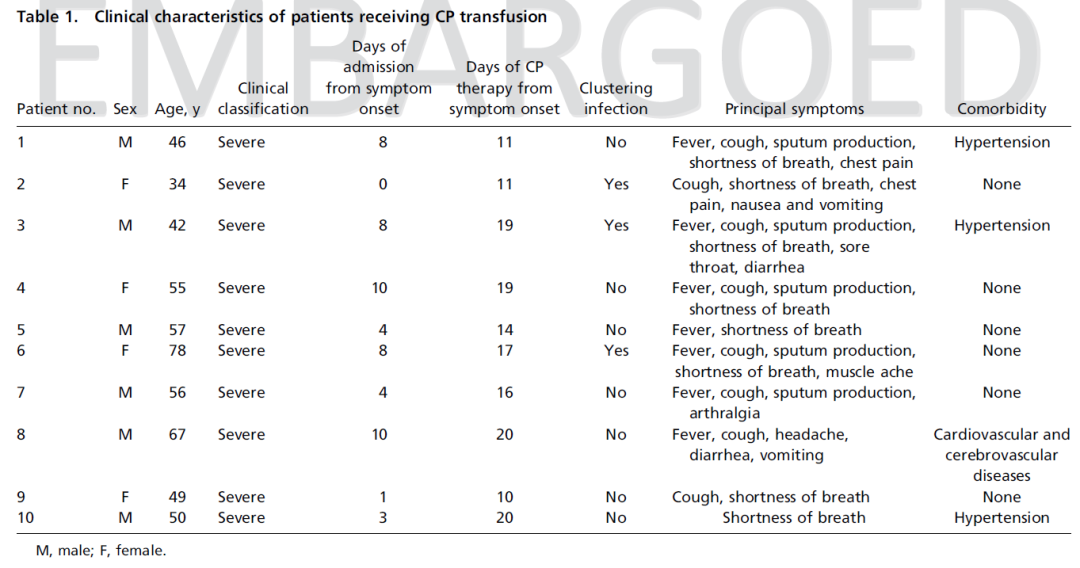
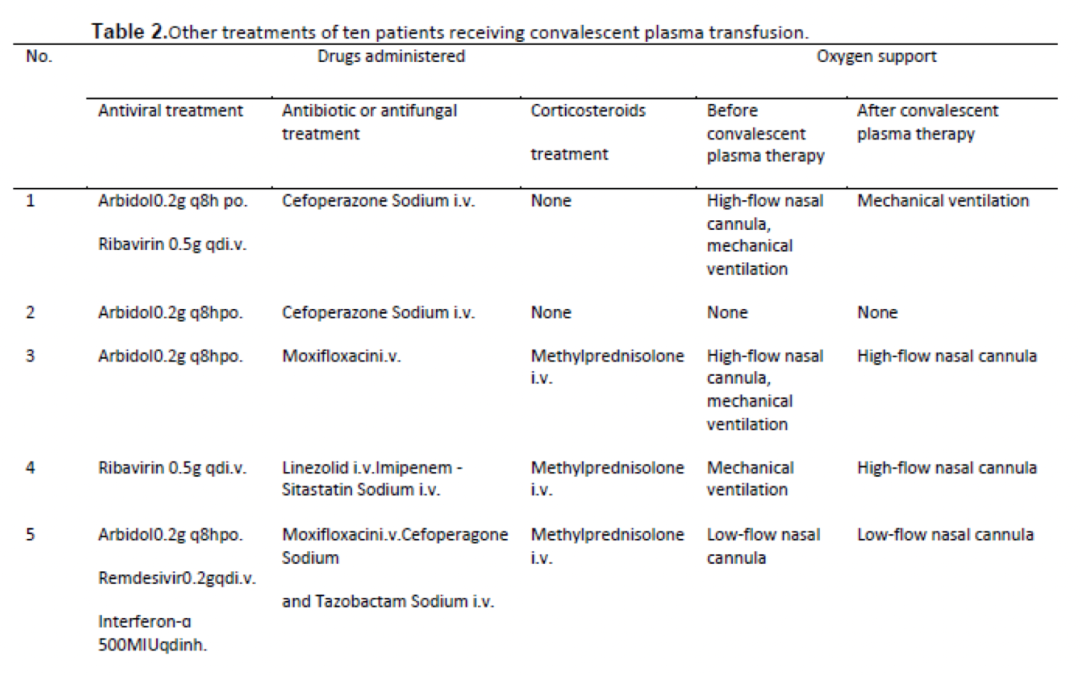
9位患者住院期间接受阿比朵尔单药治疗或联合瑞德西韦、利巴韦林、帕拉米韦、奥司他韦、干扰素α治疗,1位患者接受利巴韦林单药治疗。
患者合并感染时采用抗菌或抗真菌治疗。6例患者接受甲泼尼龙静脉注射(20 mg/24h)。
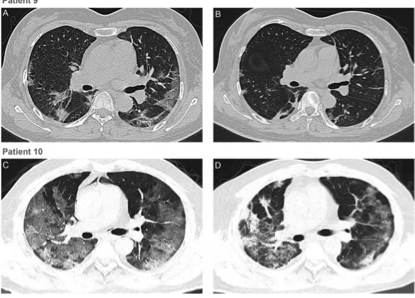
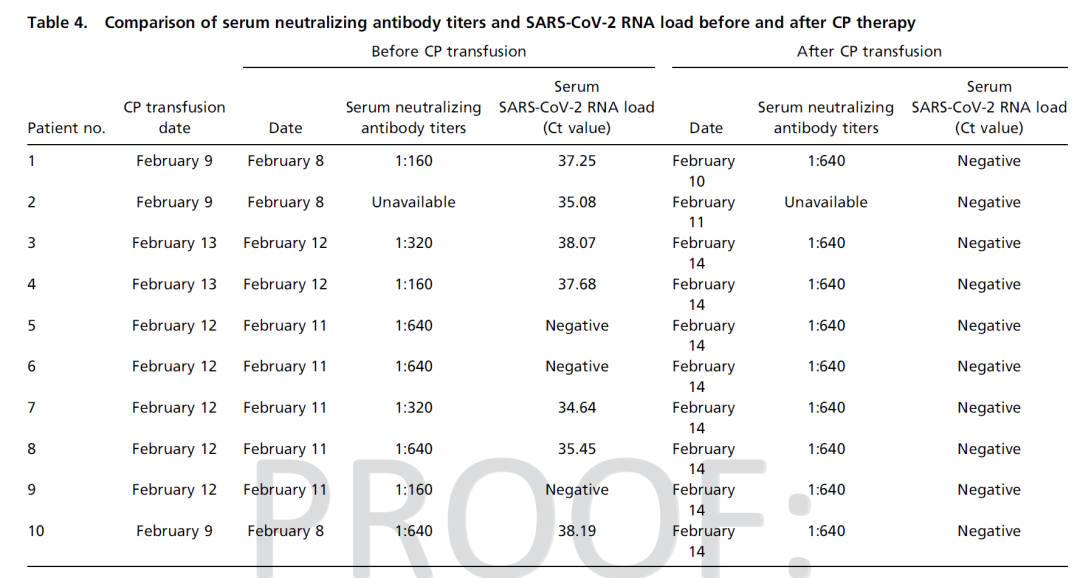
10例患者经CP输血后1 ~ 3 d内所有症状,特别是发热、咳嗽、气短、胸痛均消失或有明显改善。
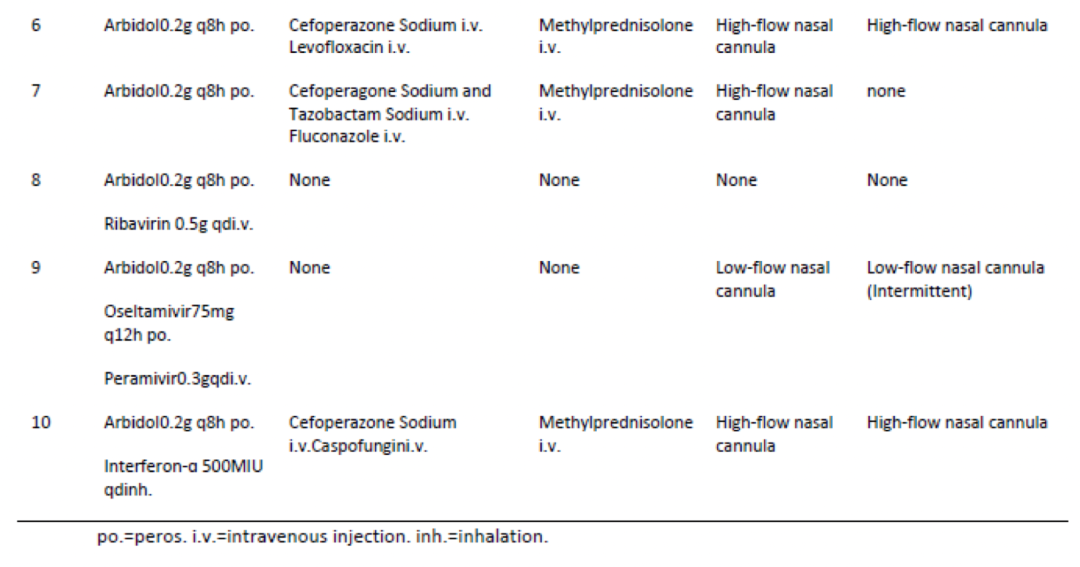
CP治疗前3例采用机械通气,3例采用高流量鼻导管吸氧,2例采用常规低流量鼻导管吸氧。CP治疗后,2例患者从机械通气过渡到高流量鼻导管吸氧,1例患者停用高流量鼻导管吸氧。此外,一名接受鼻导管吸氧治疗的患者,治疗后连续吸氧改为间断吸氧。
所有患者在CP后肺部病变均有不同程度的吸收。
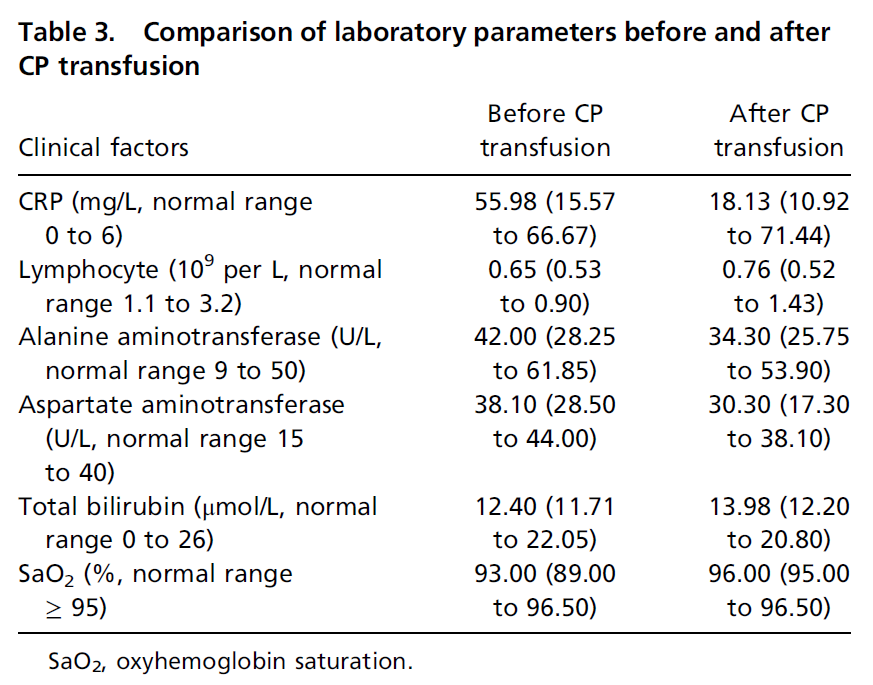
10位患者CP治疗后CRP下降,淋巴细胞数目增多,ALT,AST不同程度改善,血氧饱和度升高。
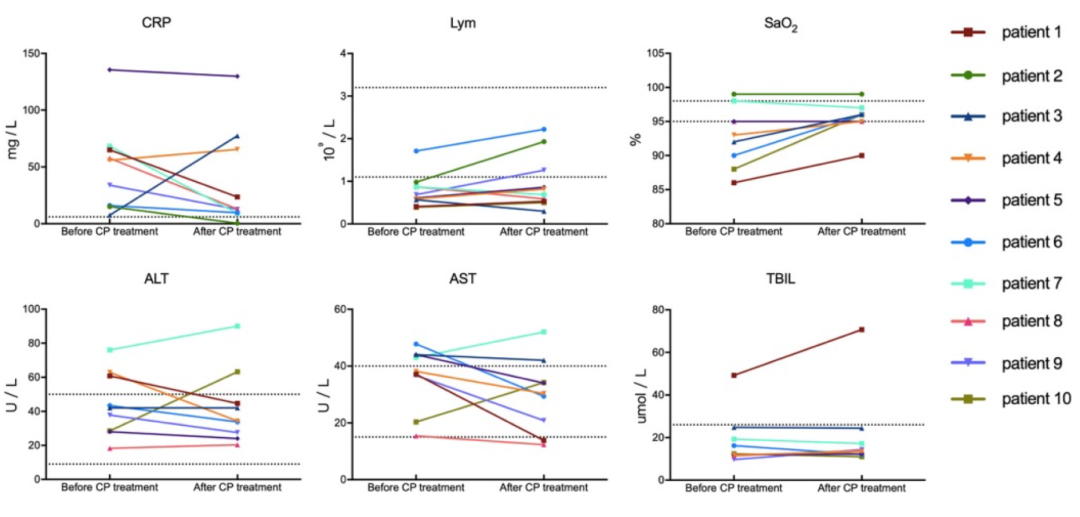
10位患者治疗前后血浆抗体滴度及核酸检测结果:中和抗体滴度增加明显,核酸检测全部转阴。
选取10位年龄及性别匹配的10例未使用恢复期血浆治疗的COVID-19患者作对照,患者的预后(分为死亡、明显改善、病情稳定)有统计学差异(p<0.001)。
参考文献
[1] Dandachi D et al. J Investig Med. 2018 Aug;66(6):957-965.
[2] CDC:https://www.cdc.gov/sars/
[3] CDC:https://www.cdc.gov/flu/pandemic-resources/h1n1-summary.htm
[4] CDC:https://www.cdc.gov/coronavirus/mers/about/index.html
[5] CDC:https://www.cdc.gov/coronavirus/2019-ncov/about/
[6] Cui J et al. Nat Rev Microbiol. 2019 Mar;17(3):181-192.
[7] Chenglong Xiong et al. Evolution and variation of 2019-novel coronavirus. http://dx.doi.org/10.1101/2020.01.30.926477
[8] Zhu N et al. N Engl J Med. 2020 Jan 24
[9] Chen N et al. Lancet. 2020 Jan 30. pii S0140-6736(20)30211-7
[10] Xu X et al. Sci China Life Sci. 2020 Jan 21.
[11] Daniel Wrapp et al. Cryo-EM Structure of the 2019-nCoV Spike in the Prefusion Conformation, bioRxiv (2020) doi:10.1101/2020.02.11.944462
[12] 刘冰, 刘雪菲, 周敏. 关注感染新型冠状病毒的糖尿病患者[J]. 中华内分泌代谢杂志, 2020, 36(00):E003-E003.
[13] Huang C et al. Lancet. 2020 Jan 24. pii: S0140-6736(20)30183-5
[14] Wan Y et al. J Virol. 2020 Jan 29. pii: JVI.00127-20.
[15] Yu Zhao et al. bioRxiv preprint first posted online Jan. 26, 2020
[16] Wei-jie Guan. et al.Clinical characteristics of 2019 novel coronavirus infection in China. medRxiv preprint doi: https://doi.org/10.1101/2020.02.06.20020974
[17] Channappanavar R et al. Semin Immunopathol. 2017 Jul;39(5):529-539
[18] 《新型冠状病毒肺炎诊疗方案(试行第六版)》国卫办医函[2020]145号
[19] 伦琴医疗:《新型冠状病毒肺炎影像分流指南(第一版)》
[20] Min Zhou et al. https://medrxiv.org/cgi/content/short/2020.03.24.20043117v1
[21] Y. Feng et al., COVID-19 with Different Severity: A Multi-center Study of Clinical Features. Am J Respir Crit Care Med 10.1164/rccm.202002-0445OC (2020).
[22] Chaolin Huang, Yeming Wang, Xingwang, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. The Lancet, 2020, 395(10223).
[23] Nanshan Chen, Min Zhou, Xuan Dong, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study[J]. The Lancet, 2020, 395(10223).
[24] Yingxia Liu, Yang Yang, Cong Zhang, et al. Clinical and biochemical indexes from 2019-nCoV infected patients linked to viral loads and lung injury[J]. Science China(Life Sciences), 2020, 63(03):364-374.
[25] Wang Dawei, Hu Bo, Hu Chang, et al. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China.[J]. JAMA, 2020.
[26] 卫生应急办公室. 1月23日新型冠状病毒感染的肺炎疫情情况[EB/OL]. [2020-02-10]. http://www.nhc.gov.cn/yjb/s3578/202001/5d19a4f6d3154b9fae328918ed2e3c8a.shtml
[27] Fei Zhou, Ting Yu, Ronghui Du, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020 Mar 11. pii: S0140-6736(20)30566-3.
[28] Guan W, Ni Z, Hu Y, et al. Clinical Characteristics of 2019 novel coronavirus infection in China[J]. N Engl J Med, 2020.
[29] 黄宪章等. 中华医院感染学杂志. 2003;13(11):1084-1086.
[30] Rice TW et al. Crit Care Med. 2012;40:1487-1498.
[31] Randolph AG et al. Pediatrics. 2011;128:e1450-1458.
[32] Almand EA et al. Viruses. 2017 Mar 21;9(3).
[33] J. Infect. Dis. 211, 80–90 (2015) .
[34] N. Engl. J. Med. 374, 33–42 (2016).
专家介绍

周敏
教授,主任医师,博士生导师,上海交通大学医学院附属瑞金医院呼吸与危重症医学科副主任;中华医学会呼吸病分会青年委员及慢阻肺学组委员,中国医师协会呼吸分会优秀中青年医师。
本文由《呼吸界》编辑 Jerry 整理、排版,感谢周敏教授的审阅修改!


