摘要
中华医学会呼吸病学分会感染学组近日发布了《糖尿病合并肺炎诊治路径中国专家共识》。
糖尿病患者因宿主免疫受损易合并各种感染,其中肺炎尤为多见。 我国糖尿病合并肺炎高发、机会性感染病原体致病增多但检出率低、重症肺炎多见且病死率高,导致严重的医疗和经济负担,因此亟须多学科专家共同探讨、制定规范的诊治路径,改善疾病预后。 结合国内外文献和我国临床实践,国内呼吸与危重症医学科、内分泌科、微生物科和临床药学等专家就糖尿病合并肺炎诊治路径制定本共识。
一、概述及流行病学
糖尿病是一组由多种原因所致的、以高血糖为特征的慢性代谢性疾病,我国流行病学研究结果显示多达1.139亿中国成年人患有糖尿病,4.934亿人处于糖尿病前期[1];美国研究结果显示,糖尿病患者的医疗支出是非糖尿病的2.3倍,其中50%的费用用于控制糖尿病并发症[2,3];肺炎是糖尿病常见并发症,在糖尿病患者中因肺炎导致住院者占26%,在糖尿病晚期直接死亡原因中肺炎占8%[4]。
糖尿病合并社区获得性肺炎(community-acquired pneumonia,CAP)的常见病原体包括肺炎链球菌、肺炎支原体、流感嗜血杆菌、肺炎克雷伯菌和金黄色葡萄球菌[5],流感病毒和腺病毒也是糖尿病合并CAP易感的病原体。此外,糖尿病患者合并特殊病原体感染如结核分枝杆菌、军团菌、奴卡菌、放线菌、曲霉、毛霉的机会也显著升高。糖尿病合并医院获得性肺炎(hospital-acquired pneumonia,HAP)的常见病原体为铜绿假单胞菌和鲍曼不动杆菌,碳青霉烯耐药肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae,CRKP)和耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)感染也很常见[5,6,7,8]。我国糖尿病患者肺炎高发、早期诊断率及疾病控制率低、病原体检出率低、病死率高,但缺乏大样本的研究数据。为降低我国糖尿病患者肺炎的患病率、提高治愈率、降低病死率,亟待建立适用于中国糖尿病合并肺炎患者的临床诊疗路径,中华医学会呼吸病学分会感染学组特邀内分泌、微生物、感染以及临床药学等领域的专家共同撰写了本共识,以供临床医生参考。
二、糖尿病易感肺炎的机制及高危因素
糖尿病易感肺炎的机制包括:(1)高糖微环境可使宿主肺泡巨噬细胞(alveolar macrophage,AM)表面伪足减少,膜表面受体及黏附分子表达异常,使AM对病原微生物识别及黏附能力降低,胞内溶菌酶合成减少致杀菌能力下降;此外,AM产生的促炎因子减少且抑炎因子增加,抗原递呈作用下降,最终导致肺局部防御功能缺陷[9,10]。(2)糖尿病晚期糖基化终末产物(advanced glycation end products,AGEs)显著增加,AGEs导致胶原蛋白降解减少,在肺泡外聚集,从而引起患者肺顺应性降低;AGEs与特异性的AGEs受体结合导致各种炎性因子(如白细胞介素-1和肿瘤坏死因子-α等)的分泌和释放增加,引起血管内皮损伤,从而导致肺血管通透性增加,肺结构和功能的改变使肺通气及弥散功能均受影响,导致病原微生物在肺内易于聚集[11]。(3)糖尿病患者呼吸道黏液纤毛清除功能减弱,自主神经病变可导致副交感神经调节支气管活动能力降低并引起支气管痉挛,使呼吸道分泌物潴留和病原微生物在局部寄植。(4)因胃动力不足、胃食管反流等误吸风险增加。
1、糖尿病合并肺炎的易感因素
高血糖是引起糖尿病患者发生肺炎的重要因素,长期血糖控制不佳及糖尿病病程≥10年的患者发生肺炎风险明显增加[12],男性较女性更易出现肺炎[13,14];入院后血清白蛋白≤40 g/L增加糖尿病患者HAP发生的风险。此外,糖尿病患者合并神经系统疾病导致反复误吸及合并其他疾病(如慢性呼吸系统疾病、慢性肾功能不全、营养不良、充血性心力衰竭等)都可以增加肺炎风险[8,12,14],医疗干预措施如肾脏透析增加感染MRSA肺炎的风险。
2、影响糖尿病合并肺炎预后的危险因素
在合并Ⅱ型糖尿病的肺炎住院患者中入院血糖增高或过低都会增加肺炎病死率[15],糖尿病合并CAP的患者入院血糖间隙(即感染后血糖较平均血糖升高的幅度)与不良预后呈明显相关;入院时高糖化血红蛋白(hemoglobin A1C,HbA1C)水平(>8%)与肺炎严重性相关,预示着高病死率[8]。高龄(≥65岁)是糖尿病合并肺炎患者死亡的独立危险因素[8,13,15,16],65岁以上糖尿病患者年龄每增加1岁肺炎的死亡风险增加16%[17],在医院获得性MRSA肺炎患者中年龄每增长10岁死亡风险增加1.4倍[18];CURB-65评分≥3分是糖尿病合并金黄色葡萄球菌肺炎死亡的独立预测因素[8];糖尿病合并肺炎克雷伯菌肺炎患者死亡的独立预测因素包括男性、白蛋白<35 g/L、合并血流感染以及有创机械通气[7]。
三、糖尿病合并肺炎的诊断路径
糖尿病患者出现肺部阴影,伴或不伴有发热或呼吸道症状时,建议按以下思路诊断指导治疗(图1)。
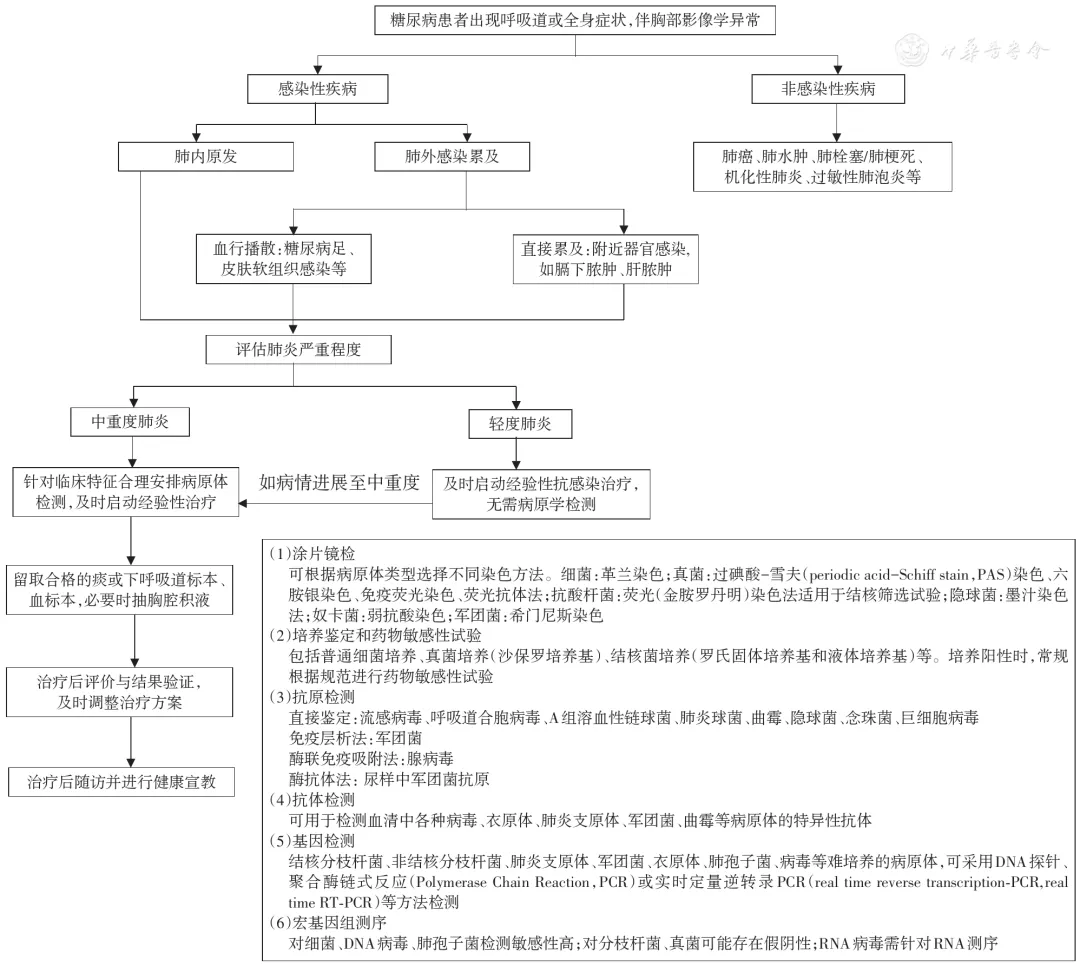
【图1】糖尿病合并肺炎的诊断路径
1、鉴别是感染性疾病还是非感染性疾病:
首先需详细询问病史、进行体格检查。感染性疾病的临床特征包括发热、咳嗽伴有脓痰,可有肺实变体征或闻及湿性啰音等,实验室检查可有血白细胞升高或降低、中性粒细胞核左移、降钙素原或C反应蛋白升高等,影像学表现为片状影、斑片状影、实变影或结节影伴有空洞或晕征,可伴有胸腔积液;如病毒性感染可表现为间质性渗出,病原学检查有助于鉴别。需注意的是,感染性疾病与非感染性疾病可以合并存在。
2、鉴别是肺内原发感染还是肺外感染累及肺:
糖尿病患者除易并发肺部感染之外,其他多部位感染也较常见,如糖尿病足、皮肤软组织感染、肝脏及尿道感染等,这些感染均可通过血行播散到肺,或腹腔脏器感染直接累及肺。肺部感染性疾病亦有可能发生播散累及肺外其他脏器。鉴别感染来源的要点是进行详细的病史询问和体格检查,根据症状和阳性体征选择相应的检查。如浅表器官超声鉴别皮肤软组织感染,腹腔脏器超声或CT鉴别深部脏器感染如肝脓肿等,胸腔超声评估是否合并脓胸等,如出现肺外感染需进行积极对症处理,如肝脓肿需要穿刺引流等。
3、评估病原体类型:
肺炎最常见的胸部影像学表现为实质性渗出病变,伴或不伴有胸腔积液。虽然根据影像学表现难以确定是哪种病原体感染,但可以给临床重要的提示。病毒性肺炎通常表现为磨玻璃样阴影,而腺病毒肺炎可表现为实变影;大片肺实变伴叶间裂下坠,蜂窝状脓肿提示肺炎克雷伯菌肺炎可能;肺叶浸润、液气囊腔,早期出现空洞、脓胸,需警惕金黄色葡萄球菌肺炎。糖尿病除了常见病原体感染外,合并机会性感染病原体的概率增加。肺部真菌病以曲霉最常见,多表现为以胸膜为基底的楔形影、结节或团块影,内有空洞;如有「反晕征」需考虑肺毛霉病的可能。糖尿病患者易并发肺结核,其影像学改变可不同于典型肺结核表现[19,20],临床抗感染效果欠佳时应进一步完善相关检查以明确病因。
轻症肺炎患者建议尽早经验性抗感染治疗,无需行病原学检测,中重度肺炎患者需根据临床特征选择病原学检测方法,同时行经验性治疗。48~72 h后对初始抗感染治疗反应及病原学检查结果进行评估。当病情无改善、病原学检查阳性时,应仔细评估阳性结果的临床意义、是否有并发症及其他部位感染,必要时调整抗菌药物治疗方案;病情无改善且病原学检查阴性时,需要进一步完善病原学检查及排查非感染性疾病。
四、评估糖尿病合并肺炎的严重程度
糖尿病合并CAP严重程度评估可以采用CRB-65、CURB-65或肺炎严重指数(pneumonia severity index,PSI)评估体系,CURB-65对评估糖尿病合并肺炎严重程度不够全面和特异。糖尿病合并肺炎的严重程度评估可参考我国CAP诊疗指南关于重症肺炎的诊断标准:符合下列1项主要标准或≥3项次要标准者可诊断为重症肺炎,主要标准:(1)气管插管需要机械通气;(2)脓毒症休克需要血管活性药物。次要标准:(1)呼吸频率≥30次/min;(2)PaO2/FiO2≤250 mmHg(1 mmHg=0.133 kPa);(3)多肺叶浸润;(4)意识障碍和(或)定向障碍;(5)血尿素氮≥7 mmol/L;(6)低血压需要积极的液体复苏[21]。
在PSI评分系统中,血糖>14 mmol/L者评分增加10分,合并充血性心力衰竭和脑血管疾病者评分各增加10分,合并血尿素氮>11 mmol/L者评分增加20分。因此当糖尿病患者血糖控制不佳、合并心脑血管疾病和肾功能异常时,PSI评分往往较高,提示发生重症肺炎的风险增加。
HAP常用的病情严重度评分系统有序贯器官衰竭评分(sequential organ failure assessment,SOFA),急性生理与慢性健康评分(acute physiology and chronic health evaluation,APACHE-Ⅱ)、IBMP-10等。对于非重症监护室(intensive care unite,ICU)患者,快速SOFA评分(qSOFA)预测住院病死率的效能优于SOFA。
五、糖尿病合并肺炎的治疗路径
(一)糖尿病合并肺炎的经验治疗
1、糖尿病合并肺炎初始经验性治疗抗感染药物选择的原则:
(1)首先确定患者发病的场所是社区还是院内,然后根据临床及影像学特征推测最有可能的病原体,并根据患者病情严重度及耐药风险进行分层治疗;覆盖常见病原体兼顾患者基础疾病、器官功能状态、药物的药动学/药效学(pharmacokinetics/pharmacodynamics,PK/PD)特性、药物过敏史等选择恰当的抗感染药物和给药方案。
(2)我国不同地区病原流行病学分布和抗感染药物耐药率差异明显,所以治疗推荐仅仅是原则性的。经验性治疗应根据本地区及本医院的病原体分布及耐药特点选择抗感染药物。
(3)选择抗感染药物时还要注意患者糖尿病相关的脏器损害程度,如糖尿病肾病;要注意抗菌药物在肺组织局部的浓度和抗菌活性;注意是否可能与降糖药物产生相互作用,从而导致血药浓度降低或血糖代谢异常等。
(4)如果初始治疗失败或病情反复,需要特别关注糖尿病患者是否伴有肺外感染病灶,如皮肤软组织感染(包括糖尿病足)、肺外脓肿(如肝脓肿)或伴发血流感染形成迁徙性病灶;此外还需要关注机会性病原体感染风险增加(如分枝杆菌、军团菌、曲霉、毛霉及肺孢子菌等)。
(5)如经验性选用喹诺酮类药物,需要警惕其可能带来的肺结核诊断的延误及血糖异常波动等问题。
2、糖尿病合并CAP初始经验性治疗抗感染药物的选择:
见图2。

【图2】糖尿病合并社区获得性肺炎(CAP)初始经验性抗感染药物选择
3、糖尿病合并HAP/呼吸机相关性肺炎(ventilator-associated pneumonia,VAP)初始经验性治疗抗感染药物的选择(图3):
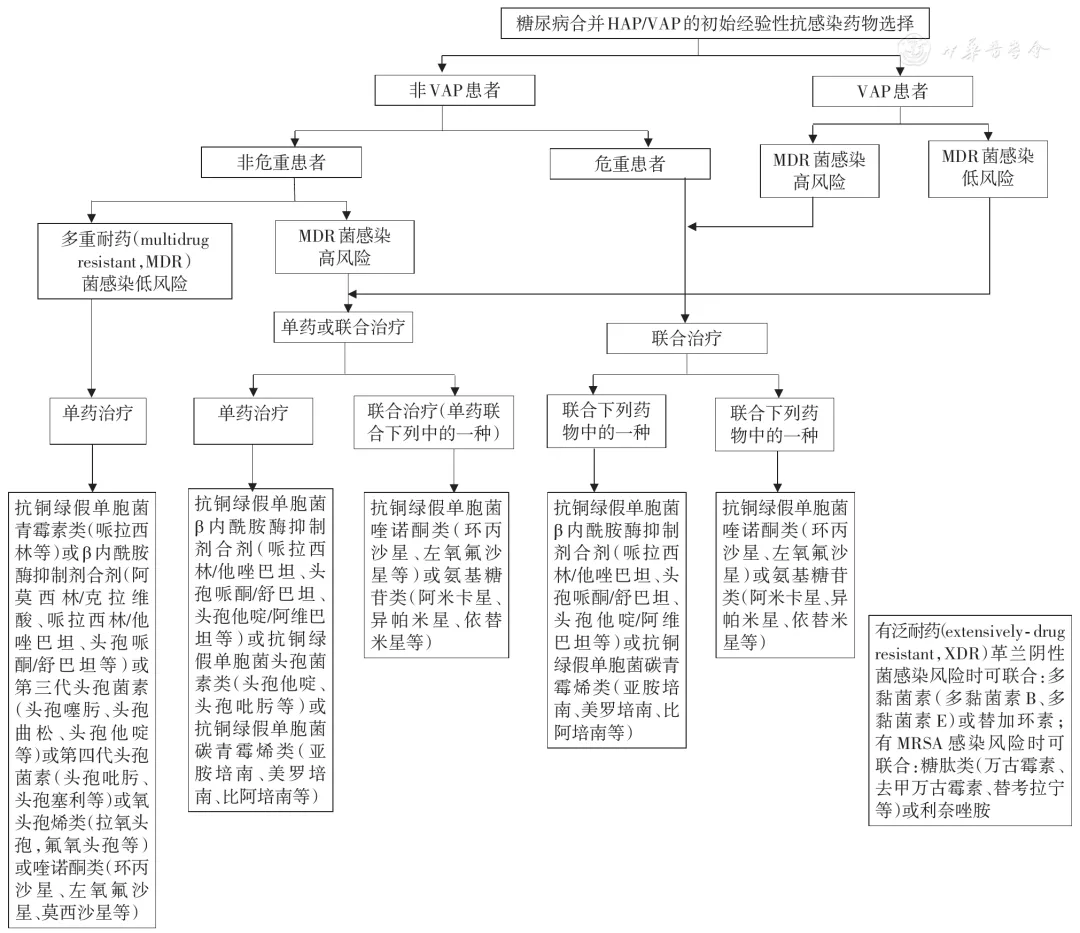
【图3】糖尿病合并医院获得性肺炎(HAP)/呼吸机相关性肺炎(VAP)的初始经验性抗感染药物选择
糖尿病合并HAP/VAP的初始经验性治疗应根据患者病情严重度及耐药危险因素等参数进行分层治疗,糖尿病住院患者尤其要关注长期卧床引起的褥疮等皮肤软组织葡萄球菌感染继发血流感染导致全身感染播散,此外由于各种医疗措施导致皮肤黏膜屏障破坏(如气管插管、留置胃管或深静脉导管等)引起肺炎克雷伯菌、念珠菌等内源性感染风险增加,肾脏透析增加MRSA感染风险。
(二)目标性抗感染治疗的药物选择及疗程
糖尿病患者对机会性病原体感染及耐药菌感染的风险均增高且常存在多种病原体混合感染,因此在解读基于核酸的分子生物学方法等敏感度较高的检测结果时,需谨慎鉴别区分感染与定植或污染;糖尿病患者目标性抗感染疗程一般在7 d以上,对于初始抗感染治疗无效、病情危重、泛耐药(extensively drug-resistant,XDR)或全耐药(pandrug-resistant,PDR)菌感染、肺脓肿、脓胸或坏死性肺炎者,应酌情延长疗程;金黄色葡萄球菌、铜绿假单胞菌、克雷伯菌属或厌氧菌等容易导致肺组织坏死,抗感染疗程可延长至14~21 d,但可以考虑静脉抗感染药物序贯为同类的口服药物[21,22]。
(三)糖尿病合并肺炎的血糖管理原则
糖尿病合并肺炎患者住院期间的血糖管理尤为重要。中国住院患者血糖管理专家共识[23]建议,住院期间血糖水平持续且明显高于7.8 mmol/L则考虑高血糖状态,提示患者有可能需要接受或调整降糖治疗。
1、对需要住院的糖尿病合并肺炎患者进行入院评估:
患者入院时均应详细询问既往糖尿病病史及降糖药物使用情况;既往有低血糖事件者,评估发生低血糖的风险程度;评估肺炎的病情,包含年龄、预期生存期、是否存在多器官功能不全、精神或智力障碍、心脑血管疾病既往史和(或)风险程度、是否需要重症监护、营养状态及进食情况等。同时需完善全天血糖水平监测,掌握血糖波动情况,必要时检测HbA1C水平以明确患者住院前3个月是否已经存在血糖控制不佳的情况。
2、对糖尿病合并肺炎患者设定个体化的血糖管理目标[23]:
见表1。

3、糖尿病合并肺炎患者血糖管理的主要措施[24]:
对于大多数糖尿病合并肺炎患者,胰岛素是控制血糖的首选治疗;需进行重症监护的患者推荐采用持续静脉小剂量胰岛素输注,监护期间可根据血糖波动情况随时调整胰岛素剂量;病情稳定拟改用胰岛素皮下注射时,需在停止静脉输注胰岛素前1~2 h开始接受皮下胰岛素注射,同时,每日皮下胰岛素注射的总剂量可以在原每日静脉胰岛素注射的总剂量基础上减少约20%~40%。
不需要进行重症监护的患者推荐皮下胰岛素注射治疗,无法正常进食、需肠内或肠外营养的患者,根据不同营养摄入情况制定血糖管理方案,见表2。

如糖尿病合并肺炎患者入院前接受口服降糖药物,入院后一般情况良好,血糖较平稳,进食规律,且没有使用口服降糖药物的禁忌证可以考虑继续应用其入院前已经使用的降糖方案,注意密切监测血糖并及时调整方案。建议所有糖尿病合并肺炎患者接受密切随访,出院1个月内接受内分泌专科评估进行适当的降糖方案调整并制订长期随访方案。
(四)抗感染药物与糖尿病治疗药物相互作用
1、降糖药物与抗菌药物相互作用:
由于糖尿病患者平时常规使用降糖药物,有些降糖药物与抗菌药物存在相互作用,从而对患者的血糖造成影响,在抗感染治疗中需要引起注意。
(1)二甲双胍:二甲双胍在体内无需肝脏CYP450酶代谢,直接以原型经肾脏排泄,目前尚无与抗菌药物合用出现相互作用的报道。
(2)α-糖苷酶抑制剂:伏格列波糖在胃肠道内几乎不吸收入血,主要以原型经肠道排泄,无药物相互作用的报道。阿卡波糖原型药物在肠道内极少被吸收,口服生物利用度为1%~2%,其在肠道内的代谢产物35%吸收入血[25,26],但血药浓度不受抗菌药物影响。
(3)磺脲类:磺脲类药物在体内主要经CYP2C9代谢,合并使用CYP2C9抑制剂氟康唑、伏立康唑、咪康唑、环丙沙星和氯霉素可能减慢其代谢,增加低血糖风险,合用时需加强血糖监测;中成药消渴丸中含有格列本脲,合并以上抗菌药物时应注意。克拉霉素抑制P-糖蛋白(P-glycoprotein,P-gp)而提高格列本脲的药时曲线下面积(area under the curve,AUC),两药合用可使格列本脲的血药峰浓度升高1.25倍,AUC增加1.35倍,临床使用时应加强血糖监测[27]。
(4)格列奈类:瑞格列奈经CYP2C8和CYP3A4代谢,那格列奈主要经CYP2C9和CYP3A4代谢,米格列奈直接经Ⅱ相代谢酶UGT代谢,极少量经CYP2C9代谢。瑞格列奈与CYP3A4/5强抑制剂(如酮康唑、伊曲康唑、克拉霉素等)合用时可能导致血药浓度升高,增加低血糖风险。
(5)二肽基肽酶Ⅳ(dipeptidyl peptidase-4,DPP-4)抑制剂:沙格列汀主要通过CYP3A4/5代谢,与CYP3A4/5强抑制剂(如酮康唑、伊曲康唑、克拉霉素等)合用时,能显著升高沙格列汀的血浆药物浓度,合用时沙格列汀的日剂量不超过2.5 mg。西格列汀少量经CYP3A4和CYP2C8代谢,有临床意义的相互作用比较少。阿格列汀、利格列汀和维格列汀在人体内基本不经CYP450酶代谢,不存在药物代谢酶相关的相互作用。
(6)噻唑烷二酮类:罗格列酮、吡格列酮主要经CYP2C8代谢,与抗菌药物合用相互作用少见。
(7)钠-葡萄糖共转运蛋白2(sodium-glucose cotransporter 2,SGLT-2)抑制剂:达格列净主要经UGT1A9代谢为无活性的达格列净3-O-葡糖苷酸,仅有极少量经CYP450酶代谢。恩格列净在体内经UGT2B7、UGT1A3、UGT1A8、UGT1A9代谢为无活性的葡糖苷酸,不抑制、诱导CYP450酶,不抑制UGT1A1,药物相互作用少见。卡格列净仅有7%经CYP3A4代谢,不诱导、抑制CYP450酶。
2、氟喹诺酮类抗菌药物对血糖的影响:
多种抗菌药物均可导致血糖紊乱,如氟喹诺酮类和大环内酯类等。其中氟喹诺酮类药物与血糖异常升高或降低有关[28,29,30],其引起血糖紊乱的机制尚不明确,可能通过副交感神经使胰岛细胞中的三磷酸腺苷敏感的钾离子通道受阻,导致胰岛素分泌紊乱而出现胰岛素异常的升高和降低等有关[29]。使用加替沙星、左氧氟沙星、环丙沙星和阿奇霉素的患者低血糖的每千例发生率分别为0.35、0.19、0.10和0.07,而高血糖的每千例发生率分别为0.45、0.18、0.12和0.10[30]。在糖尿病患者中,加替沙星、左氧氟沙星和环丙沙星较之阿奇霉素引起低血糖的相对危险度(odds ratio,OR)依次为4.3、2.1和1.1,引起高血糖的OR依次为4.5、1.8和1.0。加替沙星和左氧氟沙星引起严重血糖异常风险显著高于阿奇霉素,而环丙沙星和阿奇霉素相比,差异不大。
氟喹诺酮类药物引起的血糖异常与年龄呈正相关,60岁以上糖尿病患者发生血糖异常的几率较高[29,31],可能与老年人生理机能减退,致垂体前叶、肾上腺皮质功能下降,当发生血糖异常时正常反调节功能减低,不能及时分泌调节血糖的激素有关,治疗过程中要严密监测血糖,最大限度地降低可能出现血糖异常的风险,确保用药安全。
六、糖尿病合并肺炎的预防
预防感染、减少感染相关的并发症,对降低糖尿病相关病死率有重要意义。
1、疫苗接种:
美国糖尿病协会推荐[32],糖尿病患者需接种肺炎链球菌多糖疫苗。65岁以上的患者如果既往曾经接种过疫苗,接种时间超过5年者则需再接种一次。2~64岁糖尿病患者应接受23价肺炎链球菌多糖疫苗(23-valent pneumococcal polysaccharide vaccine,PPSV23);年龄≥65岁时,无论接种史如何都需要重新接种PPSV23疫苗。流感疫苗接种可显著降低流感流行期糖尿患者群的发病率、住院率和病死率[33],建议糖尿病患者每年都要接种流感疫苗。
2、葡萄球菌去定植:
保持皮肤清洁,加强口腔卫生,增加自身抵抗力可预防感染的发生。对入住ICU的重症患者研究结果显示:入ICU时及24 h内采集鼻和咽拭子进行MRSA主动筛查,对MRSA阳性患者进行鼻部莫匹罗星软膏涂抹,一日3次,持续5 d,可去定植,从而有效防控MRSA肺炎的发生[34,35]。对皮肤软组织损伤携带或可能感染MRSA的患者进行治疗或清除细菌时,如果是莫匹罗星敏感的MRSA,推荐在全身应用敏感抗菌药物的前提下,局部使用莫匹罗星。

参与撰写的专家组成员(按姓氏拼音排序):
包志瑶(上海交通大学医学院附属瑞金医院呼吸与危重症医学科);毕宇芳(上海交通大学医学院附属瑞金医院内分泌科);陈愉(中国医科大学附属盛京医院呼吸与危重症医学科);程齐俭(上海交通大学医学院附属瑞金医院北院呼吸与危重症医学科);范红(四川大学华西医院呼吸与危重症医学科);方洁(上海交通大学医学院附属瑞金医院药剂科);韩立中(上海交通大学医学院附属瑞金医院临床微生物科);李玉苹(温州医科大学附属第一医院呼吸与危重症医学科);乔洁(上海交通大学医学院附属第九人民医院内分泌科);苏欣(东部战区总医院呼吸与危重症医学科);夏雨(北京大学人民医院药剂科);叶枫(广州医科大学附属第一医院广州呼吸健康研究院呼吸与危重症医学科/呼吸疾病国家重点实验室/国家呼吸系统疾病临床医学中心);张静(复旦大学附属中山医院呼吸与危重症医学科);周华(浙江大学医学院附属第一医院呼吸与危重症医学科)
总执笔:周敏(上海交通大学医学院附属瑞金医院呼吸与危重症医学科)
指导专家组成员
呼吸专业(按姓氏拼音排序):曹彬(中日友好医院呼吸中心/呼吸与危重症医学科);贺蓓(北京大学第三医院呼吸与危重症医学科);黄怡(海军军医大学第一附属医院呼吸与危重症医学科);瞿介明(上海交通大学医学院附属瑞金医院呼吸与危重症医学科);施毅(东部战区总医院呼吸与危重症医学科);张湘燕(贵州省人民医院呼吸与危重症医学科)
内分泌专业(按姓氏拼音排序):宁光(上海交通大学医学院附属瑞金医院内分泌科);王卫庆(上海交通大学医学院附属瑞金医院内分泌科)
微生物专业:倪语星(上海交通大学医学院附属瑞金医院临床微生物科)
* 参考文献(略)
作者:中华医学会呼吸病学分会感染学组
通信作者:
瞿介明,Email:jmqu0906@163.com
周敏,Email:doctor_zhou_99@163.com
本文来源自:中华结核和呼吸杂志2020,43(8):639-647
(DOI:10.3760/cma.j.cn112147-20200114-00021)


