慢性阻塞性肺疾病(COPD)是全球关注的慢性病之一。据世界卫生组织统计每年约有300万人死于COPD,而肺癌是影响和危害人类健康的常见恶性肿瘤之一,其发病患者占所有肿瘤患者的12%,每年约130万人死于肺癌,小细胞肺癌占所有肺癌的15%。当小细胞肺癌遇上COPD等于「雪上加霜」,治疗上如何突破「瓶颈」是临床医生面临的极大挑战。
流行病学研究结果显示肺癌与COPD并存现象严重。Anthonisen 等[1]对5887 例轻、中度COPD患者随访14.5年发现,33%的COPD患者死于肺癌,而50%-70%的肺癌患者合并COPD。COPD是影响肺癌发病率及死亡率的一个重要且独立的危险因素。吸烟的COPD患者发生肺癌的风险是肺功能正常吸烟者的4-5倍;也有研究表明COPD患者不论是轻、中度还是重度,其吸烟量>400支/年的肺癌患病率均明显高于吸烟量<400支/年的患者。吸烟量越多、吸烟年限越长、开始吸烟年龄越早,肺癌死亡率越高。吸烟与支气管上皮细胞纤毛脱落、上皮细胞增生、鳞状上皮化生、核异形变密切相关。表明吸烟是老年COPD患者并发肺癌的独立危险因素。
慢性炎症在COPD与肺癌相关的发病机制中发挥重要的核心作用。在COPD患者中,支气管及细支气管上皮的纤毛清除功能障碍导致吸入的颗粒物积聚,呼吸道上皮细胞与致癌物质的接触时间延长,均可促使肿瘤的发生。同时,在肺癌合并COPD的患者中,慢性呼吸道炎症导致支气管上皮和肺组织微环境的改变,机体处于特殊的肿瘤微环境中,这些炎性细胞可诱导肿瘤细胞的免疫逃逸,诱发肺癌。
COPD患者和肺癌患者的临床症状会重叠,因此会造成延误诊断或漏诊
对于COPD患者,如出现咳嗽性质发生改变、迁延不愈、喘息持续加重、平喘治疗效果不佳、伴痰血、胸闷、胸痛或突然出现的血糖异常、进行性消瘦、抗感染效果不佳、声音嘶哑、胸腔积液、较长时间的低热等症状时需要引起高度注意,应及时行X线胸片或胸部CT检查。此外,动态观察COPD患者肺功能情况,在肺功能下降的基础上,发现弥散功能下降明显,应考虑并发肺癌的可能性。对于中央型肺癌积极的支气管镜检查有助于早期发现并明确病理类型,但对于一些COPD患者,由于肺功能差,难以承受支气管镜的操作。反复多次痰脱落细胞学检查可作为诊断肺癌的一个实用且方便的方法。
在临床中遇到的小细胞肺癌确诊病例,很多并不单纯以肺表现为主,有20-30%的为肺外表现。病人多以脑部症状、神经方面症状,或是其他症状前来就诊,几乎辗转多个科室才查出肺癌,再经支气管镜或例如肺活检等其他检测手段,最终确诊为小细胞肺癌。
小细胞肺癌治疗30年探索,曲折前行,数十靶向药物折戟沉沙,IMpower133,首个双阳性研究终点实验
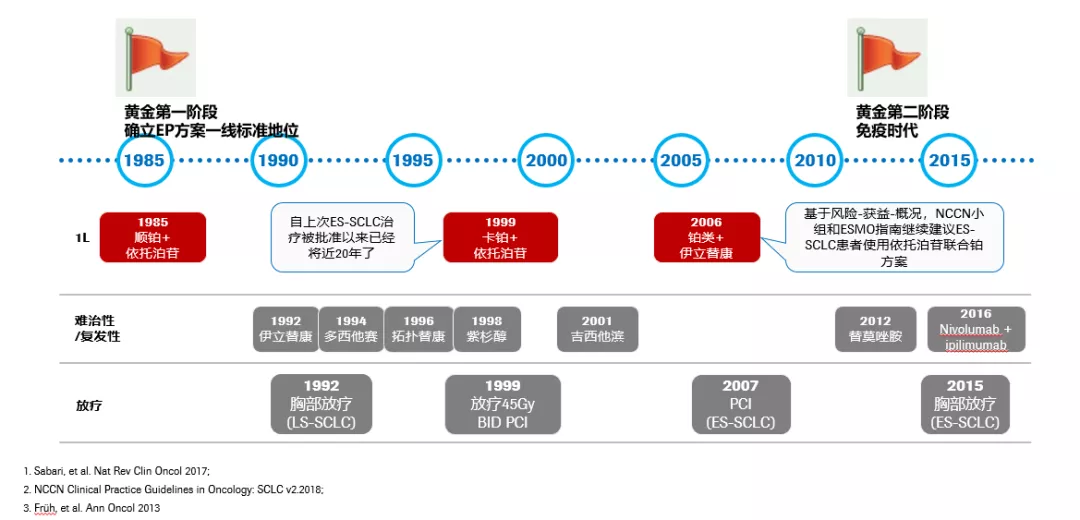
小细胞肺癌的治疗,过往40年,研究及治疗发展历程甚少突破,主要集中在化疗及放疗领域。化疗领域,自1980年以来,含铂双药方案是小细胞肺癌的标准治疗,但与先前的治疗相比,总生存期仍未突破一年。所以,治疗领域中的需求并没有被满足。
放疗领域,在1992年,对15年中进行了16项随机试验的Meta分析证实:胸部放疗vs未进行胸部放疗的患者死亡风险降低14%,确立了胸部放疗在LS-SCLC的地位。1999年,Intergroup 0096研究证实,BID方案较QD方案:显著延长中位OS,提高2年/5年生存率,同年荟萃分析证实PCI可显著降低LS-SCLC患者脑转移及死亡风险。2007年,EORTC研究首次证实PCI用于广泛期SCLC的生存获益;2015年,CREST研究证实化疗后全身缓解的广泛期SCLC患者,给予胸部放疗可显著延缓疾病进展,延长生存期。
纵观小细胞肺癌的治疗进展,可见无论化疗还是放疗,进展都非常缓慢。因此我们一定会想靶向治疗在小细胞肺癌的进展如何?
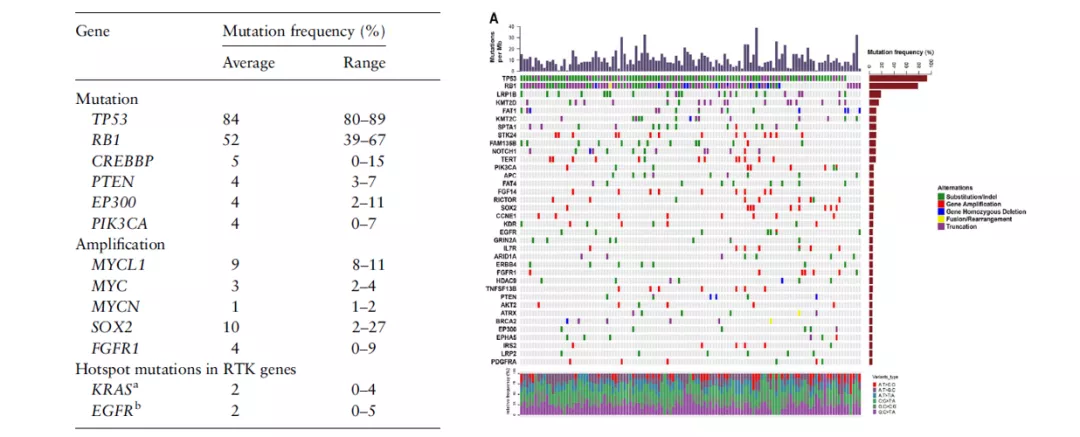
首先看一下小细胞肺癌突变的基因和频率,无论国内还是国外的研究,排在前两位的基因分别是TP53和RB1,基本在80%左右,但并没有针对TP53这个基因的靶向药物,主要因为TP53和RB1是肿瘤的抑制基因,与NSCLC里常见的驱动基因不同的是,它们抑制细胞增生,如果要把它们调整成正常基因,从目前角度来看是很有难度的。当然同样我们也可以看到比如PIK3CA,KRAS,FGFR等驱动基因,但是的确是肿瘤领域研究的难点,迄今为止很少药物可以进入Ⅲ期,或以失败告终。
众多明星药物PARP抑制剂,DLL3抗体:Rova-T等针对小细胞肺癌的数十项靶向治疗研究都都铩羽而归。因此,小细胞肺癌的治疗近40年来没有任何突破性进展。主要原因在于SCLC遗传变异复杂,单靶点的抑制对小细胞肺癌治疗作用有限,没有在分子水平上对患者进行选择。
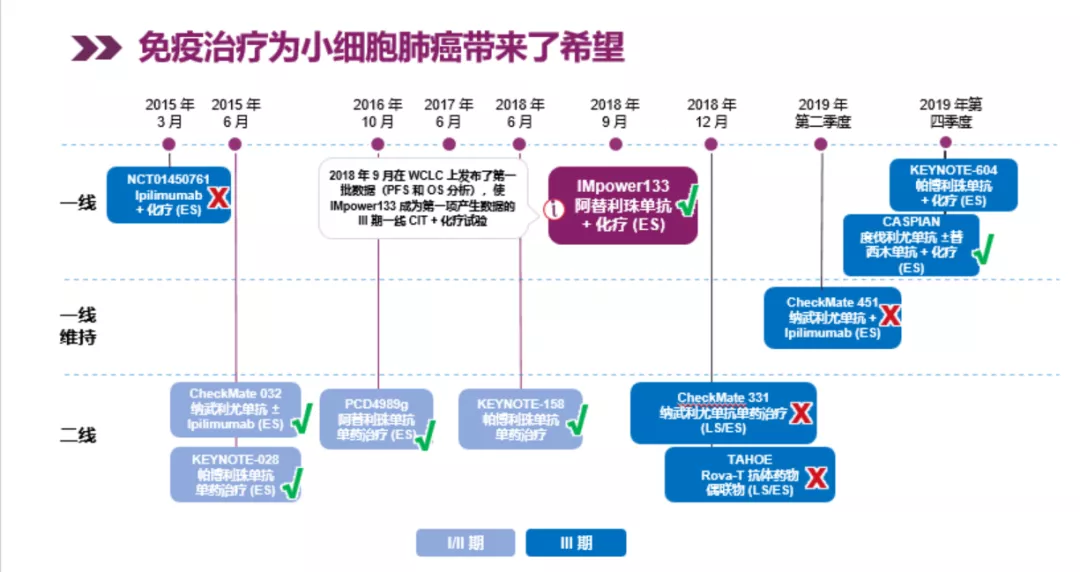
从小细胞肺癌免疫治疗进展看,整个探索过程异常艰辛,但也充满希望。从免疫检查点抑制剂,例如CTLA-4、PD-1、PD-L1抑制剂、免疫检查点抑制剂联用的一些药物,例如PARP抑制剂;以及被动免疫治疗,例如CAR-T疗法(嵌合抗原受体T细胞免疫疗法)等在小细胞肺癌都有探索性研究。
免疫治疗最早要从伊匹单抗说起,第一个上市、用于治疗黑色素瘤,通过阻断T细胞上的「刹车」蛋白CTLA-4的活性,恢复免疫系统对抗癌的能力,但伊匹单抗用于小细胞肺癌治疗不能单用,需与纳武利尤单抗(简称O药)联用,且该方案不作为一线方案;靶点为PD-1的O药和K药(帕博丽珠单抗),通过打破肿瘤细胞对免疫细胞的抑制,重新激活免疫细胞,从而达到控制癌细胞的目的,两者在小细胞肺癌都是二线适应症;阿替利珠单抗和化疗联用的IMpower133研究成为30年首个一线双终点阳性的实验,作为一线治疗方案,结束了小细胞肺癌一线治疗没有新药突破的窘境。
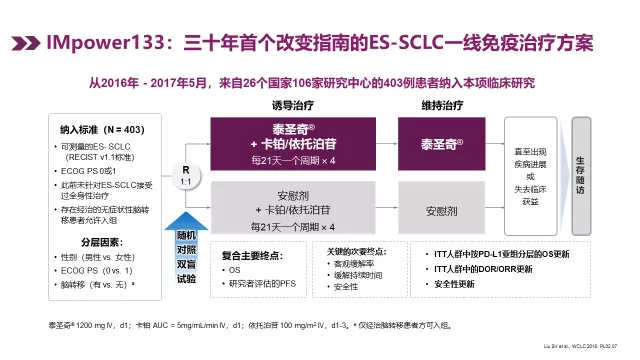
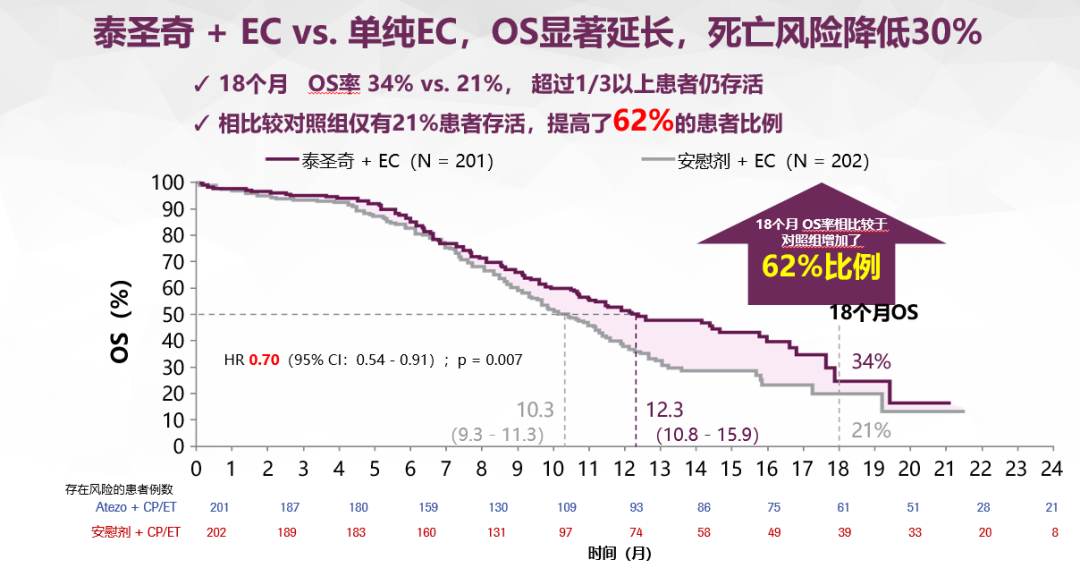
广泛期的小细胞肺癌中,IMpower133研究在一线治疗时期,用 EC方案加阿替利珠单抗,4周期后再用阿替利珠单抗维持,三十年来在广泛期小细胞肺癌首个OS超过一年。18个月时OS率还有30%多,相当于1/3的人在一年半的时候还活着,这是很好的效果。
如用免疫治疗,关于免疫治疗的起始应用时机,考虑免疫作用机制,满足条件、患者耐受的基础上应尽早使用

关于免疫治疗的起始应用时机,均应尽早使用。从以往的维持治疗研究结果,已完成的维持治疗研究结果是阴性的(化疗完成后再启动免疫维持治疗):ICIs在ES-SCLC维持治疗的探索率先来自一项小样本、单臂的探索性研究。这项研究共纳入45例接受4-6后期EP方案化疗后疾病稳定(SD)或缓解的患者,接受K药维持治疗,主要研究终点为PFS。结果显示,患者的中位PFS和OS与安慰剂组的数据相似,即K药维持治疗不能改善患者预后;
III期CheckMate 451研究也得出了同样的结果,即O药联合伊匹单抗来进行维持治疗,与安慰剂组的OS是无统计学差异的(分别为9.2个月和9.6个月(HR=0.92, 95% CI: 0.75–1.12,P=0.37),1年OS率分别为41%和40%。)。
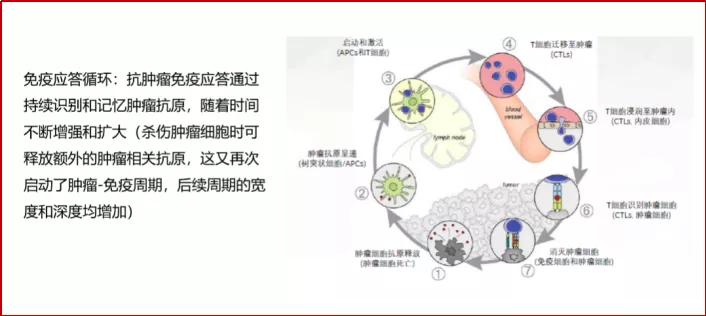
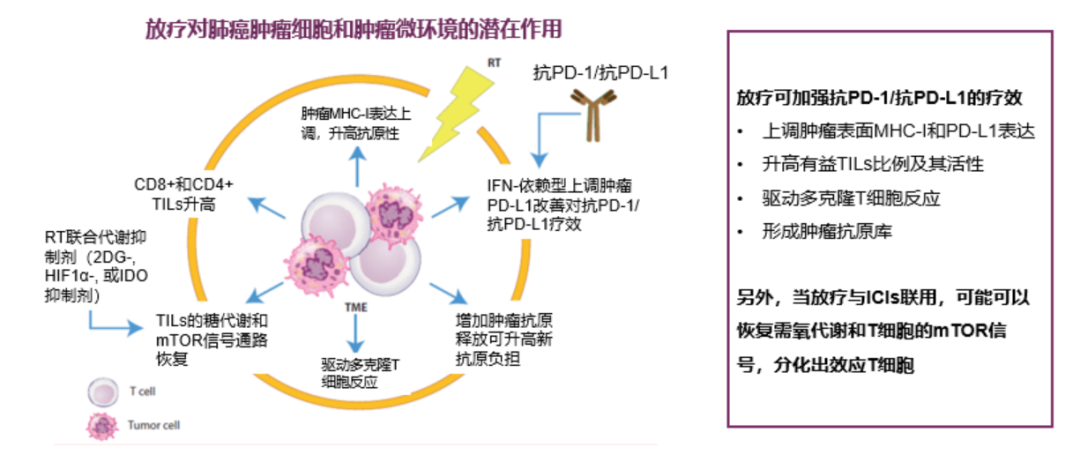
从可能的作用机制探讨:起始即与化疗进行联合才能给患者带来额外的生存获益,或许与化疗诱导的肿瘤细胞抗原的释放(SCLC本身进展快,化疗杀伤肿瘤细胞后促进更多抗原释放),与免疫治疗产生协同效应。
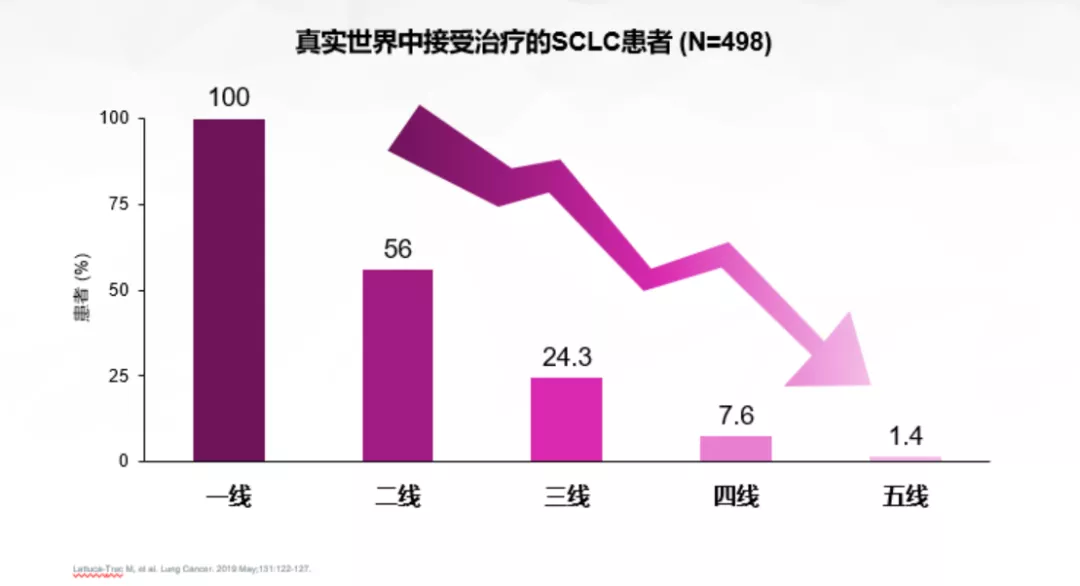
无论从免疫机制角度,还是从未达到统计学意义的实验等角度看待,免疫都应更早使用。因为SCLC一线治疗至关重要,仅50%人群有机会进入二线。
SCLC中PD-L1/PD1抑制剂+化疗联合一线治疗是否需要筛选PD-L1 or TMB?
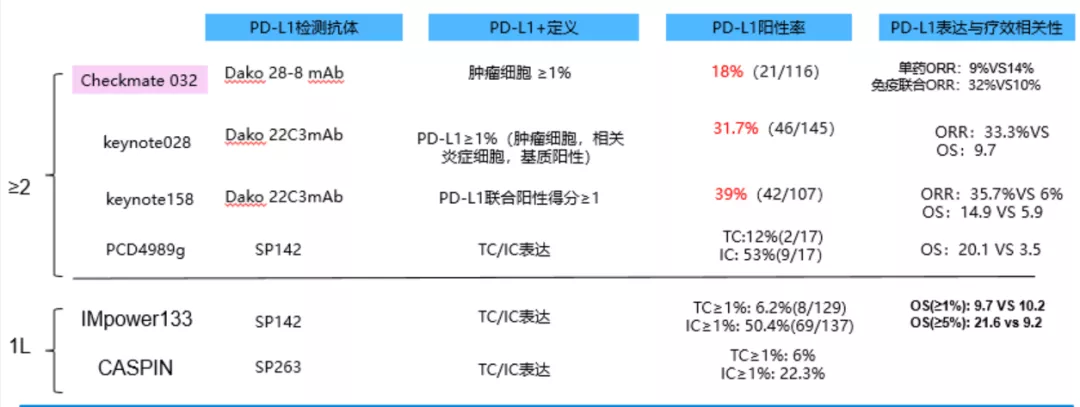
从众多PD-1/PDL-1的研究结果看,PD-L1表达与肿瘤反应无明显相关性,而对于TMB/bTMB:根据IMpower-133研究,bTMB对于Atezo疗效无预测作用,无论以10或16 mut/Mb,bTMB高组和低组之间的OS似乎无显著差异。
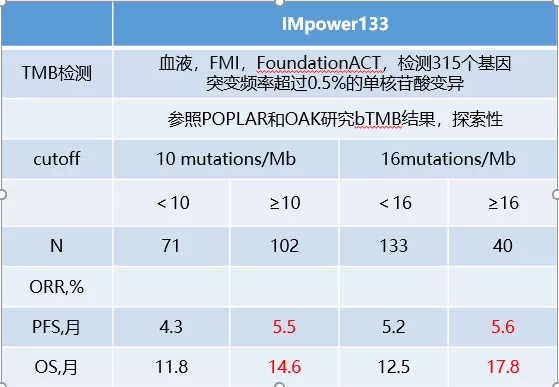
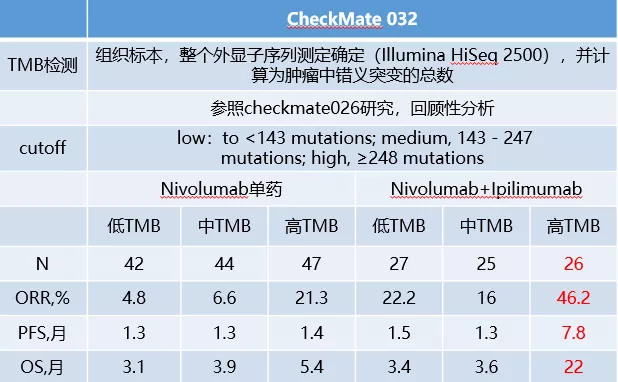
但对于nivolumab + ipilimumab的双免疫检查点抑制剂,TMB可能是一个有价值的预测标记物。NCCN指南推荐了NSCLC nivo+/-ipi治疗时参考TMB,但为maybe helpful,且没有对如何测量TMB达成共识对SCLC的TMB2A证据。
小细胞肺癌的一线免疫治疗对于特殊人群是否须额外注意有效性和安全性?激素、抗生素应用注意哪些?
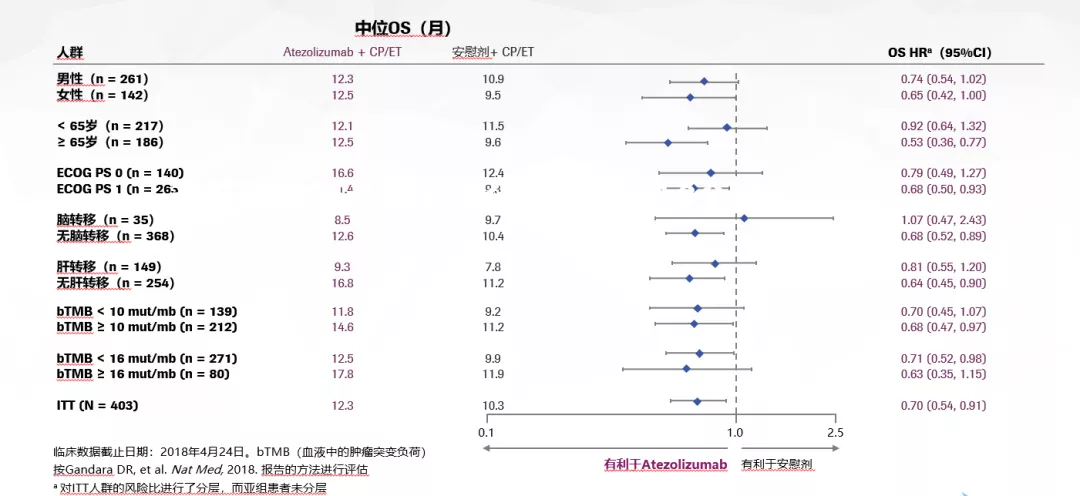
从IMpower133的亚组分析看,各亚组皆有获益,无论对于老年患者还是PS评分,以及是否发生肝转移等均获益。
激素
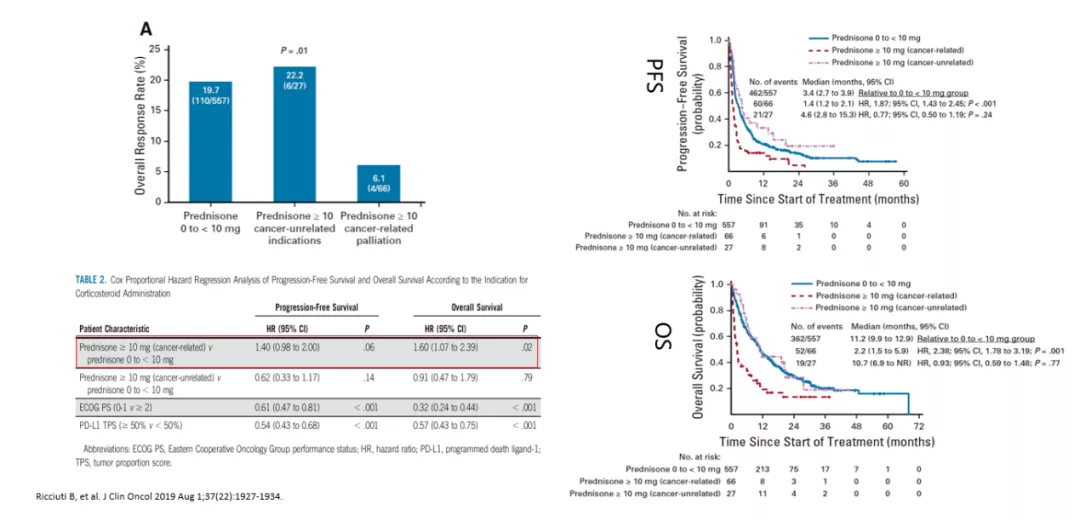
但有PD-1/PD-L1抑制剂在基线使用类固醇激素患者中的疗效探索,对于基线使用类固醇激素(>10mg)与CIT疗效更差 (ORR,PFS和OS)相关,暂时不明确较差的预后是因大剂量激素的使用还是患者更多并发症,或更差的PS评分?有研究提示,可能因激素治疗患者本身预后较差(激素使用为缓和肿瘤相关症状)。基于目前证据,计划接受CIT的患者应该谨慎使用类固醇激素,医疗需要的类固醇(例如脑转移)不应避免。
使用抗生素治疗患者
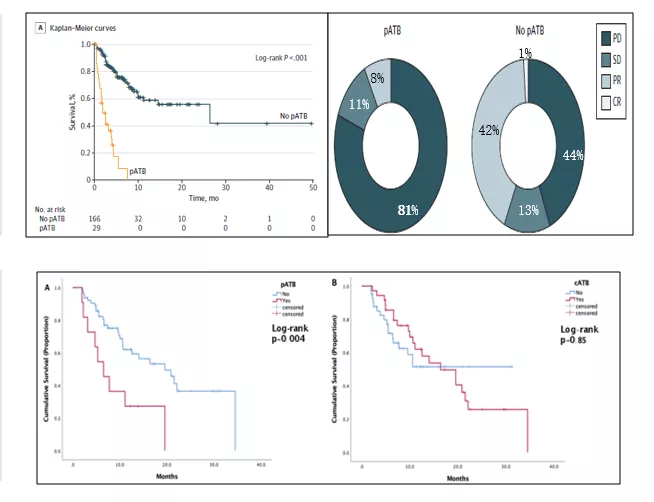
2019年David等发表的一篇多中心前瞻性研究,纳入196例接受PD-1/PD-L1抑制剂治疗的晚期肿瘤患者,分析起始免疫治疗前30使用抗生素(pATB)和免疫治疗同时使用抗生素(cATB)对患者免疗效及生存的影响。结果表明:pATB患者OS较差,同时疗效也较差。
2020 ASCO报道77例患者,起始免疫治疗前30使用抗生素(pATB),免疫治疗同时使用抗生素(cATB);pATB(p=0,004)而非cATB(p=0.085)OS更差(19.6m vs 6.5m,HR=2.9).pATB 和 cATB均不能预测PFS或ORR(p>0.05);多变量分析证实pATB可以独立于PD-L1状态,PS和cATB预测OS。
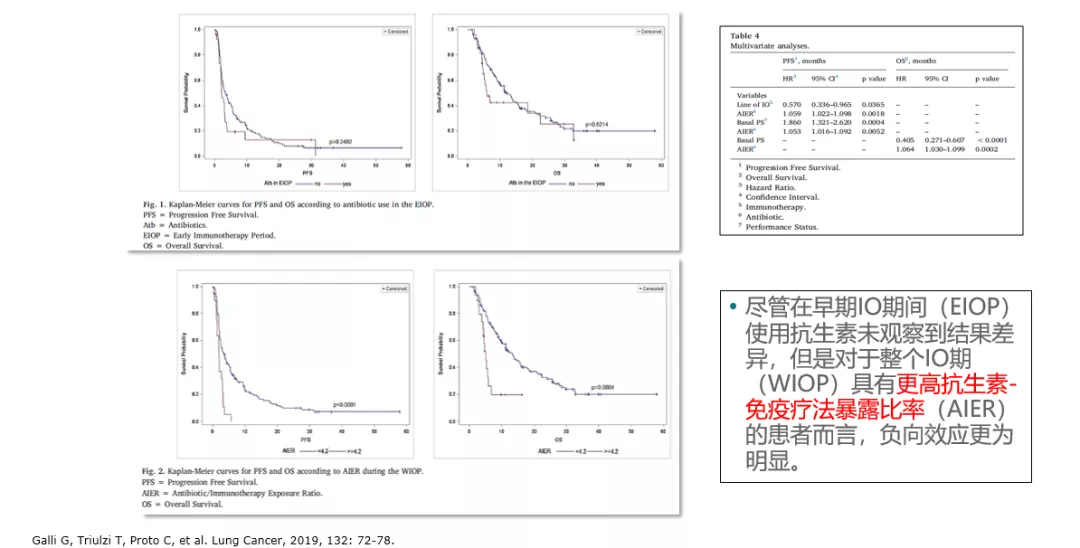
对于小样本研究表明,起始免疫治疗前30天内使用抗生素(pATB)对免疫治疗疗效影响较大,预后更差,具体机制需要进一步探索;抗生素使用时间较长的患者,因此可作为不良预后提示因素。值得注意的是,这些研究都是小样本的回顾性研究,还需前瞻性研究确认,对于需要使用抗生素的患者仍推荐进行合理用药。
很多同仁会问,自身免疫疾病是否可以接受CIT治疗?
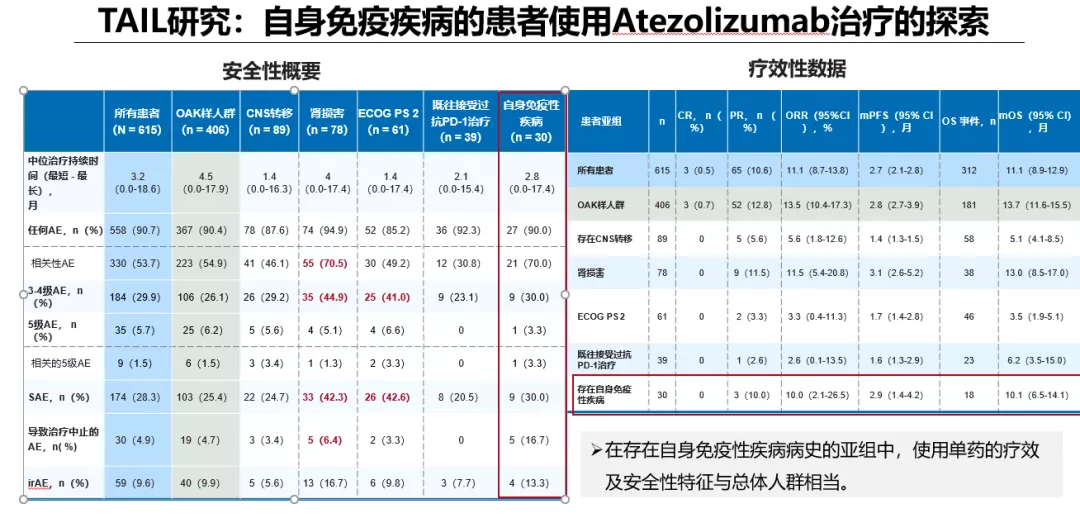
目前的真实世界及临床研究数据提示:有自身免疫性疾病病史的晚期NSCLC患者与没有自身免疫性疾病的患者的临床结局相似。但同时,应警惕小部分患者应用ICIs治疗后原有自身免疫疾病恶化的情况,警惕自身免疫病患者的irAE发病率有所增加,尤其是内分泌、胃肠道、血液和淋巴irAEs以及一般irAEs。
综上,小细胞肺癌合并COPD无异于「雪上加霜」,化疗加免疫为该类患者治疗带了了曙光,期望在未来的研究中精准寻求到化疗联合免疫的获益人群成为可能,还有放疗和免疫的联合是否能给小细胞肺癌合并COPD带来更大的获益空间、双免疫或新的免疫复合制剂能否有所突破都是值得期待的。
* 参考资料:
[1] Anthonisen NR, Skeans MA, Wise RA, et al. The effects of a smoking cessation intervention on 14.5-year mortality: a randomized clinical trial[J]. Ann Intern Med, 2005, 142(4):233-239.
[2] 《中国医学前沿杂志(电子版)》2014年第6卷第2期
专家简介

周敏
教授,主任医师,博士生导师,上海交通大学医学院附属瑞金医院呼吸与危重症医学科副主任;中华医学会呼吸病分会青年委员及慢阻肺学组委员,中国医师协会呼吸分会优秀中青年医师。


