演讲主要分三方面,第一,病例分享;第二,从尸检结果分析这例患者病理的主要特点,就像之前有很多专家讲过,不同个体的COVID-19的尸检病理可能会存在个体差异,但是我觉得总体而言还是存在一些共性;第三,谈谈救治体会。感谢卞修武院士的团队所做的尸检工作和提供的资料。
一、危重型COVID-19病例分享
基本情况
患者,女,60岁,退休职工。
主诉:干咳、气促10天。
现病史:患者10天前无明显诱因出现干咳、气促,伴乏力、食欲减退。无寒战,无全身肌肉酸痛不适,无胸痛、咯血,无心慌、恶心、呕吐等不适。患者气促症状进行性加重,2020-02-08武汉协和医院胸部CT示「双肺肺炎」,予以「阿比多尔、莫西沙星、莲花清瘟胶囊」治疗,患者仍有气促、憋闷。因查新冠病毒核酸阳性,于2020-02-10收入火神山医院。患者自始至终未出现发热,这也告诉我们并不是所有COVID-19都会出现发热的症状。
既往史:平时健康状况一般,无传染病史,无手术史、外伤史,无输血史、无药物过敏史。肥胖,糖尿病。
个人史:无吸烟史、饮酒史。
家族史:双亲已故,死因不详。
体格检查
生命体征:T 36.5℃、P 84次/分、RR 23次/分、BP 125/65mmHg。
查体:一般情况尚可,神志清楚,检查合作。无巩膜、皮肤黄染,皮肤无瘀斑、瘀点,结膜无充血、睑结膜无苍白,双侧瞳孔等大等圆,无颈静脉怒张,甲状腺未及肿大,无胸骨压痛,呼吸运动正常,其余肺部体征未查,心、腹、神经系统未及明显异常,双下肢无水肿。
辅助检查
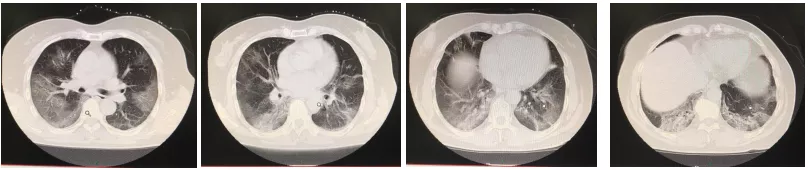
胸部CT(起病一周左右,2020-02-08,武汉市协和医院):双肺弥漫性磨玻璃样改变,双下肺出现纤维条索样影,考虑病毒性肺炎可能。
核酸检测:新型冠状病毒肺炎核酸阳性。
初步诊断
1.新型冠状病毒肺炎(核酸+)重型
2.I型呼吸衰竭
治疗过程
初始治疗(2-10)
1、入院时患者存在呼吸衰竭,属于重型患者。在火神山医院的普通病房治疗,鼻导管吸氧(5L/min)。当时患者的一般情况尚可,呼吸频率不是很快。
2、给予阿比多尔、莲花清瘟胶囊抗病毒。
病情呈进行性进展,呼吸困难无好转,氧分压下降,用无创呼吸机尝试进行呼吸支持,但是患者抵抗明显,无创不耐受。2-12血常规示白细胞升高(9.1×10^9/L),L 0.75×10^9/L。
治疗方案调整(2-14)
1、氧合指数有一定程度的恶化,提高鼻导管吸氧流量(10L/min)。
2、阿比多尔、莲花清瘟胶囊抗病毒,舒普深抗感染。
3、病情有所加重,当日转入重症监护室。
转ICU后初始治疗(2-14至2-15)
1、鼻导管吸氧(10L/min),安静状态下SpO2 96-99%
2、阿比多尔抗病毒,莫西沙星抗感染,初始感觉患者可能会挺过重型的阶段,给予甲强龙抗炎(20mg 2/日),低分子肝素抗凝,其他对症支持治疗。
但是2天以后,2-16氧合出现恶化,氧饱和度维持90%。白细胞较前升高(14.8×10^8/L)。
治疗方案调整(2-16至2-26)
1、2-16改为经鼻高流量吸氧(40-50L/min,FiO2 80-90%)SpO2维持98-100%。
2、提高激素的剂量,甲强龙抗炎(40mg 2/日 2-19至2-22),胸腺法新提高免疫,右美托咪定镇静,余治疗同前。
经鼻高流量吸氧时,患者的呼吸频率、心率也不是很快
2月26日,流量50L/分,浓度100%,SpO2在93-95%(进一步下降),活动后可降至90%以下。白细胞较前升高(19.6×10^9/L),咽拭子核酸检测阴性。
治疗方案调整(2-27至2-29)
1、2-27改无创呼吸机辅助通气(PSV-S/T模式,FiO2 100%,IPAP 10cmH20,EPAP 8cmH20)SpO2维持在95-100%。由于呼吸频率有一定程度加快,出现重度缺氧的表现,所以患者对无创没有太大的抵抗,但是拒绝气管插管,相对来说依从性较差。
2、血象明显升高,考虑可能存在感染。头孢哌酮/舒巴坦3g 1/8h+卡泊芬净 50mg/日,继续抗病毒、对症支持治疗。
平静状态下SpO2维持在95-100%,进食等活动后SpO2可降至85%。
治疗方案调整(3-01)
1、美罗培南 1g 1/8h+利奈唑胺 0.6g 1/12h+卡泊芬净 50mg/日,丙种球蛋白10g/日。低分子肝素皮下注射抗凝。
2、无创呼吸机(FiO2 100%,IPAP 20cmH20,EPAP 12cmH20 )SpO2 95%。
如果是这样的氧合状态,使用无创或许患者不用立刻气管插管。但是到了3-2晨,RR>30次/分,HR>130次/分,SpO2 85%,我个人认为,如果呼吸频率持续在30次/分以上,提示患者可能对缺氧不耐受。血气分析示酸血症,二氧化碳蓄积,可能呼吸肌有一定程度的疲劳。氧合指数小于100mmHg,但是在无创的情况下,计算氧合指数不是特别准确,实际上后来插管以后氧合指数还是在100mmHg左右。所以,当天出现呼吸频率升高,血氧饱和度掉到85%,我们果断进行气管插管。
治疗方案调整(3-02)
1、3月2日上午9点经口气管插管,有创呼吸机辅助通气(A/C模式,F 19次/分,FiO2 100%)。SpO2 92%,心率下降至100次/分。同时镇静、镇痛、肌松处理。
2、复查血气分析:pH7.411,PaO2 63.9mmHg,PaCO2 55.1mmHg,SaO2 93.6%(FiO2 100%),氧合指数64mmHg。
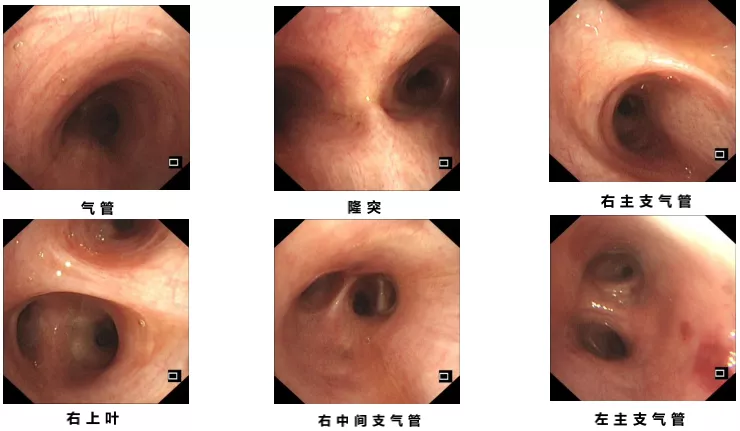
3、床边气管镜检查,提示气管以及双侧主支气管腔内少量浆液性分泌物。
4、因为氧合指数非常低,机械通气后氧合没有明显改善,经过讨论,3月2日晚7点行VV-ECMO(双侧下肢股静脉)。
5、泰能 1g 1/8h+万古霉素 1g 1/12h+卡泊芬净 50mg/日,镇静、止痛、肌松、抑酸、抗凝,输血(红悬+血浆+血小板)。
3月2日 支气管镜检查
在气管插管前做了支气管镜检查,气道内粘膜较光滑,并没有特别多的分泌物,仅有少量浆液性分泌物。
辅助检查
气管插管之前的胸部CT,每天都在进展。
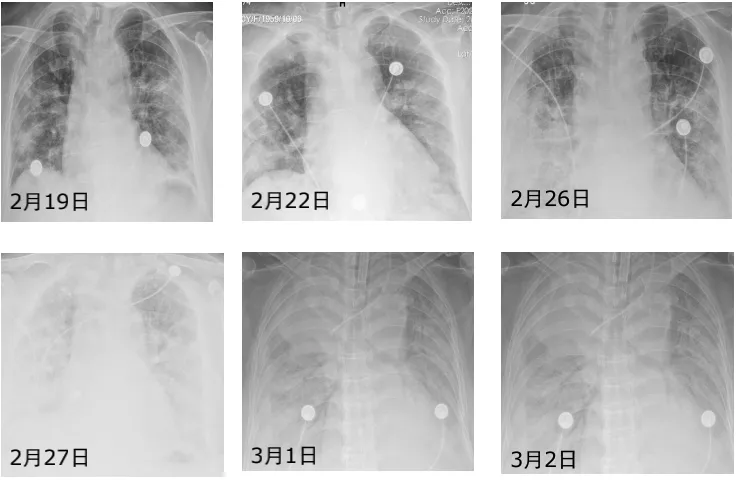
病情变化(3-3)
1、VV-ECMO + 有创呼吸机 SpO2维持在94-95%
呼吸机参数:P-A/C,吸气压力10cmH2O,PEEP 8cmH2O,频率12次/分,氧浓度40%。监测MVe 1.4L/min(非常低),峰压20cmH2O
ECMO参数:转速3000-3300rpm,流速3.6-4.2L/min,氧气5L/min
血气分析:(3-3 6:00):pH7.60,PaO2 79mmHg,PaCO2 27mmHg,SaO2 99%;(3-3 18:00):pH7.58,PaO2 60mmHg,PaCO2 29mmHg,SaO2 96%
支持治疗:血浆、血小板、红悬、白蛋白等
抗感染:泰能+万古霉素+卡泊芬净
监测:APTT,ACT
纠正电解质紊乱:补钾、补钙
镇静、镇痛
3-3胸片:双肺白肺
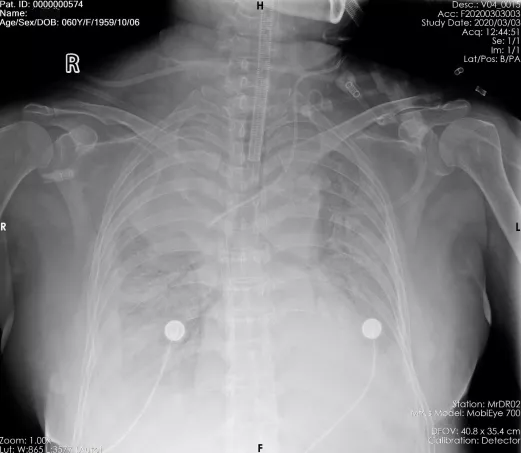
病情变化(3-4)
1、VV-ECMO + 有创呼吸机 SpO2维持在94-96%
呼吸机参数:P-A/C,吸气压力10cmH2O,PEEP 8cmH2O,频率10次/分,氧浓度40%。监测MVe 0.8L/min,峰压18cmH2O,平台压18cmH2O,平均压13cmH2O。
ECMO参数:转速3000-3300rpm,流速3.6-4.2L/min,氧气5L/min
血气分析:(3-4 6:00):pH7.54,PaO2 85mmHg,PaCO2 33mmHg,SaO2 99%。
在整个ECMO的治疗中,分钟通气量越来越低,肺顺应性非常差。
2、为了让肺有充分休息的机会,进行俯卧位通气。
血气分析(3-4 20:00):pH7.43,PaO2 92mmHg,PaCO2 43mmHg,SaO2 98%。
病情变化(3-4至3-5)
调整呼吸机参数:P-SIMV,吸气压力10cmH2O,PEEP 10cmH2O,PSV 10cmH2O,频率10次/分,氧浓度40%。监测MVe 0.8-0.9L/min,峰压21cmH2O,平均压18cmH2O。
血气分析(3-5 10:00):pH7.40,PaO2 84mmHg,PaCO2 41mmHg,SaO2 98%。
复查PCT 2.17,有一定升高,继续抗细菌、抗感染治疗。
病情变化(3-6)
1、VV-ECMO + 有创呼吸机 SpO2维持在94-95%
呼吸机参数:P-SIMV,吸气压力10cmH2O,PEEP 10cmH2O,PSV 10cmH2O,频率10次/分,氧浓度40%。监测MVe 0.58L/min(持续下降),峰压20cmH2O,平均压18cmH2O
ECMO参数:转速3200rpm,流速3.6L/min,氧气5L/min
血气分析(3-6 14:00):pH7.59,PaO2 67mmHg,PaCO2 22mmHg,SaO2 96%
2、继续俯卧位通气
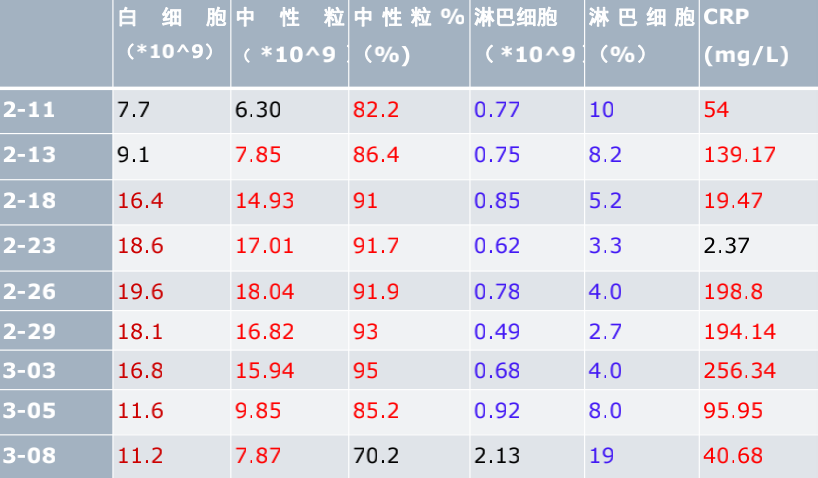
3、血常规:白细胞11.6×10^9/L,中性粒细胞百分比 91.5%,淋巴细胞百分比5.8%,淋巴细胞绝对值0.68×10^9/L,血小板总数118×10^9/L,C反应蛋白111.25mg/L。
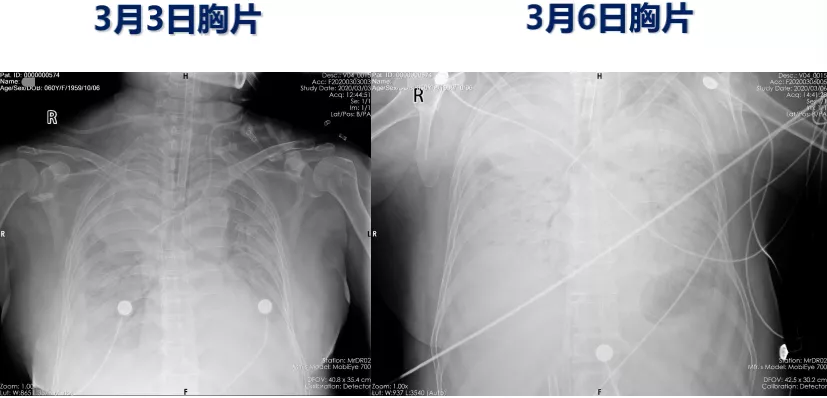
对比胸片来看,肺部并没有特别明显的改善,反倒有一定程度的加重。
病情加重(3-7)
1、VV-ECMO + 有创呼吸机 SpO2维持在95-98%
呼吸机参数:P-SIMV,吸气压力10cmH2O,PEEP 10cmH2O,PSV 14cmH2O,频率10次/分,氧浓度40%。监测MVe 0.5L/min,峰压20cmH2O,平均压18cmH2O。
ECMO参数:转速3300rpm,流速 3.8L/min,氧气5L/min
血气分析:(3-7 6:00):pH7.59,PaO2 96mmHg,PaCO2 24mmHg,SaO2 99%。(3-7 18:00):pH7.44,PaO2 70mmHg,PaCO2 36mmHg,SaO2 95%。
2、继续俯卧位通气
3、床边B超提示右侧大量胸腔积液,下午4点行胸腔穿刺置管引流500ml血性胸水
病情变化(3-7)
1、从晚上19:00到23:00血气分析监测提示血色素持续下降,从10.8g降到了4.1g,血压下降,升压药物速度加快
2、快速输血、补液
3、考虑胸腔大量出血

病情变化(3-8)
1、白天血压维持不住,升压药物速度不断加快
2、继续快速输血、补液、碳酸氢钠纠正酸中毒
3、血色素从2.5g/dL补到6g/dL,酸中毒明显
4、血气分析(3-8 14:00):pH7.17,PaO2 170mmHg,PaCO2 30mmHg,SaO2 99%,Hb 6g/dL ,BE-16mmol/L。
5、18:00开始CRRT,快速输血,去甲肾上腺素和垂体后叶素维持血压。但酸中毒难纠正,血管阻力低。
6、血压下降至测不出,3/8 22:52 宣布死亡
辅助检查的变化
血红蛋白:在输血时,呈一过式上升,3-6至3-8下降,3-8下降至43g/L。
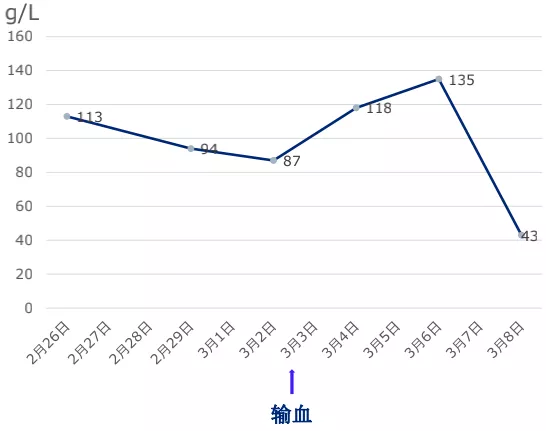
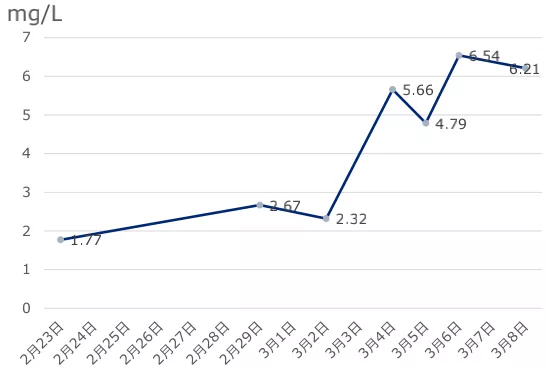
D二聚体:我们一直都在进行抗凝的治疗,但后期还是持续升高。
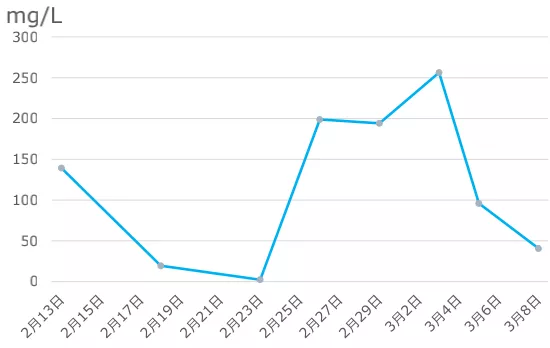
CRP:居高不下,后期有一定程度的下降。
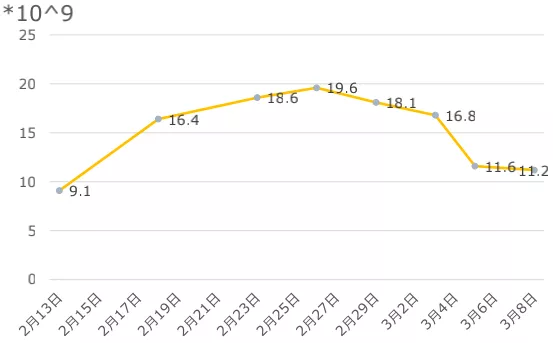
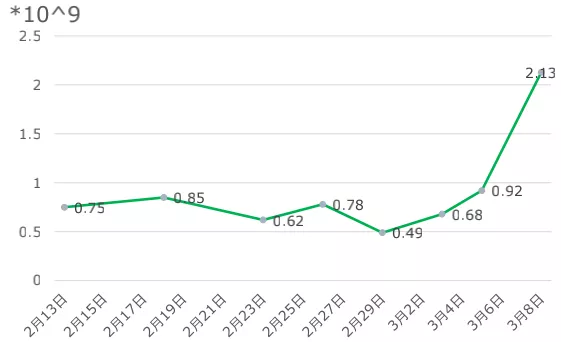
白细胞:在病情中段,有明显升高,后期明显下降。
中性粒细胞百分比:
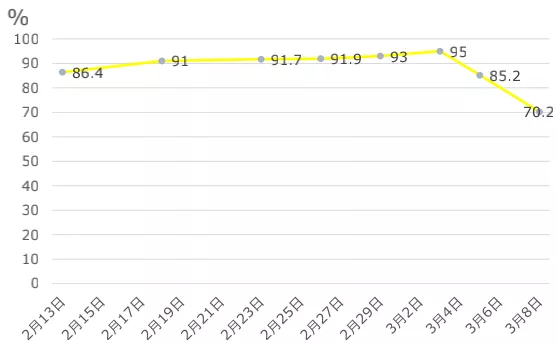
淋巴细胞:早期偏低,最低是0.49×10^9/L,到后期反倒有一定程度上升。
血常规:
病程总结
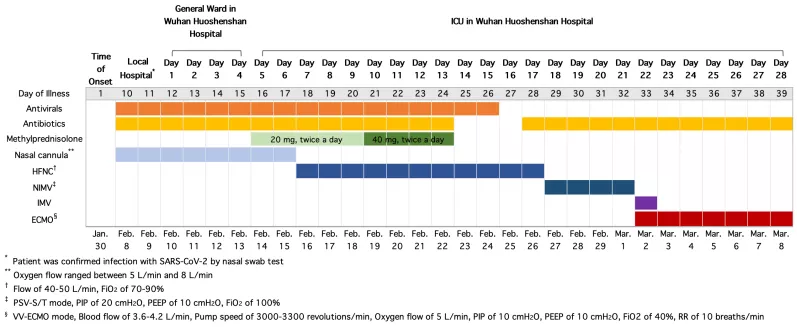
呼吸支持的过程,从早期的鼻导管吸氧、高流量吸氧,然后使用无创、有创、ECMO,按照循序渐进的治疗原则进行,到了什么节点应该进行什么呼吸支持都是及时实施。重点看一下激素的治疗,早期给予20mg 2/日,后期加量至40mg 2/日。
二、危重型COVID-19尸检病理
我们重点分析尸检结果。为什么会出现血色素明显的下降呢?哪里出现了出血?
尸检结果
体表和体腔:左侧腹腔和盆腔大量出血及血凝块,胸腔有出血,但是被引流掉了。
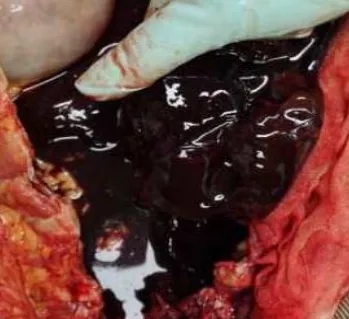
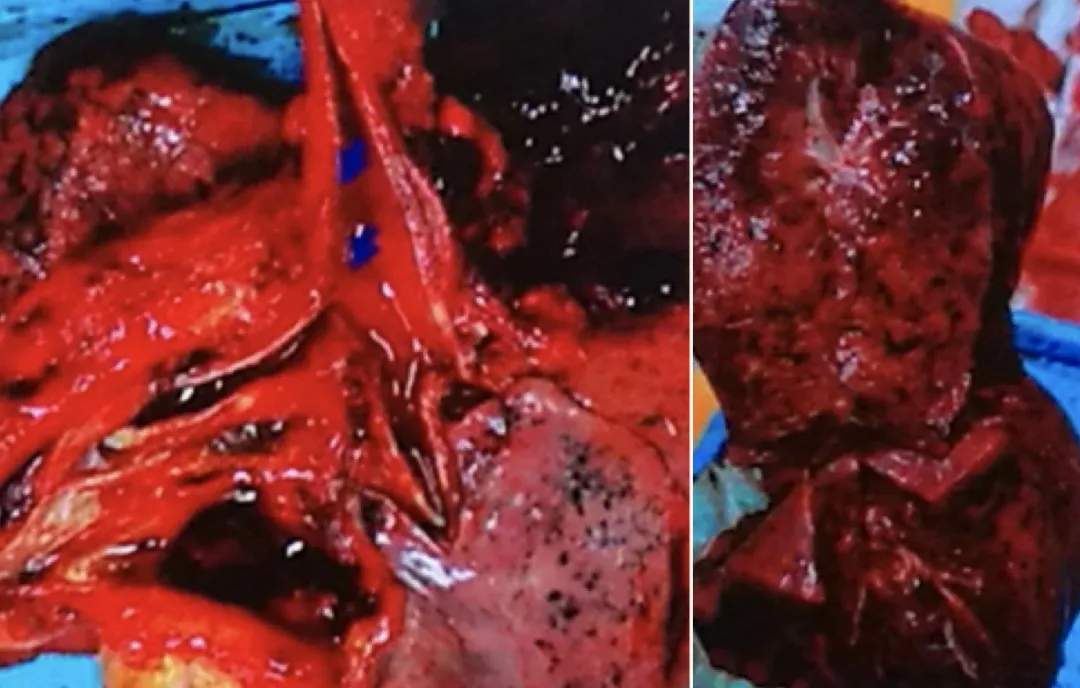
肺脏大体:气管腔和双侧支气管腔内少许粘液,与气管镜下的改变类似。双肺暗红色,切面见片状、灶性实变。
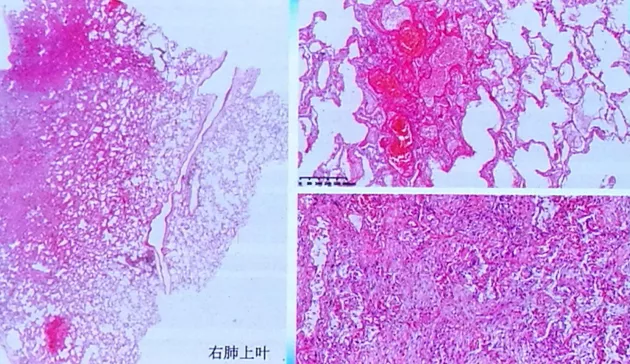
肺脏镜下:右肺上叶是病变最轻的地方,稍微有一点正常的肺泡组织。病变多样:肺泡破裂、出血、渗出、纤维化。
肺脏高倍镜下:肺泡渗出(纤维蛋白、炎症细胞),间质纤维化。
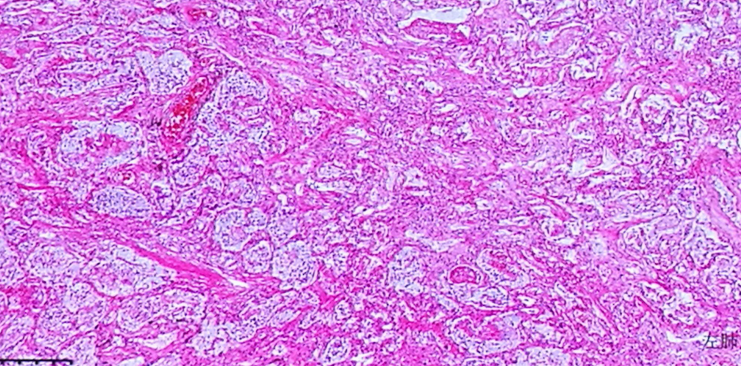
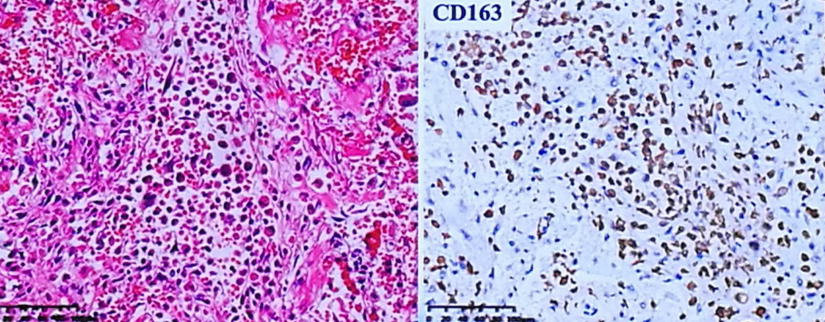
肺脏高倍镜下:Ⅱ型肺泡上皮细胞增生、脱落于肺泡腔。肺泡腔内:脱落上皮、纤维蛋白渗出物炎症细胞(通过染色表明以单核-巨噬细胞为主,少量中性粒细胞),间质纤维化。
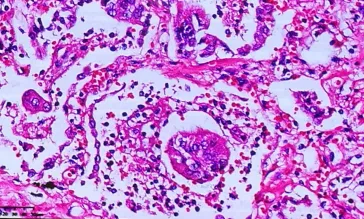
肺脏高倍镜下:与其他ARDS一样,透明膜形成,这是其他病毒性肺炎共性的表现,这也是引起严重的低氧血症的原因。少量细菌感染(下图右),但是细菌感染的部位不多,可能与使用抗细菌药物有关。渗出样病变累及终末细支气管(粘液大气道很少,小气道和肺泡里大量充填)。
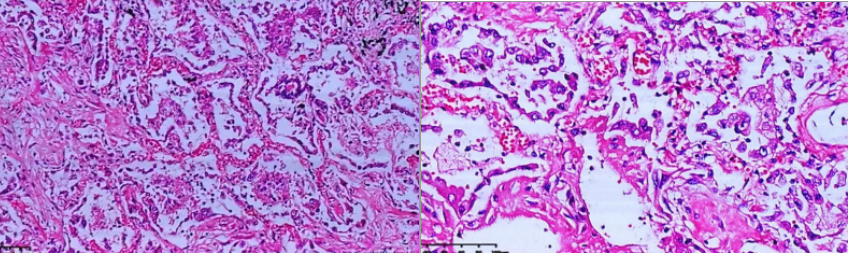
肺脏高倍镜下:间质纤维化非常明显,患者的病程不到1个月,但是早期就已经出现间质纤维化。我认为与其他病毒性肺炎最大的差别就是纤维化出现的时间非常早。伴有增生的上皮细胞。
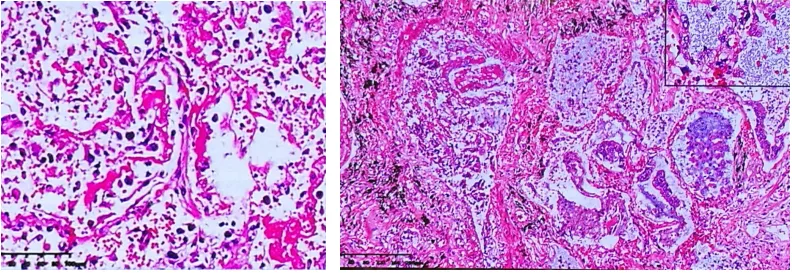
肺脏高倍镜下:肺泡腔、终末小气道炎症细胞渗出,通过免疫组化染色以巨噬细胞为主。
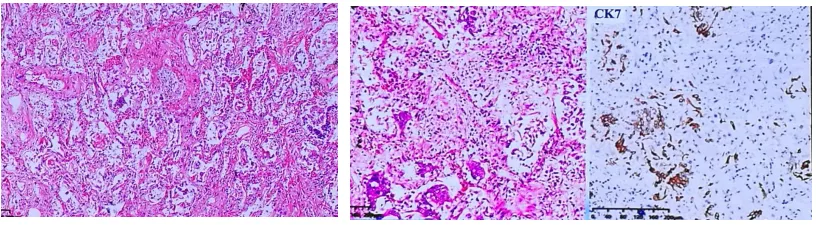
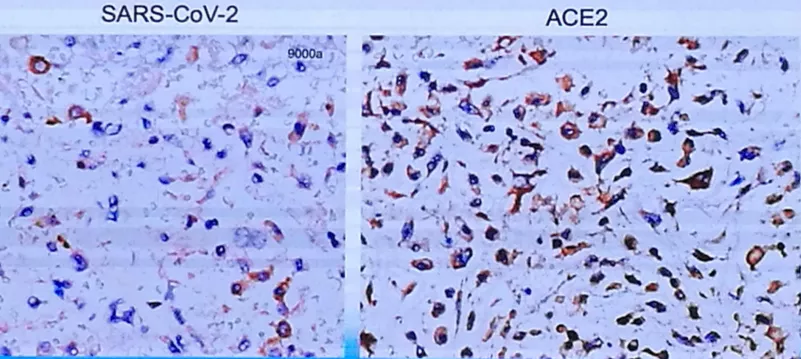
肺脏高倍镜下:SARS-Co-2和ACE2免疫组化染色。
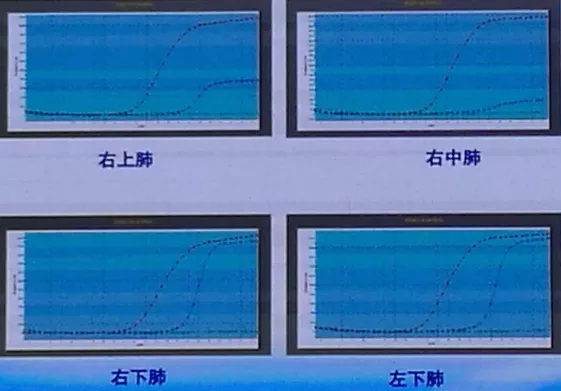
肺脏病毒核酸检测:各个肺叶的新冠病毒核酸检测均呈阳性(PCR)。
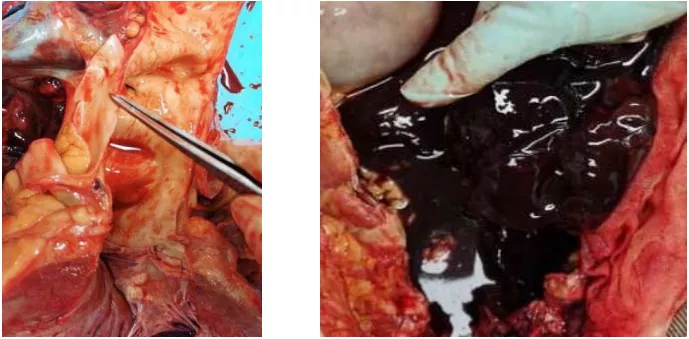
胸主动脉夹层破裂:胸主动脉偏左肺侧见一血肿区,长约10-12cm、宽2-3cm,为主动脉夹层破裂出血,这是引起患者快速死亡的原因。主动脉夹层始于主动脉瓣上1.5cm处、长约7cm、内膜见破口;主动脉内壁散在分布的粥样硬化斑块。
其他脏器:值得注意的就是淋巴结内:淋巴细胞较正常减少,外周血淋巴细胞减少,肺泡内真正渗出的淋巴细胞很少,淋巴结里面的淋巴细胞也很少,提示我们外周血淋巴细胞下降并不是渗出到了其他地方,而是真正的淋巴细胞的死亡导致的淋巴细胞减少。肺外器官均为多器官功能衰竭的继发性改变。肺外脏器中除了肺门淋巴结核酸检测阳性,其他均为阴性。
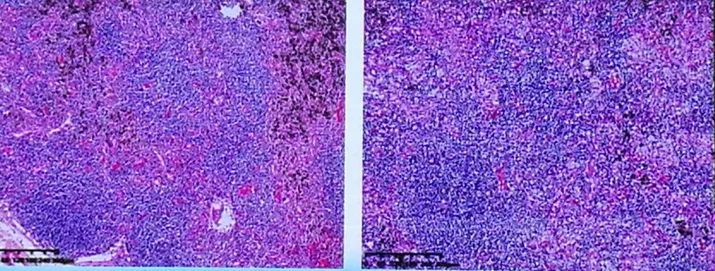
淋巴结病理
尸检病理小结
> 肺脏病变最为严重:肺泡渗出性炎症伴间质炎症和纤维化。
1、肺泡上皮增生、脱落于肺泡腔
2、肺泡腔、终末细支气管远端气道内:粘液渗出充填,伴巨噬细胞为主的炎症细胞浸润,少量中性粒细胞,淋巴细胞很少
3、间质纤维化非常明显,出现较早,也是提示我们当时上ECMO以后,分钟通气量很低,肺的顺应性很差,一个原因是是肺泡腔内大量的充填,另外一点就是早期纤维化形成
4、透明膜形成
> 肺外脏器大多数为继发性改变,没有发现是病毒侵袭导致,可能和全身炎症反应以及缺氧有关。
> 淋巴结内淋巴细胞减少。
> 肺脏病毒负荷重,肺外脏器病毒未见累及。
死亡原因
危重型新型冠状病毒肺炎致多脏器功能衰竭;胸主动脉夹层破裂导致大出血,失血性休克。我个人认为,这个患者即使没有主动脉夹层破裂,到最后能够成功救治的几率相对较低,因为肺部的病理改变非常严重。
三、危重型COVID-19救治体会
个人体会
第一,危重型患者经常会出现肺顺应性差的现象,二氧化碳分压高,气道压力高,使用呼吸机以后,从病理学角度我们可以得知,虽然大气道、中气道没有太多的分泌物,但是原因在于终末气道肺泡充填大量粘液、脱落上皮、巨噬细胞,以及早期的、非常严重的、区别于其他病毒性肺炎的肺间质纤维化。
第二,鼻咽拭子核酸阴性不代表体内病毒的清除,尤其危重型患者,BALF的检测阳性率更高。
第三,危重型COVID-19的肺纤维化发生更早(与其他病毒性肺炎相比),近期研究报道地塞米松治疗有效,个人认为对于危重型有效果一方面体现在抑制炎症反应,第二可能与早期逆转纤维化有关,使得肺部病理改变有逆转。
第四,病程越长,后期恶化加重后往往纤维化越明显,预后不良,也常常是ECMO无法撤机的原因,病毒清除后肺移植可考虑。
专家介绍

唐昊
上海长征医院(海军军医大学第二附属医院)呼吸与危重症医学科,副教授,副主任医师,硕士生导师,海军军医大学长征医院援鄂医疗队副队长,中华医学会呼吸病学分会青年委员,中国医师协会呼吸医师分会青年委员,上海市医学会呼吸病学分会委员,上海市医师协会呼吸医师分会委员,上海市医学会呼吸病学分会委员哮喘学组副组长,美国犹他大学Huntsman Cancer Hospital访问学者,上海市青年科技启明星,上海市卫生系统优秀青年人才,上海市浦江人才,白求恩-中青年优才计划,上海市优秀中青年呼吸医师。


