病情摘要
张X,女,70岁,汉族,退休,湖北武汉人。主因「持续发热9天伴呼吸困难1天」于2020.2.10入院。
现病史:9天前无明显诱因出现持续发热,体温最高38.6℃,伴盗汗、乏力、肌肉酸痛、食欲不振。自服「连花清瘟胶囊、强力感冒片及阿莫西林」后症状无好转,2月9日于湖北省中西医结合医院查肺CT示「双肺多发磨玻璃样感染病灶」,并出现呼吸困难,活动后明显。
既往史:高血压、2型糖尿病。2008年乳腺癌手术史。否认华南海鲜城接触史及新冠肺病人密切接触史。
查体:T36.9℃,HR 96次/分,RR 20次/分,BP 158/87mmHg,SO₂:92%,双肺呼吸音粗,心脏、腹部查体未见明显异常。
在这个特殊的时间段,当肺上出现了磨玻璃影时,患者甚至都会觉得自己到了地狱,况且她还逐渐出现呼吸困难……或许因为曾服用感冒药,所以入院时体温并不算高。引起我们注意的是,血氧饱和度只有92%,提示有低氧血症。
完善检查
2020.2.11 (入院时检查)
血常规:WBC 4.66 G/L,L 1.24 G/L, N 3.1 /L, HGB119 g/L,PLT 163*10^9/L;血生化:AST 45 U/L↑,ALT 47U/L ↑, LDH 296U/L ↑, BUN 10.9 mmol/L ↑,Cr 135.7mmol/L ↑;D-二聚体、凝血功能正常,铁蛋白 986.69ng/ml ↑,糖化 8.6% ↑;炎症指标:CRP 85.06mg/L ↑,ESR 121mm/h ↑,PCT 0.37ng/ml ↑。
肺炎衣原体支原体抗体:阴性;BNP 26.8 pg/ml。
2020.2.14 新冠病毒核酸检测阳性。
血气分析:PO₂:69 mmHg,FiO₂:40%
血常规没有太多异常,但铁蛋白、CRP、ESR显著增高,PCT也有增高。我们进行了病原学的检测,最终临床确诊为新冠肺炎患者。根据粗略计算,这位患者的氧合指数在170左右,有肺损伤情况。此外,她既有高血压、糖尿病等高危因素,又有肿瘤的病史。引起了我们高度的重视。
初步诊断
新型冠状病毒肺炎 重型
ARDS
急性肾功能不全
肝功能异常
高血压病
2型糖尿病
乳腺癌术后
2月10日~2月25日 / 治疗第一阶段
抗病毒:阿比多尔片 0.2g bid;重组人干扰素α2b注射液 500万IU 雾化 bid
抗感染:舒普深 3.0 iv q8h+拜复乐 0.4 iv qd(尽管我们并没有获得很明确的细菌感染证据,但是患者的PCT是增高的)
抗炎:甲强龙 40mg qd*3d→20mg qd*3d →强的松 10mg/d(因为氧合不好,使用了小剂量的激素)
调节免疫:注射用胸腺法新 1支 ih qd
预防VTE:克赛 4000IU ih qd
呼吸支持:经鼻高流量吸氧(HFNC)后,患者的氧饱和度维持得较好
支持治疗:丙球 15g iv qd*5天
其他治疗:胰岛素泵控制血糖,降压,护肝等治疗
诊疗经过
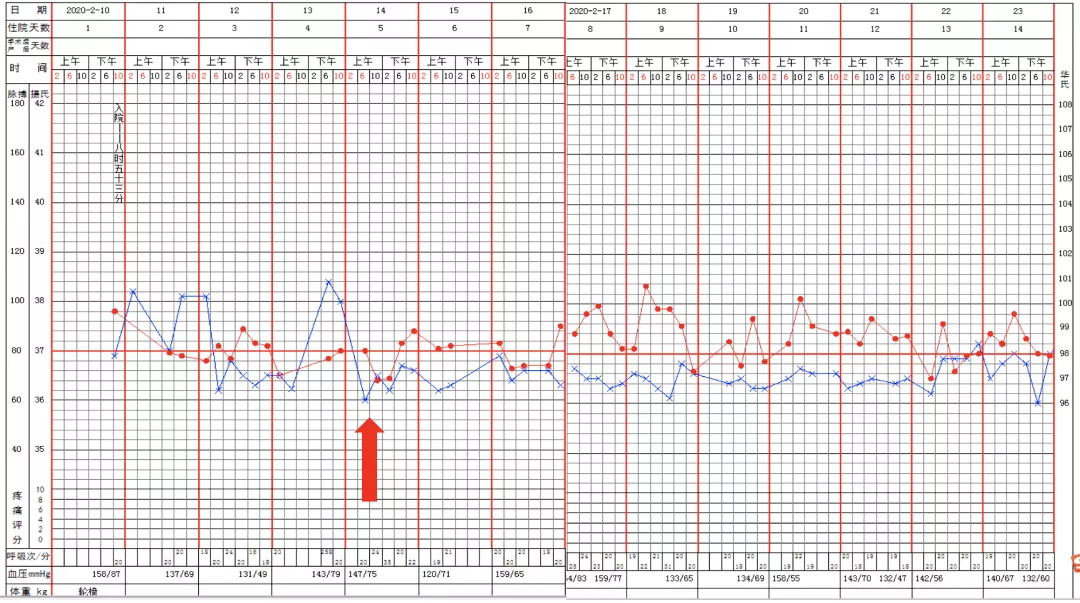
在症状方面,体温逐渐恢复到正常,合并有少许咳嗽,呼吸困难有所缓解,于是,呼吸支持方面,经鼻高流量吸氧改为鼻导管吸氧。此时核酸检测也连续2次阴性了。
检查变化
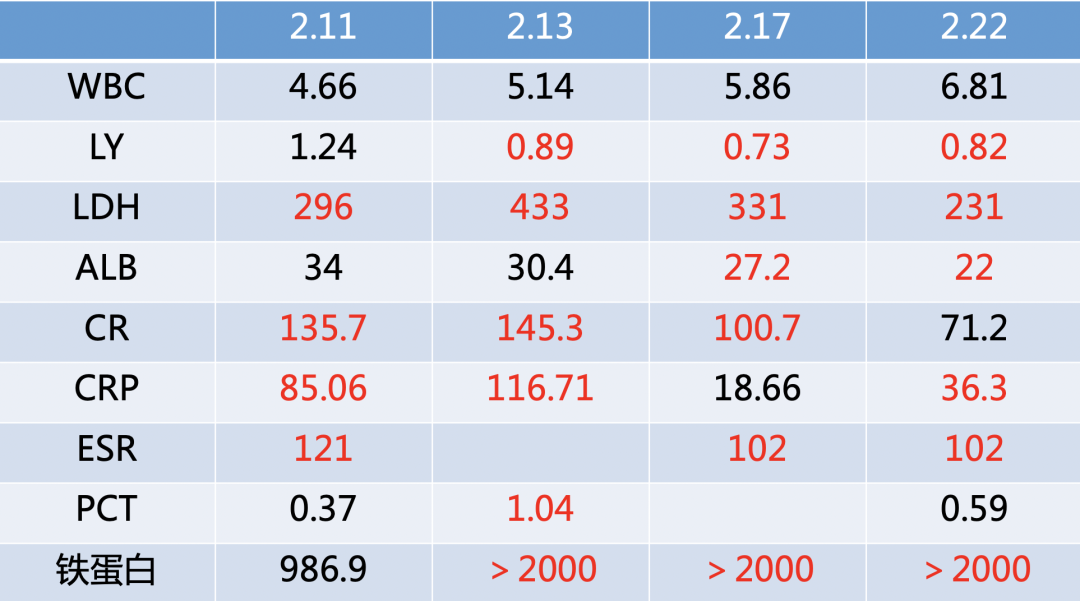
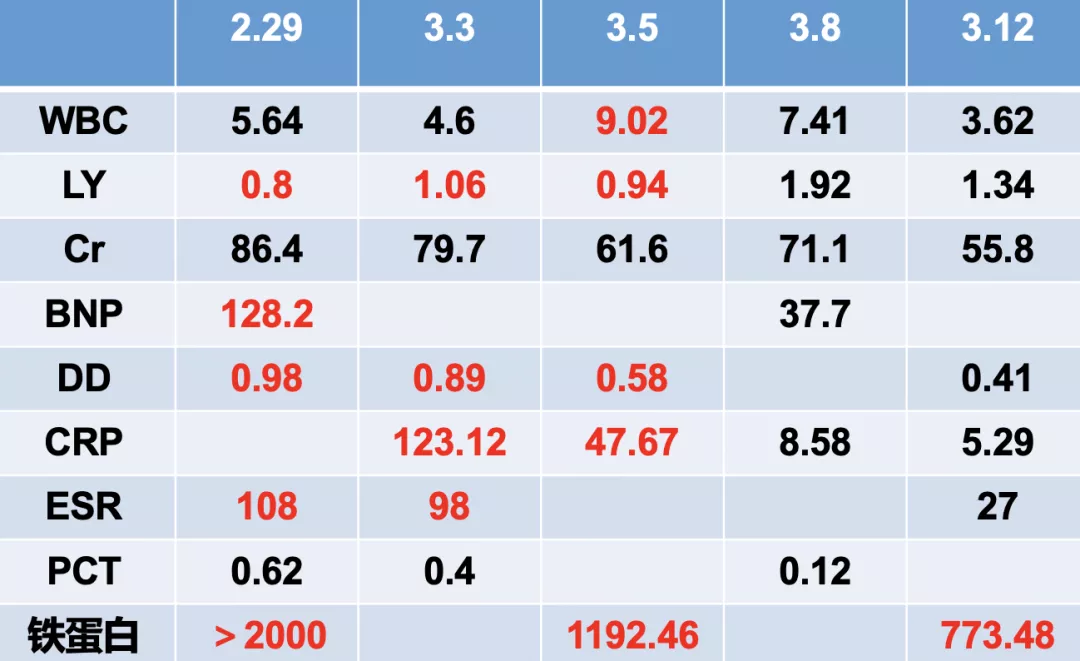
引起我们注意的是,尽管这位患者的临床症状似乎有缓解、氧合也得到了改善,但她的淋巴细胞绝对值较之前有下降的趋势;LDH有波动,相比最高峰时绝对值是有下降的;白蛋白有降低;肝功能相对稳定;CRP相比入院时有很明显的下降,但ESR持续在高位,及铁蛋白也显著升高。
影像学变化
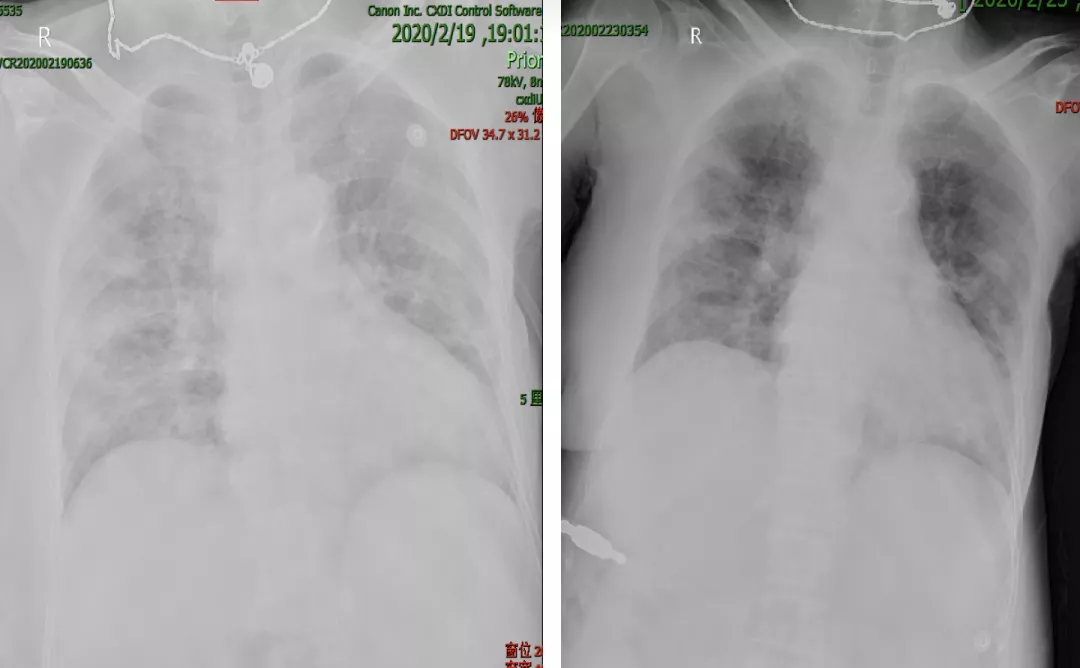
入院后第9天,2月19日,我们给患者复查了床边胸片,还能看到双肺弥漫性的磨玻璃样片影(左图);4天后(2月23日),我们再复查床边胸片,认为双肺的浸润影相比之前有吸收、好转。
并且,给患者进行鼻导管给氧时,SpO₂能达到95%以上。能否说治疗得到了初期的成功呢?当时的经验也认为治疗两周之后,有些患者的病情是可以趋于稳定的。我们都认为,这位患者通过治疗应该有较好的转归。然而事情出乎我们的意料。
2月26日~3月11日 / 治疗第二阶段

在体温单上,我们明显能看到,在症状方面,患者2月26日开始再次出现发热,Tmax 38.2℃;咳嗽变化不明显,偶有黄脓痰;呼吸困难逐步加重;有心悸;同时出现腹泻(有没有可能是药物导致的消化道症状呢?);检测血糖显示血糖不易控制。
呼吸支持方面:鼻导管→无重复吸收面罩→HFNC。
抗生素方面:哌拉西林他唑巴坦、利奈唑胺、伏立康唑。
抗炎方面:继续小剂量激素。
其他治疗无调整。
继续对患者进行严密的监测
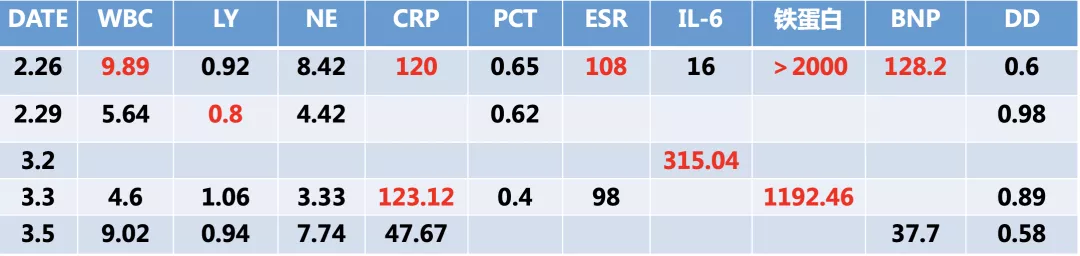
有一个非常突出的表现,就是IL-6明显升高,而我们在积极进行细菌学检测时,痰培养、血培养都正常,复查新冠肺炎病毒核酸也是阴性。
床边心脏彩超:升主动脉稍宽,左房增大,主动脉瓣轻度关闭不全,左室舒张功能减低,EF55%。
双下肢深、浅静脉+腓肠肌静脉彩超示血管通畅。
心梗三项正常;肿瘤标志物正常。
影像学评估
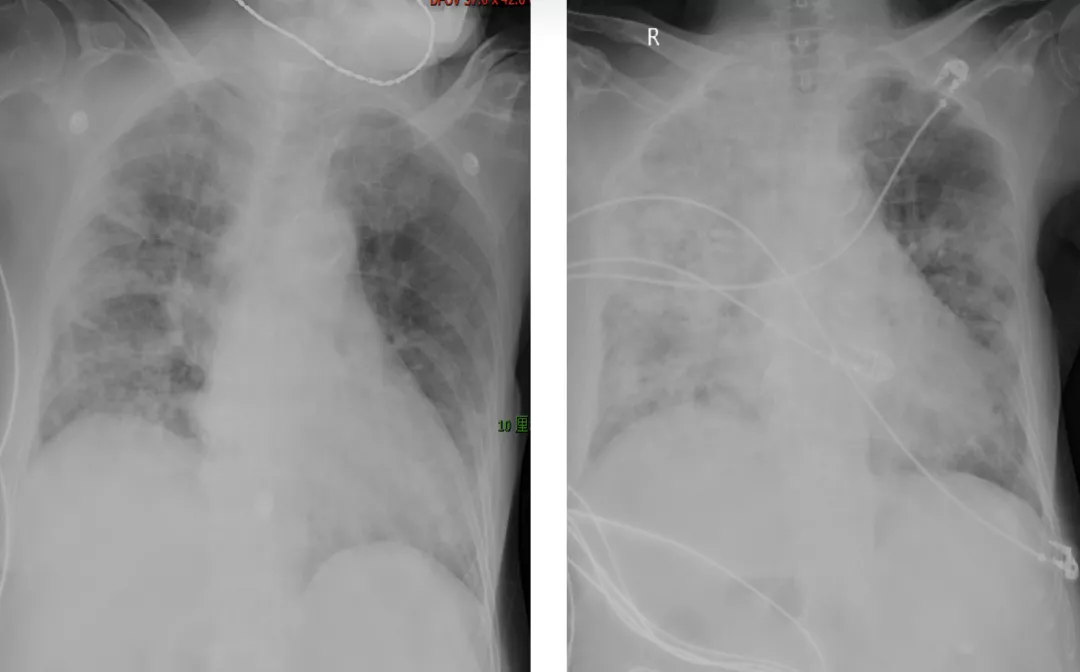
患者的呼吸困难不断加重,于是我们复查了床边胸片,非常不幸,在此前病灶有所吸收的基础上,再次出现了恶化,尤其是右肺。(左 2020.2.26;右 2020.3.1)
问题、困惑及诊疗经过
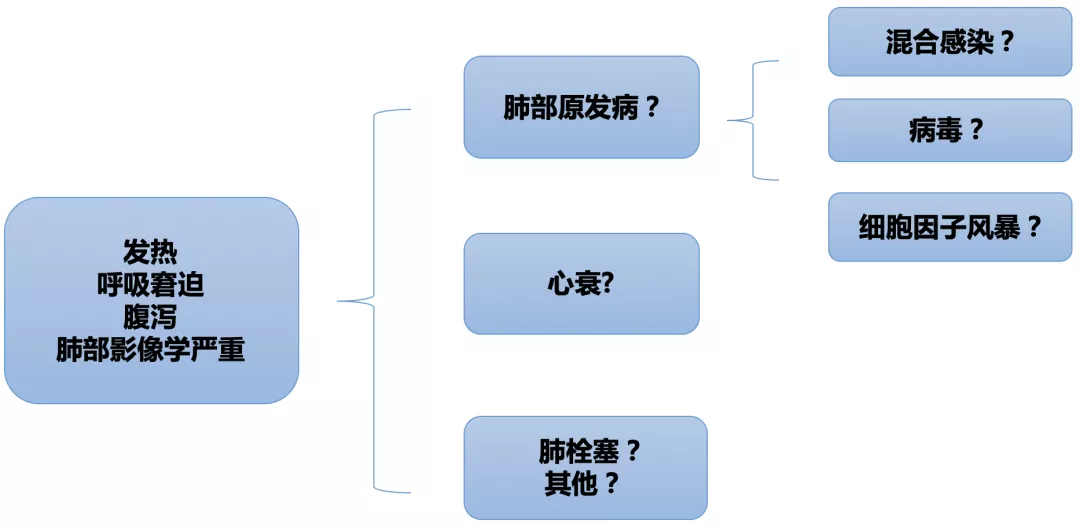
这时,我们内心非常焦灼,在前两周的治疗中,患者曾一度好转,此刻却再次出现发热、呼吸窘迫,并且出现了消化道的症状以及肺部影像学的加重,为什么?出现了混合感染?还是病毒本身没有得到很好的控制?或者是心衰、肺栓塞导致的病情进展?
我们想,既然患者的IL-6有很高水平的上升,是不是「细胞因子风暴」造成了患者临床症状的波动呢?
这时第7版新型冠状病毒肺炎诊疗方案发布了,对于这种双肺的广泛病变,并且是危重症的患者,实验室如果检测到IL-6水平增高,可以考虑用托珠单抗的治疗。当时的局面比较被动——患者病情出现了反复,并且,经过这次反复后,甚至比入院前的情况更重。3月3日,我们一方面给予了托珠单抗400毫克,同时将激素调整为40毫克甲强龙(此前已改为口服)。
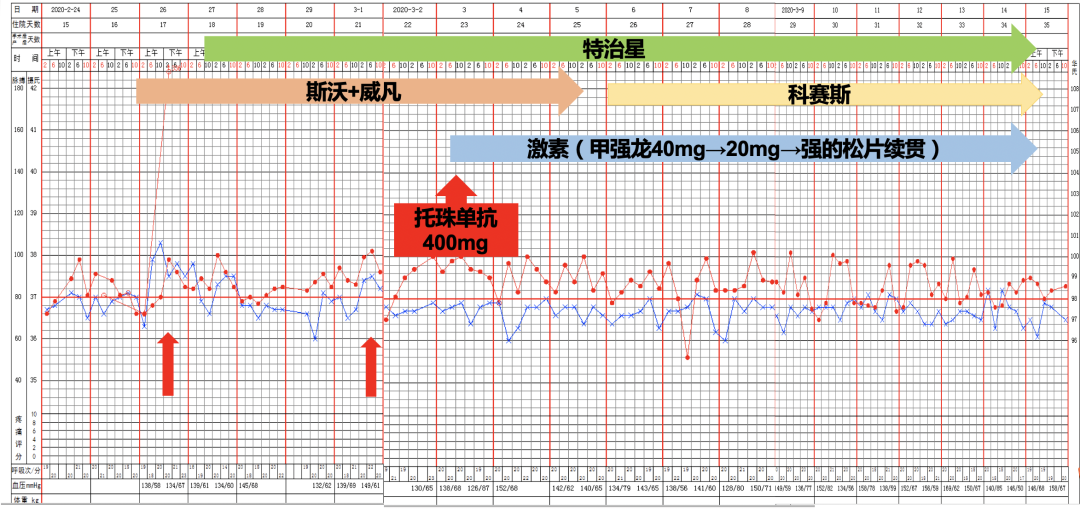
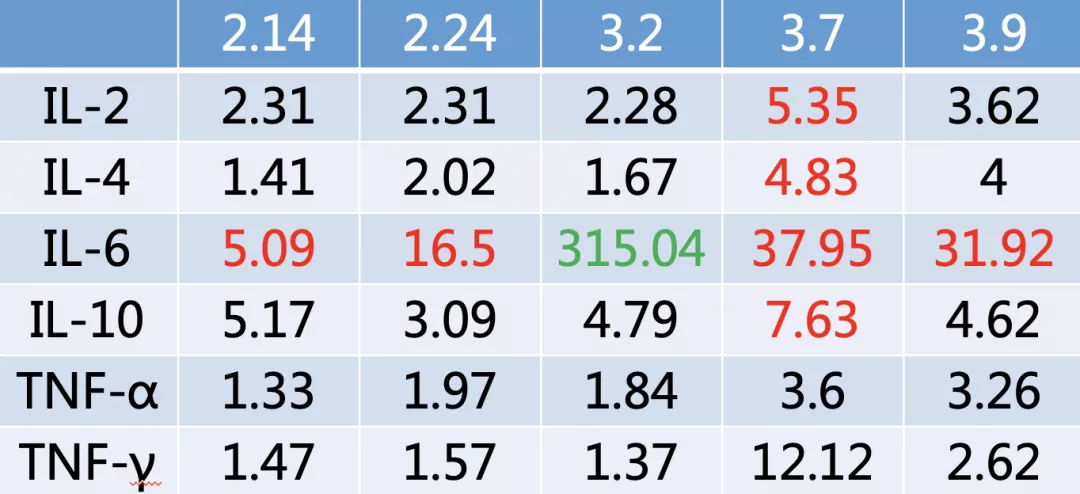
症状方面:体温正常,咳嗽明显减少,呼吸困难显著改善,腹泻症状消失,食欲改善;小剂量胰岛素可稳定血糖;呼吸支持:HFNC→鼻导管吸氧。
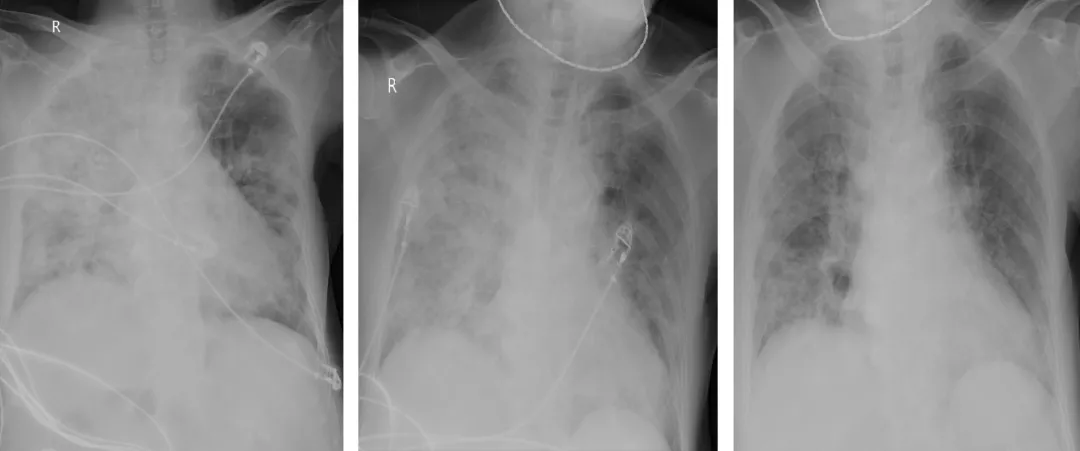
复查胸片,在3月1日(左图)急剧加重之后,我们在4日、11日(中图、右图)连续复查了两次的胸片,较比之前都在进一步吸收好转。
3月12日~3月25日 / 治疗第三阶段
患者病情稳定后,激素逐步减量,同时辅以康复训练,患者最终完全脱氧,于3月25日出院。
我们再次深刻体会到「普通型转重症型预警指标」的重要
老年(年龄> 65 岁)
伴有合并症,如高血压、糖尿病、冠心病等
外周血淋巴细胞进行性下降, CD4+ T 淋巴细胞数<250/µl
外周血炎症因子, 例如 IL-6、 C 反应蛋白( CRP) 等进行性上升
乳酸进行性升高,乳酸脱氢酶( lactic dehydrogenase, LDH) >2 倍正常值上限
肺内病变在 2~3 d 内明显进展>50%
代谢性碱中毒
序贯器官功能衰竭评分( sequential organ failure assessment, SOFA) 高
入院时 D-二聚体水平>1mg/L 等是重型的危险因素
常常讨论的COVID-19抗病毒/细菌治疗
目前无特效的抗病毒药物,已用于临床及临床试验的药物:法匹拉韦、瑞德西韦、洛匹那韦/利托那韦、利巴韦林、氯喹、羟氯喹、阿比多尔......服药期间应密切监测药物不良反应,以及与其他药物间的相互作用,抗细菌药物:应避免盲目或不恰当使用。

COVID-19与细胞因子释放综合征有怎样的关系?
重症COVID-19患者IL-2、IL-6、IL-7、IL-10、G-CSF、IFN-γ、TNF-α显著上升,这些因子的变化与疾病的进展及预后相关;重症COVID-19导致死亡的患者病理改变为伴发纤维粘液样渗出物的双侧弥漫性肺泡损伤。
细胞因子释放综合征(CRS)是一种致命的失控的全身炎症反应,临床表现具有非特异性,综合征严重危及生命,特点是T细胞及Nk细胞减少,IL-6增高,发热,器官与组织功能不全,异常凝血功能。IL-6为相关性较好的早期标记物。这个病例中,我们使用的是IL-6拮抗剂「托珠单抗」进行治疗。
COVID-19与糖皮质激素是需要我们不断探索的问题
对新型冠状病毒肺炎患者使用糖皮质激素需要符合以下基本原则:
1)使用糖皮质激素前需仔细权衡利弊
2)慎用糖皮质激素,应主要用于重症患者
3)对于新型冠状病毒感染前因各种原因已经存在低氧血症或由于慢性疾病已经规律使用糖皮质激素的患者,使用糖皮质激素应更加谨慎
4)剂量和疗程:中小剂量(≤ 0.5-1 mg/kg/d 甲泼尼龙或同等剂量),短程(≤7日)
关于激素在COVID-19的应用,目前争议还很大,已有相关RCT研究,期待相关结果公布。
COVID-19与氧疗、呼吸支持
尽管这位患者出现了「白肺」,但通过观察,除了传统氧疗,最高级别呼吸支持手段是HFNC。没有使用无创、有创通气甚至ECMO。直到今天,很多西方学者都担心经鼻高流量氧疗会造成气溶胶扩散,但是也有研究结论认为:在健康志愿者中,在颗粒直径在10-10000nm之间,并没有证据显示气溶胶增加。
HFNC
特点:高氧浓度(FiO₂ 21-100%),高流速(最高可达60-70L/min),加温加湿,低水平的呼吸末正压(CPAP效益)。
适应症:当普通氧疗装置难以纠正急性低氧性呼吸衰竭( 150 mmHg≤PaO₂/FiO₂<300 mmHg)和(或) 呼吸困难时,可以考虑早期 HFNC治疗。
相对禁忌症:重度I型呼吸衰竭,通气功能障碍(PH<7.30);矛盾呼吸;气道保护能力差,有误吸高危风险;血流动力学不稳定,需要应用血管活性药物;面部或上呼吸道手术不能佩戴HFNC者;鼻腔严重堵塞;HFNC不耐受。
NIV
无创正压通气常用模式包括持续气道正压通气(CPAP)和双水平正压通气(BiPAP),无创正压通气治疗低氧血症呼吸衰竭时需要床旁关注治疗细节。
模式选择:因CPAP人机同步性优于BiPAP,首选CPAP模式;对于不能耐受CPAP或者合并慢阻肺患者可考虑选择BiPAP。
禁忌症:气道分泌物多/排痰障碍;严重感染;极度紧张;严重低氧血症PaO₂<45mmH;严重酸中毒pH<7.20;近期上腹部手术后;严重肥胖;上气道机械性阻塞。心跳呼吸停止;自主呼吸微弱、昏迷;误吸可能性高;合并其它器官功能衰竭(血流动力学不稳定、严重脑部疾病、消化道大出血/穿孔);面部创伤/术后/畸形;不合作。
无创正压治疗低氧血症呼吸衰竭失败常见的高危因素:休克;多脏器功能衰竭;高APACHE II评分;P/F<147mmHg;VTe>9.5ml/kg;高RR;高分钟通气量等。
本例病例总结
我还想强调的是「气道管理」,重症新冠患者的分泌物引流非常重要,我们需要做好防护来对这类患者进行吸痰治疗,另外VTE的预防也不容忽视,还有脏器支持、营养、康复等等,患者的最终康复需要所有医务人员共同努力。总而言之,目前尚没有特效的抗病毒治疗,我们需要随时严密的、动态的监测患者的病情变化。
参考文献
[1] 中华医学会呼吸病学分会, 中国医师协会呼吸医师分会. 新型冠状病毒肺炎防治专家意见 [J/OL] . 中华结核和呼吸杂志,2020,43 (2020-04-05)
[2] Grein J, Ohmagari N, Shin D, et al. Compassionate Use of Remdesivir for Patients with Severe Covid-19. N Engl J Med. 2020;382(24):2327-2336. doi:10.1056/Nbjmoa2007016
[3] Cao B, Wang Y, Wen D, et al.
[4] A Trial of Lopinavir-Ritonavir in Adults Hospitalized with Severe Covid-19. N Engl J Med. 2020;382(19):1787-1799. doi:10.1056/NEJMoa2001282
[5] Luo W, Li YX, Jiang LJ, Chen Q, Wang T, Ye DW. Targeting JAK-STAT Signaling to Control Cytokine Release Syndrome in COVID-19 [published online ahead of print, 2020 Jun 17]. Trends Pharmacol Sci. 2020;S0165-6147(20)30143-7. doi:10.1016/j.tips.2020.06.007
[6] Wang W, Liu X, Wu S, et al. The Definition and Risks of Cytokine Release Syndrome in 11 COVID-19-Affected Critically Ill Patients with Pneumonia: Analysis of Disease Characteristics [published online ahead of print, 2020 Jun 30]. J Infect Dis. 2020;jiaa387. doi:10.1093/infdis/jiaa387
[7] Gautier-Vargas G, Baldacini C, Benotmane I, et al. Rapid
[8] resolution of cytokine release syndrome and favorable clinical course of severe COVID-19 in a kidney transplant recipient treated with tocilizumab. Kidney Int 2020.
[9] Dastan F, Nadji SA, Saffaei A, Tabarsi P. Tocilizumab administration in a refractory case of COVID-19. Int J Antimicrob Agents 2020: 106043.
[10] Price CC, Altice FL, Shyr Y, et al. Tocilizumab Treatment for Cytokine Release Syndrome in Hospitalized COVID-19 Patients: Survival and Clinical Outcomes [published online ahead of print, 2020 Jun 15]. Chest. 2020;S0012-3692(20)31670-6. doi:10.1016/j.chest.2020.06.006
[11] Shang L, Zhao J, Hu Y, Du R, Cao B.
[12] On the use of corticosteroids for 2019-nCoV pneumonia. Lancet. 2020;395(10225):683-684. doi:10.1016/S0140-6736(20)30361-5
[13] Frat JP, Thille AW, Mercat A, et al. High-flow oxygen through nasal cannula in acute hypoxemic respiratory failure. N Engl J Med. 2015;372(23):2185-2196. doi:10.1056/NEJMoa1503326
[14] Kang BJ, Koh Y, Lim CM, et al. Failure of high-flow nasal cannula therapy may delay intubation and increase mortality. Intensive Care Med. 2015;41(4):623-632. doi:10.1007/s00134-015-3693-5
专家介绍

周琼
华中科技大学同济医学院附属协和医院呼吸与危重症医学科主任,教授,主任医师,博士生导师,美国国立卫生研究院(NIH)访问学者。现任中华医学会呼吸病学分会青年委员会委员,中国老年医学会呼吸病学分会慢性阻塞性肺疾病学术委员会委员,湖北省病理生理学会呼吸专业委员会副主任委员,湖北省医学会呼吸病学分会常务委员,湖北省预防医学会过敏病预防与控制专业委员会常务委员。研究领域为肺部疾病的免疫学机制及胸膜疾病的基础和临床研究。主持国家自然科学基金面上项目四项,卫生部公益性行业基金一项,省部级课题三项。以第一作者/通讯作者发表SCI论文20余篇。获得中华医学科技奖二等奖1项;获得华中科技大学「十佳青年教工」称号。
本文由《呼吸界》编辑 Jerry 整理、排版,感谢周琼教授的审阅修改!


