引言
「我这就是个炎症,都说是炎症」临床中每天可见这种抱着侥幸心理前来就诊的患者,有的甚至辗转过多家医院,有的做过病理未能获得阳性结果,但抗炎治疗又无效……实际诊断中,该抓哪些线索?该往哪里思考?该用到哪些手段?我们选了这4例像极了「炎症」的病例,分两期讲述,每一例诊断都十分曲折,但最终还是找到了突破口,希望能对同道有一些帮助。
无阳性病理结果,抗炎治疗后病变不仅没有吸收,甚至电脑阅片结果提示双肺病变远较其从当地医院带来的胸片加重……这个病例让我们的诊断几度陷入困境
这是一个47岁的女性患者,工人,2014年3月12日主诉「胸闷、气短5月」入院治疗。患者称3个月前无明显诱因出现胸闷、气短,活动后显著,伴咳嗽、咳痰,咳少量白色粘痰,间断发热,体温最高38℃。刚开始,患者自行服用抗生素(具体不详)治疗,症状无好转,后至当地县医院住院治疗,行胸部正位片检查提示「双下肺炎症」,给予「头孢曲松」抗炎治疗后体温下降,症状有所减轻,未复查胸片即出院。
2014年6月3日患者再次出现活动后胸闷、气短,间断咳嗽,咳黄色粘痰,无咯血,无发热,再次就诊于当地县医院,行胸部CT检查提示「左肺下叶高密度影」,再次按肺炎给予「哌拉西林他唑巴坦、左氧氟沙星」抗炎治疗,症状稍有减轻。但复查胸部CT病变无吸收,建议上级医院进一步诊治,患者未予重视。直到来我院就诊的1周前,患者自觉胸闷、气短加重,咳嗽、咳痰变化不大,当地医院再次胸部CT检查示「左下肺实变影」,患者才来到我院,门诊以「肺炎」收住院治疗。
患者自发病以来,除体重减轻约5公斤外,其他一切如常,且既往体健,否认烟酒等不良嗜好,否认肿瘤家族史。患者的查体情况为:T 36.9℃,P 116次/分,R 23次/分,BP 131/81mmHg,全身浅表淋巴结未触及肿大,听诊双肺呼吸音粗,未闻及干湿性罗音。初步诊断为肺部阴影,不排除炎症或者肿瘤。
我们对患者进行了辅助检查:血常规示中性粒细胞百分比74.11%,凝血示D-二聚体2680.00 ug/L,ESR 81mm/h,C反应蛋白、降钙素原、内毒素、真菌D-葡聚糖、半乳甘露聚糖肽、肝肾功、电解质、心肌酶、电解质均正常;结核杆菌抗体、结核杆菌DNA、结核感染T淋巴细胞检测、PPD试验均阴性;病毒TROCH、EBV-DNA、CMV-DNA阴性;自身抗体、抗中性粒细胞抗体、风湿系列阴性;肿瘤标志物CA125 53.85 U/ml(正常值0—35 U/ml);血气分析(FiO2 21.0%)示pH 7.402、PaO2 70.1mmHg、PaCO2 37.2mmHg、SaO2 95.8%。
入院后,给予患者莫西沙星抗感染治疗。2014年6月14日行支气管镜检查,镜下见:双肺上叶支气管系统粘膜轻度潮红,分泌物不多,双下叶及右中叶支气管粘膜大致正常,各管腔通常,未见肿物及狭窄。支气管镜下活检病理结果提示左下叶支气管粘膜及肺组织慢性炎伴少数肺泡扩张。
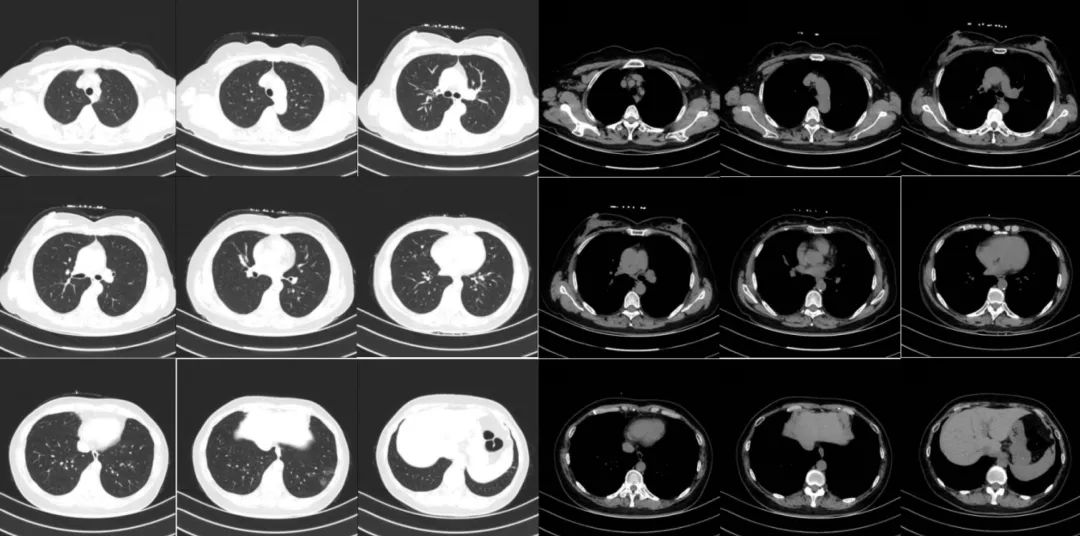
患者入院抗炎1周后,我们安排其复查胸部CT。以下为2014年6月19日患者胸部CT影像学资料:
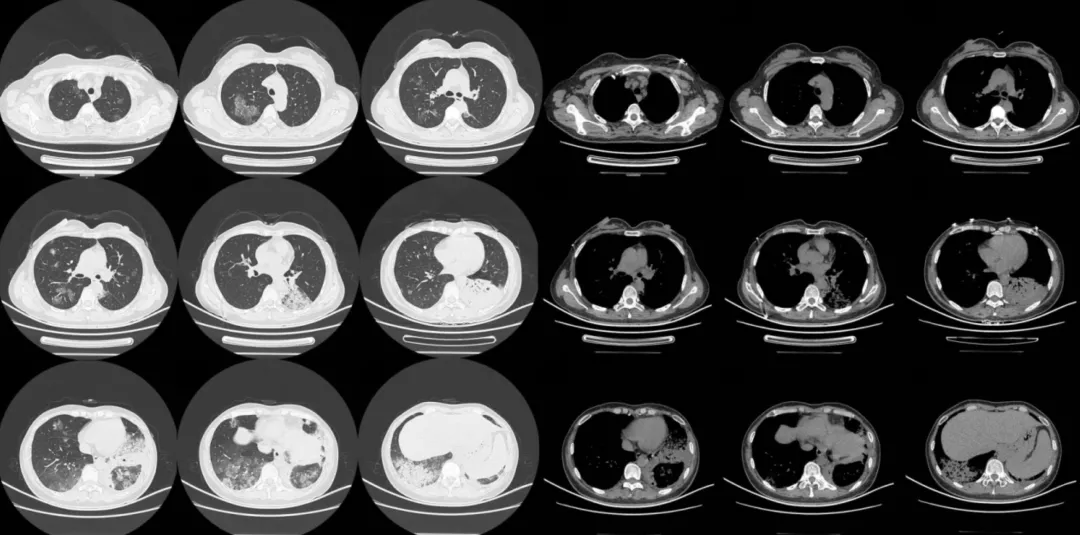
我院胸部CT提示:患者双肺下叶多发大片状致密影,边界不清,右肺、左肺上叶可见沿支气管播散多发GGO和结节,呈非对称性分布,叶间裂前凸;纵隔可见多发小淋巴结影,左侧胸腔可见微量胸腔积液。
此时,诊断是什么?我们陷入了困境。支气管镜未能获得阳性病理结果,抗炎治疗后病变不仅没有吸收,甚至电脑阅片的结果提示双肺的病变,较其从当地医院带来的胸片加重,右肺下叶实变影及双肺多发结节状磨玻璃影在短期内出现,当然这个不除外电脑阅片和胶片因为层厚的关系,带来的阅片误差。
患者在当地医院反复抗炎,入院后给予莫西沙星抗炎,影像学没有好转,腺癌?肺粘膜相关淋巴瘤?干酪性肺炎?隐源性机化性肺炎?肺泡蛋白沉积症?很多可能的诊断在我们医疗小组的讨论中都被考虑到,结核相关检查均是阴性,病变似有加重,但没有出现游走的特点,没有反晕征,影像学非典型铺路石征,我们一个一个排除,肺腺癌、MALT这两种可能性最大,无论是哪一个诊断,病理都是「金标准」,与患者家属沟通后,决定行经皮肺穿刺活检。可此时经超声探查发现左肺下叶窄带状实变区,下叶呼吸动度大,穿刺风险很大。为了尽可能规避风险,家属选择了放弃超声引导下肺穿刺活检,要求行PET-CT检查。我们告知患者家属,PET-CT仍是影像学检查,无法获得确诊结果,但患者家属仍坚持行PET-CT检查,结果回报「左肺下叶、右肺下叶后基底段见大片实变影,密度尚均匀,细支气管管壁僵硬,病灶核素代谢呈大片状高代谢,标准摄取值SUVmax 7.8—11.6;右肺上叶、中叶及左肺上叶内见多发磨玻璃影,部分呈结节状,大小不等,边界清楚,其中左肺上叶后段核素代谢增高,SUVmax4.7。」
根据PET-CT结果,我们将诊断锁定肺腺癌。此时看到这个结果的家属也很震惊,决定配合医生冒险行左肺下叶经皮肺穿刺活检。病理结果最终证实肺腺癌,贴壁生长型,基因突变检测提示EGFR 19del,虽然没有全身其他脏器转移,但是双肺弥漫性病变,没有手术机会。根据基因检测结果,患者开始口服吉非替尼,2015年7月,患者复查胸部 CT病变完全消失,达到CR标准。
最终诊断
肺恶性肿瘤(左肺下叶,腺癌,cT4N0M1a Ⅳa期),伴双侧肺内转移。

2015年7月13日复查胸部CT:
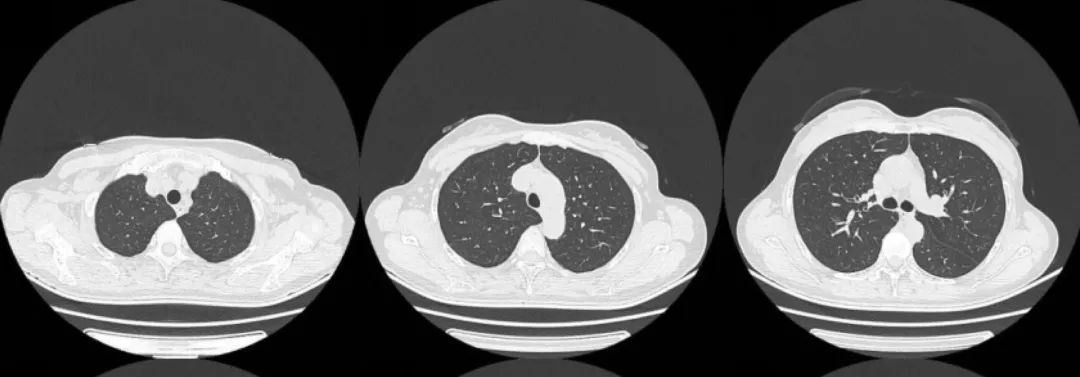
患者口服了5年的吉非替尼,胸部CT一直未发现肿瘤复发迹象。因患者出现明显的少汗症状,2019年自行停止服用吉非替尼,停药后曾复查,病情也很稳定。但就在患者及其家属满心欢喜的时候,今年5月份前来复查胸部CT,又发现「不速之客」——患者胸部CT提示左肺下叶多发磨玻璃结节影。
究竟是肿瘤复发吗?家属和我们的脑海里第一个担忧的正是这个问题。再次安排支气管镜检查,镜下见:双侧支气管系统可见少量白色稀薄分泌物,抽吸后见粘膜充血潮红,左下稍重,各管腔通畅,未见肿物及狭窄。支气管镜活检病理:「左下叶基底支」支气管粘膜及肺组织慢性炎,伴局灶上皮增生。全身排查未发现肿瘤转移证据。
尽管支气管镜检查未能发现肿瘤细胞,但仍需警惕肺癌复发。最终家属与患者沟通后,决定积极配合我们动态观察。
这种肺腺癌大多表现为肺内的结节影、团块影和斑片状阴影,易误诊为肺炎……早期手术治疗预后较好,而「肺炎型」患者多因双肺多发病灶,失去了手术机会,所以预后差,最终这个患者放弃治疗
第二个案例是一个39岁的男性患者,家中务农。患者于2019年1月17日入院,主诉咳嗽6个月,加重伴气短1周。在我院就医的6个月前无明显原因出现了咳嗽,咳少量白色粘痰,偶有痰中带血丝,无发热、盗汗及消瘦等,于当地医院就诊,给予阿奇霉素及双黄连治疗后症状好转。此后上述症状反复发作5次,均于当地医院诊治后缓解。1周前,上述症状再次出现,并较前加重,伴胸闷、气短及胸痛,右侧前胸压痛明显,于当地医院就诊,行胸部CT检查提示「双肺斑片状高密度影」,以「肺炎」收住院。入院后常规检查未见异常,痰抗酸杆菌染色阴性,PPD试验阴性,给予头孢曲松治疗2周无效且咳嗽、气短逐渐加重,遂来我院,门诊以「肺部阴影」收住入院。
该患者发病以来,饮食、夜休尚可,二便如常,体重亦无明显增减。既往体健,否认烟酒不良嗜好,否认肿瘤家族史。我们对其进行查体的情况:T 36.5℃,P 72次/分,R 24次/分,BP 107/67mmHg,全身浅表淋巴结未触及肿大,听诊双肺呼吸音粗,未闻及干湿性罗音,心律齐,未闻及病理性杂音,腹软,无压痛及反跳痛,双下肢无水肿。以下是2019年1月18日的胸部CT影像学资料:
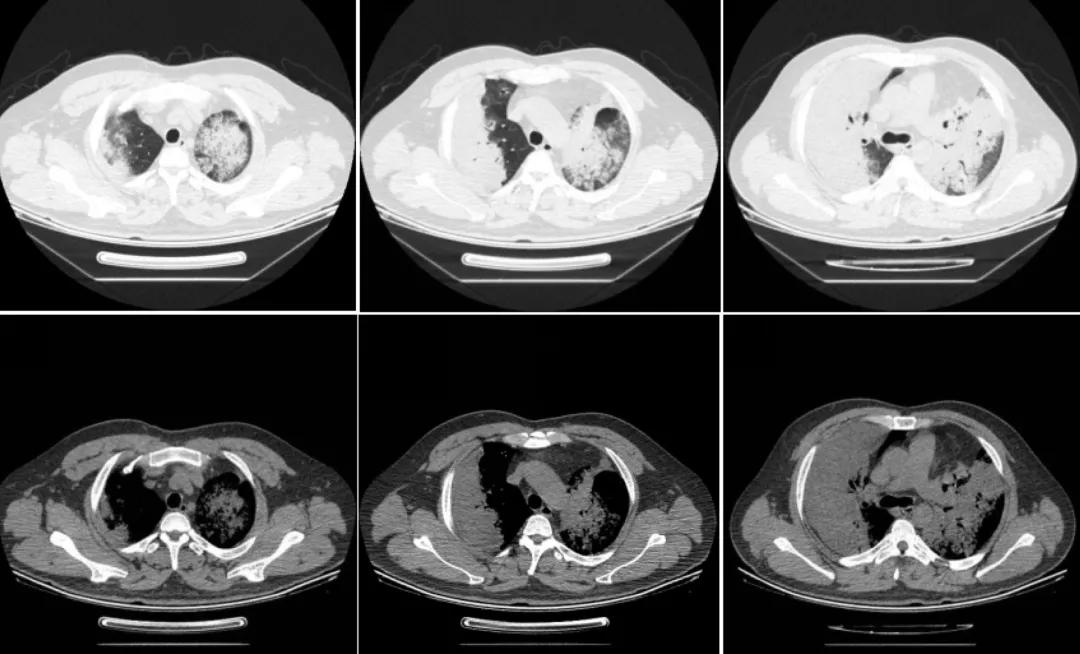
患者胸部CT提示:右肺上叶、下叶及左肺可见片状、斑片状高密度影,边界相对清楚,其内可见含气支气管影、枯枝征、囊腔、小泡。
初步诊断
肺部阴影性质待定
1. 肺炎(细菌、真菌)?
2. 肺结核 ?
3. 肺癌 ?
对患者辅助检查的情况:血常规、C反应蛋白、降钙素原、血沉、内毒素、真菌D-葡聚糖、半乳甘露聚糖肽、凝血、肝肾功、电解质、心肌酶、电解质均正常;结核杆菌抗体、结核杆菌DNA、结核感染T淋巴细胞检测、PPD试验阴性;病毒TROCH、EBV-DNA、CMV-DNA阴性;自身抗体、抗中性粒细胞抗体、风湿系列阴性;肿瘤标志物神经元特异烯醇化酶17.90ng/ml(正常值0—16.3ng/ml);血气分析(FiO2 21.0%)示pH 7.415、PaO2 67.1mmHg、PaCO2 35.8mmHg、SaO2 94.5%。
考虑患者年轻男性,慢性咳嗽6月,当地抗炎治疗后可缓解,但病情反复发作,结核不能除外,遂入院后2019年1月17日—1月20日给予左氧氟沙星0.6g IVD qd+依替米星300mg IVD qd治疗。
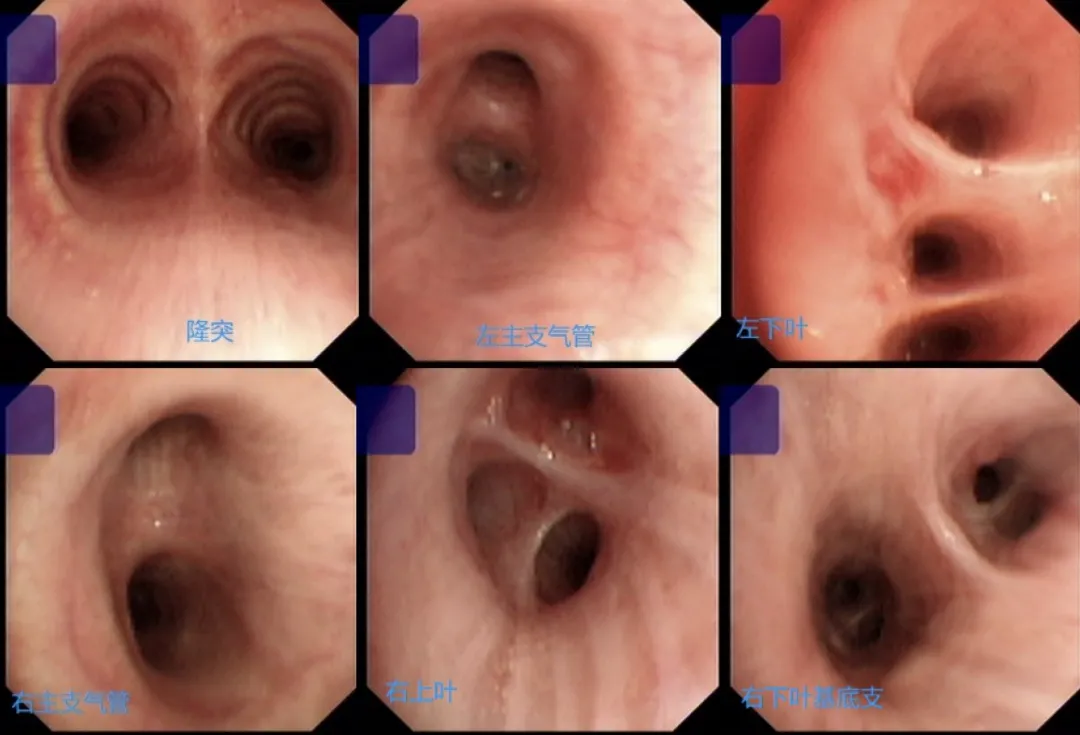
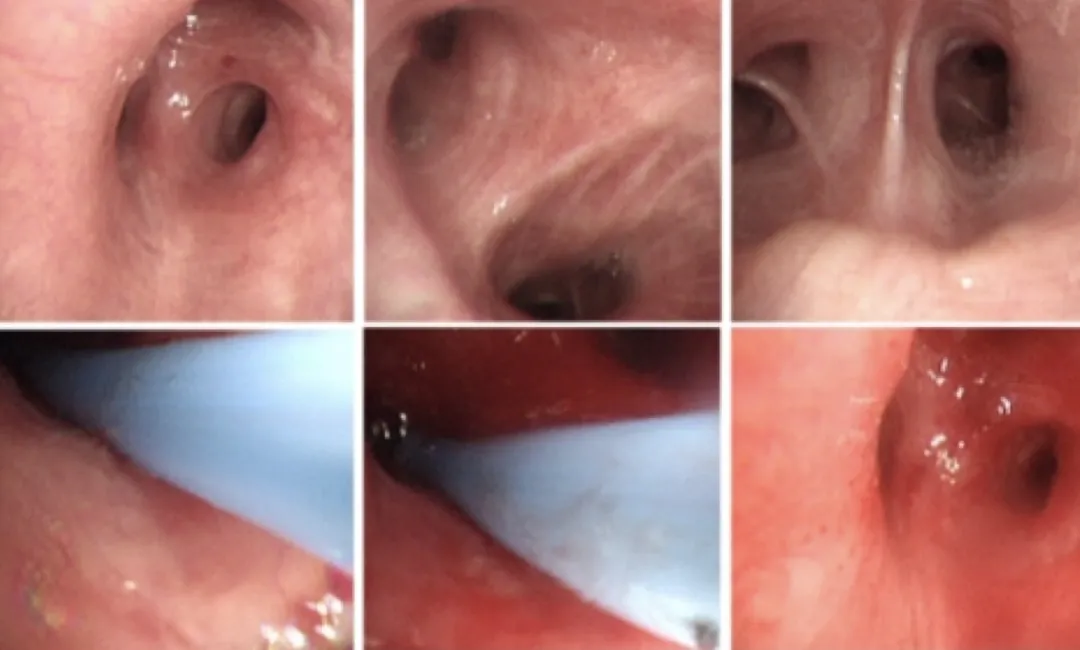
2018年1月21日,对患者行支气管镜检查发现,其双侧支气管内可见少许白色粘稠分泌物,抽吸后见粘膜超声、充血,管腔通常,未见肿物及狭窄(如下图)。
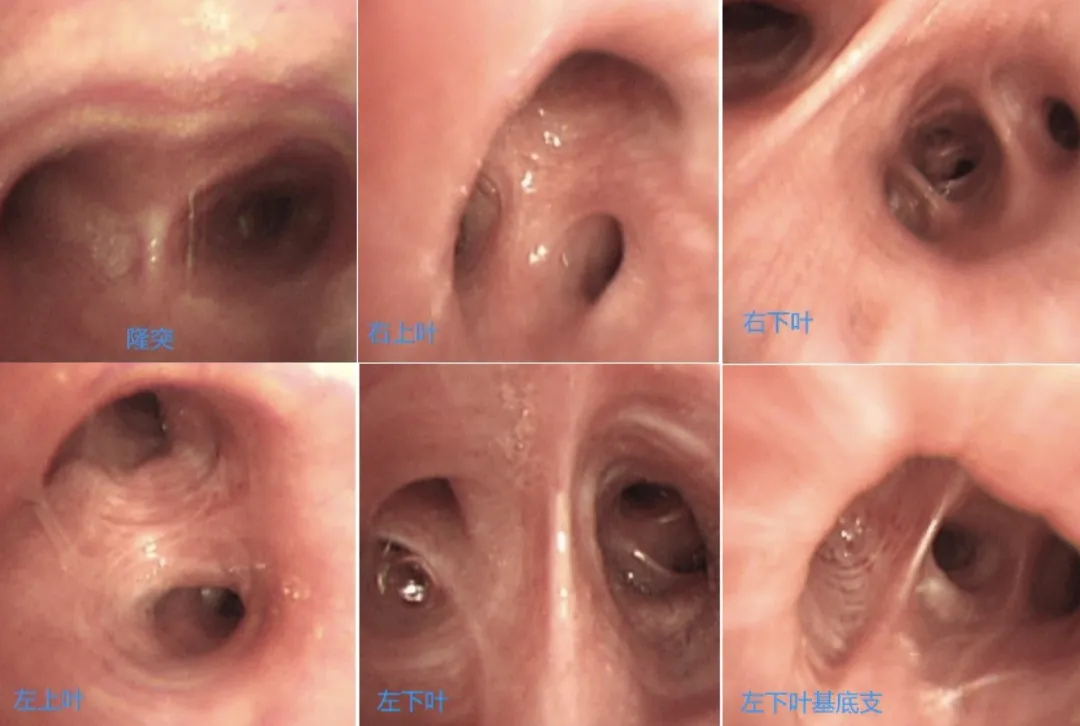
支气管镜下刷片、肺泡灌洗液送Xpert等检查,未发现结核证据。支气管镜下活检病理:送检右肺上叶支气管粘膜活检组织,镜下提示增生的支气管粘膜腺体;免疫组化:TTF-1(-),Napsin A(-);特染:PAS(-),D-PAS(-),AB(-)。
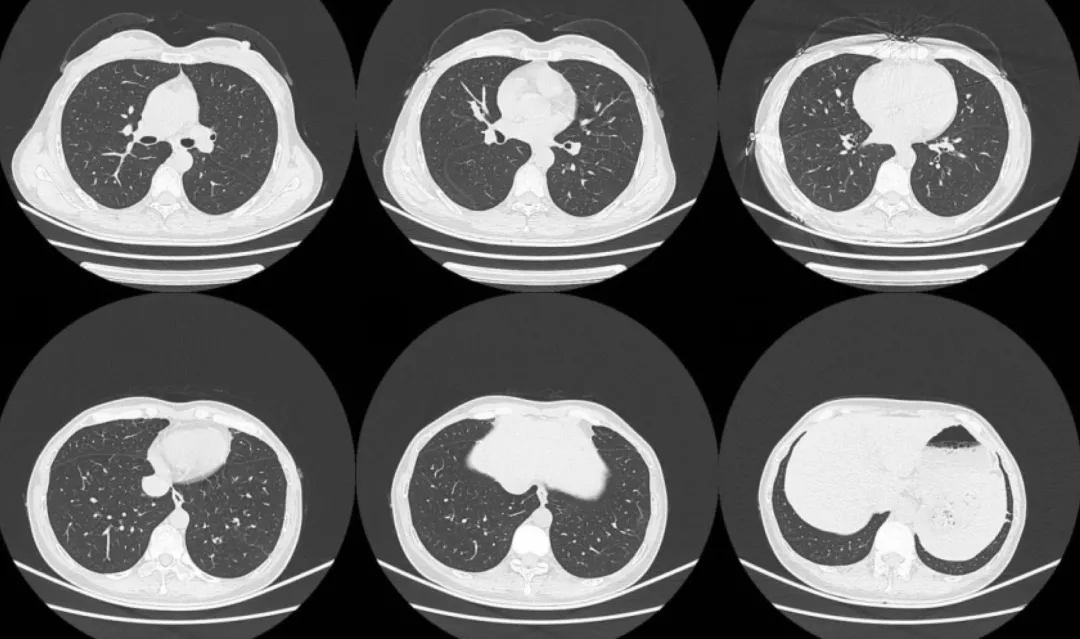
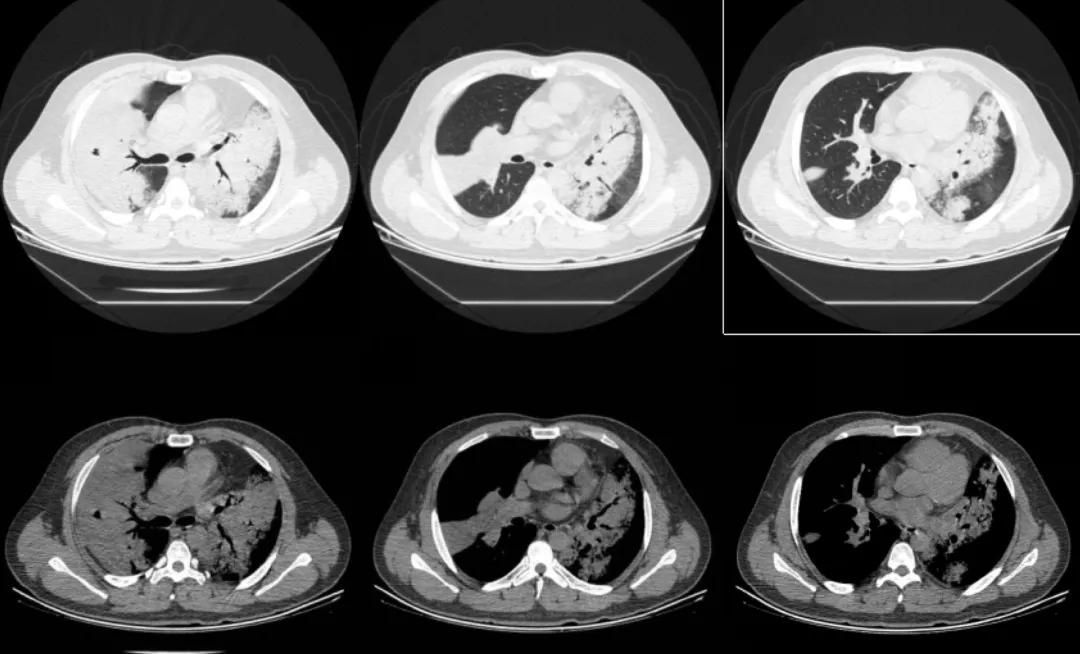
患者第一次支气管镜检查未发现结核证据,从常见病因考虑,感染性病变仍不能除外,遂于1月21日起给予比阿培南0.3g IVD q8h+替考拉宁0.4g IVD qd加强抗感染治疗。以下为2019年1月28日复查胸部CT的影像学资料:
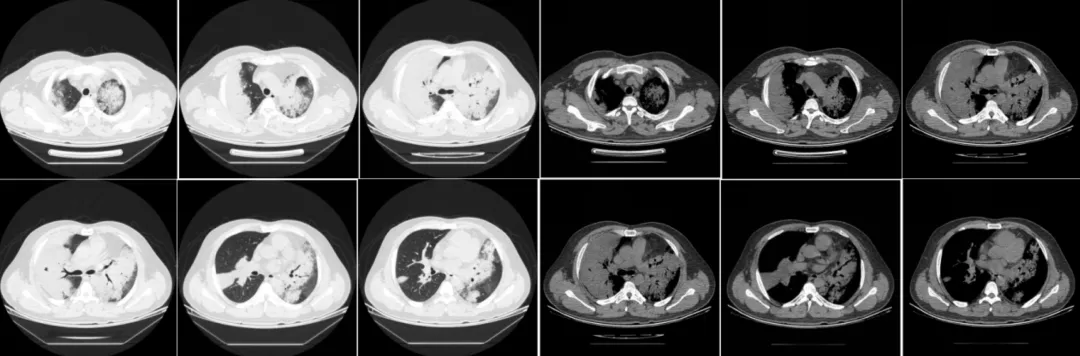
经比阿培南联合替考拉宁加强抗感染治疗后,双肺弥漫性病变无吸收。同时考虑第一次支气管镜活检病理结果与胸部CT影像表现不符合,遂于1月29日再次行支气管镜检查并行右肺上叶前段、后段冷冻肺活检(如下图)。
病理:右上叶前、后段原位粘液腺癌,浸润不除外;免疫组化:CK7(+) 、TTF-1(-)、Napsin A (-)、P63(-)、TS (+)、CK5/6(-)、P53少数细胞(+)、CgA (-)、CD56(-)、CEA(-)、P16(-)、Ki67(+)30%。进一步进行基因突变检测:未检测到EGFR、ALK、ROS1、KRAS、BRAF、HER-2、NRAS、RET、PI3KCA基因突变。全身排查:颅脑CT、上腹部CT、颈部及锁骨上窝淋巴结超声、全身骨显像未见异常。
该患者最终诊断为:肺恶性肿瘤(粘液腺癌,cT4N0M1a Ⅳa期),伴双侧肺内转移。最终,该例患者放弃治疗,自动出院。

结合这1病例分析原发性肺粘液腺癌(Primary pulmonary mucinous adenocarcinoma,PPMA):
原发性肺粘液腺癌是一组产生粘蛋白的罕见肺腺癌亚型,常表现为慢性咳嗽、咳痰,胸闷、气短、发热、咯血以及胸痛等。PPMA影像学缺乏特异性,大多表现为肺内的结节影、团块影和斑片状阴影,易误诊为肺炎、肺结核、慢性嗜酸性粒细胞性肺炎、肺泡蛋白沉积症以及其他肺部弥漫性病变。
CT表现为囊实性肿块伴有卫星状小空泡征、支气管充气征,多分布在双肺下叶,增强CT呈轻-中度强化;PET-CT平均SUV为2.3 ±1.9。
PPMA病理特征为癌组织呈界限不清的褐色或灰褐色、柔软、半透明似胶冻的瘤体组织,癌细胞分化程度高,恶性程度低,癌细胞分泌粘液在细胞内聚集将细胞核挤压到一侧呈新月形,分泌到细胞外形成粘液池。
PPMA免疫组化病理表现为CK20、CDX2和 HNF4α表达阳性,TTF-1和Napsin A表达缺乏。
PPMA发病率低,临床上较为罕见,临床症状和影像学不典型,诊断主要依靠病理学。由于分化程度高,恶性程度低,远处转移少见,主要为气道播散导致肺内转移,因此常表现为两肺多发,双肺下叶为主。原发灶完全切除病例的所有复发部位多仅限于肺部。
PPMA驱动基因突变率低,主要为ALK重排和KRAS突变,在KRAS野生病例中,存在其它靶向基因融合和突变,包括CD74-NRG1、VAMP2-NRG1、TRIM4-BRAF、TPM3-NTRK1和EML4-ALK基因融合以及ERBB2、BRAF和PIK3CA突变。
PPMA早期手术治疗预后较好,「肺炎型」患者治疗预后差,对驱动基因阴性者可选择免疫或化疗,驱动基因阳性者可选择靶向治疗。
专家介绍

张秋红
主治医师,博士在读。2003年起就读于西安交通大学临床医学(七年制),2010年毕业后留西安交通大学第二附属医院呼吸内科工作至今。任陕西省抗癌协会肿瘤个体化诊疗专业委员会委员、陕西省老年病学会呼吸学会委员。发表核心期刊论文数篇,主持陕西省重点研发计划社会发展领域项目一项。在带教工作中曾获优秀教师称号。在呼吸内科常见病如慢阻肺、哮喘、支气管扩张、肺炎、肺间质纤维化、胸腔积液等疾病诊治方面经验丰富,尤其擅长肺癌的诊治、疼痛规范化治疗、呼吸危重症患者的救治。熟练掌握胸腔穿刺置管闭式引流术、CT引导下经皮肺穿刺活检、内科胸腔镜、支气管镜等技术。

李维
西安交通大学第二附属医院呼吸与危重症医学科副主任医师,临床医学博士,任陕西省抗癌协会肿瘤个体化诊疗专业委员会委员、陕西省抗癌协会化疗专业委员会青年委员会委员、陕西省保健学会过敏性疾病防治专业委员会常委。熟练掌握呼吸内科常见病及多发病的诊治,尤其在肺部阴影、肺部结节的诊断和鉴别诊断及肺癌的治疗方面积累了一定的经验。熟练支气管镜检查、超声支气管镜检查、胸腔镜检查、CT引导下经皮肺穿刺术、支气管热成形术等呼吸科常用诊疗技术。主要研究方向为肺癌的早期诊断及治疗。

杨拴盈
一级主任医师,教授,博士生及博士后导师。西安交通大学第二附属医院呼吸与危重症医学科主任。教育部新世纪优秀人才。中华医学会呼吸分会委员;中华医学会呼吸分会肺癌学组委员;中国呼吸医师协会肺癌工作委员会委员;国际肺癌研究会会员;《中华结核和呼吸杂志》、《中华肺部疾病杂志》、《中国肺癌杂志》、《国际呼吸杂志》《现代肿瘤医学》、《中国呼吸与危重症杂志》、《西安交通大学学报(医学版)》常务编委或编委。主持国家自然科学基金4项,发表论文182篇,SCI 53篇,获省科技进步二等奖2项,主编专著1部,参与制定肺癌诊疗相关指南、共识13部。


