引言
嗜酸性粒细胞增多综合征(HES)可能是一种罕见且长期被忽视的慢性咳嗽原因,此类患者气道中可能有嗜酸性粒细胞浸润,但吸入糖皮质激素或全身糖皮质激素治疗效果不佳,他们往往辗转于多家医院就诊,常被误诊为咳嗽变异性哮喘(CVA)、哮喘或其他嗜酸细胞增高相关性肺病,严重影响患者的生活质量,给患者带来严重的经济负担。上一期《疑案探密》我们分享的案例,就是1例HES伴嗜酸性气道炎症和顽固慢性咳嗽患者。从该案例中,我们可以与同道分享的经验有哪些?在鉴别诊断中,PubMed数据库为我们提供了哪些关键依据?回顾该案例,有哪些特征引领着我们的思路?
咳嗽是否也为HES的主要临床表现之一?HES累及肺的发生率高吗?临床特征如何?HES的咳嗽特点是怎样的?……本患者须考虑什么?
嗜酸性粒细胞增多综合征(HES)是一组异质性疾病,不明原因的持续嗜酸性粒细胞增多症(血嗜酸性粒细胞计数>1.5×109 /L,持续6个月以上),并伴有器官受累的体征和症状 [2] 。 心脏损害是HES发病率和死亡率的主要原因,常表现为心肌病、心内膜炎、瓣膜脱垂伴关闭不全、传导系统受累,本患者心脏方面病变需考虑先天性与嗜酸性粒细胞增多引起的心脏受累相鉴别。
回顾该病例特征
中年男性,表现为慢性咳嗽、气道嗜酸性粒细胞炎症和长期多次外周血嗜酸性粒细胞增多且>1.5×109/L,并伴有心脏损害和呼吸道症状。本患者的突出特点是存在HES和顽固性慢性咳嗽,到底是「一元论」还是「多元论」?
我们在PubMed数据库对「HES」与「慢性咳嗽」进行文献回顾:(该研究结果发表在BMC pulmonary(2020)20:90,谢佳星为第一作者,赖克方教授为通讯作者)网址如下: https://doi.org/10.1186/s12890-020-1134-x
我们检索到了8个队列(共411例)HES患者(表1)[3],肺部受累发生率为25-67%(37.77%),咳嗽发生率为10-41%(23.11%)。发现,16例HES病[3, 5-19](病例3-18,表2)以咳嗽为主要或唯一症状,这些患者的平均年龄为53.6岁,男女比例为13:3,血嗜酸性粒细胞计数均升高,平均值为7800/uL,BALF中的嗜酸性粒细胞均显著升高,从20%到84%不等。其中有9例还伴有PDGFRα融合基因阳性(病例3-11),加上本例病例(病例1,表2),共有10例PDGFRα融合基因且以慢性咳嗽为主要或唯一表现的HES患者。他们都是男性,平均年龄47.7岁。有5例查了总IgE水平,提示血清总IgE不高。除病例9和病例11外,所有患者的肺活量正常。只有2例(病例4和5)进行了气道反应性检查,病例5表现为明显的气道高反应。6例进行了胸部X线检查,有4例表现正常。只有病例1和3进行了诱导痰细胞学检查,提示痰中有明显的嗜酸性粒细胞。另外有2例BALF中嗜酸性粒细胞显著增加(病例1为27%,病例5为20%)。气道粘膜活检显示2例(病例3和4)气道粘膜嗜酸性粒细胞浸润。
并且,这些患者都曾辗转于多家医院,并曾被诊断为哮喘、胃食管反流病、肺炎和其他疾病。其中5人接受口服皮质类固醇(OCS)(病例1、3、4、6和9)。3例接受ICS(病例1、3和5)。2例接受质子泵抑制剂(病例4和5),2例接受诊断性抗寄生虫治疗(病例1和4)。所有这些治疗都无效,最终在接受伊马替尼治疗后病情才得以缓解。以下为关键性依据:
表1:6个队列HES肺部受累和咳嗽的发生率
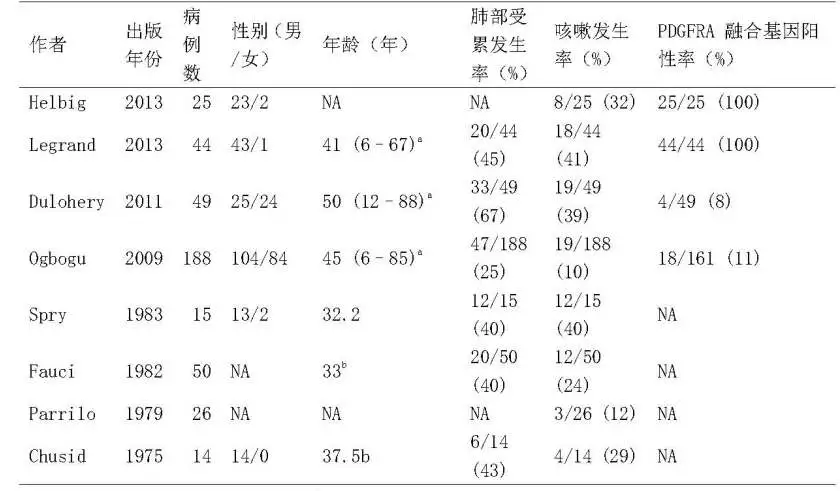
NA:无数据;a中位数(范围);b 平均数
表2:以咳嗽为表现的高嗜酸性粒细胞综合征18例临床总结

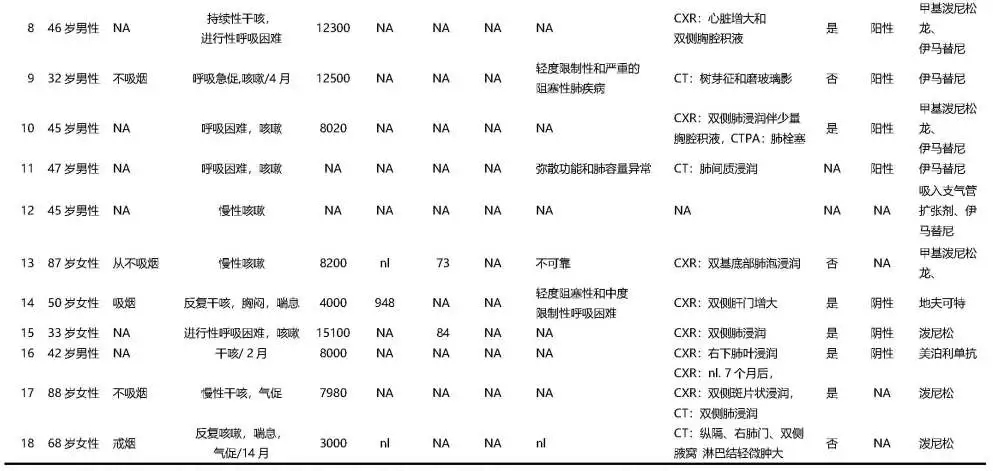
BALF:支气管肺泡灌洗液,CT:计算机断层扫描,CTPA:肺血管造影,CXR:胸片,DLCO:一氧化碳弥散量,Eos:嗜酸性粒细胞,FEV1:1s内用力呼气量,FVC:用力肺活量,nl:正常;NA:无数据;a:目前的情况;b:痰中有大量的嗜酸性粒细胞。
关键性依据分析如何?哪些研究可证实效果?……HES患者咳嗽可能与气道和血液嗜酸性粒细胞计数高有关,可得哪些推断与结论?
随着PDGFRα融合基因检测的普及,越来越多的HES伴PDGFRα融合基因阳性的病例被认识的,这些病人常常被误诊多年,给患者的生活和经济都造成了很大的影响。目前所有HES相关的慢性咳嗽病例只有PDGFRα融合基因重排最常见,而其他融合基因重排,如PDGFRβ、FGFR1和JAK2融合基因重排,在HES伴慢性咳嗽病例中尚未见报道。
尽管先前的研究发现,美泊利单抗不能缓解难治性嗜酸性哮喘患者的咳嗽[20],但它在病例16中却被证实有效[17]。美泊利单抗可能是PDGFRα融合基因阴性的HES患者的一种治疗选择。有研究证明贝那利单抗治疗PDGFRα阴性HES患者后,可以有效减少血液、骨髓和组织Eos增多[21]。
HES患者咳嗽可能与气道和血液嗜酸性粒细胞计数高有关。基底膜增厚、杯状细胞增生或气道嗜酸性粒细胞炎症可以引起咳嗽[22]。肥大细胞也可能参与咳嗽的发生,并成为伊马替尼的靶细胞。已经证实,PDGFRα融合基因阳性的HES患者骨髓中出现大量活跃的肥大细胞[23]。
虽然PDGFRα HES或MHES(病例1-12,表2)可显示支气管高反应性,但对OCS和ICS无反应,这提示似乎过敏性因素不是此病的发病机制。这类患者的嗜酸性气道炎症和支气管高反应性的机制值得进一步研究。此外,心脏也是HES患者最常见的受累器官之一。大量回顾性临床研究数据提示FIP1L1-PDGFRα出现在5-20%伴有明显嗜酸性粒细胞增多的病人。在FIP1L1-PDGFRα阳性的病人中,约20-40%有心脏受累,其典型表现包括心室血栓形成、心内膜增厚纤维化,而瓣膜异常、心室扩张、心室功能受损的诊断必须结合其他可能合并存在的心脏疾病(如冠心病)综合评估。心功能不全引起的肺水肿也可能是HES患者伴发咳嗽的原因。
由此可见,嗜酸性粒细胞增多综合征(HES)可能是一种罕见且长期被忽视的慢性咳嗽原因。对于嗜酸性粒细胞增多的患者,尤其是男性患者,PDGFRα融合基因的筛选试验至关重要。
因此,治疗方面,除了常规药物,包括糖皮质激素、羟基脲和IFN-α外,美泊利单抗是美国唯一批准用于治疗HES的生物制剂,美泊利单抗是一种特异性的靶向白细胞介素5的单克隆抗体,通过阻断单白细胞介素5的信号通路,减少血液、组织中嗜酸性粒细胞的水平,同时也能降低嗜酸性粒细胞所介导的炎症。有研究表明,大多数原发性(肿瘤性)HE和HES患者对糖皮质激素或其他抗炎药无反应。在这些患者中,需要特定的靶向药物强化治疗以控制HE[1]。
国内外有数例伊马替尼100mg-400mg/天治疗高嗜酸细胞增多症病人的个案报告后,最终获得血液学完全缓解,FIP1L- PDGFRα基因最终证实是伊马替尼治疗靶基因,现已证实,伊马替尼对伴有PDGFRα或PDGFRβ重排的骨髓增殖性肿瘤有显效[24]。
大多数PDGFRα融合基因阳性患者对伊马替尼反应良好,早期使用该药物治疗可预防不可逆器官损伤的发生[1]。但是正如本例病人的随诊情况那样,有文献表明,嗜酸性粒细胞浸润引起的心脏损害可能是不可逆的,发生心脏损害后再使用伊马替尼治疗可能不会改善心脏结构异常[25],而且在伊马替尼起效前仍需使用全身糖皮质激素改善心功能。
因此,对于所有怀疑HES的患者,应注意监测Eos浸润引起的器官损害的情况,包括详细检查皮肤、心脏评估、凝血功能、血清肌钙蛋白和BNP、心电图和超声心动图、肺功能、胸腹部影像、心脏MRT和活检、胃镜检查[1]。由于肺是HES的常见受累器官之一,因此有呼吸道症状的HES患者应推荐使用FENO、诱导痰、BALF来监测气道和肺的嗜酸性细胞炎症。以便在出现不可逆器官损害前早期针对性用药,以改善预后。
参考文献
1. Valent, P., et al., Eosinophils and eosinophil-associated disorders: immunological, clinical, and molecular complexity. Semin Immunopathol, 2021. 43(3): p. 423-438.
2. 中华医学会血液学分会白血病淋巴瘤学组, 嗜酸粒细胞增多症诊断与治疗中国专家共识(2017年版) %J 中华血液学杂志 %J Chinese Journal of Hematology. 2017. 38(7): p. 561-565.
3. Arai, A., et al., Successful imatinib treatment of cardiac involvement of FIP1L1-PDGFRA-positive chronic eosinophilic leukemia followed by severe hepatotoxicity. Int J Hematol, 2007. 86(3): p. 233-7.
4. Xie, J., et al., Cough in hypereosinophilic syndrome: case report and literature review. BMC Pulm Med, 2020. 20(1): p. 90.
5. Roufosse, F., et al., Severe Prolonged Cough as Presenting Manifestation of FIP1L1-PDGFRA+ Chronic Eosinophilic Leukaemia: A Widely Ignored Association. Respiration, 2016. 91(5): p. 374-9.
6. Kobayashi, M., et al., A case of hypereosinophilic syndrome presenting with chronic cough successfully treated with imatinib. Respirology, 2009. 14(2): p. 302-4.
7. Chung, K.F., et al., Cough and hypereosinophilia due to FIP1L1-PDGFRA fusion gene with tyrosine kinase activity. Eur Respir J, 2006. 27(1): p. 230-2.
8. Barker, B., et al., Persistent cough: an unusual cause. Idiopathic hypereosinophilic syndrome (HES). Thorax, 2010. 65(11): p. 1009, 1024.
9. Messie, K., et al., Clonal hypereosinophilic syndrome: two cases report in black men from sub-saharan Africa and literature reviews. ISRN Hematol, 2011. 2011: p. 974609.
10. Hossain, N.M., et al., A 32-year-old man with persistent cough, shortness of breath, eosinophilic pneumonia, and peripheral blood eosinophilia. Myeloid neoplasm associated with eosinophilia and platelet-derived growth factor receptor-alpha rearrangement. Chest, 2012. 142(6): p. 1680-1683.
11. Gurgun, A., et al., Hypereosinophilic syndrome presenting with large left ventricular apical thrombus and pulmonary embolism. Echocardiography, 2011. 28(9): p. E180-2.
12. Slabbynck, H., et al., Idiopathic hypereosinophilic syndrome-related pulmonary involvement diagnosed by bronchoalveolar lavage. Chest, 1992. 101(4): p. 1178-80.
13. Karnak, D., et al., Hypereosinophilic syndrome with pulmonary and cardiac involvement in a patient with asthma. Cmaj, 2003. 168(2): p. 172-5.
14. Wojciechowska, C., et al., Heart failure mimicking prior myocardial infarction in a patient with idiopathic hypereosinophilic syndrome. Int Heart J, 2011. 52(3): p. 194-6.
15. Osowo, A., J. Fetten, and S. Navaneethan, Idiopathic hypereosinophilic syndrome: a rare but fatal condition presenting with common symptoms. South Med J, 2006. 99(2): p. 188-9.
16. Goldman, M.H., B.S. Bochner, and D.M. Essayan, Cough, shortness of breath, and eosinophilia in a 68-year-old man. Ann Allergy Asthma Immunol, 1996. 77(3): p. 177-83.
17. Klion, A.D., How I treat hypereosinophilic syndromes. Blood, 2015. 126(9): p. 1069-77.
18. Klion, A.D., et al., Molecular remission and reversal of myelofibrosis in response to imatinib mesylate treatment in patients with the myeloproliferative variant of hypereosinophilic syndrome. Blood, 2004. 103(2): p. 473-8.
19. Pardanani, A., et al., Imatinib therapy for hypereosinophilic syndrome and other eosinophilic disorders. Blood, 2003. 101(9): p. 3391-7.
20. Haldar, P., et al., Mepolizumab and exacerbations of refractory eosinophilic asthma. N Engl J Med, 2009. 360(10): p. 973-84.
21. Alen Coutinho, I., et al., Benralizumab in Severe and Refractory PDGFRA-Negative Hypereosinophilic Syndrome. J Clin Immunol, 2021. 41(3): p. 688-690.
22. Niimi, A., C.E. Brightling, and P.V. Dicpinigaitis, Cough in asthma is due to eosinophilic airway inflammation: a pro/con debate. Lung, 2014. 192(1): p. 33-8.
23. Klion, A.D., et al., Elevated serum tryptase levels identify a subset of patients with a myeloproliferative variant of idiopathic hypereosinophilic syndrome associated with tissue fibrosis, poor prognosis, and imatinib responsiveness. Blood, 2003. 101(12): p. 4660-6.
24. Stella, S., et al., Molecular Pathogenesis and Treatment Perspectives for Hypereosinophilia and Hypereosinophilic Syndromes. Int J Mol Sci, 2021. 22(2).
25. Pitini, V., et al., Serum concentration of cardiac Troponin T in patients with hypereosinophilic syndrome treated with imatinib is predictive of adverse outcomes. Blood, 2003. 102(9): p. 3456-7; author reply 3457.
专家介绍

赖克方
广州医科大学附属第一医院;广州呼吸健康研究院;呼吸疾病国家重点实验室 临床实验部主任。呼吸疾病国家重点实验室慢性咳嗽学组组长,中华医学会呼吸病学分会哮喘学组副组长,中国医师协会呼吸医师分会哮喘与变态反应工作委员会副主任,中国研究型医院学会环境医学分会副会长,中国医促会胃食管反流病学分会副主委,中国咳嗽联盟主席,中国首部咳嗽指南的起草者,美国胸科医师学会(ACCP)咳嗽指南专家组成员,欧洲呼吸协会(ERS)慢性咳嗽指南专家组成员,ERS咳嗽联盟国际顾问,ERJ Open Res副主编,20余种SCI杂志和国内杂志编委和审稿专家。先后负责国家重大科技计划、国家自然科学基金课题等20余项。在AJRCCM,ERJ, Chest等国内外杂志发表论文200余篇,主编《慢性咳嗽》专著,参编专著12部,申报国际国内专利10余项。

谢佳星
广州医科大学附属第一医院国家呼吸医学中心、广州呼吸健康研究院、呼吸疾病国家重点实验室;博士,主任医师,广州医科大学学术型硕士研究生导师;阳江市人民医院呼吸内科 学科带头人(柔性引进),广东医科大学硕士研究生导师;中国医师协会呼吸医师分会 青年委员;中国医药教育协会慢性气道疾病专业青委会 副主任委员;欧洲呼吸学会Long term fellowship Fellow;全国卫生健康系统新冠肺炎疫情防控工作先进个人;“中国嗜酸性肉芽肿性多血管炎诊治规范多学科专家共识(中华结核与呼吸杂志,2018,41(7) : 514-521)”专家组成员;主编《肺部嗜酸性粒细胞增多相关疾病鉴别诊断》(人民卫生出版社2021年出版);《结核与肺部疾病杂志》编委;主要方向:重症哮喘、嗜酸性粒细胞增多疾病、慢性咳嗽。

符昱
广州医科大学附属第一医院、广州呼吸健康研究院、呼吸疾病国家重点实验室学术型硕士研究生。主要研究方向:重症哮喘、慢性咳嗽。
本文完
采写编辑:冬雪凝;排版:Jerry


