
对于抗纤维化治疗的时机选择,今天从纤维化性间质性肺疾病(f-ILD)、抗纤维化治疗的时机、抗纤维化治疗的获益几个方面与大家进行分享。
首先看几个重要概念,1、间质性肺疾病(ILD):这是一组疾病,存在各种各样的原因,可能以炎症为主,可能以纤维化为主,可能两者共同存在;2、纤维化性ILD(f-ILD)是间质性肺疾病里的一部分,它的特点就是以纤维化改变为主,而纤维化怎么判定?胸部HRCT和/或病理的一些特征性改变可以协助我们判断。3、进展性纤维化性ILD(PF-ILD):24个月内,在原发疾病充分治疗的前提下,f-ILD仍在持续进展。进展性肺纤维化(PPF):判断标准和PF-ILD相仿,但是时间周期缩短至1年。PF-ILD和PPF虽然名称不同,判断标准不同,但是本质类似,都是指纤维化性ILD在治疗的过程中出现进展。
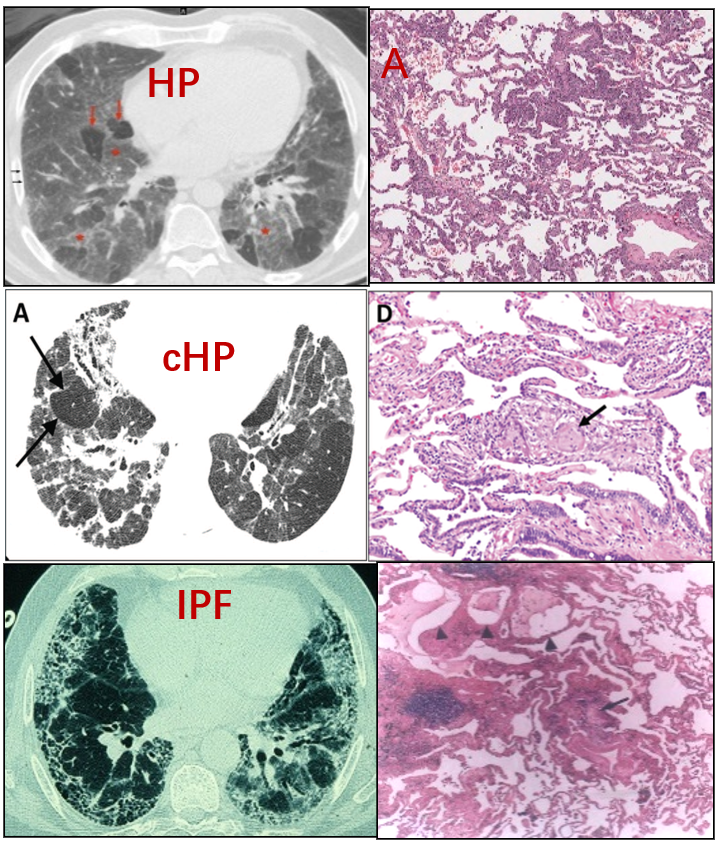
一、纤维化性间质性肺疾病(f-ILD)
既然讲抗纤维化的治疗,我们首先需要了解纤维化性间质性肺疾病谱。
它是一组异质性疾病,影像以网格、蜂窝、牵拉性支扩为主,病理表现以胶原纤维沉积、肺结构破坏等等为主。部分患者起病初就表现为肺纤维化了,也有些病例最初以炎症为主,但在治疗过程中炎症部分逐渐消退,未吸收部分最终变成了肺纤维化。
纤维化性间质性肺疾病的「疾病行为」可能表现为以下几种形式:1、相对稳定;2、进行性加重;3、急性加重,主要是指原本稳定的ILD在短时间内(通常1个月内)出现了快速进展。几乎所有类型的间质性肺疾病都有可能发展为纤维化性间质性肺疾病。

2022年,指南建议了PPF的概念和诊断标准,以下三者中需要两条符合:
1. 呼吸道症状加重;
2. 疾病进展的生理学证据;
a) 随访1年内FVC%绝对值下降 ≥ 5%;
b) 随访1年内DLCO%绝对值下降(经Hb校正)≥ 10%;
3. 疾病进展的影像学证据:存在以下一项或多项:(原征象加重或有新发征象)
a) 牵拉性支气管扩张和细支气管扩张的范围或严重程度增加
b) 新发的磨玻璃影伴牵拉性支气管扩张
c) 新发的细小网状影
d) 网状结构异常的范围增大或粗糙度增加
e) 新发或范围增大的蜂窝状结构
f) 肺容积进一步缩小(FVC,用力肺活量;DLCO,肺一氧化碳弥散量)
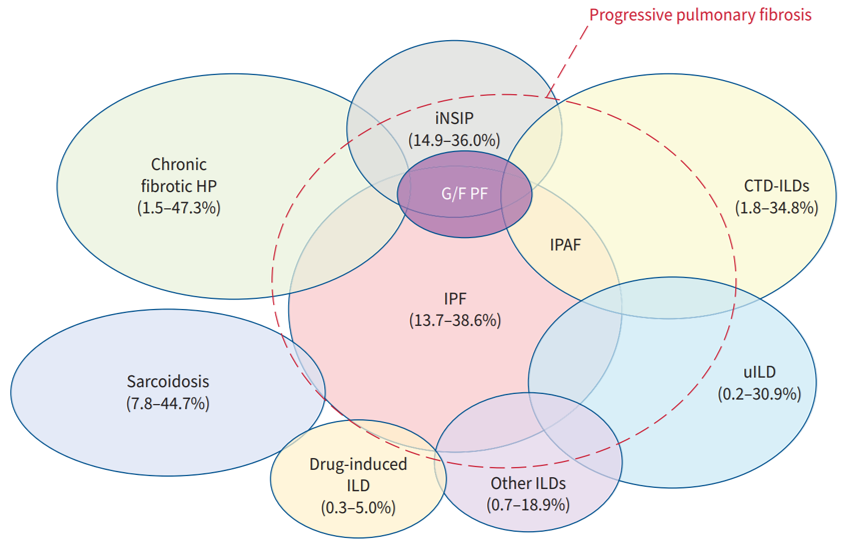
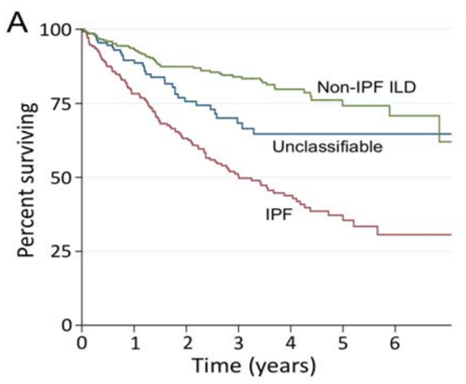
尽管充分治疗,仍有部分ILD继续进展为PPF, 在不同类型间质性肺疾病中,这个比例有所不同 ,为什么我 们强调「明确背后的基础疾病」?因为这对疾病初期的干预非常重要,而且明确病因对于预测PPF风险也是至关重要,有一项回顾性分析共纳入1370例ILD患者,其中包含不能分类的特发性间质性肺炎,特发性肺纤维化和非IPF-ILD。结果发现,这三组人群中不能分类的IIP较其他类型的非IPF-ILD进展可能性更大,预后和IPF相对来说更接近。
另外一项多中心,回顾性分析入选1227例患者,其中CTD-ILD占40%(包括RA-ILD、SSc-ILD、IIM-ILD、其他),还有特发性间质性肺炎(IIP)和纤维化性HP。在这三组患者中,肺功能下降速度最快的是纤维化型HP,也就是说,诊断为纤维化型HP后,患者后续进展为PPF的可能性更大,尤其是致敏原不明确的慢性纤维化性HP。
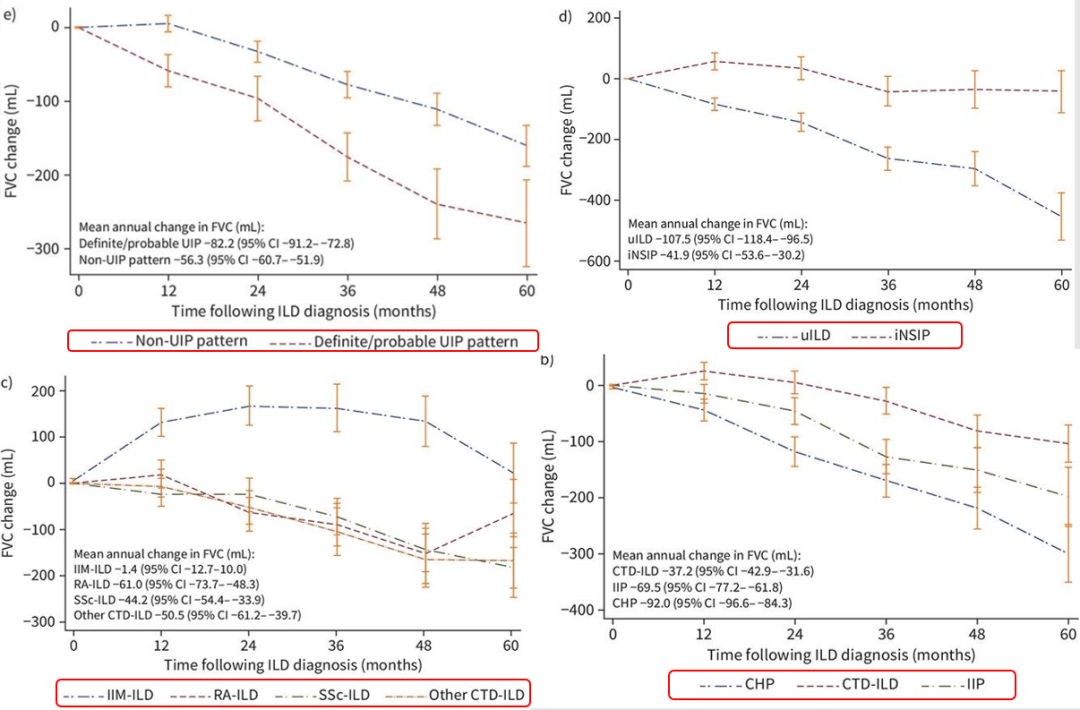
炎性肌病相关的ILD真正进展到纤维化性ILD的相对较少,经过治疗,FVC甚至会回升,然后趋于稳定,其他类型ILD患者肺功能通常是下降的,另外,不能分类的ILD和特发性的NSIP相比,前者进展为PPF的可能性相对更高;UIP型也是进展为PPF相对独立的危险因素。
文献将临床研究进行了汇总,对不同疾病肺纤维化进展的风险因素进行梳理:
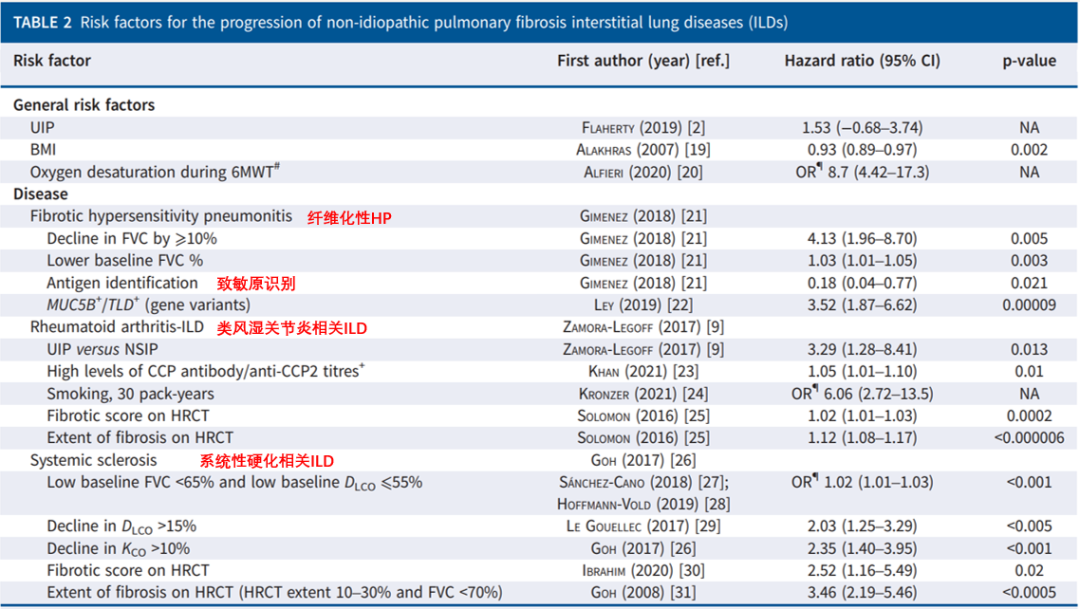
如上图所示,分为一般危险因素和疾病特异危险因素,UIP型、高BMI、六分钟步行试验时血氧饱和度低是后续进展为PPF的一般危险因素。
不同背景原因引起的纤维化性ILD后续发展成PPF也有各自的危险因素,如纤维化性HP的致敏源没有被识别,后续进展的机率就明显增大;对于类风湿关节炎相关ILD,UIP型表现、吸烟、HRCT显示肺纤维化程度重,都是后续发展成PPF的危险因素。系统性硬化相关ILD也如此,纤维化的严重程度、基础肺功能情况、吸烟影响后续发生PPF的机率。
目前暂无质量较高的文献证实血清学指标能否提前预测进展为PPF的可能性。
二、抗纤维化治疗时机和获益
到底怎样进行抗纤维化治疗?在f-ILD里,特发性肺纤维化(IPF)是一个相对特例,我们对它的研究比较多,从整体人群上来说,尼达尼布和吡非尼酮都可以让这部分患者FVC下降速度减慢,如果我们以FVC高低、GAP评分来分组,也就是按照肺功能受损的程度、疾病严重程度进行分层,相对较轻或者较重的患者都能从抗纤维化治疗中获益。
一项观察性研究在129例IPF患者中评估延迟管理对IPF患者生存时间的影响,发现首次出现呼吸困难症状到明确诊断的时间越长,远期预后就越差。真实世界研究把所有进行了抗纤维化治疗的IPF患者作为治疗组,没有进行治疗的组为对照组,在长期的观察过程中,用药组的全因死亡风险、急性加重住院风险都更低。
这样看来,IPF需要尽早启动抗纤维化治疗,它的获益体现在延缓肺功能下降、减少急性加重、改善活动耐量、降低全因死亡等。
如果不是IPF,是其他类型的f-ILD怎么办?
Non-IPF的PPF肺功能变化趋势与IPF有相似之处,所以这部分患者的抗纤维化治疗也非常迫切。
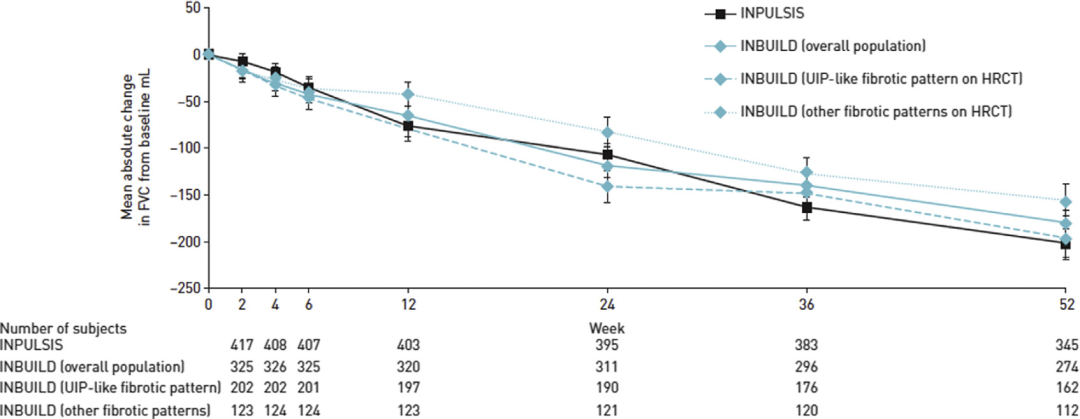
1、尼达尼布:研究发现能够降低整体PPF患者人群的FVC年下降率,在不同亚组里,这种获益能够得以延续,即基础病因不影响抗纤维化治疗疗效;另外,合并使用DMARDs、小剂量糖皮质激素并不影响抗纤维化治疗的效果;从首次急性加重或死亡风险、ILD进展或死亡风险方面来看,整体人群和HRCT表现为UIP样纤维化型的患者都能从抗纤维化的治疗中获益。
2、吡非尼酮:吡非尼酮治疗PPF的临床研究提前进行了终点分析,指南虽然没有很高级别推荐吡非尼酮,但分析发现,与安慰剂组相比较,吡非尼酮治疗后患者FVC、DLCO下降速度减缓,6分钟步行距离(6MWD)也表现出损失更小的趋势。
那么,除了PPF外,抗纤维化的药物有没有必要提前使用?比如SSc-ILD患者,能不能在诊断时就进行治疗?
SENSCIS研究发现尼达尼布显著延缓SSc-ILD疾病进程,和安慰剂组相比,尼达尼布显著减缓患者FVC年下降率,延缓下降44%,两组之间的差值为40.95 mL/年。52周内,与安慰剂组对比,无论是否使用糖皮质激素,尼达尼布均能降低FVC的年下降率,且经统计学检验,尼达尼布的治疗效果在亚组间无异质性,SENSCIS-ON中继续使用尼达尼布时,其100周内FVC变化与52周观察的结果一致,治疗过程中,抗纤维化药物也并没有增加额外的副作用风险。另外,有研究发现,对于RA-ILD伴UIP患者,吡非尼酮治疗52周延缓FVC下降较安慰剂更显著。
整体看下来,Non-IPF-fILD何时启动抗纤维化治疗?
2023年,《ERJ》发表了新的专家共识,给出比较客观的建议:
1、诊断初期,导致ILD原发疾病治疗应放在第一位。
2、在原发疾病明确诊断、已经充分治疗的前提下,要不要同时加抗纤维化治疗?目前来看,只有系统性硬化有临床实验的证据。除SSC-ILD/RA-UIP外,不推荐抗纤维化药物用于其他Non-IPF-fILD的一线治疗,其他类型的fILD如果未常出现PPF,目前还没有证据提示需要联合应用;
3、如果原发疾病已经经过充分治疗,但是仍然发展到PPF的程度,无论是否使用免疫抑制剂,Non-IPF-PPF都可以考虑启动抗纤维化治疗,抗纤维化药物也可以和激素、免疫抑制剂联合应用,尤其要关注密切监测药物相关副作用,如对消化系统、肝肾功能的影响。最开始启动治疗时,一个月要复查一次,如果稳定,可以延长到三个月,如果三个月之内仍然稳定,可以进一步延长监测时间。
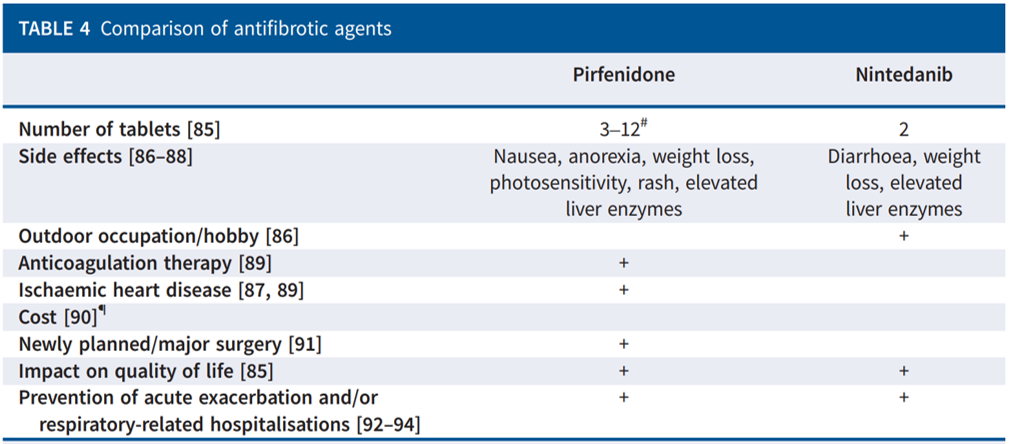
如何选择吡非尼酮和尼达尼布?
2022年,PPF的指南更新中,推荐尼达尼布抗纤维化治疗,没有对吡非尼酮进行相对积极的推荐,但《ERJ》的指南里提到,目前缺乏头对头比较两者在PPF中疗效的临床试验,根据药物作用机理,理论上,两者均可能使PPF患者受益,基于临床实验设计方面的差异,也很难就此就将吡非尼酮排除出PPF治疗。
在治疗过程中,如果患者无法耐受或因为各种原因不能使用尼达尼布的话,吡非尼酮也是一种选择,可以根据患者具体情况来选择合适的抗纤维化药物,例如,如果患者户外工作比较多,就需要额外考虑吡非尼酮可能导致的光过敏情况;如果患者合并一些心血管事件,尼达尼布就要慎重考虑。
再有,抗纤维化药物如何与糖皮质激素/免疫抑制剂联合应用?要不要长期联合使用?
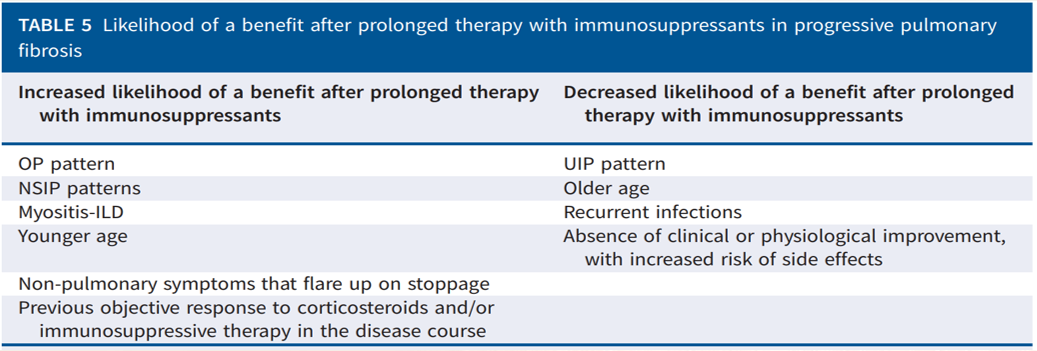
应在密切观察的前提下,尽可能减少糖皮质激素的用量,如果在减量过程中,患者的原发疾病有活动或复发,还是要积极选择合适的免疫抑制剂,但停用后如果出现肺外其他症状,如关节痛等,可考虑小剂量维持,另外,糖皮质激素依赖的ILD,如停药后肺功能下降的结节病等,也可以考虑小剂量维持,免疫抑制剂的选择在不同患者之间存在较大差异,要根据疾病的不同进行区分。
对于是否联合使用,有一些线索可以辅助我们做出判断,如果患者肺部影像以OP、NSIP为主,炎性肌病继发的ILD,患者比较年轻,停用了药物后出现一些肺外表现,在这些情况下,可以考虑延长免疫制剂的应用时间,但对于UIP型、患者年龄较大,有反复感染等情况的,则不建议长时间应用免疫抑制剂治疗,而是以抗纤维化治疗为主。
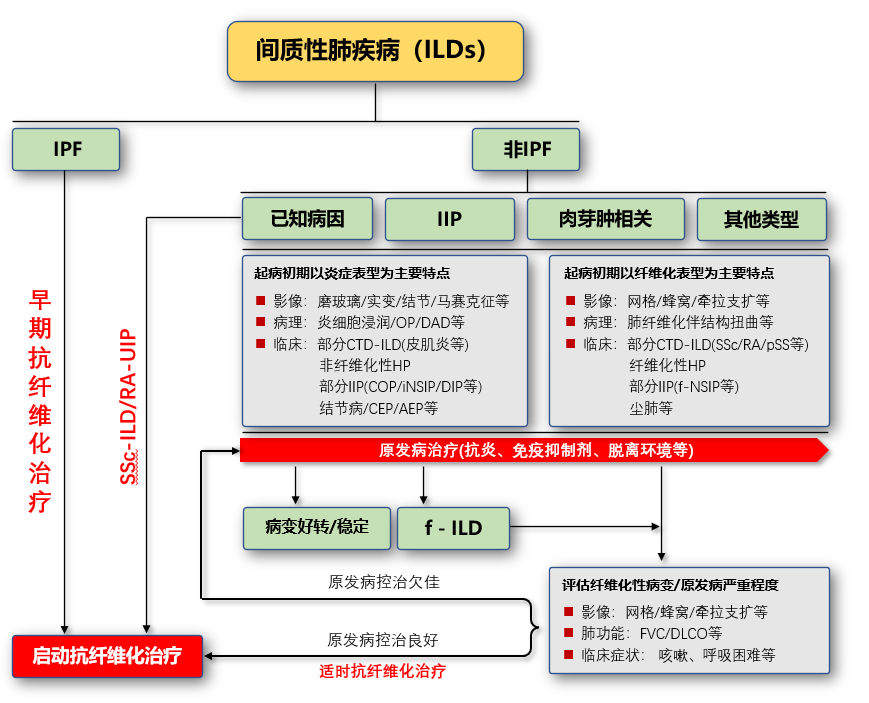
整体来说,对于ILD,如果通过临床、影像、病理的多学科讨论方法明确诊断IPF了,需要尽早启动抗纤维化治疗。如果是非IPF,需要按照ILD常用的分类方法进行进一步诊断,ILD原因不同,可以通过治疗原发疾病、脱离环境等方法进行干预,经过规范治疗后,患者肺内病变好转或者稳定,可以逐渐过渡至维持治疗阶段;如果仍遗留纤维化性病变,需要按照f-ILD管理。最关键点是密切监测肺纤维化情况、原发疾病的控制情况。当f-ILD进展与原发病控制欠佳有关,需要调整免疫抑制剂;当f-ILD进展,原发病控制稳定,可以考虑抗纤维化治疗。对已知原因的ILD,目前只有SSc-ILD可以早期加用抗纤维化治疗,RA-UIP也有研究发现加用抗纤维化药物可能获益。以下流程图供参考:
参考文献
[1]Clin Chest Med 42 (2021) 321–335.
[2]Raghu G, et al. Am J Respir Crit Care Med. 2022 May 1;205(9):e18-e47.
[3]Eur Respir J. 2023 Mar 30;61(3):2103187.
[4]Eur Respir J 2013; 42: 750–757.
[5]Eur Respir J. 2022 Jun 16;59(6):2101396.
[6]Kolb, et al. Thorax (2016) pii: thoraxjnl-2016-102087
[7]Costabel, et al. AJRCCM 2016, 193 :178–185
[8]Albera, et al. Eur Respir J 2016;48 :843–851
[9]Ley, et al. Ann Intern Med 2012; 156 : 684–691
[10]Lamas DJ, et al. Am J Respir Crit Care Med. 2011;184(7):842-7.
[11]Eur Respir J 2020;55:2000085.
[12]Respir Res 2019;20:57. Eur Respir Rev 2018;27:180076.
[13]N Engl J Med 2019;381:1718–27
[14]Behr J, et al. Lancet Respir Med. 2021;9(5):476-486.
[15]Behr J, et al. Lancet Respir Med. 2021 Mar 30;S2213-2600(20)30554-3.
[16]Distler O, et al. N Engl J Med. 2019;380:2518-28.
[17]K. B. Highland, et al. presented at ATS 2021. Poster number: A1806.
[18]Solomon JJ, et al. Lancet Respir Med. 2022 Sep 2:S2213-2600(22)00260-0.
[19]N Engl J Med 2020; 383: 958–968.
专家介绍

任雁宏
中日友好医院呼吸与危重症科副主任医师,博士;中华医学会呼吸病学分会间质性肺疾病学组秘书;中国医师协会呼吸医师分会间质病学组委员;作为负责人和主要参与人员承担国家自然科学基金项目2项,国家973科技计划课题1项;2010年入选北京市科技新星计划;作为主要成员获得国家科技进步奖二等奖1项;参与编写《呼吸治疗》《呼吸重症监护治疗病房医生工作手册》;在N Engl J Med、Anathesesia、Respiration、Thorac Cancer等杂志发表多篇研究论文;主要专业方向为间质性肺疾病、肺部及胸膜肿瘤。
本文由《呼吸界》编辑 Jerry 整理,感谢任雁宏教授的审阅修改!
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


