截至昨日中午,尽管中国大陆地区现有新冠病毒感染者约3万例,但共划定3500多个高中风险区,防疫形势甚为紧张。疫情初期时研发的新冠疫苗已无法有效防止omicron变异株感染,但仍然在降低重症、住院和死亡方面发挥重要作用。与此同时,科学家在加紧研发针对omicron变异株的新疫苗。
疫苗效力持久性、防护力以及新疫苗和加强针效力等问题,在新冠疫苗接种铺开近两年后,是各方普遍关注之处。上周,《新英格兰医学杂志》(NEJM)在线发表综述《Covid-19疫苗——免疫、变异株、加强针》,总结了当前对各类新冠疫苗诱导免疫应答的认识,以及体液免疫和细胞免疫对于持久预防重症疾病的重要性。
综述认为接种疫苗加强针应该依据可靠的科学数据,而不应该依据中和抗体滴度的短期增加,并建议Covid-19加强针接种频率不要高于每年一次。我们在此发布综述中文翻译。
Covid-19疫情已夺去约1500万人的生命,其中仅美国就有100多万人丧生。多种Covid-19疫苗的快速研发是生物医学研究的一大胜利,全世界已接种数十亿剂疫苗。Covid-19疫苗领域面临的挑战包括疫苗分配不公、人们对接种疫苗犹豫不决、疫苗诱导产生的免疫力发生减弱以及出现可部分逃逸抗体的高度传染性变异株。这篇综述总结了我们当前对Covid-19疫苗诱导产生的免疫应答的认识,以及体液免疫和细胞免疫对于持久预防重症疾病的重要性。
抗病毒免疫
免疫系统可大致分为固有免疫系统和适应性免疫系统。固有免疫应答是对抗病毒的第一道防线,细胞模式识别受体(如toll样受体)识别病原体相关分子模式后,固有免疫应答迅速启动。固有抗病毒免疫包括分泌I型干扰素、抗病毒细胞因子及特定细胞应答,包括中性粒细胞、单核细胞和巨噬细胞、树突细胞及自然杀伤细胞。
适应性免疫应答是对抗病毒的第二道防线,涉及对病毒表位的抗原特异性识别。适应性免疫包括免疫系统的两个互补分支:体液免疫和细胞免疫。针对SARS-CoV-2的体液免疫包括与SARS-CoV-2刺突蛋白结合,并且中和病毒或通过其他效应机制消除病毒的抗体。针对SARS-CoV-2的细胞免疫包括病毒特异性B细胞和T细胞,它们可提供长期免疫记忆,并在再次暴露于抗原时迅速扩增。B细胞生成抗体,CD8+ T细胞直接清除受病毒感染的细胞,CD4+ T细胞则支持免疫应答。
对于包括SARS-CoV-2病毒在内的急性病毒感染,中和抗体可能在阻止感染发生方面至关重要,而体液和细胞免疫应答可能可以控制感染后病毒复制,并避免进展成重症疾病、住院和死亡(图1)。对于可以在很大程度上逃逸中和抗体的高度传染性SARS-CoV-2变异株,细胞免疫对于长期预防重症疾病可能尤其重要。
现有Covid-19疫苗
非人灵长类动物研究的早期数据显示了天然免疫和疫苗免疫对实验性SARS-CoV-2攻毒的防护效力。这些结果为SARS-CoV-2疫苗快速临床研发提供了临床前支持。世界卫生组织(WHO)报告称,截至2022年5月6日,有超过300种Covid-19疫苗处于临床前或临床研发阶段。属于8个疫苗制造公司的10种Covid-19疫苗已被WHO批准在全球使用。
这些疫苗涉及四种疫苗平台:灭活病毒疫苗(中国国药的Covilo,科兴的克尔来福和Bharat Biotech的Covaxin),mRNA疫苗(Moderna的Spikevax mRNA-1273和辉瑞–BioNTech的Comirnaty BNT162b2),腺病毒载体疫苗(阿斯利康的Vaxzevria和Covishield ChAdOx1及强生-杨森的Ad26.COV2.S)以及含佐剂蛋白疫苗(Novavax的Nuvaxovid和Covovax NVX-CoV2373)。还有更多疫苗已获得其他监管机构批准,并在临床上广泛使用,但本综述无意全面总结所有Covid-19疫苗。据估计,Covid-19疫苗全球接种在疫苗推出第一年挽救约2000万人生命。
在美国,有四种疫苗已获得全面批准或紧急使用授权:mRNA疫苗BNT162b2和mRNA-1273,腺病毒载体疫苗Ad26.COV2.S以及最近的含佐剂蛋白疫苗NVX-CoV2373。omicron变异株出现之前,美国开展的随机、安慰剂对照3期试验表明,两剂BNT162b2疫苗、两剂mRNA-1273疫苗和两剂Ad26.COV2.S疫苗对有症状Covid-19感染的初始防护效力为94%~95%,一剂Ad26.COV2.S疫苗防护效力为72%(表1)。
mRNA疫苗是美国和欧洲最广泛接种的疫苗,但在发展中国家接种相对有限,原因包括成本、必须冷冻保存、分发物流问题和商业考虑等,而这导致了全球范围内严重的健康不平等。在美国和大多数其他发达国家,70%以上符合条件的人已全程接种疫苗,而非洲只有不到15%的人全程接种疫苗(图2)。假如之前执行更加公平的疫苗推广方案,并且实现WHO提出的2021年发展中国家40%的疫苗接种率目标,估计原本可以挽救60万人生命。腺病毒载体疫苗比mRNA疫苗稳定性更高,并且不需要冷冻保存,因此在发展中国家得到更广泛接种。
美国食品药品管理局(Food and Drug Administration)及疾病控制和预防中心(Centers for Disease Control and Prevention,CDC)最近限制了Ad26.COV2.S在美国的使用,原因是发生了罕见但严重的疫苗所致免疫性血栓性血小板减少症(VIIT),也称为血栓合并血小板减少综合征(TTS)。有54人发生VITT(其中9人死亡),因此发生率为3~4例/100万疫苗接种者。然而,在许多发展中国家,腺病毒载体疫苗仍然是一线疫苗,而南非VITT发生率可能低于美国。欧洲接种ChAdOx1后也有关于VITT的报道,发生率为13~39例/100万疫苗接种者。美国还报道了3例接种mRNA-1273后发生的VITT(其中1人死亡)。
心肌炎和心包炎是BNT162b2和mRNA-1273的并发症,接种第二剂后的发生率为每100万接种疫苗的青少年和青年男性中有52~137例,并且报道了至少10例死亡。据报道,接种第二剂mRNA疫苗后7天内,心肌炎发生率为566例/100万人-年。虽然疫苗所致心肌炎大多为轻度,但也可发生重度并发症。心脏磁共振成像结果改变在相当一部分青年男性中持续存在,即使心肌炎康复后还持续存在至少3~8个月。但Covid-19感染后的血栓形成和心肌炎发生率远高于接种Covid-19疫苗后的发生率。
疫苗效力持久性
BNT162b2和mRNA-1273疫苗可诱导产生极佳的短期中和抗体应答和防护效力。然而,mRNA疫苗诱导产生的较高初始血清中和抗体滴度会在3~6个月内下降,并在8个月内进一步下降,其半衰期约为60天。不同于BNT162b2和mRNA-1273,Ad26.COV2.S诱导产生的初始中和抗体滴度较低,但中和抗体应答和临床效果相当持久,至少可持续8个月。6~8个月时,接种BNT162b2、mRNA-1273和Ad26.COV2.S的抗体应答基本相似。真实世界预防效果研究的数据与上述免疫学数据基本一致,接种BNT162b2和mRNA-1273的初始防护力高于接种Ad26.COV2.S,但这些差异在几个月后缩小。因此,BNT162b2和mRNA-1273诱导产生较高的初始抗体滴度,但几个月后下降,而Ad26.COV2.S诱导产生较低的初始抗体应答,但较为持久。
mRNA疫苗诱导产生的免疫力发生减弱与接种疫苗者的突破性感染增加相关,其最初例证是2021年7月,美国马萨诸塞州普罗温斯敦发生SARS-CoV-2 delta变异株大规模突破性感染。发生突破性感染的疫苗接种者产生了特别强的免疫应答,即所谓的混合免疫。这些发现提示,通过广泛接种疫苗和感染的综合作用,对SARS-CoV-2具有免疫力的人群将继续增加。此次暴发中的基因组学和流行病学数据证明,全程接种疫苗的人之间发生了病毒传播。
mRNA疫苗和腺病毒载体疫苗诱导产生细胞免疫应答,其持久性超过血清抗体滴度。据报道,接种BNT162b2疫苗后,生发中心B细胞可持续存在至少6个月。CD8+ T细胞应答在接种Ad26.COV2.S疫苗之后尤其高,可持续存在至少6~8个月。因为CD8+ T细胞应答可控制感染后的病毒复制,因此即使血清中和抗体滴度下降之后,SARS-CoV-2疫苗也可能继续产生针对重症疾病的明显防护力。
在免疫功能低下的人群中,接种Covid-19疫苗后的抗体和T细胞应答均降低,降低幅度取决于免疫抑制的程度和类型。对于这些人群,建议接种更多剂疫苗和使用单克隆抗体进行预防性治疗。
SARS-CoV-2高关注变异株
2020年春季,之前在全球范围内流行的主要毒株迅速从原始毒株变成SARS-CoV-2基因组携带4个突变的变异株,包括位于刺突蛋白内的一个使其具有适应性优势的D614G点突变。之后又出现多波取代之前SARS-CoV-2变异株的新变异株,新变异株通常表现出更高传染性和更强抗体逃逸能力(图2)。2020年末,alpha(B.1.1.7)、beta(B.1.351)和gamma(P.1)变异株分别在英国、南非和巴西出现。之后,这些变异株在全球范围内被delta(B.1.617.2)变异株取代,后者于2021年夏季在印度出现。
2021年末,高度传染性omicron(B.1.1.529)变异株在非洲出现,并快速成为全球最流行的毒株。不同于有4个突变的delta变异株,omicron变异株有超过50个突变,包括刺突蛋白中的超过30个突变,这使得其对于疫苗诱导产生和既往非omicron变异株感染诱导产生的中和抗体应答具有很强逃逸能力。omicron变异株迅速分成了亚变异株BA.1、BA.1.1、BA.2、BA.2.12.1、BA.4和BA.5(图2)。针对BA.5(美国目前的主要流行株)的中和抗体滴度下降至针对BA.1和BA.2的中和抗体滴度的约1/3。
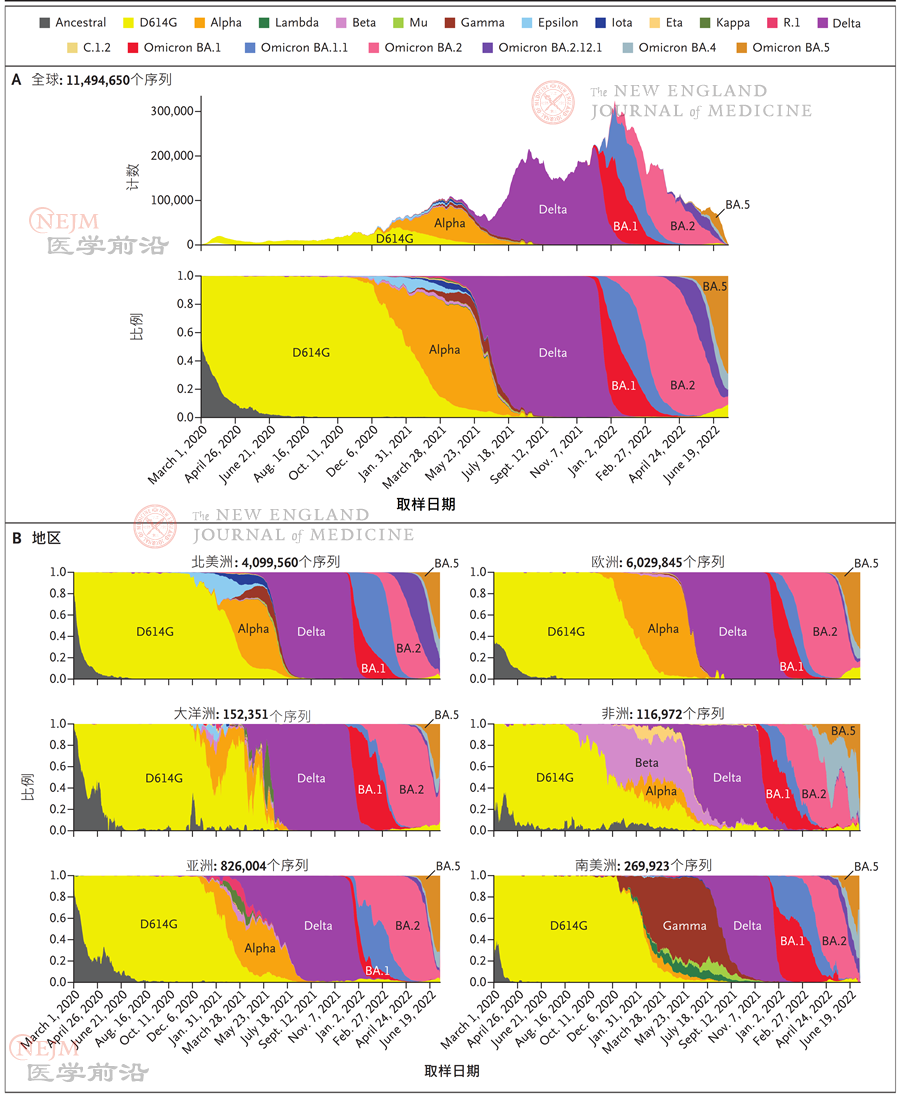
图2. 随时间推移出现的SARS-CoV-2变异株
图A显示了总体和每周平均病例数,以及随时间推移的SARS-CoV-2变异株频率,图B显示了各地区频率。这些数据是基于2020年3月1日—2022年7月8日,通过全球SARS-CoV-2序列收集工作共享并通过GISAID数据库发布的序列Pango谱系。
多项研究表明,各种疫苗初免方案诱导产生的中和抗体与omicron变异株之间的交叉反应性都很低,但注射加强针可使omicron变异株中和抗体显著增加。然而,研究证明,增加的中和抗体滴度和临床预防效果在接种第三剂mRNA疫苗后4个月内减弱。据报道,接种第四剂mRNA疫苗之后,针对SARS-CoV-2 omicron感染的防护力在仅仅4周后就会减弱,但针对重症疾病的防护力可持续更长时间。疫苗和感染诱导产生的混合免疫可以比其中任何一项发挥更强、更持久的防护力。
疫苗诱导产生的中和抗体与omicron变异株之间的交叉反应性有限,而疫苗诱导产生的T细胞应答与omicron变异株和既往变异株之间的交叉反应性很高(>80%)。这些数据提示,针对SARS-CoV-2变异株的细胞免疫基本完好。在南非omicron变异株激增期间,两剂Ad26.COV2.S和两剂BNT162b2疫苗针对住院治疗的防护力分别为72%和70%,针对进入ICU的防护力分别为82%和70%(表1)。在基本上无高滴度中和抗体的情况下实现的强防护力提示,对于可以很大程度上逃逸中和抗体的变异株所导致的重症疾病,其它免疫措施(包括CD8+ T细胞应答和可能的其它功能性抗体应答)发挥了重要预防作用。
在美国,CDC综合数据显示,BNT162b2、mRNA-1273和Ad26.COV2.S疫苗都对2021年秋季delta变异株激增以及2021—2022年冬季和2022年春季omicron变异株激增产生明显防护力(图3)。在每100,000名疫苗接种者突破性感染率方面,delta变异株激增期间Ad26.COV2.S高于mRNA疫苗,但omicron变异株激增期间Ad26.COV2.S低于mRNA疫苗,这可能体现出Ad26.COV2.S诱导产生的免疫力更持久。这些数据与真实世界预防效果研究结果一致,后者表明mRNA疫苗最初比Ad26.COV2.S疫苗更有效,但数月后两者差异减小或消失。
防护力相关免疫指标
在非人灵长类动物中进行的早期临床前研究发现,中和抗体和其他功能性抗体是疫苗对于SARS-CoV-2攻毒的防护力相关指标。应用纯化IgG进行的过继转移研究证实,只要给予足够大剂量的抗体,单纯抗体足以在非人灵长类动物和仓鼠中阻止感染。
非人灵长类动物体内的CD8耗竭研究也表明,当抗体滴度不足以产生防护力时,CD8+ T细胞有助于发挥防护作用。此外,在非人灵长类动物中,omicron变异株攻毒试验中的疫苗失效与omicron中和抗体和CD8+ T细胞均处于低水平相关。这些数据提示,如果针对感染毒株的抗体滴度足够高,单纯抗体可以阻止感染,但是,体液免疫和细胞免疫的综合作用对于突破性感染发生后的病毒学控制至关重要。
mRNA-1273和Ad26.COV2.S试验中对相关免疫指标进行的分析证实,抗体滴度与针对有症状Covid-19感染的防护力相关。然而,这些研究是在omicron变异株出现之前开展,且T细胞应答未包含在相关指标分析中。对于可很大程度逃逸中和抗体应答的高度传染性变异株(例如omicron变异株),防护力相关指标可能更倾向于细胞免疫。此外,在患Covid-19的血液肿瘤患者中,CD8+ T细胞已被证明与生存期相关。如上所述,在南非omicron变异株激增期间,BNT162b2和Ad26.COV2.S都在无针对omicron变异株高滴度中和抗体情况下,针对重症疾病产生强防护力。此外,在南非beta和delta变异株激增期间,Ad26.COV2.S在无针对这些变异株的高滴度中和抗体情况下,针对住院治疗和死亡产生了防护力。
总之,这些数据提示,中和抗体主要负责阻止SARS-CoV-2感染发生,而抗体和CD8+ T细胞应答对于预防重症疾病至关重要(图1)。现有疫苗针对omicron变异株感染和传播防护力较弱,即使是在注射加强针后处于免疫力峰值时。此外,预防高度传染性omicron变异株感染所需中和抗体滴度可能远高于预防既往变异株所需滴度。不同于中和抗体,疫苗诱导产生的CD8+ T细胞应答与omicron之间具有高度交叉反应性,并且可能很大程度上提供了针对重症疾病的防护力。未来研究应关注黏膜体液和细胞免疫在接种部位发挥的作用,它们可能在预防SARS-CoV-2感染方面十分关键。
Covid-19疫苗加强针拟定框架
我们期望Covid-19疫苗可以预防病毒感染并阻止其进一步传播,这一期望依据的是2020年(病毒变异株出现之前)的初步数据,因为这些数据显示在接种mRNA疫苗后处于免疫力峰值时,中和抗体滴度高,疫苗防护效力强。然而,鉴于血清中和抗体滴度大幅下降,并且已出现传染性和抗体逃逸能力增强变异株,因此我们现在应重新调整Covid-19疫苗目标。现有疫苗可能无法针对omicron变异株感染或传播产生高水平、持久防护力,即使接种多剂加强针和引入更新版omicron特异性疫苗后也是如此。接种Covid-19疫苗的最重要目标应该是针对现有和未来变异株所致重症疾病、住院和死亡产生长期防护力。
因此,关于加强针的建议不仅要考虑中和抗体峰值滴度,还要考虑对重症Covid-19持久预防作用。实现上述防护力可能需要综合利用体液免疫和细胞免疫,并且重点是长期而不是短期免疫应答。然而,迄今为止,该领域主要关注的还是短期中和抗体应答。目前正在探索omicron变异株加强针的潜在作用,但在非人灵长类动物中开展的一项研究表明,在omicron变异株攻毒试验中的防护力方面,omicron特异性mRNA疫苗并未优于原始mRNA-1273疫苗。早期临床研究表明,如果将同时含原始毒株和omicron BA.1变异株刺突免疫原的二价mRNA疫苗作为加强针,它诱导产生的omicron变异株中和抗体峰值滴度不到原始mRNA疫苗加强针诱导产生抗体滴度的两倍。因此,更新版加强针与现有疫苗相比的临床获益不明确。
目前还在研究异源初免-加强(混合接种)方案(包括mRNA和Ad26疫苗组合),目的是评估与单独接种任一类型疫苗相比,该策略可否提高体液和细胞免疫强度和持久性。此外,研发泛sarbe冠状病毒亚属(sarbecovirus)和泛乙型冠状病毒属(betacoronavirus)疫苗的早期研究正在进行中。
每4~6个月注射一次加强针,从而维持较高血清中和抗体滴度可能并非切实可行,也非理想的长期策略。将mRNA疫苗作为加强针也并非没有风险。此外,频繁注射加强针的建议可能会加重一般人群的“加强针疲劳”,因为在美国符合加强针注射条件的人群中,迄今只有47%注射过加强针。关于频繁注射加强针的益处,目前专家观点仍有分歧,公众认为公共卫生机构发布的信息令人困惑且言过其实,人们对接种疫苗犹豫不决仍然是目前面临的重大挑战。频繁注射加强针的建议可能会分散我们对关键目标的注意力(使美国和全球大量未接种疫苗的人接种疫苗),并可能进一步加剧全球健康不平等。
因此,疫苗加强针计划应该依据可靠的科学数据(即对重症疾病的防护力显著、持续增强),而不应该依据中和抗体滴度的短期增加。加强社区参与和开展研究可能也有助于减少有关疫苗的种种错误信息。Covid-19加强针的接种频率最好不要高于每年一次,而且希望能够更低,此外应向公众提供多种加强针方案。使用防护力更为持久的疫苗平台尤为理想。
结论
Covid-19疫情似乎正从超急性阶段转向地方性流行阶段。现有Covid-19疫苗对omicron变异株感染的预防效果不及对既往变异株感染的预防效果,但对重症疾病的防护力很大程度上得以维持。Covid-19疫苗主要目标应该是针对重症疾病、住院和死亡产生长期防护力。因此,对Covid-19疫苗和加强针的研究不仅要评估短期中和抗体滴度,还要评估抗体应答、记忆B细胞应答和交叉反应T细胞应答持久性。
参考文献
1. Callaway E. New Omicron-specific vaccines offer similar protection to existing boosters. Nature 2022;609:232-233.


