随着全球至少5亿人感染新冠,随之而来的“长新冠”(Long Covid)成为了另一场大流行。美国疾控中心(CDC)对“长新冠”的定义为:人们在首次感染新冠病毒后四周或更长时间内,可能出现的各种新的、复发的或持续的健康问题。
“长新冠”患者经常提及的是挥之不去的神经系统症状。来自美国顶尖高校斯坦福大学、耶鲁大学等团队的最新研究发现,“长新冠”患者的这些神经系统症状类似于癌症治疗中出现的认知障碍(“化疗脑”)。而新冠感染后的脑白质中的小胶质反应性和随之而来的神经失调是该综合征的核心。
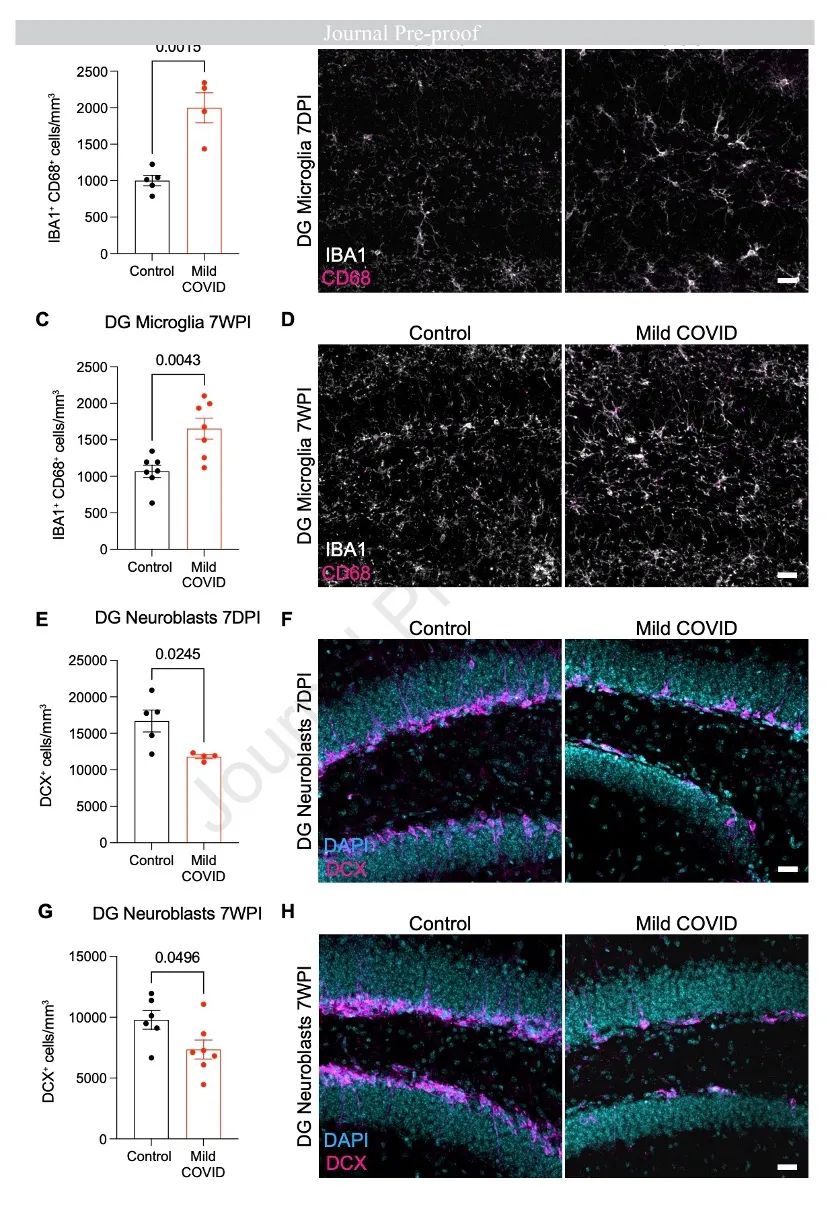
研究聚焦呼吸道感染SARS-CoV-2后的神经生物学效应,并在小鼠和人类中发现了脑白质选择性小胶质反应性。在小鼠出现轻度呼吸道COVID之后,其海马神经发生持续受损,少突胶质细胞减少和髓鞘丢失以及CSF细胞因子/趋化因子(包括CCL11)升高显著。研究发现,全身性CCL11能导致海马体的小胶质细胞反应性和神经发生受损。同样,感染新冠病毒后具有持久认知症状的人类体内也表现出升高的CCL11水平。
该研究还发现,与SARS-CoV-2相比,小鼠轻度呼吸道流感在早期时间点同样引起类似的白质选择性小胶质反应性,少突胶质细胞丢失,神经发生受损和CCL11升高的模式,但流感康复后仅CCL11和海马病理升高持续存在。这些发现说明了癌症治疗和呼吸道SARS-CoV-2感染后的类似神经病理学,这意味着即使是新冠感染轻症同样能导致认知障碍。
前述研究的通讯作者为美国神经领域和免疫领域的大咖:加州斯坦福大学神经病学和神经科学系教授Michelle Monje、耶鲁大学免疫生物学系教授Akiko Iwasaki。研究机构还包括纽约大学、美国国家神经疾病和中风研究所、美国国家癌症研究所等。研究于当地时间6月12日刊登于国际顶尖学术期刊CELL。
根据此前的研究,持续的认知障碍影响了大约四分之一的新冠感染者。虽然需要入院治疗的新冠感染者出现认知障碍的概率更大,但即使是那些在急性感染期症状轻微的人也可能经历持久的认知功能障碍,俗称“COVID-fog”(新冠脑雾),这种与COVID相关的认知障碍综合征的特征是注意力、信息处理速度、记忆力和执行功能受损。
最新的研究显示,随着焦虑、抑郁、睡眠障碍和疲劳率的增加,这种认知障碍综合征大大提升了“长新冠”的发病率,并且让感染者难以恢复到之前的职业水平。鉴于全球SARS-CoV-2感染的规模,这种持续性认知障碍综合征已经成为了一场重大的公共卫生危机。新冠感染者经常经历的认知症状综合征与癌症治疗相关认知障碍综合征相似,通常被称为“化疗脑”。
神经炎症是癌症治疗相关认知障碍病理生理学的核心,这提示新冠感染可能也有存在相似的病理生理学机制。而轻度COVID的炎症反应也可能诱发神经毒性细胞因子/趋化因子的升高,这是白质小胶质反应性的一种模式,以及随之而来的形成髓鞘的少突胶质细胞和海马神经前体细胞的失调。


研究重要发现
• 呼吸系统感染新冠病毒能诱发脑脊液细胞因子升高和小胶质细胞反应性
• CCL11因子能激活海马体的小胶质细胞并损害神经发生
• 呼吸道感染新冠病毒会导致少突胶质细胞和髓鞘轴突持续丢失
• 呼吸道感染流感病毒能引起类似反应,但持续时间较短
重要知识点
少突胶质细胞(oligodendrocyte):分布于中枢神经系统。比星状胶质细胞小,其胞突短而少,细胞核呈圆形,小而致密,电镜下胞质电子密度高,主要含线粒体、核蛋白体和微管。在灰质,少突胶质细胞主要位于核周体附近;在白质,它们并排存在于有髓神经纤维之间,并构成髓鞘。组织培养中可见少突胶质细胞运动活跃。
少突胶质细胞的主要功能是在中枢神经系统中包绕轴突、形成绝缘的髓鞘结构、协助生物电信号的跳跃式高效传递并维持和保护神经元的正常功能。其异常不仅会导致中枢神经系统脱髓鞘病变,还会引起神经元损伤或精神类疾病,甚至可以引发脑肿瘤。
CCL11:趋化因子配体11,也称为嗜酸性粒细胞趋化因子 (Eotaxin),是CC趋化因子家族中的小分子量细胞因子。其能通过诱导嗜酸性粒细胞的趋化性进行选择性招募,因此参与变态反应。CCL11在人和小鼠血浆中的表达升高与其衰老有关。
海马体:大脑中的一个关键记忆中心,与短期记忆形成相关,通常是年龄相关认知衰退研究的焦点。
髓鞘:是包裹在神经细胞轴突外面的一层膜,其作用是绝缘,类似于电线皮,防止神经电冲动从神经元轴突传递至另一神经元轴突,避免干扰。
脑白质:是大脑内部神经纤维聚集的地方,由于其区域比细胞体聚集的大脑表层颜色浅,故名脑白质。
研究者通过一系列实验证明,即使是SARS-CoV-2的轻度呼吸道感染也会导致持续的神经炎症变化,从而导致对健康认知功能重要的神经细胞类型的失调。这种神经炎症变化,特别是白质选择性/富集性小胶质细胞反应性,海马神经发生受损,少突胶质细胞谱系失调和其他疾病背景下的髓鞘丧失有关。
详细内容
各种免疫刺激诱导不同的免疫反应,这些反应差异性地涉及免疫细胞的特定亚群,并在全身和中枢神经系统中诱导疾病特异性细胞因子和趋化因子谱。在SARS-CoV-2和H1N1流感呼吸道感染的小鼠模型中观察到的神经炎症特征的差异强调了这一原理。SARS-CoV-2感染诱导广泛的炎症反应 - 远远超出了其他呼吸道病毒感染的典型1型免疫反应。同样,研究者在这里发现,即使是轻度呼吸道COVID也可以诱导多种细胞因子和趋化因子的显著升高,以及皮质下和海马区域白质小胶质的持久反应性。相比之下,H1N1流感引起部分重叠但又不同的脑脊液细胞因子/趋化因子谱和更受限制的持续性细胞变化模式。
全身炎症诱发的神经炎症、随之而来的神经胶质失调和神经功能受损是超过了COVID通常的症状。其他病毒综合征如流感也可引起小胶质细胞反应性,中枢神经系统细胞因子水平升高,并损害认知功能,即使在没有神经侵入的情况下。然而,本研究中观察到的SARS-CoV-2急性感染期后少突胶质细胞缺陷比H1N1流感更持久,并且与甲氨蝶呤化疗后的持久变化更一致。研究者表示,一般来说,从危重中恢复的新冠感染者经历长期认知障碍的发生率更高,而持续的认知障碍也是重症监护后综合征。SARS-CoV-2的特殊免疫原性和这里观察到的神经炎症变化的持续存在,考虑到全球这次大流行期间感染人群的规模,这导致了与COVID相关的持久认知障碍危机。
在呼吸道感染SARS-CoV-2或H1N1流感的小鼠中都发现了CCL11水平升高。在新冠感染后有认知症状的人类中发现的CCL11水平升高,这可导致海马神经发生不足,并诱导海马体中的小胶质细胞反应性。但这一发现意味着海马体特别容易受到呼吸道感染的神经炎症影响,这与最近关于COVID幸存者边缘神经系统结构变化的报告一致:CCL11的这种区域/回路特异性作用突出了不同的细胞因子/趋化因子谱对神经系统施加疾病特异性作用的潜力,从而引起某些认知或神经精神症状的不同患病率。
与认知障碍的“新冠脑雾”和“化疗脑”综合征的临床相似性一致,这里的发现说明了许多病理生理学上的相似性,包括髓鞘少突胶质细胞的消耗和髓鞘丢失。髓鞘调节神经冲动传导的速度,为轴突提供代谢支持,并表现出适应性可塑性;即使髓鞘形成的微小变化也会对神经回路动力学产生深远的影响,从而对认知功能产生深远的影响。皮质下白质小胶质/巨噬细胞反应性以及相关的少突胶质细胞和髓鞘轴突的丧失在SARS-CoV-2呼吸道感染和甲氨蝶呤化疗相关认知障碍的小鼠模型中是相似的。研究者表示,虽然甲氨蝶呤直接刺激小胶质细胞的反应性,但介导呼吸道感染诱导皮质下白质小胶质反应性的机制仍有待完全阐明,并且可能涉及细胞因子/趋化因子信号传导机制或细胞神经免疫相互作用,需要进一步研究。
除了由相对轻微的急性呼吸道感染和随之而来的神经炎症引起的神经病理学变化外,更严重的COVID还可能导致额外的神经病理学后果。这些包括微血管血栓、神经元丢失、皮质炎症,甚至在某些情况下直接的脑部感染。因此,SARS-CoV-2感染的神经系统后遗症被证明是常见的,而且会使人衰弱的。虽然这里描述的炎症诱导的多细胞失调可能通过治疗干预措施逆转,但这些更严重的COVID并发症(如中风)可能会对大脑造成不可逆转的损害。
附:重要图表