2022年6月22日,《新英格兰医学杂志》(NEJM)在线发表美国马里兰大学医学院Bartley Griffith等人开展的世界首例基因编辑猪心人体移植病例详情,首次披露患者为何被拒绝人体心脏移植、供体猪饲养、抑制免疫排斥措施、术后紧急处置和猪心非典型排斥直至衰竭等关键内容。今年早些时候,这例异种移植的初步成功和患者最终不明原因死亡曾被广为报道(点击阅读详情)。
供体猪4个基因被敲除,另有6个人体基因被插入猪基因组,以抑制猪心生长、降低免疫排斥、血栓形成及炎症反应。移植心脏功能正常,没有明显免疫排斥反应。移植后49天出现舒张功能衰竭,心肌显著增厚,经过数天治疗和检测,研究者判定猪心发生不可逆损伤,组织学检查显示分散的肌细胞坏死、间质水肿和红细胞外渗,无微血管血栓形成迹象。患者在移植后60天撤除生命支持系统后死亡,研究者仍需进一步研究器官损伤的病理生理机制。
NEJM同期配发的社论指出这份病例让我们领略了“遗传和生物工程以及细胞和发育生物学是如何快速而深刻地解决医学问题的”。社论认为,即使通过多功能干细胞等技术让患者自体器官再生和三维组织工程最终成为器官移植来源,但异种移植技术将得到更广泛应用,例如将人体组织逆向植入动物体内以降低成本并解决某些技术问题,以及让患者在等待自体器官成熟的数月或更长时间内暂时移植异种器官。
值得注意的是,器官移植领域近期取得多项重要成果。NEJM上个月曾发表两例猪肾人体异种移植报告 ,当时所用的基因编辑猪仅敲除1个基因,但研究者通过将猪胸腺移植到肾包膜下降低了宿主免疫激活风险。移植肾54小时内功能正常,未见免疫排斥反应。一周前,斯坦福大学医学院团队在NEJM发表肾移植后无需服用免疫抑制剂的病例。
我们在此简介NEJM猪心移植病例。全文翻译即将上线,请届时登录《NEJM医学前沿》官网、APP或微信小程序阅读全文翻译。

图1. 从体细胞到基因编辑的猪
移植前:强大的技术和伦理储备
依从性差,常规心脏移植被拒
一名患慢性轻度血小板减少症、高血压、非缺血性心肌病并且接受过二尖瓣修复术的57岁男性因严重心力衰竭住院。其治疗方案为静脉注射多种正性肌力药,在住院第11天植入主动脉内球囊反搏泵。患者发生了多次室性心律失常合并心脏停搏,需要心肺复苏,并且从住院第23天开始接受外周静脉-动脉体外膜氧合(ECMO)。
患者被判定为治疗依从性差,这导致其不符合同种异体移植和机械循环支持的标准。该病例经由两个地区级和两个国家级知名心脏移植项目审核,移植申请均遭到拒绝。医院器官移植甄选委员会同意考虑实验性异种移植。尽管患者希望移植来自人类供体的心脏,但被告知其处境后,他同意接受异种移植。
尽管患者有双心室心力衰竭,但其肾功能完好,并且因轻度低氧血症而间断性鼻导管吸氧。移植前值得关注的状况包括肾上腺功能不全、消化道出血、菌血症(通过抗菌治疗清除)和药物引起的白细胞减少症。他在2022年1月7日移植经过基因编辑的猪的心脏。
严格审批
鉴于该研究属于首次人体应用,研究者向美国FDA提出申请联合应用10基因编辑猪供体、人源化抗CD40单克隆抗体和用于保存心脏的XVIVO心脏灌注系统进行基因编辑猪心人体移植。FDA评估了研究者关于心脏异种移植的临床前经验、详细知情同意书以及人畜共患病监测和预防计划。
医院伦理委员会评估了患者整体认知能力和给予知情同意能力。该机构进行了三次评估,还由外部机构进行了一次独立的精神鉴定。机构审查委员会全体成员批准了该计划,患者提供了书面知情同意。
基因工程改造猪
该动物克隆自成纤维细胞,该细胞系的10个基因经过编辑,以便心脏异种移植物更适合移植到人体内。基因编辑包括敲除三处免疫显性异种抗原碳水化合物,即半乳糖-α-1,3-半乳糖(GGTA1z编码)、Sda血型抗原(B4GALNT2编码)和N-羟乙酰神经氨酸(CMAH编码);敲除生长激素受体基因GHR以便减少异种移植物的自发生长。为减轻移植物受到的抗体依赖性补体损伤,移植物表达人类CD46和补体衰变加速因子CD55。移植物还表达人类血栓调节蛋白和内皮细胞蛋白C受体,目的是使猪源血液因子在激活蛋白C方面更加无效。其他人类转基因蛋白包括抗炎蛋白CD47和血红素加氧酶1。
筛查人畜共患病
人畜共患病的预防和监测对于异种移植成功极其关键。对源动物的严格管理包括早期断奶、使用生物安全设施及常规监测病原体。源动物从猪内源性逆转录病毒(PERV)-C-阴性细胞系克隆而成,每3个月检测一次可影响猪或人类健康的病原体,包括PERV-A、PERV-B、PERV-C、猪巨细胞病毒(pCMV)和猪嗜淋巴疱疹病毒(pLHV)。
异种移植后,患者在预定时间点接受PERV-A、PERV-B和PERV-C检测。随时间推移,采集并储存患者血浆、血清和外周血单核细胞(PBMC),供未来检测人畜共患病。每周通过血浆微生物游离DNA(mcfDNA)检测法对人类病原体进行无偏检测。
源动物检出PERV-A和PERV-B,未检出PERV-C。检出猪圆环病毒3型(PCV3,该病毒并未被证明可感染人类细胞),但由于循环阈值高(39),因此认为不属于阳性。未检出其他猪病毒性病原体。
这些结果提示,通过不摄入初乳、早期断奶和使用生物安全设施等饲养方法,可以成功清除猪病毒性病原体。
围手术期:波澜不惊
早期恢复,尚属顺利
静脉-动脉ECMO(每分钟2~3升)在移植后继续,目的是支持异种移植物,减小突发室性心律失常影响。术后8小时,患者尿量减少,再次评估患者肾血流量。因残留夹层的假腔造成左肾上极动脉闭塞,放置血管内支架进行治疗。然而,少尿性急性肾衰竭在术后持续存在,导致患者需要接受肾脏替代治疗。移植后第2天,胸腔闭合后,拔除气管插管。胸片显示肺野清晰(图1)。正性肌力药一直无需使用,ECMO在第4天停止。


图2. 胸片
图A是移植前的胸片,显示心脏扩大。图B是移植后的胸片,显示原位异种移植物。
第6天在小剂量尼卡地平治疗下,患者血流动力学稳定,平均收缩压为130~170 mmHg,平均舒张压为40~60 mmHg;肺动脉收缩压和舒张压分别为32~46 mmHg和18~25 mmHg,中心静脉压为6~13 mmHg。心输出量为每分钟5.0~6.0升,每搏输出量为每平方米体表面积65~70毫升。异种移植物保持每分钟70-90次的窦性心律。LVEF至少为55%。
LVEF在术后保持正常或高动力状态(图2和3B)。然而,左心室和右心室壁厚度、左心室腔大小和整体纵向应变发生变化。从移植到第45天,沿室间隔和后壁底部测得的左心室壁厚度为1.2~1.4 cm,在短轴视图上测得的右心室壁厚度为1.0~1.1 cm,左心室腔大小为3.4~4.6 cm。整体纵向应变表明基线时顺应性良好,数值范围为−25%~−36%。
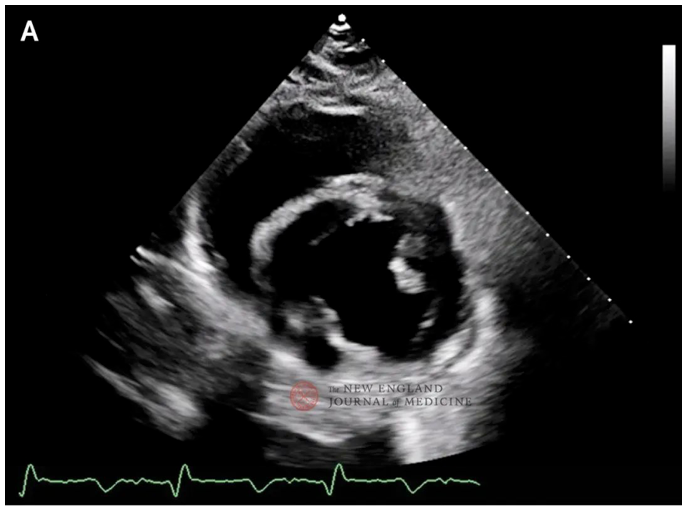

图3. 经胸超声心动图。
移植后第19天,异种移植物的经胸超声心动图(图A,胸骨旁短轴)显示,异种移植物功能正常,整体纵向应变正常,舒张末期左心室后壁厚度正常。第49天(静脉-动脉ECMO插管之前)的经胸超声心动图(B图)显示,心脏收缩功能保留,整体纵向应变由负值向0值变化(即异常加重),舒张末期左心室后壁厚度增加。
不明原因腹膜炎
移植后第12天,患者自诉腹痛。CT显示小肠壁增厚和游离液体。剖腹探查发现脓性液体,有大肠埃希菌和热带念珠菌生长。小肠壁增厚,有一个正在缓解的局部缺血区,但无急性缺血或穿孔迹象。血管内超声和肠系膜血管造影证实血流充足。腹腔冲洗后关腹,未采取其他干预措施。
患者腹膜炎随即康复,但无法通过肠内营养达到热量目标,因而采用肠外营养。肠道缓慢重新适应肠内营养,移植后第40天已适应。
免疫抑制和感染预防
尽管异种移植物经过基因工程改造,但患者仍需要接受免疫抑制治疗。利妥昔单抗和抗胸腺细胞球蛋白分别用于耗竭B细胞(CD20+)和T细胞(CD3+),补体C1酯酶抑制剂用于抑制补体。用于阻断CD40共刺激的人源化单克隆抗体采用重复单剂给药。
患者术后立即开始使用更昔洛韦预防病毒感染,使用艾沙康唑预防真菌感染,使用阿托伐醌预防耶氏肺孢子虫感染。还给予冲击剂量的甲泼尼龙(移植当日给予1000 mg)。
移植后当日开始接受吗替麦考酚酯维持性免疫抑制治疗,但第21天时因严重中性粒细胞减少症停药,粒细胞集落刺激因子治疗5天有效。由于吗替麦考酚酯停药,患者从第35天开始接受他克莫司治疗。维持性免疫抑制治疗还包括KPL-404和快速减量的甲泼尼龙,供体特异性抗体水平保持在基线水平以下,并一直保持低水平,直至移植后第47天,当日IgG水平和IgM水平(升幅小于IgG)急剧升高(患者第43天静脉注射免疫球蛋白)。移植后血清肌钙蛋白I水平升高,但在第24天恢复基线水平,之后从第35天开始急剧升高(图3A)。

图4. 术后的临床详情和检测结果。
平均荧光强度(MFI)值根据阳性对照(数值指定为100%)进行标准化。整体纵向应变在图B中表示为绝对值;应变通常报告为负百分比。
心内膜心肌活检提示无排斥
移植后第34天,心内膜心肌活检显示并无排斥迹象(图4A),右心房压为5 mmHg,肺动脉压为25/15 mmHg,心脏指数为2.7,混合静脉血氧饱和度为65%。患者可在无需心血管支持的情况下复健,异种移植物功能正常,无排斥迹象(图2A)。

图5. 组织学评估。
首次心内膜心肌活检(A图,移植后第34天)显示正常的组织学特征。第二次心内膜心肌活检(B图,第50天)显示间质红细胞外渗、裂解和水肿,无细胞浸润和血管内血栓形成。第三次心内膜心肌活检(图C,第56天)显示间质水肿和红细胞外渗有所缓解,但有坏死肌细胞。尸检时(图D和E,第60天),室间隔可见间质水肿和红细胞外渗、心肌坏死、轻微纤维化和居中细胞核。
最后18天:急转直下
不幸感染
移植后第43天,患者变得更加嗜睡,给予气管插管;患者出现低血压,经过补液和血管升压素治疗后有效。胸片提示双肺进展性渗出。支气管镜检查显示右肺一级和二级气道遍布弥漫性浅溃疡,提示患者发生病毒或真菌感染。患者患低丙种球蛋白血症。扩大抗微生物剂覆盖范围,并且静脉注射1 g/kg剂量免疫球蛋白。每周mcfDNA检测结果显示pCMV明显增加,这令人担心可能发生病毒感染。
供体脾的pCMV检测结果呈阳性,表明源动物可能有潜伏性pCMV感染。患者PBMC也呈pCMV阳性。因此,抗病毒药从更昔洛韦换成西多福韦。上述气道病变活检未发现病毒性细胞病变效应和病毒包涵体,Grocott乌洛托品硝酸银染色呈阴性。约5天后复查支气管镜显示弥漫性气道溃疡减轻。患者气管插管在移植后第47天拔除,他继续进行室内复健,并在移植后第48天(连续卧床109天后)可以坐在椅子上招手。
猪心衰竭
第49天晚上,患者出现轻度腹部不适和腹胀,血清乳酸水平在8小时内从4 mg/dL上升至11.2 mg/dL。患者出现低血压,需要使用血管加压药,并且再次接受气管插管。出现肢端发绀,这提示移植后首次出现心输出量降低。
剖腹探查未见异常。新放置的肺动脉导管显示混合静脉血氧饱和度为33%。虽然超声心动图显示LVEF为65%~70%,但左心室壁厚度和右心室壁厚度显著增加,左心室腔显著减小(图2B)。
与基线相比,左心室壁和右心室壁持续增厚,左心室腔持续减小,且与左心室舒张末期容积和负荷无关。整体纵向应变值由负值向0显著变化(即异常加重)(图3B)。
心内膜心肌活检(第50天)未显示抗体介导的急性细胞排斥(图4B)。然而,患者有局灶性毛细血管损伤伴红细胞外渗和水肿。抗体染色显示毛细血管内有IgG和IgM(前者水平较高),但C3d或C4d呈阴性。苏木精-伊红染色或免疫组化(CD3+或CD68+)染色观察到心肌细胞缺血,但无细胞浸润。肌钙蛋白I水平上升。
自此时起,异种移植物来源的游离DNA(xdcf DNA)水平(图3C),以及异种移植物特异性IgG和IgM血清水平也达到峰值(图3A)。研究者怀疑患者有抗体介导的排斥反应的非典型表现,并开始采取治疗。治疗方案包括5天期间进行1.5倍血浆容量的治疗性血浆置换,之后进行3次1.0倍血浆容量的血浆置换,以及静脉注射免疫球蛋白、补体抑制和B细胞耗竭。患者继续接受ECMO支持。
非典型排斥后,患者死亡
第56天,重复心内膜心肌活检显示病理性抗体介导的排斥(图4C)。与上一次活检相比,间质红细胞外渗和水肿有所减轻,但心内膜心肌活检显示40%肌细胞坏死。同样,无细胞排斥迹象,但C4d、IgG和IgM染色呈弱阳性,而且在坏死肌细胞区域更明显,这可能表明非特异性结合。
复查超声心动图显示LVEF大于70%,右心室功能正常,纵向应变改善。双心室壁增厚略有减轻,左心室腔仍然减小。在无需儿茶酚胺支持的情况下,患者的静脉-动脉ECMO流量可从每分钟4.5升缓慢减少至每分钟3升。后续超声心动图未显示室壁厚度、心室腔大小或整体纵向应变有所改善,ECMO流量无法减少至每分钟2升以下。
研究者认为异种移植物发生不可逆损伤,移植后第60天,患者生命支持系统撤除。
初步尸检显示,心脏重量从移植时的328 g增加至600 g。心肌细胞间距很大,居中细胞核被纤维条索隔开。肌细胞坏死是分散的,并与肌细胞完整性丧失相关。内皮细胞的变化从清晰细胞核到细胞肿胀,有血管完全溶解区域。红细胞以与血管外渗相符的模式分散在肌细胞间隙内。这些发现与典型的异种移植排斥不符(图4D和4E)。
成败得失,扑朔迷离
异种心脏支持患者存活7周。用于耗竭T细胞和B细胞的诱导方案,联合基于CD40的疗法似乎预防了人体对基因编辑异种移植物的明显排斥。对异种移植物进行的心内膜心肌活检未显示急性细胞或抗体介导的排斥。直至导致患者需要ECMO支持的后期功能障碍发生后一周才观察到补体染色。明显的突发舒张功能衰竭,以及收缩功能无障碍的整体病理性心肌增厚仍然无法解释。
异种移植后60天对受者PBMC进行的PCR检测未显示PERV-A、PERV-B或PERV-C迹象,这提示猪心未向受者传播这些病毒。移植后对受者进行的mcfDNA检测未显示PCV3迹象。第20天时,mcfDNA检测结果呈低水平pCMV阳性,并且该水平在后续几周有所增加。考虑到饲养方法、器官移植前供体动物鼻拭子样本的阴性PCR监测结果以及抗病毒预防,检出pCMV出乎意料。目前尚不确定通过血浆mcfDNA或PCR检出的pCMV代表猪心中的可复制病毒、患者体内的可复制病毒还是猪心中的遗传物质脱落。
该患者的肺灌洗样本中还检出人类疱疹病毒6型(HHV-6),HHV-6已被证明与pCMV具有交叉反应性,并与同种异体移植物排斥相关。胸腔和腹腔器官的苏木精-伊红染色初步检测未发现明显的病毒性细胞病变。
参考文献
Griffith BP, Goerlich CE, Singh AK, et al. Genetically modified porcine-to-human cardiac xenotransplantation. N Engl J Med 2022 June 22. DOI: 10.1056/NEJMoa2201422 (Epub ahead of print).


