前言
在《呼吸界》日前推出的「遏制、终止、终结肺结核」第二季系列直播中,我们邀请了王辰院士及结核病领域专家赵雁林、李燕明、沙巍、余方友、逄宇、李仁忠、初乃惠、陈效友,他们在直播间就「我国结核病综合医院诊疗能力及新形势下防治技术对策、耐药肺结核的诊疗技术与新进展、非结核分枝杆菌的临床鉴别诊断和精准治疗」等话题为大家做了精彩报告并互动,《呼吸界》编辑特此整理直播文字,经专家审阅后与大家分享。
大家好,接下来我与大家分享一下临床医师对耐药结核病实验室技术的认识与评价。
结核病的形势
首先还是要认识一下耐药结核病的形势,大家从下图中的数据可以看出实际上结核病的形势依然非常严峻。
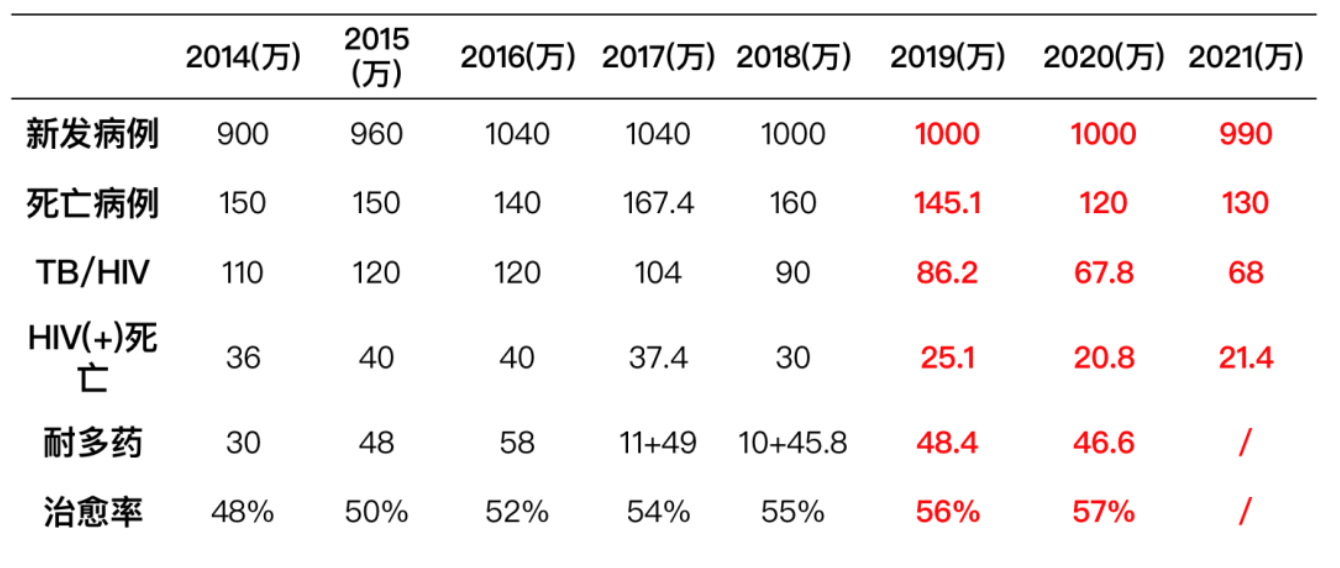
按照WHO实施「End TB」策略,从2020年的目标实现来看,仍然差距很大。结核病的患病率目标是要降低20%,但实际只达到了11%。家庭因结核病灾难性的支出目标要下降到0,但仍然未达标。
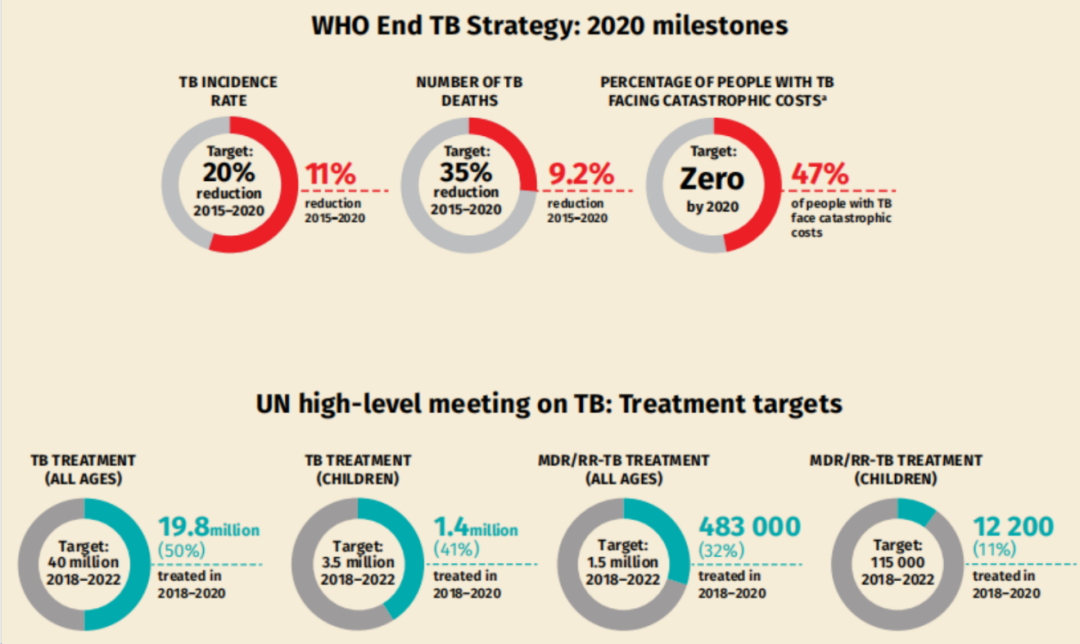
按照联合国高水平会议制定的目标,从全年龄人口的治疗来看也仅仅只实现了不到50%的目标。因此,结核病的全球形势依然非常严峻。
结核病的诊断技术
1882年德国科学家罗伯特∙科赫发现结核分枝杆菌是结核病的病原体以来,结核病的诊断技术多种多样。从结核菌素皮肤试验、胸部影像学、痰抗酸染色涂片及培养以及已PCR为代表的分子生物学技术等。2007年以来分子生物学技术突飞猛进,使得结核病的快速诊断日新月异。诊断技术可以分为从结核分枝杆菌病原学本身检测技术,如抗酸染色涂片,分枝杆菌培养及菌株鉴定以及分子生物学检测,这些技术是针对菌体或部分成分,阳性结果具有确诊的价值;其他技术是结核病辅助诊断价值,阳性结果间接证据,不具有确诊价值,如胸部影像(平片、CT等)、结核菌素皮肤试验以及免疫诊断技术(γ-干扰素释放试验等)。下图中简单列了几个技术,我画红框的技术从病原学的角度看是有确诊价值的,后面的几项技术只是一个间接的发现,但没有确诊的价值。
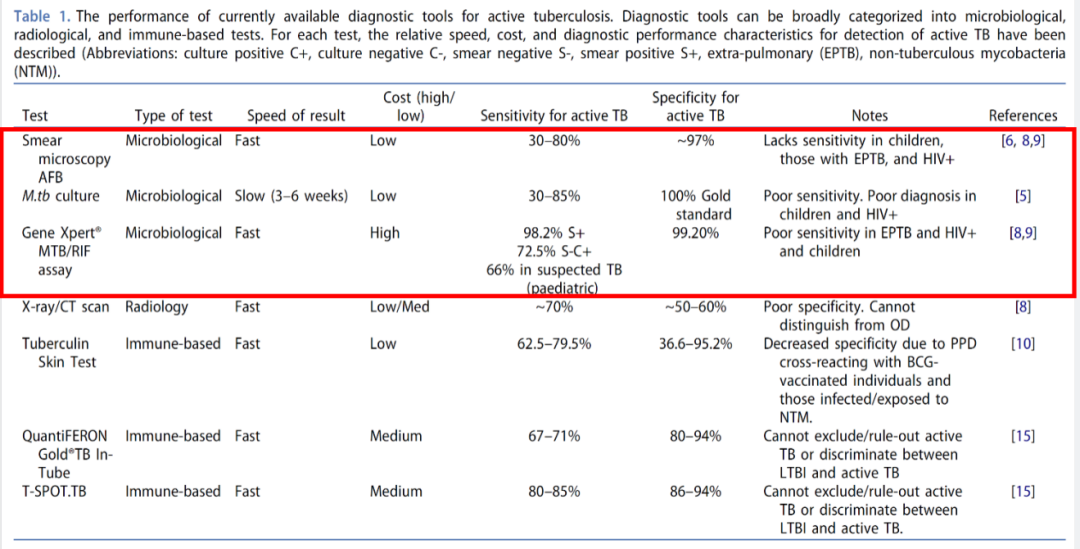
(Halliday A, et al. Expert Rev Respir Med. 2019;13(6):521-532.)
关于结核分枝杆菌耐药性检测技术,主要包括两大方面:表型药敏和分子药敏。表型耐药检测主要是通过待检测的结核分枝杆菌是否在含药培养基中生长与否进行判定;而基因型耐药的检测主要是通过相关的分子生物学技术检测结核分枝杆菌相关的耐药基因是否存在突破进行判定。下图中是国际上的一些商业化的分子检测技术。
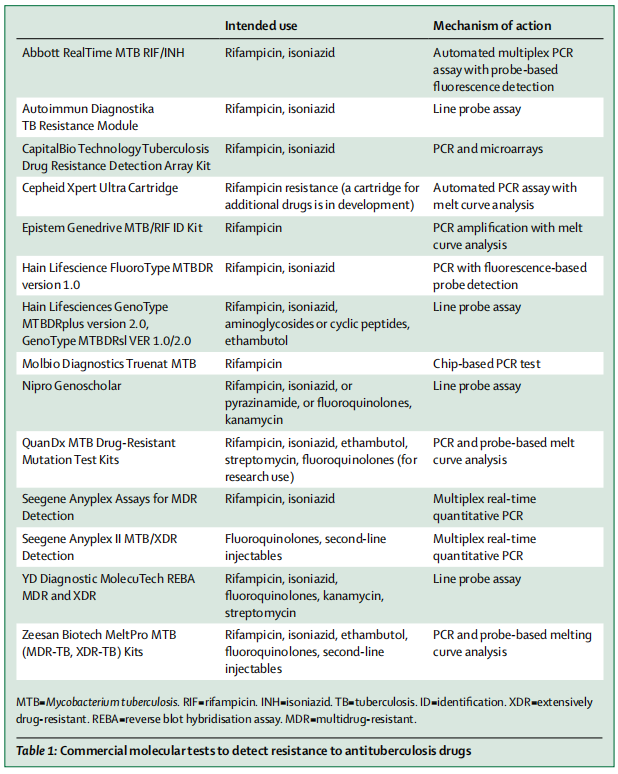
(Walzl G, et al. Lancet Infect Dis. 2018;18(7):e199-e210. )
根据中国结核病预防控制工作技术规范(2020版),在结核分枝杆菌耐药性检测方面,包括表现耐药和分子耐药检测技术,在分子耐药检测技术中,建议包括线性探针、基因芯片、熔解曲线、基因测序等在内的一些检测技术。

关于耐药结核病的检测流程,我国在2019年出台的《结核分枝杆菌耐药性检测专家共识》,强调「表型药敏与分子药敏联合检测」优势互补策略,利用表型药敏的「金标准」价值和分子药敏快速的特点。
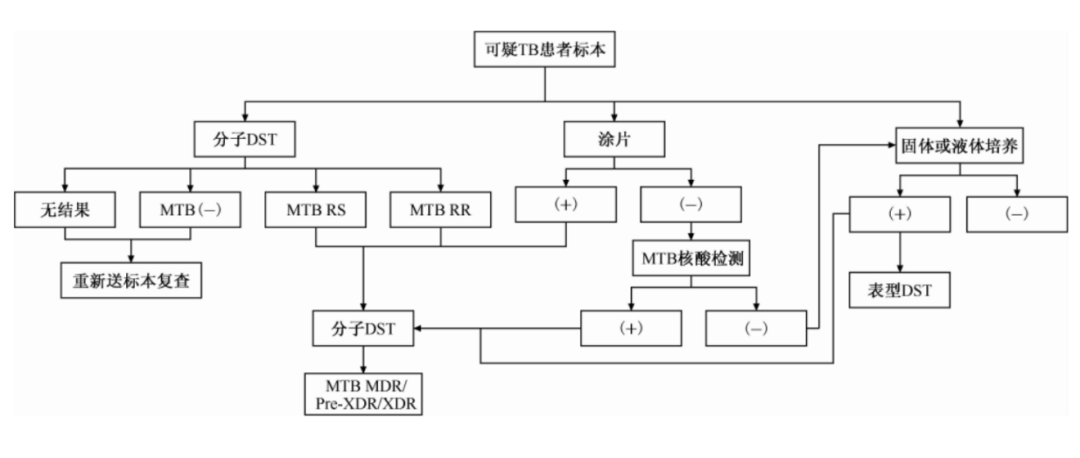
(中国防痨杂志. 2019,41(2):129-137.)
耐药结核病的相关概念
关于耐药结核病的相关概念,包括单药耐药、多药耐药、耐多药、广泛耐药等,针对广泛耐药结核病因二线注射剂在耐多药结核病治疗的价值的原因,现已将其概念有所调整,更多强调的是除了异烟肼、利福平和氟喹诺酮药物耐药之外,把A组药物中的其他两种药物(贝达喹啉和利奈唑胺)中至少有一种耐药作为标准。
几个相关概念
我们在谈实验室检测的时候,这里有几个概念是非常重要的:
最低抑菌浓度(MIC):抑制细菌生长的最低药物浓度
耐药(resistance):是指某细菌群体中超过1%的细菌能在临界点药物浓度下生长
敏感株(sensitive isolate):标准剂量的药物能在感染部位达到临界浓度并被抑制的菌株
耐药株(resistant isolate):是指任何耐受剂量的药物均不能抑制的菌株
耐受株(tolerant isolate):任何剂量均不能杀灭的菌株,其本身的状态是存活并不生长。
临界点浓度(critical concentration):是指能抑制95%野生菌株,但不能抑制耐药菌株的最低药物浓度。
临界点浓度的确定是比较复杂的,它要根据MIC以及其他的一些相关因素来确定。目前WHO推荐的耐药临界点浓度为能够抑制95%以上的结核分枝杆菌野生株(吡嗪酰胺为90%)生长的药物浓度.
临界点浓度的确定至关重要,理想的情况是,临界点浓度至上不能生长的菌判定为「可能敏感菌」,反之则判定为「可能耐药菌」。
但真实的情况未必如此,下图1较为理想,临界点浓度能很好地区分「可能敏感菌」和「可能耐药菌」,但图2则不尽然,图3情况更糟。追根溯源还是出现在对「可能敏感菌」和「可能耐药菌」的定义上。所谓「可能敏感菌」是指从来没有接触过药物的野生株,「可能耐药菌」是指接受该药物治疗至少6个月,治疗效果不佳的分离株。这种定义其实是很难严格区分「可能敏感菌」和「可能耐药菌」。
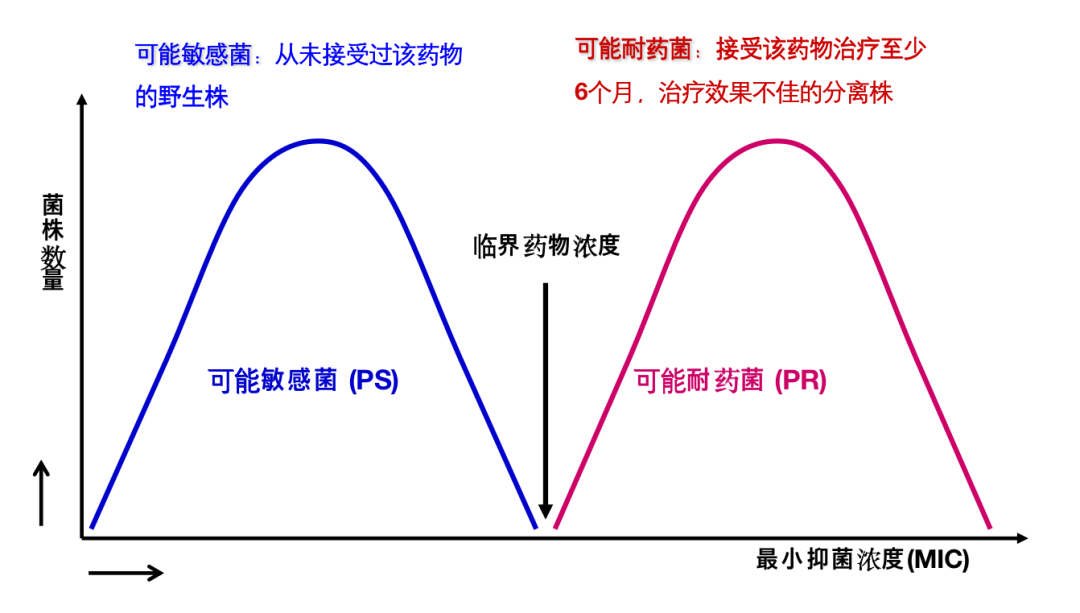
图1
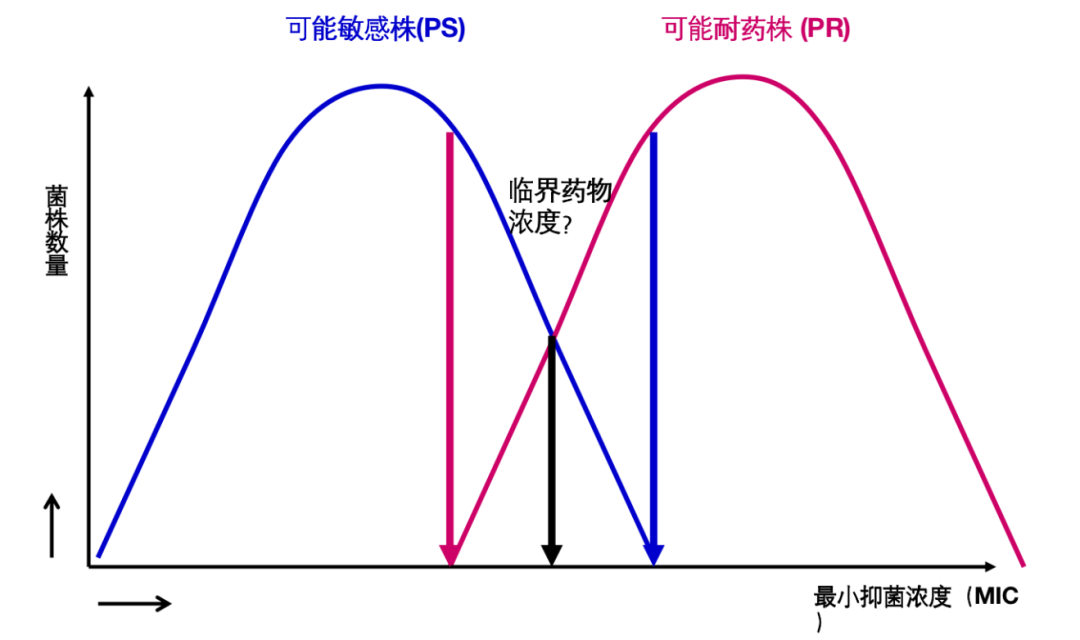
图2
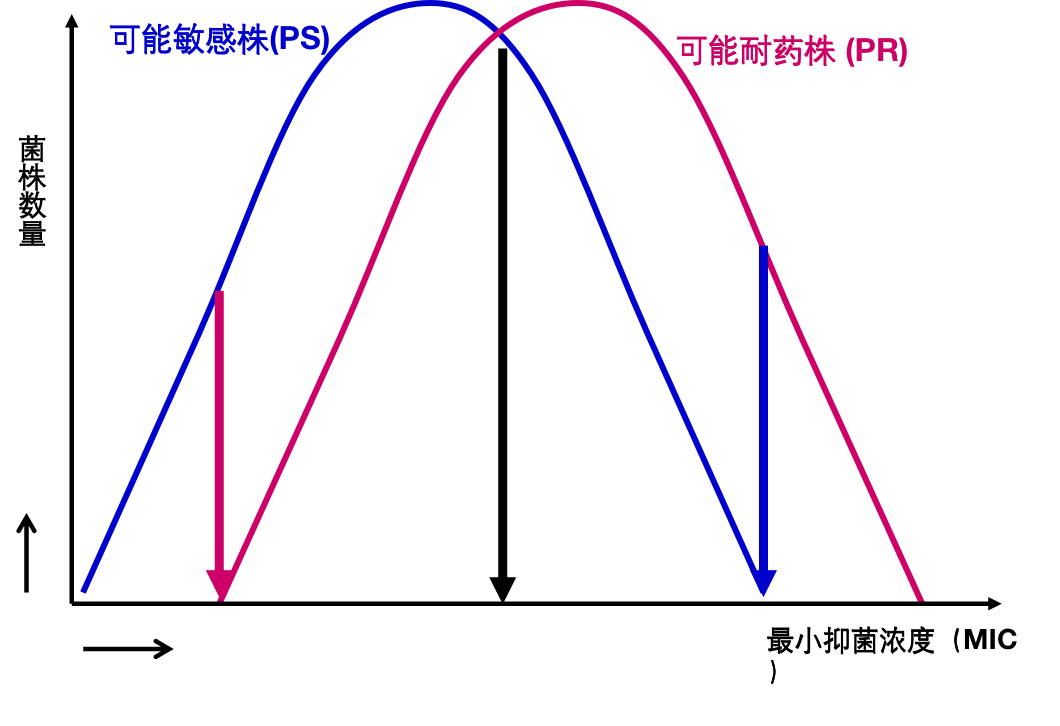
图3
结核病耐药的相关基因
关于结核病耐药的相关基因,重点关注的是一线抗结核药物,主要包括异烟肼和利福平。
异烟肼的耐药相关基因有:katG、inhA、kasA和ahpC等, katG基因突变,覆盖异烟肼耐药约60%~80%;inhA突变可能覆盖异烟肼耐药约15%~20%,有文献报告为10%左右。
利福平耐药基因为rpoB基因,该基因突变覆盖利福平耐药约95%,这个数字所有的文献基本上是一致的。当然在利福平耐药基因中还包括rpoA、rpoC等。其他抗结核药物,包括吡嗪酰胺、乙胺丁醇、氟喹诺酮类药物以、贝达喹啉、氯法齐明、利奈唑胺等都存在相关的耐药基因,这些基因突变导致的相关药物耐药没有异烟肼和利福平的一致性好。此外,外排泵相关基因的突变导致结核分枝杆菌外排泵活性增加,也是导致药物耐药的原因之一,值得关注。
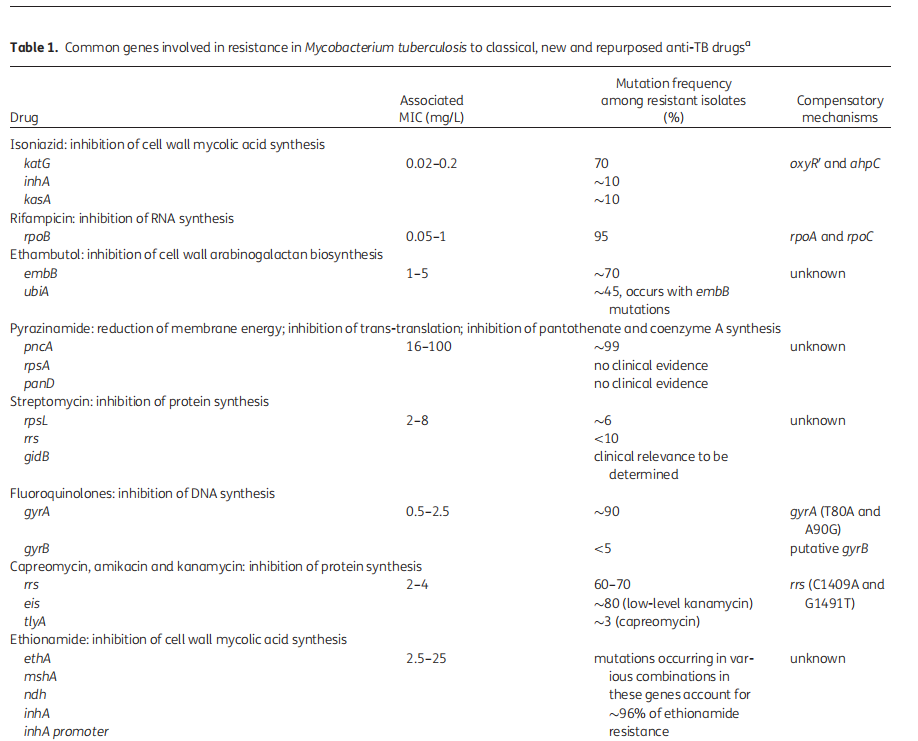

(Dookie N, J Antimicrob Chemother. 2018;73(5):1138-1151. )
耐药结核病相关的检测技术
结核分枝杆菌耐药性的检测分为两个方面,一方面就是耐药表型的检测技术,它是以培养为基础,也就是通过培养把标本里的结核分枝杆菌整体都复制,然后再采取相应的策略来检验这样的菌能否在含药培养基中继续生长。另一方面就是关于耐药基因的检测,这个技术是以PCR为基础,通过PCR技术将耐药的相关基因进行数量级的扩增,然后再采取相应的策略来检测相关的耐药基因是否存在突变。这些技术包括Xpert/Xpert Ultra、GenoType® MTBDR/LPA、MeltPro/HRMA、RCA等等。
耐药表型检测技术——显微镜观察下的药物敏感性试验(MODS)
无论是液体培养基培养还是固体培养基培养的药物敏感性试验,都是先培养,再将培养无转种含药培养基中继续培养,如果培养出菌,提示耐药,否则提示敏感。这个实验是以培养为基础的,也就是在液体培养基当中把结核分枝杆菌通过较短时间进行培养,然后再放到显微下观察是否有结核分枝杆菌生长。如果有就说明它可以在有药的情况下生长,就定为耐药。如果在含药的培养基中没有生长,而在无药的培养基中生长就定为敏感。
有文献报道,以液体培养为金标准,其检测的敏感性能达到92.3%,特异性达到98.8%。以改良罗式培养基作为金标准的话,其敏感性也能达到91.3%,特异性达到94.7%。
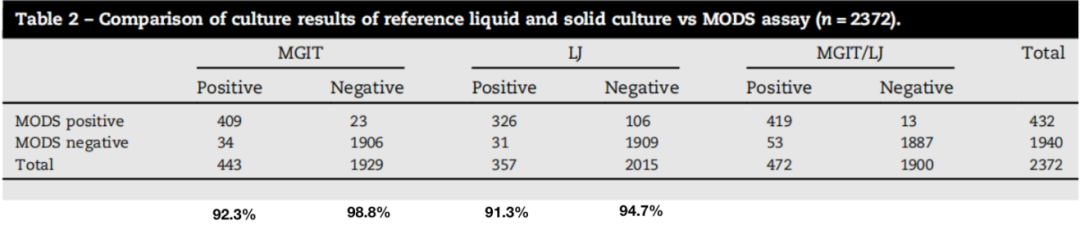
(Agarwal A, Med J Armed Forces India. 2019;75(1):58-64.)
从这个数据可以看出,MODS是一个很好的技术,但是现在临床用得并不广泛。MODS还有一个非常好的优势,就是它所用的时间很短,我们可以看到在培养7天的时候,它的阳性率能够达到36.4%,14天能达到77.2%,经过21天的培养,大概能达到100%,它的中位的生长时间大概在10.3天。那么我们看MGIT960在培养7天的时候大概只能达到22.8%,14天达到68%, 21天达到88.9%。
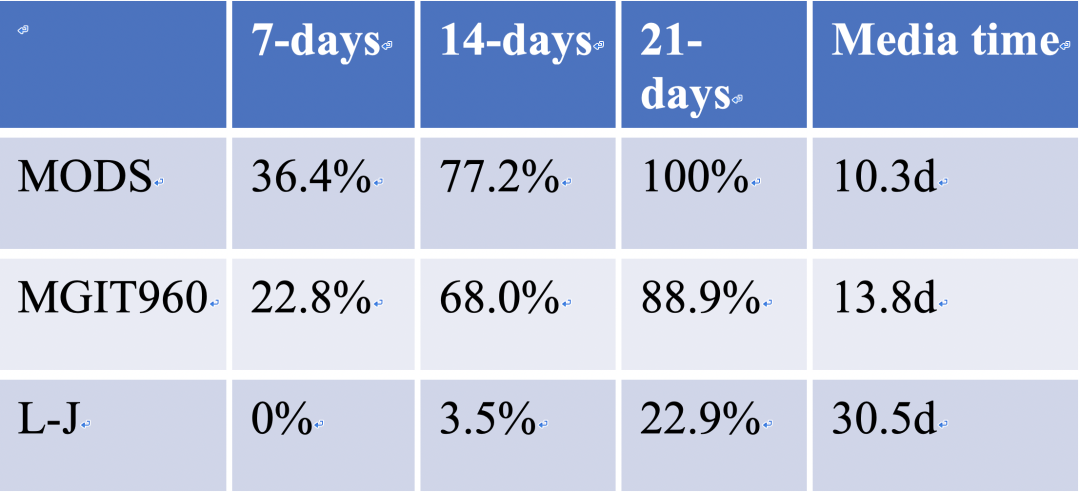
这两个技术都是以液体培养为基础,为什么有所差别?这主要是与我们判断结果的方式有关系。MODS是提前人工去观察,那MGIT960是机器自动探测其氧耗程度。
耐药基因检测技术——Xpert/Xpert Ultra
关于耐药分子生物学检测的两个重要的技术,分别是Xpert和Xpert Ultra。它们分别是一代产品和二代产品。无论是Xpert还是Xpert Ultra,检测阳性代表着待测样品中存在一定数量的结核分枝杆菌DNA,同时,可检测到利福平耐药相关基因rpoB的利福平耐药决定区(RRDR)是否存在基因突变。该技术在利福平耐药性检测,无论是敏感性还是特异性均值得信赖,适合于多种标本的检测,但在结核性胸腔积液中的敏感性总体上较其它标本低。有文献报道,Xpert/Xpert Ultra的阳性率与所检测人群结核病的患病率存在相关关系,患病率越低的人群,检测的阳性率相对较低。
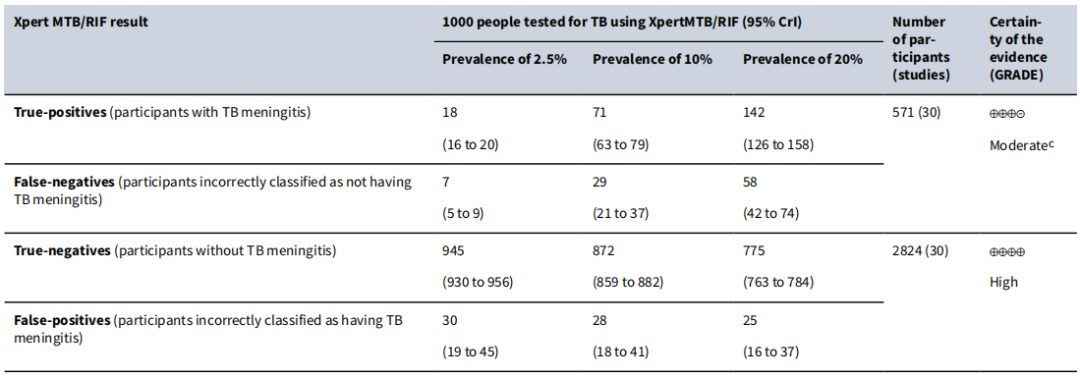
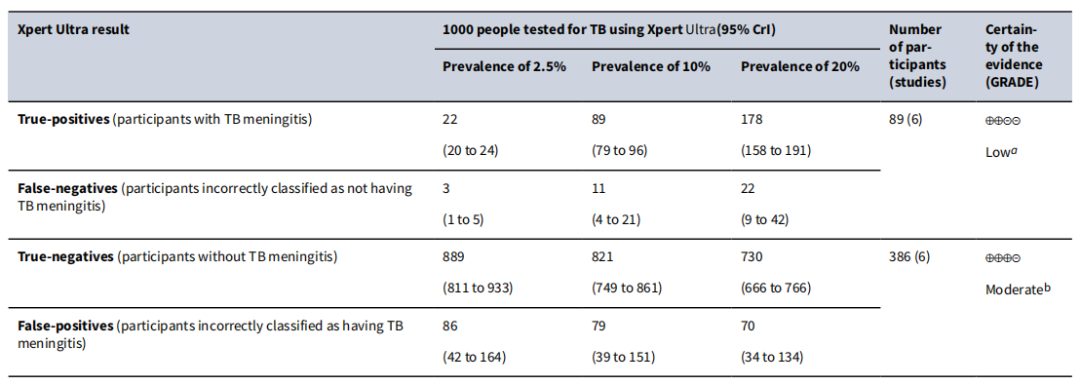
(Kohli M, Cochrane Database Syst Rev.2021;1(1):CD012768.)
尽管Xpert/Xpert Ultra技术检测的敏感性和特异性高,但依然不能完全替代表型药物敏感性试验。也就是说我们可以优先考虑Xpert/Xpert Ultra,但是在很多情况下,我们仍然需要表型药敏来进行复核。
国产耐药基因检测技术——MeltPro
MeltPro 技术是一种国产检测技术。有文献报告,将MeltPro、GeneXpert、GenoTypeMTBDR、Genechip等产品做了一个对比研究。
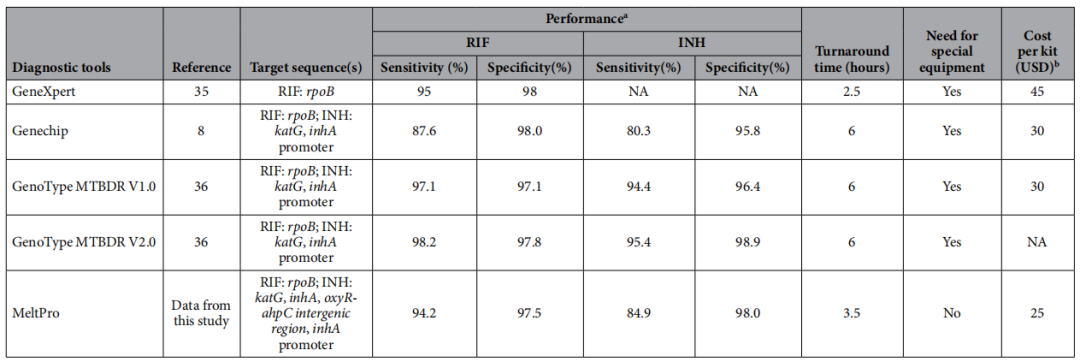
(Pang Y, et al. Sci Rep. 2016;6:25330. )
可以看到MeltPro在检测利福平的敏感性达94.2%,与其他几种检测技术相差无几,其特异性达97.5%。对异烟肼的敏感性较GenoTypeMTBDR技术相对低一些。可能的原因系GenoTypeMTBDR一代和二代的产品同时检测了异烟肼的katG和inhA两个耐药相关基因。
虽然MeltPro与其他技术比较无论从敏感性和特异性无明显优势,但是其检测的时间短具有一定的优势,除了GeneXpert检测时间为2.5小时外,其他分子生物学技术检测时间大概在6个小时左右,MeltPro只要3.5个小时就能够得到结果。
其次MeltPro不需要昂贵的检测设备,检测费用相对较低,适合更多的发展中国家。
另外,MeltPro采用的是MMCA策略,能够实现单管多基因检测,并采用熔点分析技术判断基因突变,可以实现较高通量的检测。
Sanity2.0系统
Sanity2.0系统与MeltPro技术相同,仅是Sanity2.0检测设备体积小,可以多场景应用。
另外需要说明的是无论MeltPro还是Sanity2.0所采用的熔点分析,不是高分辨溶解曲线分析技术(HRMA),这一点需要说明。
下面是一个临床应用的案例,通过这个案例我们可以看到几个重要信息。首先送检的时间是早上8:31,报告时间是同一天下午13:58。大家可能会有疑问,为什么前面提到检测时间是3个小时,这里却用了5个多小时?可能在实验室交接标本以及处理标本时会存在一定的时间差。同时,该技术最大的一个优势就是能够在1张报告单上提供至少4种药物的耐药性检测结果。
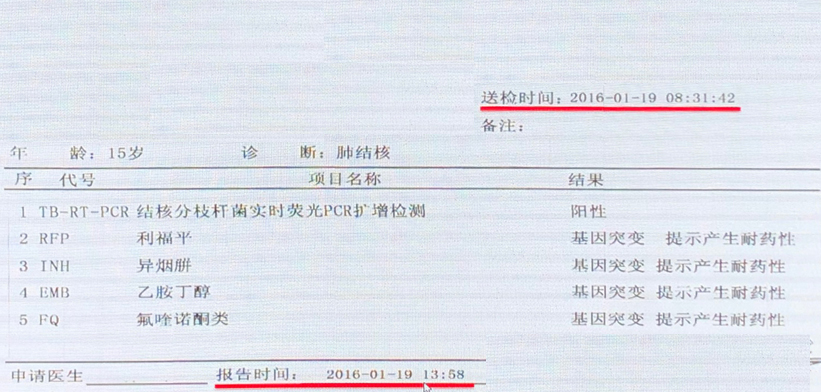
药物敏感性试验在一线和二线抗结核药物中应用的临床评价
有文献报告,无论是从灵敏度还是特异度来看,关于异烟肼和利福平的药物敏感性实验是可靠的。同时,氟喹诺酮类药物的灵敏度和特异度的结果也都非常好。当然其它一些二线药物的敏感性试验的灵敏度和特异度存在着差距,这也是临床中针对一线药物,尤其是异烟肼和利福平,其药物敏感性试验报告的结果可信度大。
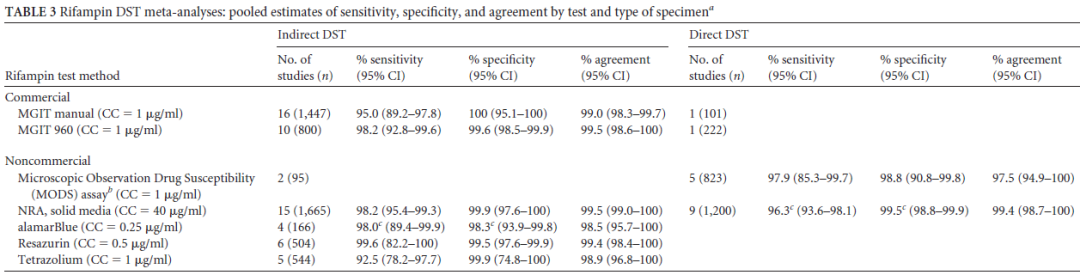
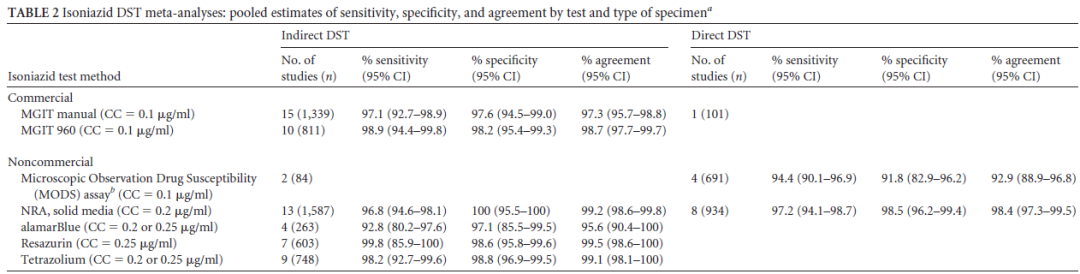
(Horne DJ, et al. J Clin Microbiol. 2013 Feb;51(2):393-401. )
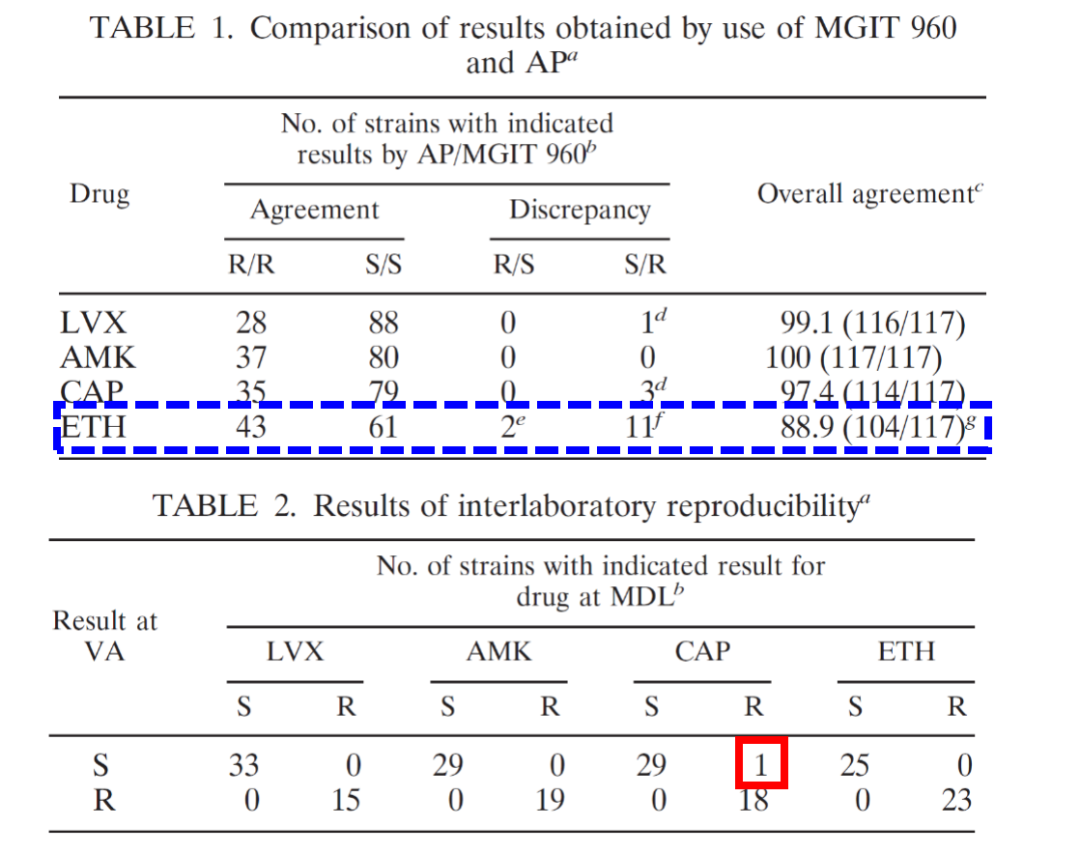
(Lin SY, et al. J Clin Microbiol. 2009 Nov;47(11):3630-4.)
当然,表型药敏试验仍然存在着一定的局限性。原因有以下几方面:
1、它是在体外实验,没有考虑到药物、细菌和宿主之间的相互作用。而在患者体内存在着药物与人体的相互作用,细菌与人体的相互作用等,同时药物在人体内的吸收、分布、代谢以及排泄等过程,会受到体内血浆蛋白质的水平等影响因素,导致体外试验的结果与体内真实情况存在着差异。
2、体外药敏试验多采用的是单药,而化学药物的治疗是采用的方案,是多种药物的联合,药物之间存在相互作用。
3、结核分枝杆菌的复制一代大概需要18~24小时,也就是说一条大肠杆菌半个小时所生长细菌的数量,结核分枝杆菌大概需要72天。结核分枝杆菌生长这么长的时间,培养基中的药物可能存在降解的问题。另外结核分枝杆菌的生长的成簇性。这种成簇性可能导致药物的很难均匀渗透到成簇菌团中,也会影响试验的结果。
4、临界点浓度确定的标准尚未完全统一,也是导致表型药敏结果存在局限性。
表型和基因型检测结果不一致怎么办?
临床上可能发现基因型和表型检测结果不一致的问题。文献报道,表型和基因型之中有不统一的结果,这是无论在肺结核还是肺外结核中都存在的一个问题。
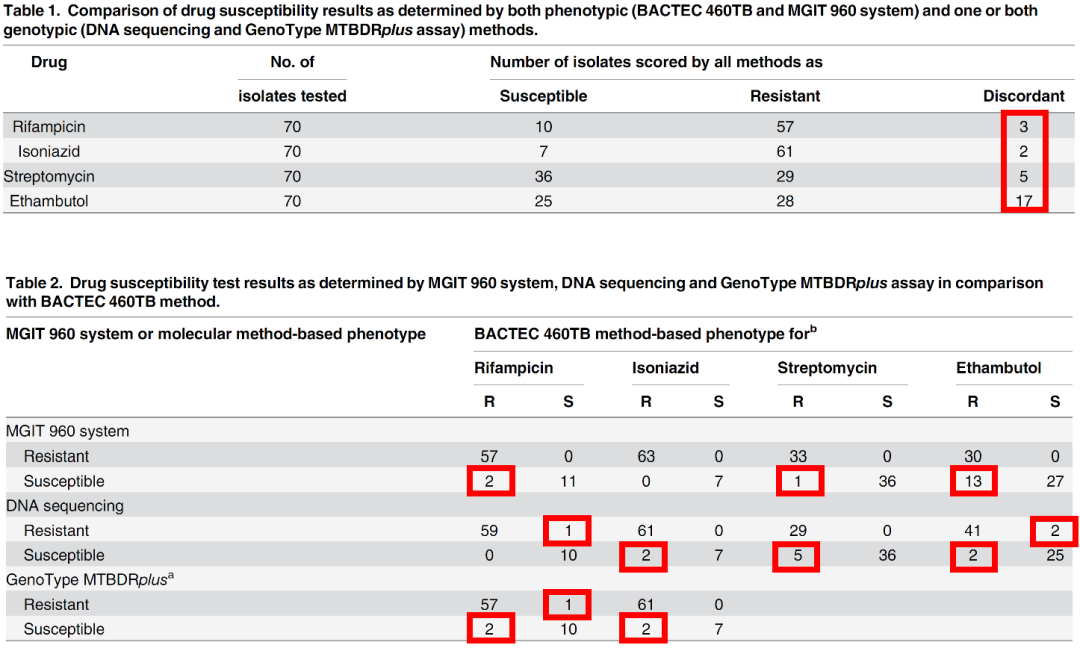
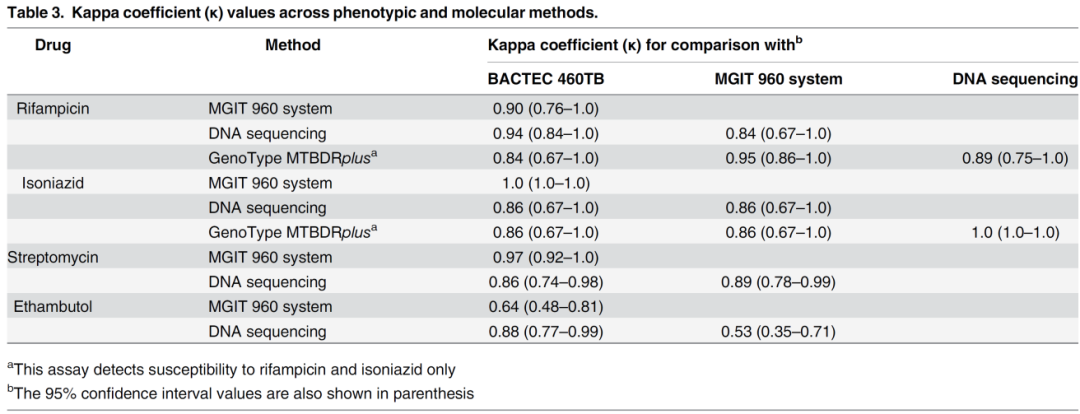
有文献报道,利福平的表型药敏结果与分子药敏不一致的情况。
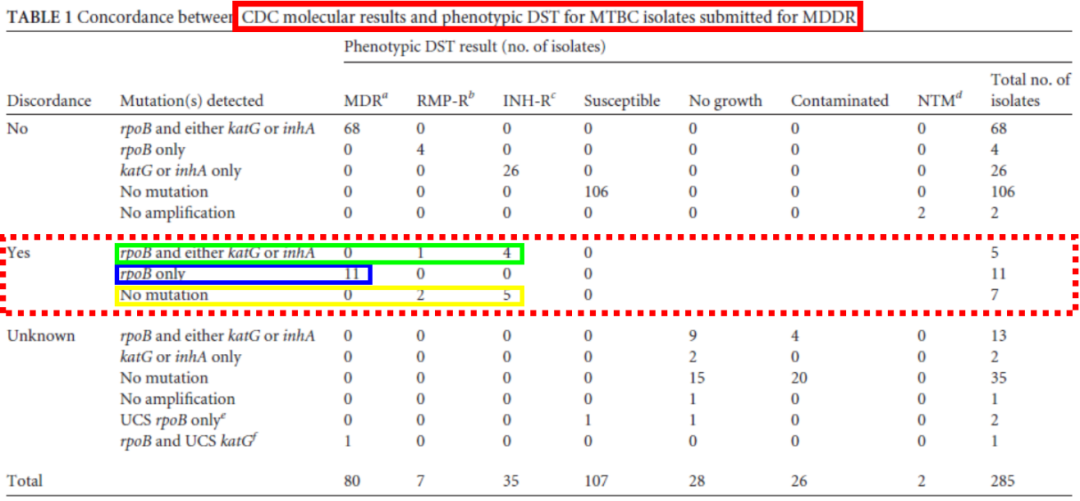
(Yakrus MA, et al. J Clin Microbiol. 2014;52(6):1932-7. )
在利福平耐药基因rpoB的突变,存在无义突变的情况。如文献报道在531这个位点,虽然核苷酸进行了突变,但是它的氨基酸并没有改变,也就是说这种突变是没有实际意义的。但是我们用分子生物学技术检测的时候,却恰恰检测到了它的突变。这种突变在分子生物学的角度是耐药的,但是在表型检测上它依然是一个敏感的。

(Mathys V, et al. Int J Tuberc Lung Dis. 2014;18(10):1255-1257.)
关于rpoB不同位点突变引起的高中低耐药的问题,值得关注,通常利福平rpoB基因突变的位点中526、531位点突变往往引起高水平耐药。

(Kambli P, et al. Diagn Microbiol Infect Dis. 2015 May;82(1):49-53. )
异烟肼katG突变往往引起高水平耐药,但inhA单独的突变往往是一个中低水平耐药。同时需要关注,inhA突变往往同时引起丙硫异烟胺耐药。
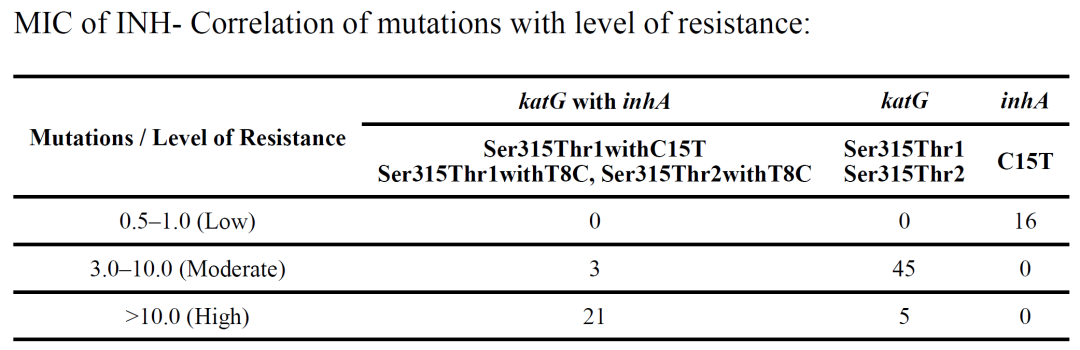
(Kambli P, et al. Diagn Microbiol Infect Dis. 2015 May;82(1):49-53. )
关于表型和基因型检测结果不一致的原因有以下几个方面:
1、临界点浓度确定存在的不统一性
2、突变热点以外区域的突变。例如利福平,常规检测的是81个核苷酸区域,其实这个区域基因位点的突变仅代表了95%的利福平耐药,也就是说还有5%的利福平耐药可能是其它区域的突变。
3、无义突变造成的结果
临床上出现了这样的情况该怎么办?首先需要进行DST重新检测。其次就是进行DNA测序,如果检测的靶基因无突变,可能存在热点以外的区域基因突变。另外就要进行实验室的质控,避免因实验室检测的误差造成不一致的结果。
药物敏感性试验与临床疗效的不一致性
关于药物敏感性试验和临床疗效不一致的问题,有文献报道,一种可能是继发性耐药问题,患者病灶内的结核分枝杆菌存在着异质性,起始以敏感菌占优势,耐药菌未能检出,随之治疗,敏感菌被杀灭,耐药菌成为优势菌群。另一种情况可能是耐药菌的再感染。
有关分子药敏检测技术中,滚环复制技术(RCA)可以早期检测感染菌群中存在耐药菌和敏感菌的混合状态。有文献报道,RCA可以在菌群中混杂5%的耐药菌时便可检出,在临床上起到提前预警继发性耐药的出现。
针对药敏试验和临床疗效不一致的情况出现时,在复核之后,建议临床调整治疗方案。
NGS在结核病诊断中的价值
结核病实验室诊断有一个绕不开的话题就是NGS的检测。从文献报道来看,NGS在结核病的诊断的敏感性和特异性并不比Xpert,甚至培养具有优势。因此,在临床可疑结核病病例的诊断中,由于其敏感性以及费用等问题,NGS不作为首选技术。
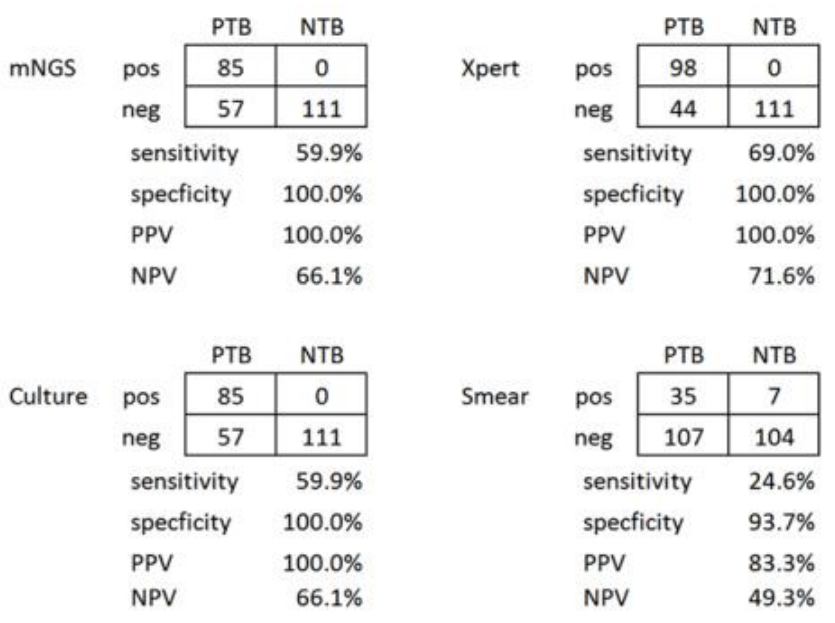
(Liu X, et al.Int J Infect Dis. 2021;104:50-57. )
关于耐药结核病的检测,我们重点关注的是耐药基因的一些检测技术。其实在耐药结核病中很多的耐药机制不能完全用耐药基因来解释。下图阐释了36%~95%的耐药结核病可以用基因突变来解释。但仍然还有5%甚至64%的耐药情况不能够用基因突变来解释。
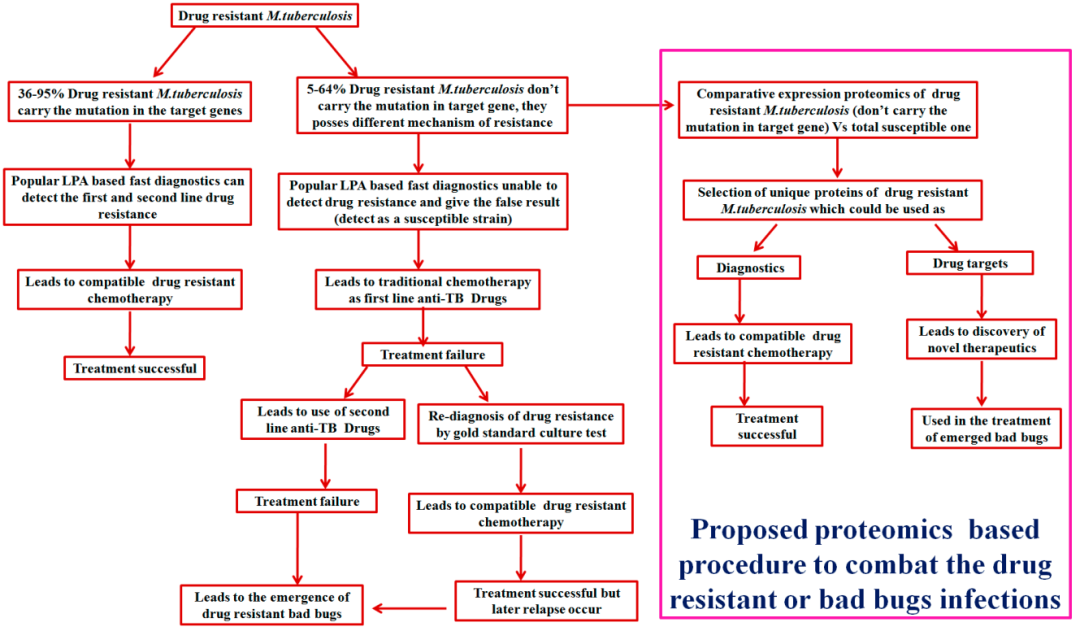
(Sharma D, et al. Proteomes. 2018;6(2):26.)
如果不能用基因突变来解释耐药的问题,就要采取另外的一些策略来检测,甚至包括蛋白质组学的技术。
结核病宿主和结核菌的异质性
有关结核病宿主和结核菌异质性的问题。不同的结核病患者,由于遗传背景不同,年龄的差异,合并症的不同等不同会导致不用患者之间的异质性较大,同种细菌在感染不同的宿主之后,它产生的临床表现也不尽相同。另外,同一宿主感染的细菌菌群,同样存在着异质性的问题,同时同一患者的不同病灶中的菌群也可能存在着异质性的问题。正是这些异质性的存在,给临床检测甚至临床治疗带来一些困惑。因此,临床医生针对不同的患者,以及患者不同的发病阶段所表现出来的临床表现予以充分的认识,这样可能会更好的去评价不同的检测技术在临床诊断中的价值。
小结
耐药结核病的形势依然严峻。临床医师需要充分了解并认识耐药结核病不同检测技术的价值和应用场景。临床实践中,在遇到不同检测技术结果不一致,临床疗效与检测结果不一致时,需要结合患者的实际情况来进行决策,而不是仅仅围绕实验室的报告来决策,要结合检验科、放射科等辅助科室的检验结果来对病人进行综合分析。
讨论
崔晓敬:非常感谢陈院长,这是我听过非常高级别的关于结核病诊断技术的一个讲座。从表型技术到分子技术,甚至探讨到宿主和结核菌的异质性,让我收获很多。线上有很多的观众都非常认真的在听课,他们提出问题的水平也很高。有几个问题想请教一下陈院长,第一个问题是目前氟喹诺酮类药物的使用率越来越多,尤其在我们呼吸科治疗肺炎的时候,现在市面上有哪些能够快速鉴别氟喹诺酮类药物耐药的一些技术?
陈效友:氟喹诺酮类药物应用比较普遍,尤其在呼吸科,因为它不良反应相对较少,而且抗菌谱相对比较广。其实一般药物上市之后,随着应用的越广泛,耐药产生的情况会越多。现在氟喹诺酮类耐药的检测技术有两个层面,一个是表型药敏试验,另一个就是分子生物学的技术。
结核病专科医院可以实现氟喹诺酮类药物的表型药敏检测,但是分子检测需要相对专业的人才以及相应的检测设备。前面提到的MeltPro和Sanity2.0技术,因设备简单,操作技术并不复杂,在基层医疗机构可以实现,此类国产产品推荐可以优先去选用。
崔晓敬:谢谢陈院长。第二个问题是氟喹诺酮类药物和异烟肼都有高低不同水平的耐药突变,区分高低水平的耐药对于用药有没有一些指导的意义?
陈效友:实际上关于一些一线药物和部分二线药物,我们都会提到高水平耐药和低水平耐药。实验室检测到某种药物属于高水平耐药的话,临床不再选择这种药物来治疗。至于实验室检测到某种药物低水平耐药,临床一般不首选此类药物,如果临床中可选的药物品种有限,比如异烟肼,也可以选择应用,但需要增加异烟肼的剂量。
当然在这里需要提醒的一点是如果异烟肼是一个低水平的耐药,很可能是 inhA这个基因的突变,但是这个基因的突变会导致丙硫异烟胺相应的耐药,所以一般来说异烟肼低水平耐药往往在临床上不建议再使用丙硫异烟胺。
崔晓敬:谢谢陈院长,我们还想再请教您一个问题,就是用熔解曲线检测出异质性耐药的时候怎么报告?用熔解曲线检测出耐药的情况下,患者使用耐药结核方案进行治疗吗?
陈效友:所谓异质性耐药,严格意义上说是指该菌群中存在不同类型的耐药菌株,而非敏感菌和耐药菌的混合。按照耐药性的概念来说,一个群体里如果有1%以上的细菌是耐药的话,我们就把这个群体作为耐药的群体来看待。实际上任何病人,体内感染的菌群无论表型上是敏感还是耐药,其群体里面的细菌不是一个均质性,都存在异质性,只是耐药菌和敏感菌比例的问题。如果这个耐药菌的比例小于1%,就作为敏感对待,但耐药比例大于1%,就作为耐药对待,也就是说大部分的耐药群体里面仍然也会存在着敏感群的情况。通过熔解曲线检测到这个群体耐药,无论耐药的比例是多少,均需要考虑调整方案。
本期直播嘉宾

陈效友
首都医科大学传染病学系教授,博士研究生导师。首都医科大学附属北京地坛医院副院长 主任医师。兼任中国防痨协会副理事长、北京医学会结核病学分会主任委员,中华医学会结核病学分会常务委员和中国性病艾滋病防治协会艾滋病与机会性感染专业委员会副主任委员。从事结核病及相关疾病的诊断、治疗和相关基础研究。近三年,承担、完成多项国家及省部级科研课题,以第一作者或通讯作者在SCI及国内核心期刊发表学术论文40余篇,获得国家发明专利1项,出版专著与教材3部。

崔晓敬
医学博士,中日友好医院呼吸中心呼吸与危重症医学科主治医师,2018年通过呼吸与危重症专科医师考核 。北京防痨协会临床分会委员,中国防痨协会中西医结合分会委员,全国结核综合质控专家委员会委员。
本文由《呼吸界》编辑 孙煜然 整理,感谢陈效友教授的审阅修改!
* 感谢厦门致善生物科技股份有限公司的大力支持


