最近明星基因缺氧诱导因子的研究获得今年的诺贝尔生理学奖,多种呼吸系统疾病都与低氧有着密切的关联。今天就给大家重点探讨诺贝尔奖得主约翰·霍普金斯大学的格雷格·塞门扎教授在低氧性肺动脉高压领域的科学贡献。
肺动脉高压(PH)是一种难治性疾病,其特征在于的肺血管重塑和持续性的肺动脉压升高。肺血管重塑涉及到血管壁中细胞的异质性,主要有肺动脉内皮细胞、肺动脉平滑肌细胞、成纤维细胞、炎症细胞和血细胞。根据其病理特点有效的治疗PH方法应该是通过抑制平滑肌细胞的异常增殖和迁移或者提高肺动脉内皮细胞的功能来减少肺血管阻力,但是目前的治疗药物并不能改善肺动脉细胞的异常增殖。因此,基于PH的分子发病机理寻找新的治疗靶标是临床上迫切需要解决的问题。
所有的生物都依赖于感知和响应氧气变化的能力来生存;急性缺氧变化可导致现有蛋白质的改变;长期适应缺氧通常涉及基因表达的改变。氧减少有效应答的转录调控均是由缺氧诱导因子(HIFs)介导。缺氧诱导因子-1α(HIF-1α)是一种转录因子,通过调节血管生成,红细胞生成,炎症和增殖的数百种基因来响应低氧条件。HIF-1α与HIF-1β以异二聚体的形式发挥调控下游靶基因的功能;而HIF-1β总是处于活化状态。HIF活性具有氧气浓度依赖性,其中HIF-1α亚基可探测氧气的浓度,给相关基因作出通报,让细胞作出反应;当人体不缺氧时,HIF-1α被VHL标记分解掉,防止人体过度反应。

【图1】来自格雷格·塞门扎.Annu. Rev. Pharmacol. Toxicol. 2019.
在2000年JCI杂志中,格雷格·塞门扎博士课题组制备了Hif1a转基因小鼠,发现纯合 Hif1a-/-小鼠在母体子宫内死亡,但杂合Hif1a+/- 小鼠可存活,而在常氧下,Hif1a+/-杂合表型与正常野生型Hif1a+/+相比,无明显差异。相对于野生型慢性低氧性肺动脉高压模型组,Hif1a+/-杂合小鼠在慢性低氧三周后,肺动脉压力和右心肥大程度明显降低,血管肌化程度减少,明显减轻低氧诱导的肺动脉高压症状。2015年,广州医科大学王健教授与格雷格·塞门扎博士合作研究发现在低氧暴露下,Hif1a+/-可控制BMP4的成熟和分泌,在肺动脉平滑肌中,Hif1a过表达促进BMP4的分泌,而抑制Hif1a的表达则相反,同时Bmp4+/-小鼠可部分减轻低氧诱导的肺动脉高压症状,提示HIF-1α的抑制可能是治疗肺动脉高压的一种新的治疗策略。
从Hif1a+/-小鼠分离的肺动脉平滑肌细胞在低氧暴露下具有抗增殖能力,那么慢性缺氧时,如何调控肺动脉平滑肌细胞的收缩和增殖?细胞内离子浓度是由各种膜通道和转运蛋白的活性和/或表达来调节的。离子通道在调节平滑肌细胞功能中起着重要作用。其中,钾离子通道 (KV1.5)是用来调控膜电位,Na+/H+交换(NHE1)是用来调节胞内 pH,而非选择性阳离子通道(NSCC)用来调节Ca2+稳态。王健教授与格雷格·塞门扎博士在2006-2008年合作的三篇文章分别显示,HIF-1α可直接调控Kv 通道Kv1.5和NHE1的表达,而且还通过通道蛋白TRPC1和TRPC6调控Ca2+参与肺动脉平滑肌细胞的收缩。王健教授团队发现钙离子通道蛋白TRPC1和TRPC6在低氧诱导下特异表达增高。该研究得到同行的高度评价,改变了对低氧性肺动脉高压发病机制传统的认识,建立了慢性低氧性肺动脉高压发病机制新学说。
HIF-1参与肺动脉高压的发生机制,如何建立有效的基于HIF-1的靶向治疗肺动脉高压方案?而HIF-1α的抑制可能是治疗肺动脉高压的一种新的治疗策略。因为HIF- 1α蛋 白在成年人的肺中常常不活跃,故它可作为一种理想的靶标。 2008年,Gregg L教授从Johns Hopkins Drug Library中筛查到HIF-1α的抑制剂: 强心苷(即地高辛),并在慢性低氧肺动脉高压大鼠模型做了验证,发现地高辛可部分减缓慢性低氧引起的肺动脉高压的发展并抑制慢性低氧引起的肺血管重塑。 地高辛还能抑制肺动脉平滑肌细胞中低氧诱导的离子稳态的变化,通过抑制通道蛋白NHE1和TRPC1的表达,降低慢性低氧性肺动脉高压中肺动脉平滑肌细胞中内钙和pH水平,维持离子动态平衡。
近年来发现
HIF-2α在肺动脉高压中也有一定的作用。2017年,美国亚利桑那大学袁小剑教授和广州医科大学汤海洋教授,王健教授的合作研究发现在特发性肺动脉高压患者和动物疾病模型的肺微血管内皮细胞中观察到显著的内皮转分化现象的存在,疾病模型组HIF-2α水平高于正常组,而可降解HIF-2 α的PHD2表达下调。同时在HIF-2α敲除的肺血管内皮细胞中,发现HIF-2 α通过调控内皮转分化标志SNAI1和SNAI2的表达。在内皮特异性敲除HIF-2 αEC-/-小鼠可预防低氧诱导的肺动脉高压。而在平滑肌特异性敲除HIF-2 αSMC-/-和内皮细胞特异性敲除HIF-1 αEC-/-小鼠,与野生型相比,对低氧诱导的肺动脉高压无明显差异。提示HIF-2 α在肺血管内皮细胞中调控内皮转分化过程,因此,联合激活PHD2并抑制内皮细胞中HIF-2 α的表达减少内皮转分化现象是一种特发性肺动脉高压的潜在治疗方法。
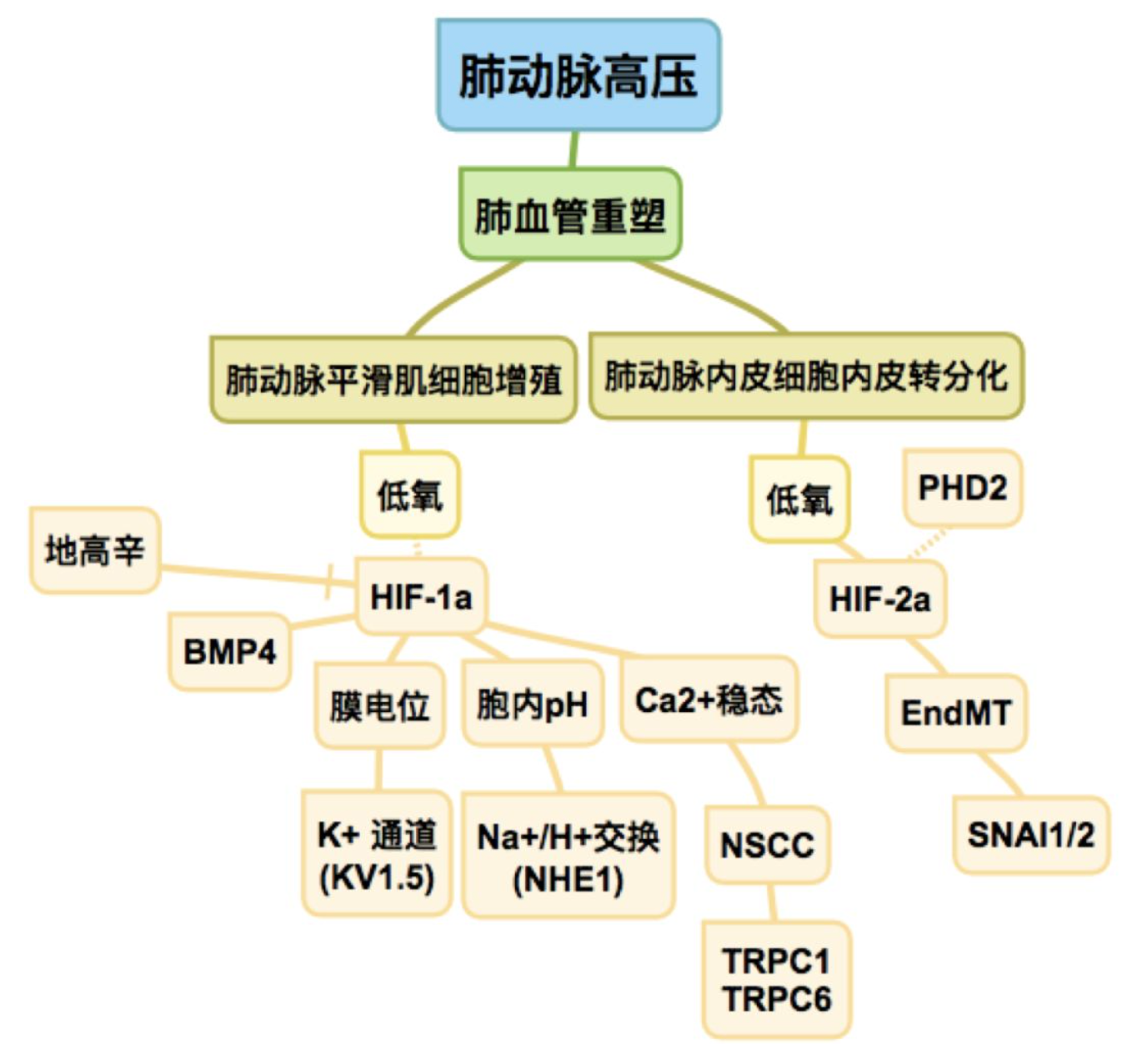
【图2】格雷格·塞门扎和王健教授关于缺氧诱导因子在肺动脉高压发病机制中的作用
鉴于HIF-1 α和HIF-2 α分别在肺动脉平滑肌细胞和肺动脉内皮细胞中承担不同的功能。在2019年格雷格·塞门扎博士在Annual Review of Pharmacology and Toxicology总结了靶向HIFs的药物,为开发新型治疗肺动脉高压新型有效药物提供新思路。
参考文献
[1] Yu AY, Shimoda LA, Iyer NV, Huso DL, Sun X, McWilliams R, Beaty T, Sham JS, Wiener CM, Sylvester JT, Semenza GL. Impaired physiological responses to chronic hypoxia in mice partially deficient for hypoxia-inducible factor 1alpha. J Clin Invest 1999;103:691–696.
[2] Shimoda L A, Fallon M, Pisarcik S, et al. HIF-1 regulates hypoxic induction of NHE1 expression and alkalinization of intracellular pH in pulmonary arterial myocytes[J]. American Journal of Physiology-lung Cellular and Molecular Physiology, 2006, 291(5).
[3] Wang J, Weigand L, Lu W, Sylvester JT, Semenza GL, Shimoda LA. Hypoxia inducible factor 1 mediates hypoxia-induced TRPC expression and elevated intracellular Ca2+ in pulmonary arterial smooth muscle cells. Circ Res 2006;98:1528–1537.
[4] Whitman E M , Pisarcik S , Luke T , et al. Endothelin-1 mediates hypoxia-induced inhibition of voltage-gated K+ channel expression in pulmonary arterial myocytes.[J]. American Journal of Physiology Lung Cellular & Molecular Physiology, 2008, 294(2):L309.
[5] Lu W, Wang J, Shimoda LA, Sylvester JT. Differences in STIM1 and TRPC expression in proximal and distal pulmonary arterial smooth muscle are associated with differences in Ca2+ responses to hypoxia. Am J Physiol Lung Cell Mol Physiol 2008;295:L104–L113.
[6] Gregg L. Semenza,Pharmacologic Targeting of Hypoxia-Inducible Factors. Annual Review of Pharmacology and Toxicology. 2019
专家介绍 - 王健

广州医科大学,呼吸疾病国家重点实验室二级教授,博士生导师,广东省珠江学者特聘教授,广东省血管疾病重点实验室主任,教育部长江创新团队带头人。中华医学会呼吸分会肺血管病学组副组长,广州医科大学肺血管病学组学科带头人等。2006年获美国生理学会呼吸分会年青科学家奖,2003年和2008年两次获得美国约翰.霍普金斯大学医学系基础研究优秀科学家奖。其研究方向主要集中在肺血管形态功能的异常(如慢性阻塞性肺疾病)在肺损伤发生发展中的作用、钙离子通道调控在肺动脉高压发生的分子机制、尼古丁与肺动脉高压的关系、缺氧性肺动脉高压发病机制以及中药治疗肺动脉高压的机理研究等方面。


