我们先来看看流感病毒检测面临哪些挑战?
• 病原培养是非常困难的,效率低,几乎不可能在常规实验室进行,临床时效性和可行性不足。
• 流感容易发生抗原漂移,导致免疫学检测方法效果欠佳。
• 甲型流感病毒(FluA)目前已发现18个HA亚型和11个NA亚型,需要众多引物探针的组合才能覆盖全部亚型。
• 流感病毒基因组高度易变,可使现有的引物探针不匹配而检测失败。
• 流感病毒容易发生耐药性并存在多个潜在的耐药位点,点突变检测目前开展较少。
• 目前的检测方式主要集中在定性检测,缺乏方便准确的定量检测方法。
理想的流感病原诊断方法具有哪些优点?
特异性强:即诊断只对流感病毒或其亚型,不同病毒/亚型之间无交叉反应。
灵敏度高:即使只有微量的目标分子,或是在很多干扰物质存在的情况下,也能有效诊断。
稳定性好:不同时间,不同地区,不同操作者规范操作时,方法性能不受影响。
简单迅速:方法操作简单快速,容易自动化操作,便于大规模检测。
流感检测时间窗口:
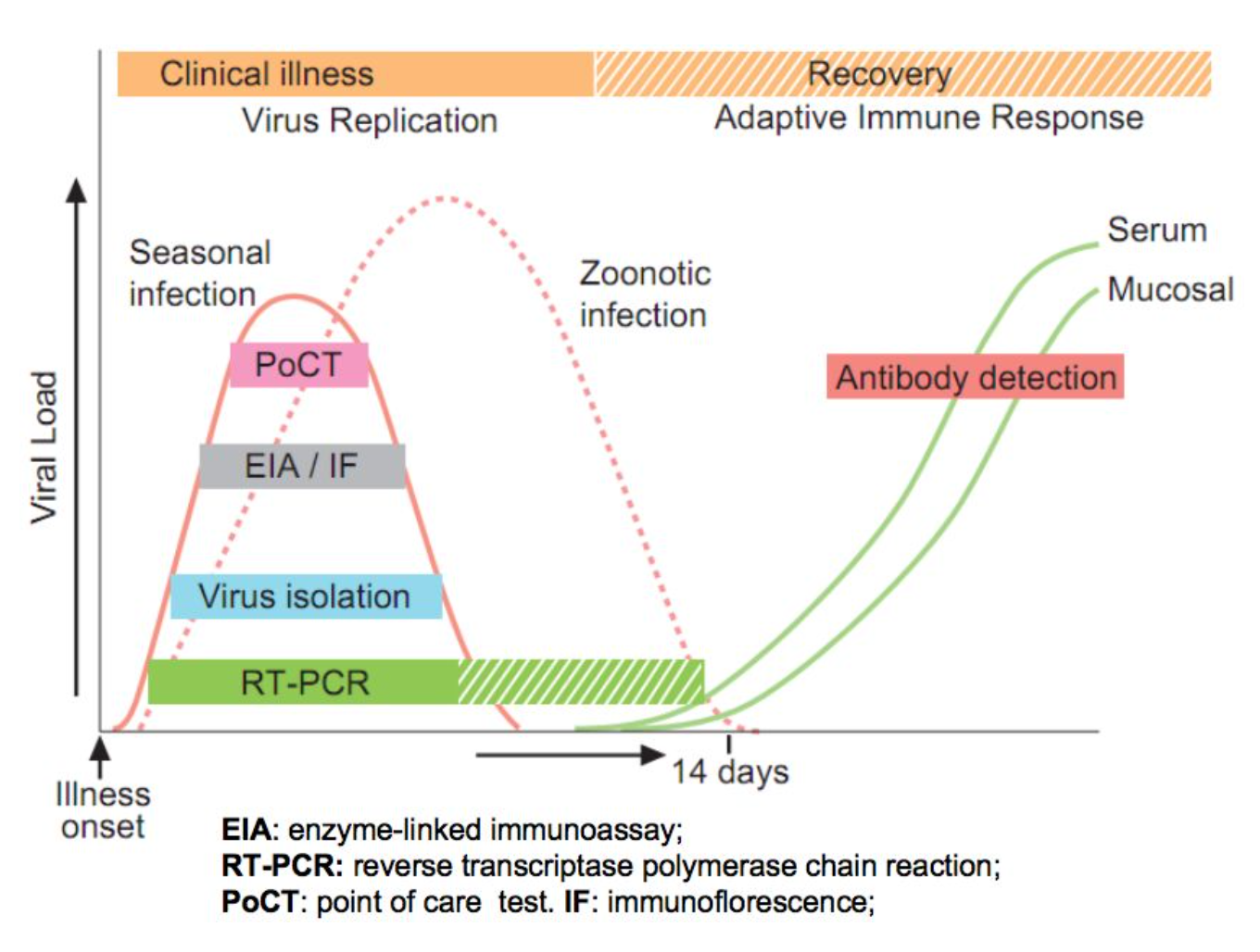
根据流感检测时间窗口,我们可以看到比如PoCT、荧光检测技术、病毒分离培养法、RT-PCR这些方法,它们检测的时间和时间段有所不同。从这张曲线图我们了解到,大多数方法在1-7天内病毒复制,流感病毒在感染后3-5天达到最高的病毒载量。RT-PCR的检测时间窗口最长,可以达到14天。血清学的诊断方法也就是抗体检测,相对来说比较滞后,大概14天后才可以用于检测。
送检样本包括哪些?
由于流感是呼吸道疾病,流感病毒主要在呼吸道上皮细胞中复制,所以优先选择呼吸道样本进行病毒检测,比如鼻拭子、咽拭子、鼻咽抽提物、鼻洗液、咽漱液,气道抽提物。来自尸检、胸腔手术、肺穿刺活检的样本以及BALF样本如果能检测到病毒通常意味着下呼吸道感染,意义重大。进行病毒分离样本应尽量最大化收集到病毒感染的上皮细胞、鼻咽抽提物和洗液含有较多的上皮细胞,病毒分离效果较好。还有其他的检测,比如血液、关节液,消化道样本通常情况下很少出现病毒,送检意义不大。禽流感重症病例高度怀疑系统性感染时可以考虑送检。
三大类呼吸道病毒常用鉴定方法
第一类:病毒分离培养
有细胞培养和鸡胚培养(9-11日龄鸡胚)这两种方法。刚才提到,病毒分离培养技术常规实验室无法做到,只有在CDC和一些研究机构才能进行。
第二类:免疫学方法
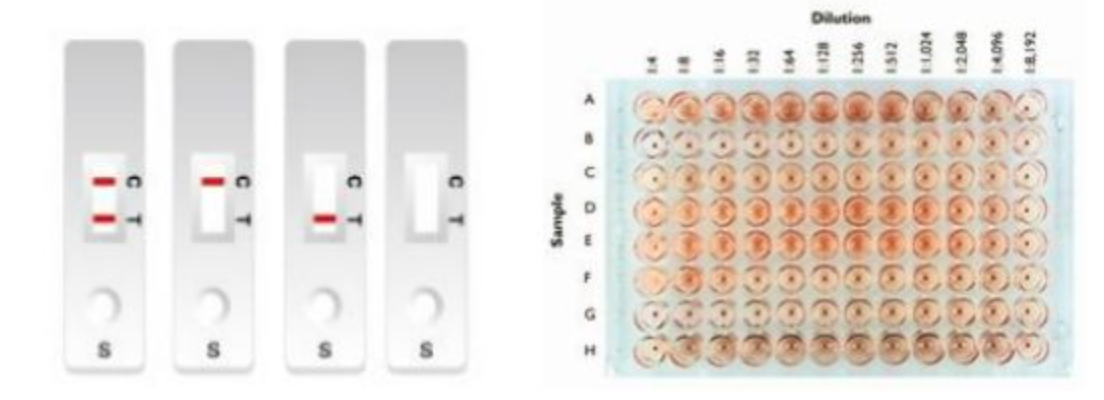
包括胶体金快检/免疫荧光检测,血凝抑制实验和中和实验。
第三类:分子检测方法(临床常用)

最常见的就是PCR检测(荧光定量PCR),还有一代测序、新一代测序技术(Next generation sequencing),都有在文献里有一些报道。
一、病毒培养法
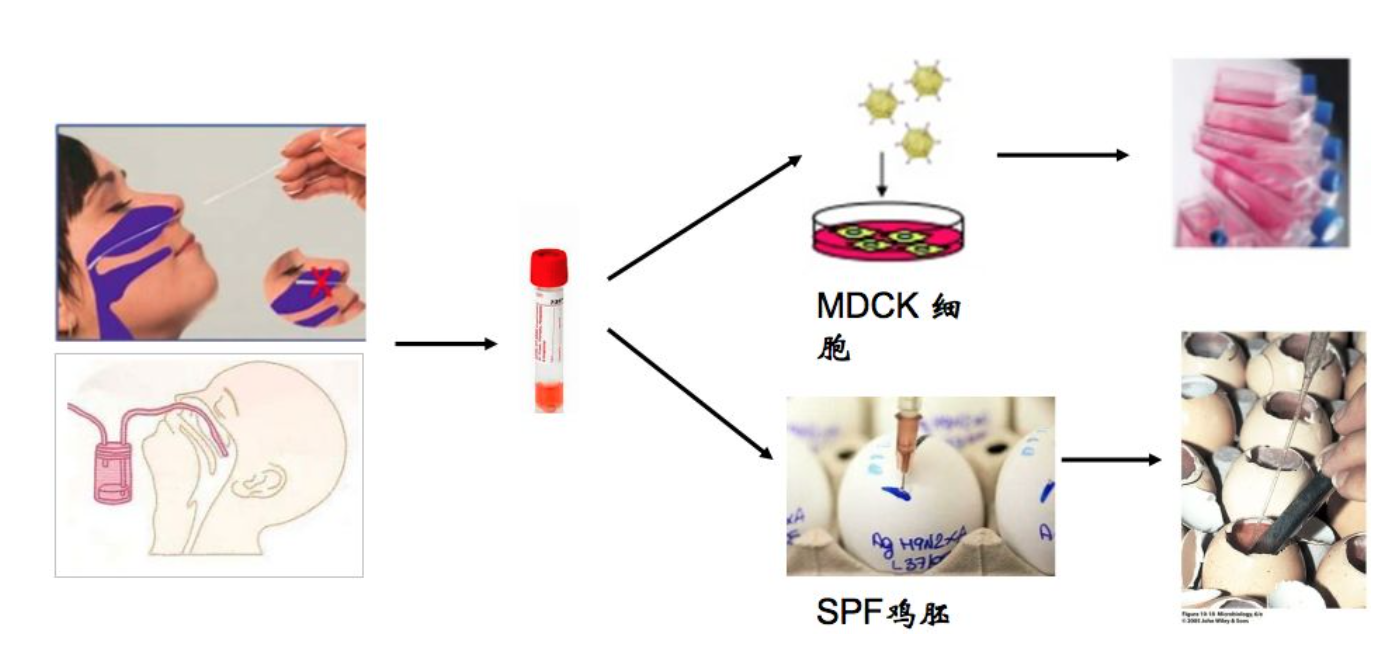
病毒培养一直是流感病毒鉴定的金标准,可以进行后续的抗原耐药监测实验。但是由于耗时费力(3-5天),并且对技术人员的要求相对来说较高,对环境要求也很高,所以在临床诊断中无法大规模使用。
二、免疫学方法
1、胶体金抗原检测
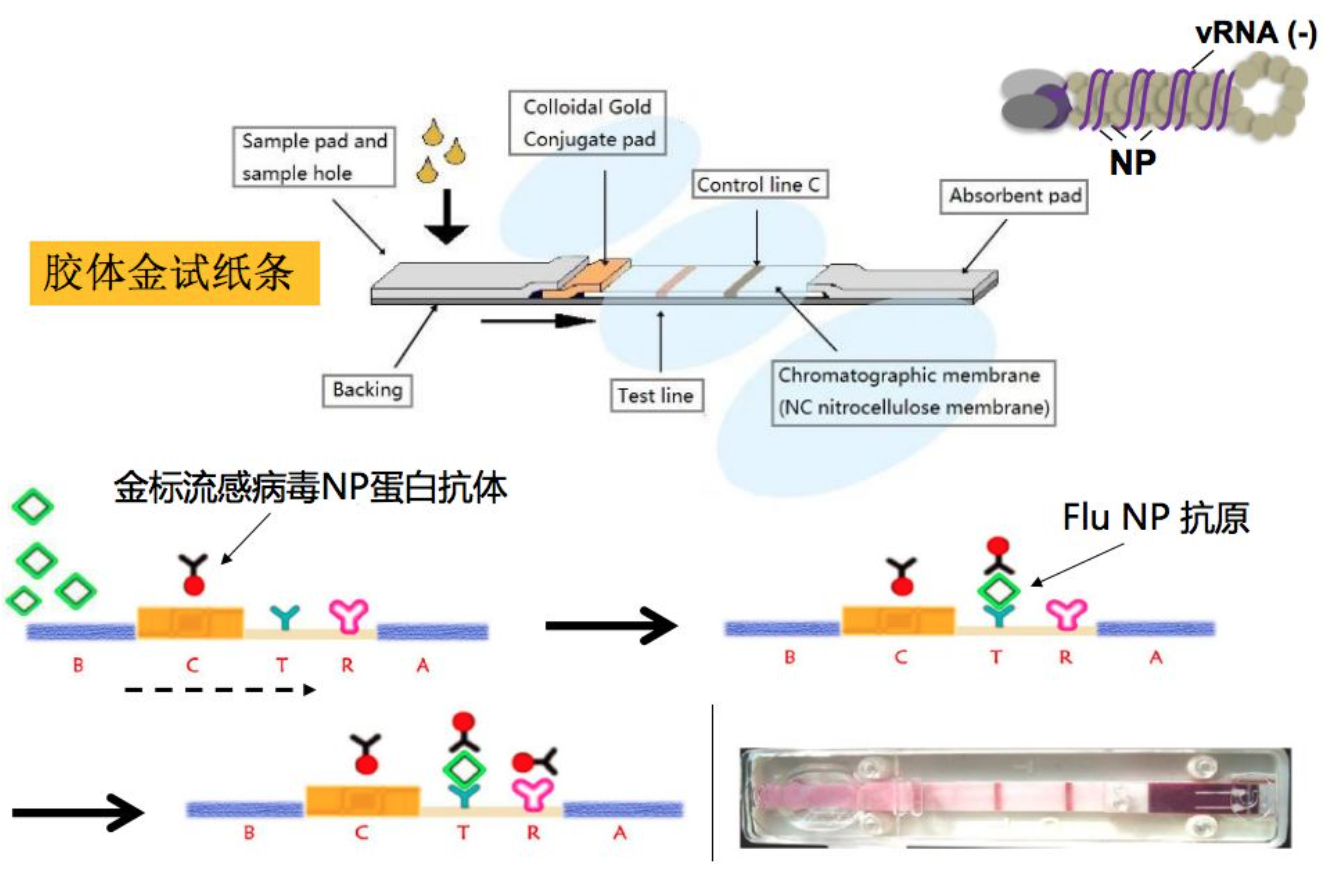
比较常用的是胶体金抗原检测,现在也有些试剂的厂家在做。胶体金抗原检测的原理很简单,胶体金即薄膜免疫层析技术,它利用具有高度敏感性的单克隆抗体来检测鼻咽拭子标本中的甲型和乙型流感病毒的,病毒核蛋白单克隆抗体连同一种对照抗体分别被固定到膜支持物上,形成三条独特的线。膜支持物跟其他试剂/垫结合在一起构成检测条。当样本中有流感病毒时,金标抗体将与病毒结核并被Test line的第二个抗体捕获形成肉眼可见的线,即为阳性。
这个方法速度快,10~15分钟即可得到结果,但准确性较低,不能作为病毒阴性的诊断标准。
胶体金法不能作为流感阴性确诊标准
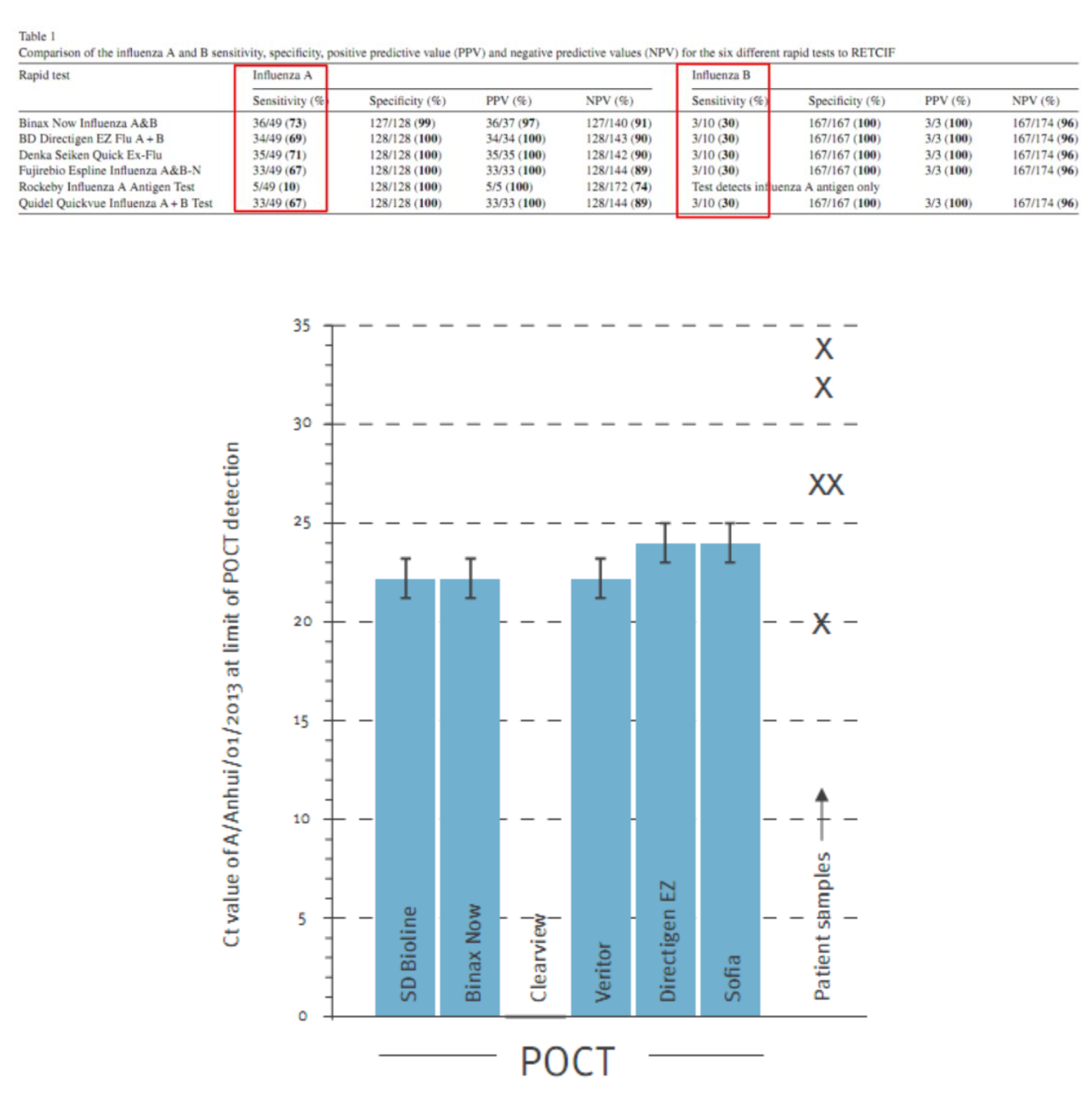
这篇文章汇总了六种不同快速检测方法对甲型和乙型流感的敏感性、特异性、阳性预测值(PPV)和阴性预测值(NPV)的比较。其中涉及不同厂家的品牌,这些品牌都会明确指出是针对甲流或乙流。在这些试剂盒里面,第5个试剂仅能检测甲型流感抗原,明确提出无法检测乙型流感抗原。但是目前所用的大部分检测方法都可以用于甲流和乙流。整个数据显示,敏感性相对来说没有特异性显示的数据好,特异性几乎都是100%,而敏感性最低为10%。因为第5个试剂只能检测甲流,无法检测乙流,所以就没办法统计乙流的敏感性。
总体而言,胶体金法时间短,15~30min出结果,阳性结果具有诊断意义。但是敏感度一般在40%-75%之间,在病毒载量较低时无法检测到目标病毒,检测阴性不能作为排除流感感染的诊断标准。胶体金方法的靶标是流感病毒NP和MP蛋白,可以确定病毒是甲型/乙型,但无法确定病毒的亚型。
2、血清抗体检测
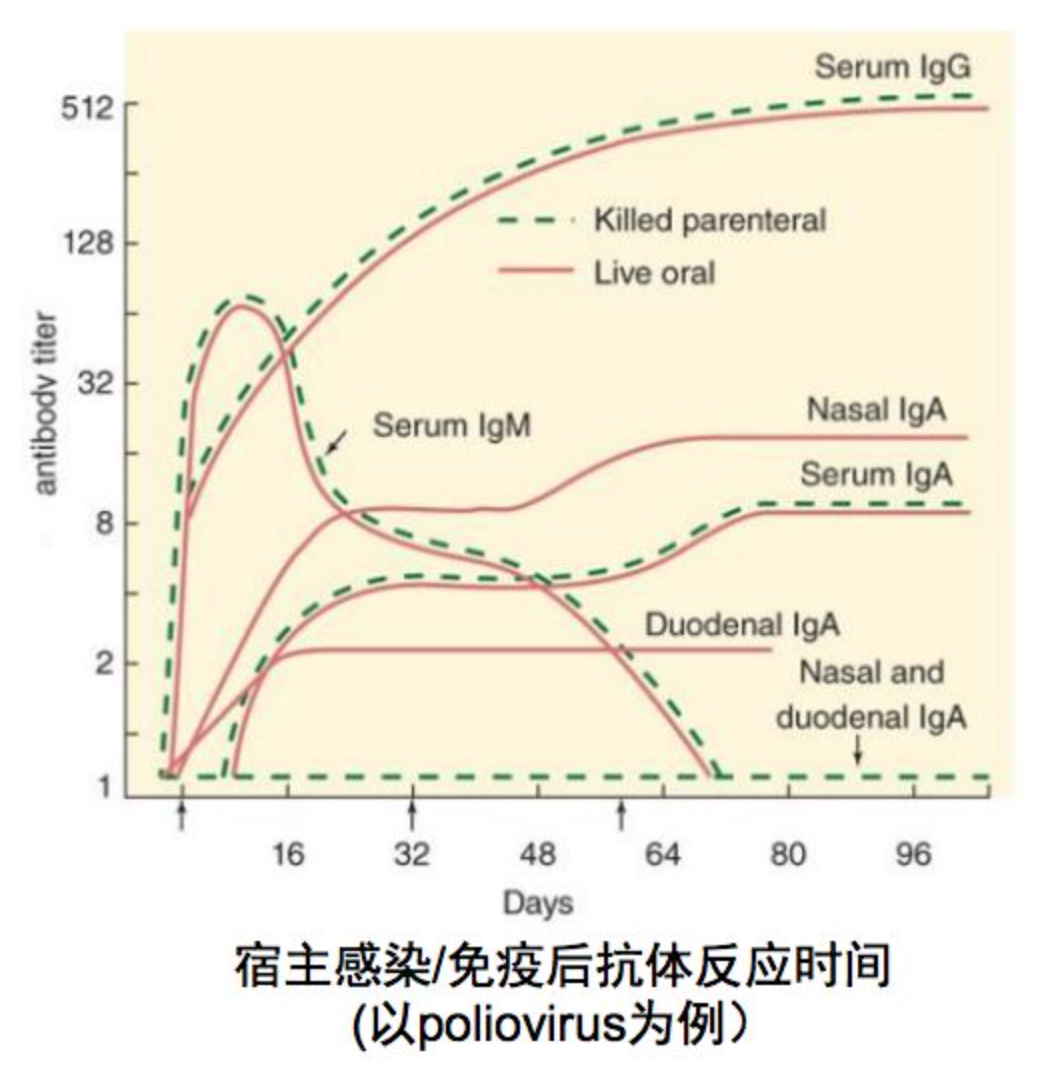
也有实验室使用血清抗体检测的方法,但是这个方法没有被指南推荐。图中显示的是在病毒感染后各种抗体IgM、IgA、IgG产生的时间,我们可以看到lgM产生时间最早,大约占到血清总抗体10%,同IgA一样可分泌到呼吸道粘膜,抵抗病毒侵入。而lgG抗体产生时间较晚,但持续时间较长,含量占到血清总抗体水平的70%。IgA是粘膜免疫的主要成员,主要分布在上呼吸道,是局部抗体,占10%左右的比例。目前,急性期和恢复期抗体水平4倍升高可作为诊断的金标准。
由于IgM的产生时间早于IgG,因此针对IgM的检测方法理论上可以尽快发现感染。而且IgM的持续时间短,高水平的IgM更有可能是当前感染产生的(而不是先前暴露产生的)。但单次的IgM检测仍然不能作为诊断的依据。
抗体检测在流感诊断上存在哪些不足?
抗体一般在患者恢复期才大量产生,恢复期抗体水平4倍升高才能明确诊断,时效性差。而流感病毒抗原性高度易变,很容易发生抗体/抗原不匹配而产生假阴性。不同流感型别之间还可能存在交叉反应,影响检测的特异性。并且,流感病毒人群感染率高,特别是季节性流感,大部分人群体内已存在较高水平的抗体,增加了结果判定的难度。如果免疫缺陷患者是流感感染的高风险人群,而这类患者的抗体产生不足,无法有效诊断。所以,目前抗体检测的方法还没有作为非常确证的一个依据。
三、分子诊断技术
分子诊断是指应用分子生物学方法检测患者/病原微生物遗传物质或表达水平的变化而做出诊断的技术。分子诊断是当前临床病原微生物诊断技术的前沿,是肺部感染诊断技术的发展方向。
• 特异性高:检测目标是核酸/基因,具有遗传稳定性。
• 灵敏度高:检测下限可达单拷贝水平。
• 适用范围广:适用于各种类型的样本。
• 操作简单:容易标准化,自动化。
分子诊断技术包括以下几种类型
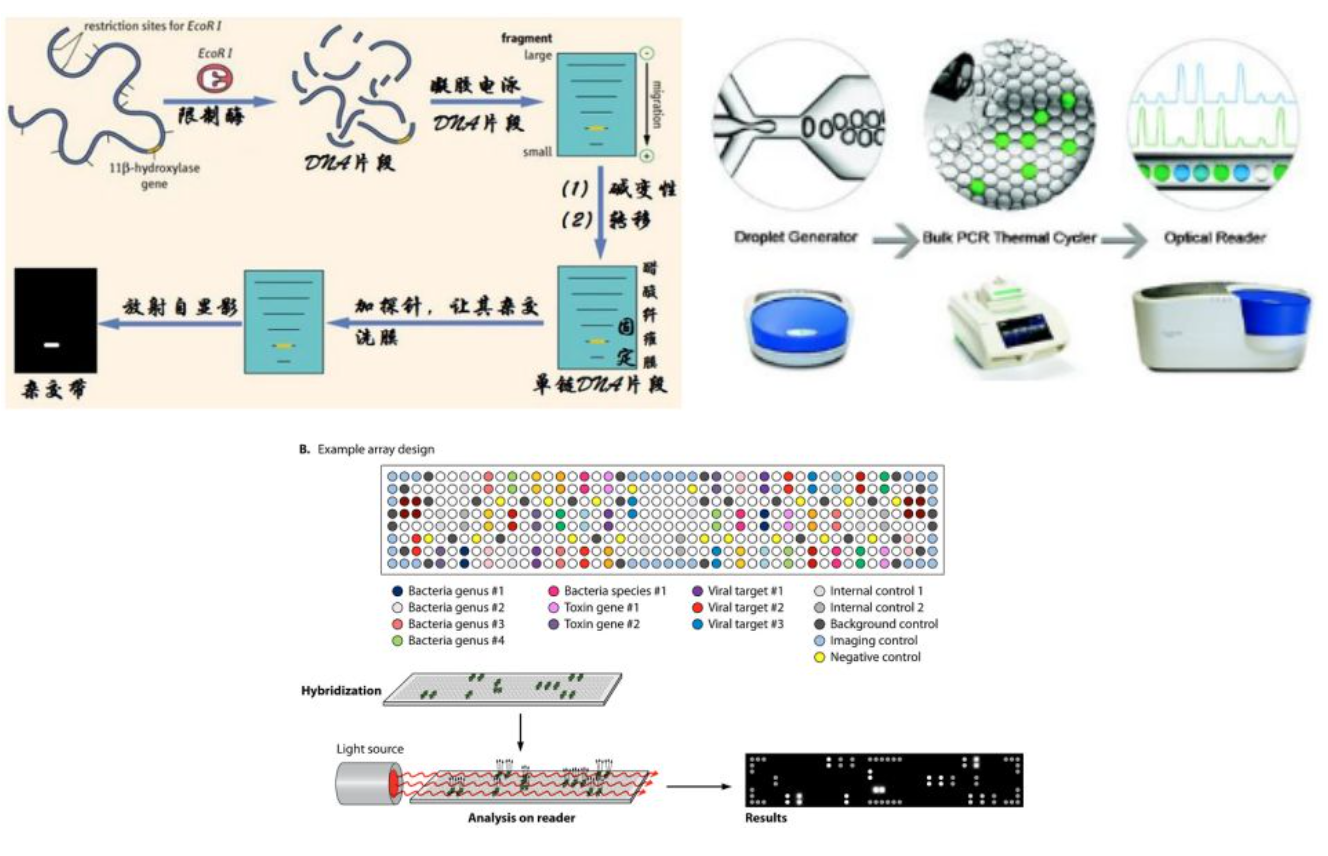
1)基于PCR的分子检测技术:荧光定量PCR技术、数字PCR技术。
2)基因芯片技术(可以多个病原同时覆盖):多病原检测。
3)DNA测序技术:Sanger一代测序、NGS技术。
4)CRISPR检测技术:对病原的诊断和位点突变的检测非常有前景的临床诊断的新型技术。
先了解一下荧光定量PCR技术
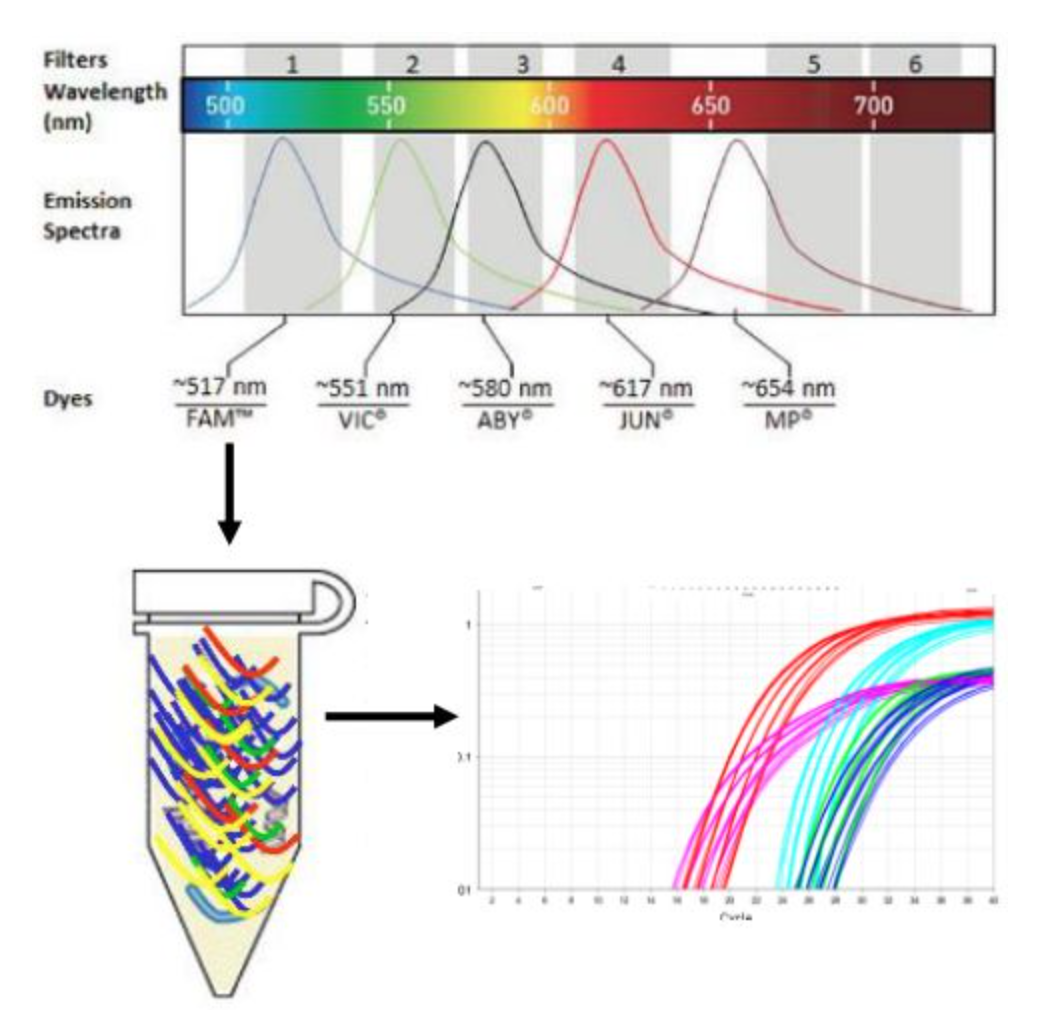
现在大多数实验室都在使用荧光定量PCR技术。一定要有荧光定量的PCR仪器,还牵扯到反转录的过程。每种病原采用一种颜色的探针进行标记,通过探针标记颜色区分病原。单管反应,通过检测到的荧光信号颜色确定目标病原。由于PCR荧光通道的限制,一般PCR仪最多检测6个通道(5种病原+1个质控)。
流感病毒亚型鉴定方法
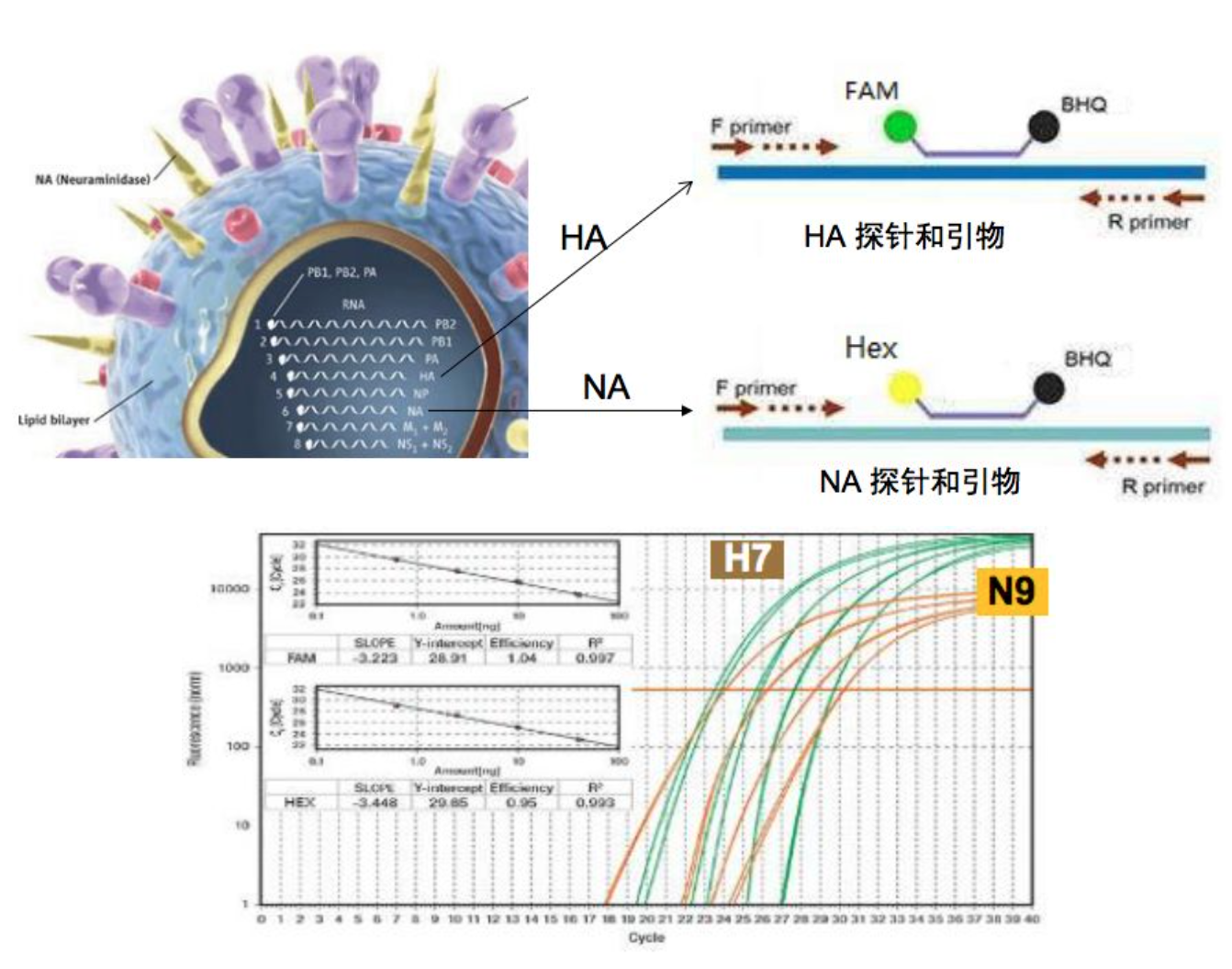
这个方法和探针有密切关系。分别设计HA和NA的引物和探针,分别用不同颜色的荧光标记。在一管反应中可同时检测HA和NA的亚型。
一个试剂盒的好坏要看探针所覆盖的亚型有多少种,这就要看说明书能覆盖多少种亚型。
模块化检测平台具有哪些特点?

这是列出的目前为止一些小型的模块化检测平台,有点像PoCT技术。GeneXpert技术是一个特别小型的机器,但它可以做很多检测,比如结核、艰难梭菌,近期获得国内注册证的是流感病毒的检测,可以同时检测甲流和乙流,不能具体分型,但是可以知道有无流感。直接拿标本放在试剂盒里,上机,30分钟就可以出结果。
FilmArray在国外使用的比较多,但是在国内还未拿到注册证。在上呼吸道感染测试中,大概覆盖了24种病原体,其中甲流和乙流能够做Ⅰ型和Ⅲ型。但是由于这24种病原体包括病毒和细菌,所以注册比较困难,现在国内还没有批准试剂盒。
这些模块化检测平台都是希望检测越来越简单、容易,不需要特别多的操作,操作相对来说方便快捷。
XpertFlu/RSV平台评估
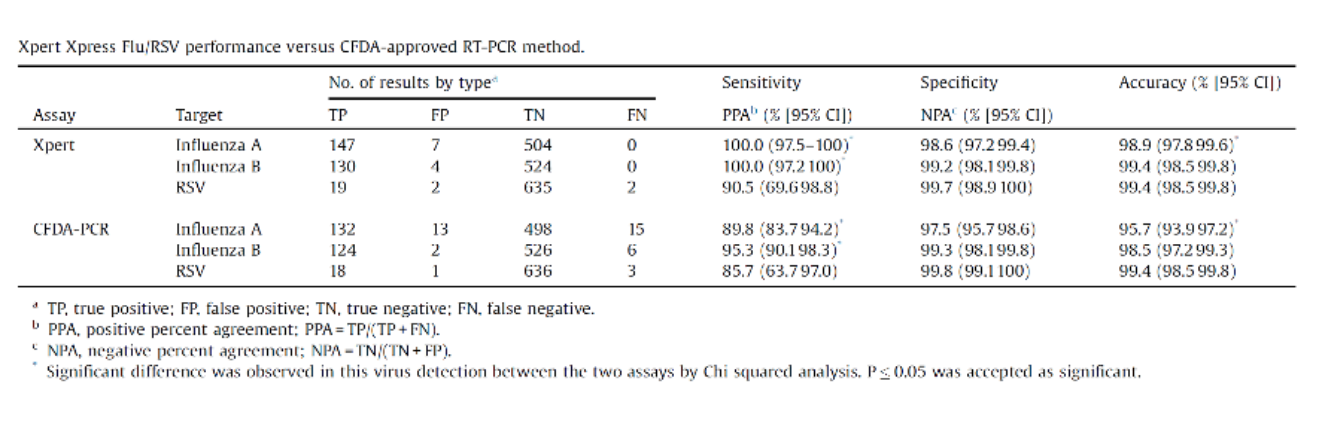
这是中日友好医院做的XpertFlu/RSV平台评估,发表在今年的《国际传染病杂志》上。这个技术可以同时检测FluA,FluB,RSV,运行时间<30min,所以评价不错。本团队评估了658份样本Xpert平台与CFDA批准的PCR检测结果的差异,并用WHO推荐的引物探针进行第三方验证,结果显示Xpert的敏感性和特异性整体高于CFDA批准的单重PCR方法。
Xpert® Xpress Flu/RSV平台
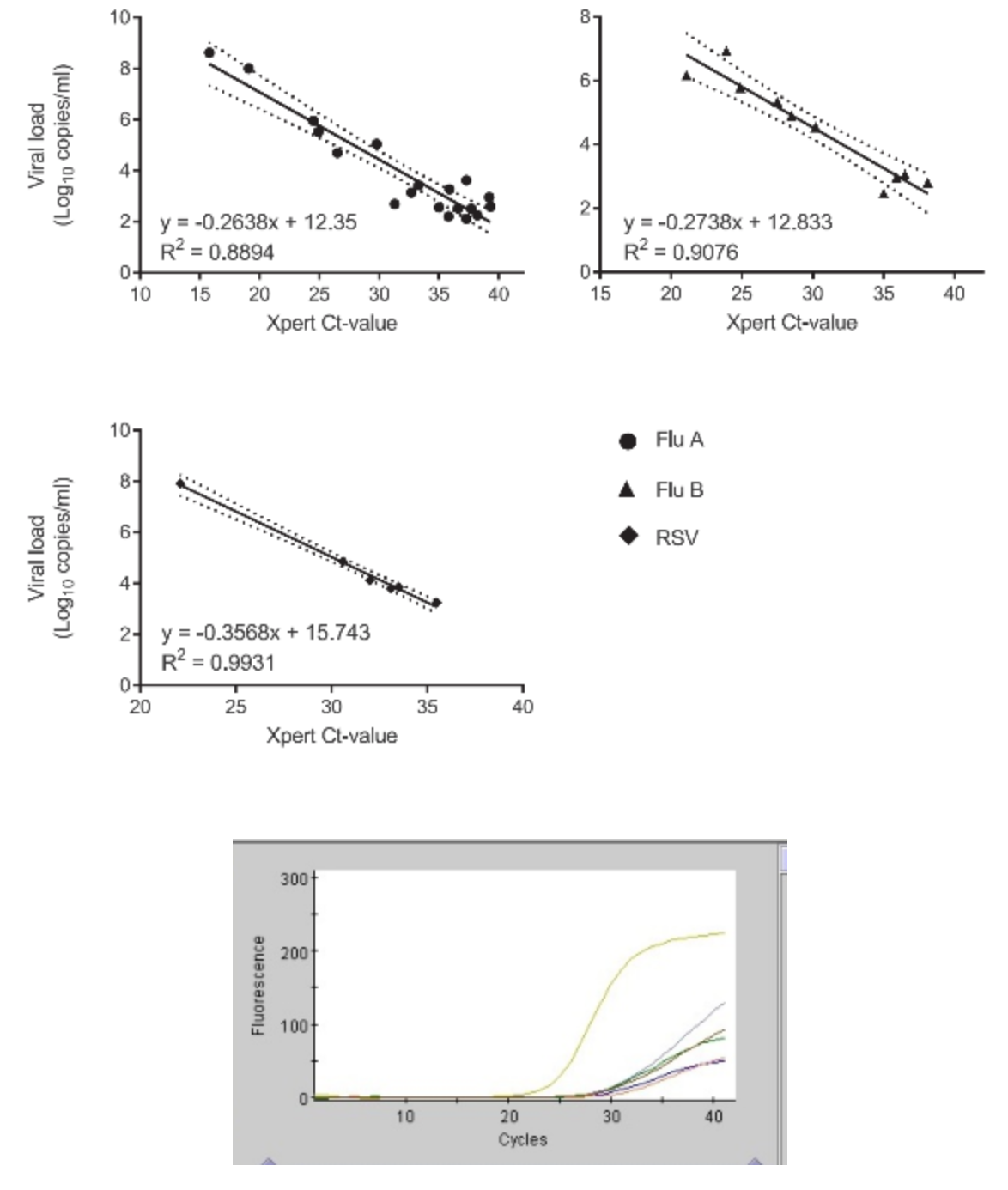
这个平台还可以看出Xpert报告的Ct值与样本中病毒载量呈正相关,可以用来评估样本中病毒载量。
总结一下流感检测技术
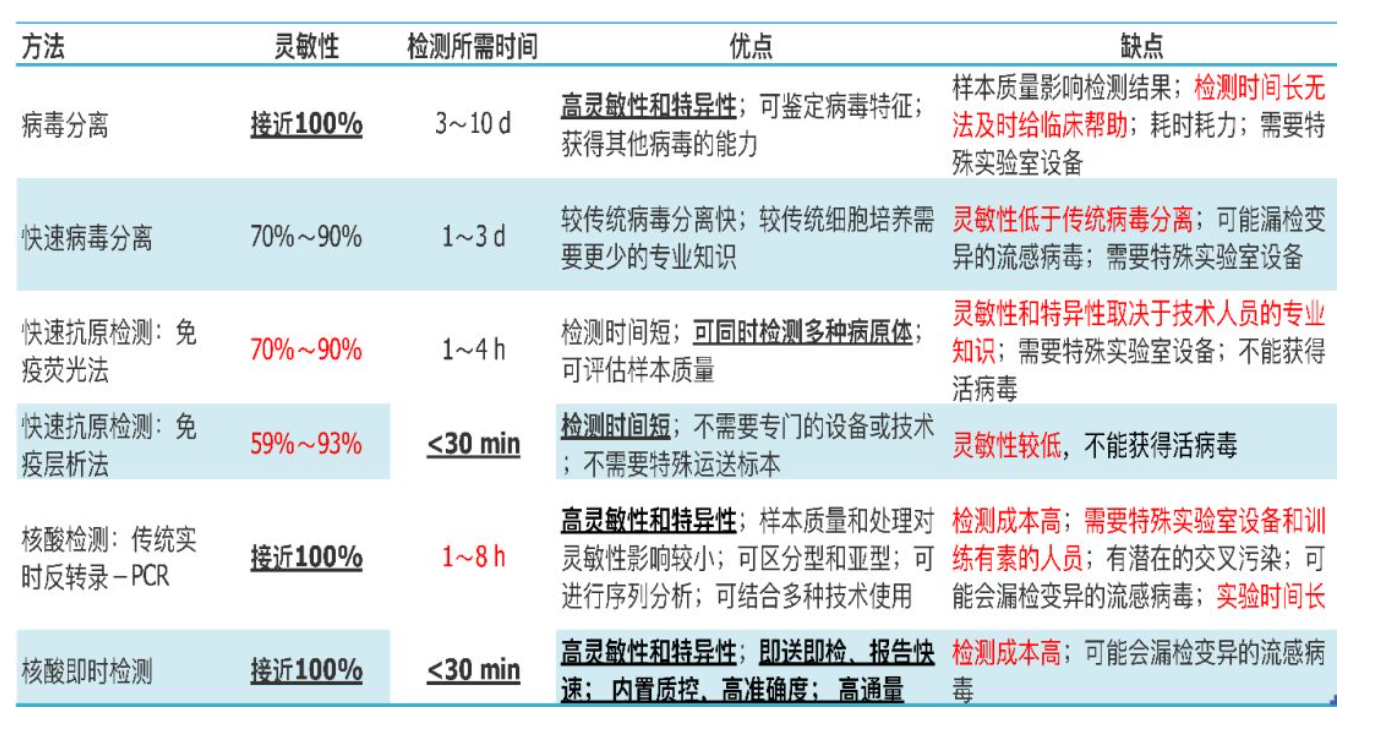
下面我们来看看季节性流感IDSA指南(2018)的相关内容
什么时候需要进行流感病毒检测?

指南中提到住院患者必检测,门急诊患者根据流感检测结果是否影响治疗而定*
这是在指南中具体提到的流感诊断方法推荐

门诊病人优先使用分子方法,而不是快速抗原诊断;
分子方法优先使用RT-PCR,提高流感检出率;
住院病人不应使用RIDT方法;
初诊病人不应使用病毒培养检测,结果无法及时给出;
流感诊断不应使用血清学检测。
英国卫生部(PHE)-赛沛试剂盒可作为Flu/RSV POCT技术
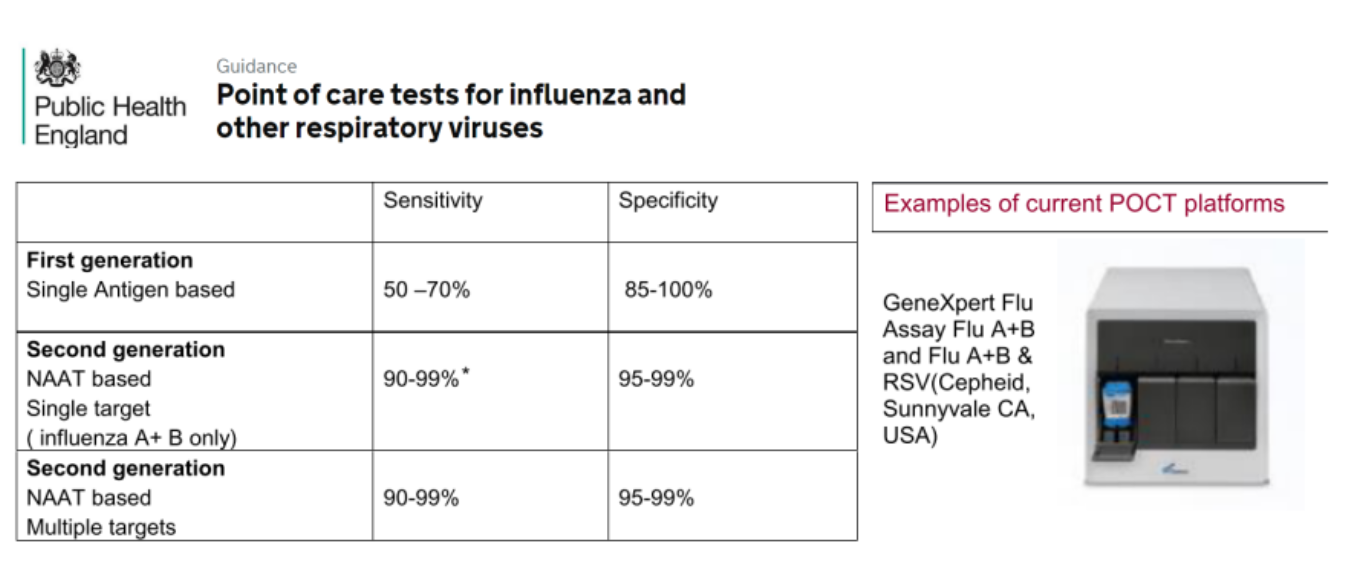
在欧洲,分子检测已成为第二代快检技术,快检不再只是抗原快速检测。赛沛Flu/RSV试剂盒被PHE引用作为分子POCT技术,具有更高灵敏度和特异性。
流行性感冒诊疗方案(2018年版修订版)


在诊疗方案里,大家可以看到,临床表现+分子诊断=确诊标准;临床表现+抗原检测=临床诊断,如果抗原检测是阴性,无法排除流感。
二代测序技术的优、缺点以及应用
为什么要采用二代测序技术?
成本低,可大批量进行流感病毒全基因组测序。无需对不同亚型病毒分别设计引物,使用通用引物即可获得所有亚型基因组序列。可同时检测低频突变并评估突变型和野生型的比例。获得病毒全基因组信息,方便后续的进化和流行病学分析。
流感病毒全基因组扩增策略
二代测序技术在流感的检测里,可以给出全基因组扩增的信息,不需要探针,因为引物是通用的,不需要涉及特定的引物。所以新的病毒、毒种、亚型的发现,都是靠全基因组测序来确定的。
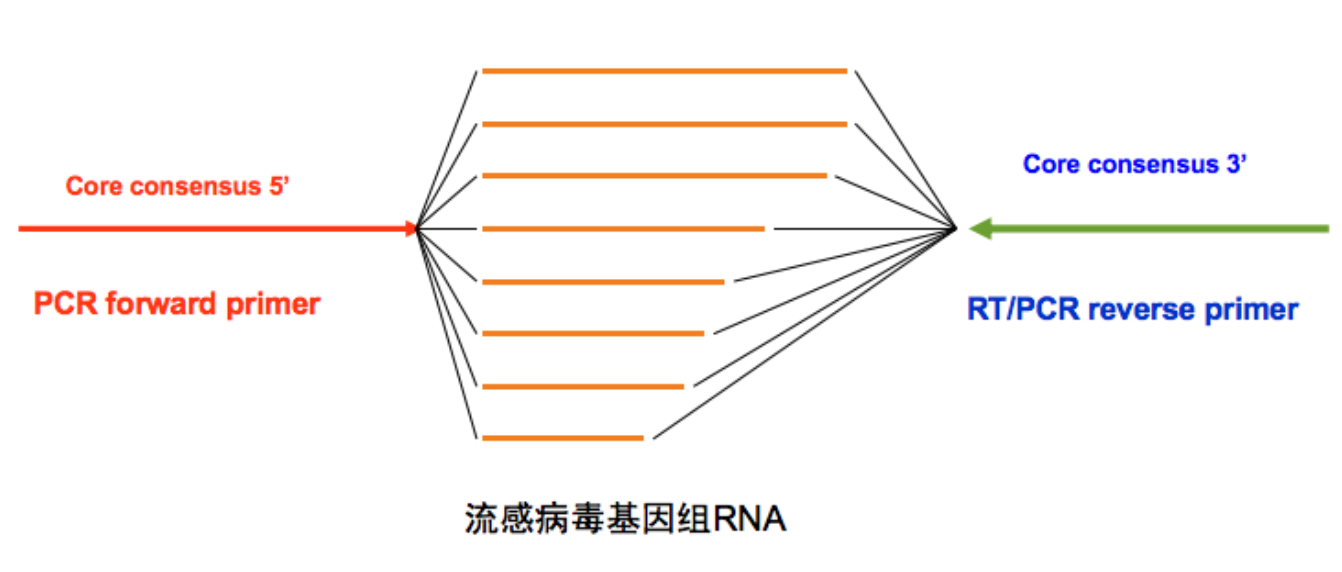
针对流感病毒基因组末端保守区,单管反应即可扩增病毒全基因组8条片段。
对各种甲型流感各种亚型均适用。
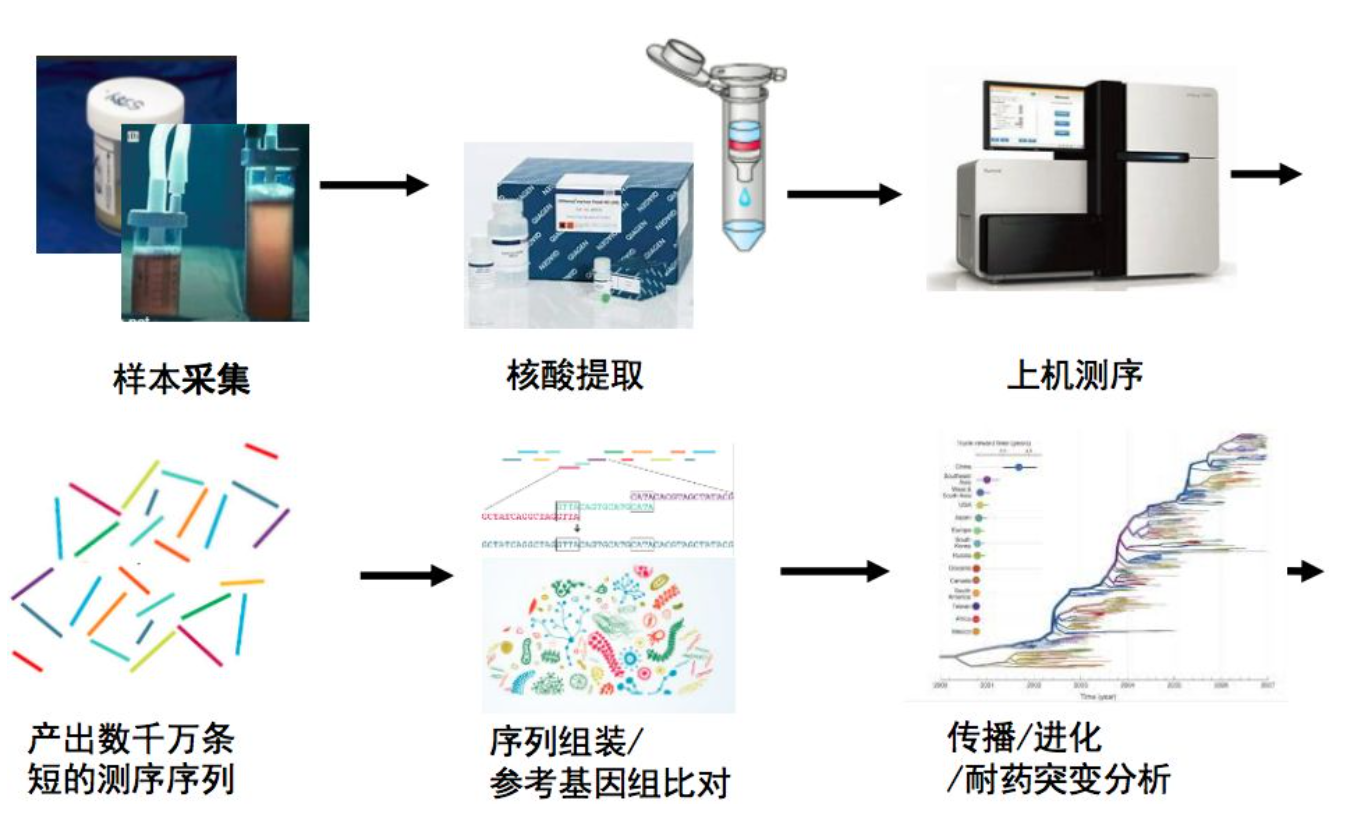
流感病毒二代测序流程
二代测序对H1N1耐药突变的动态监测
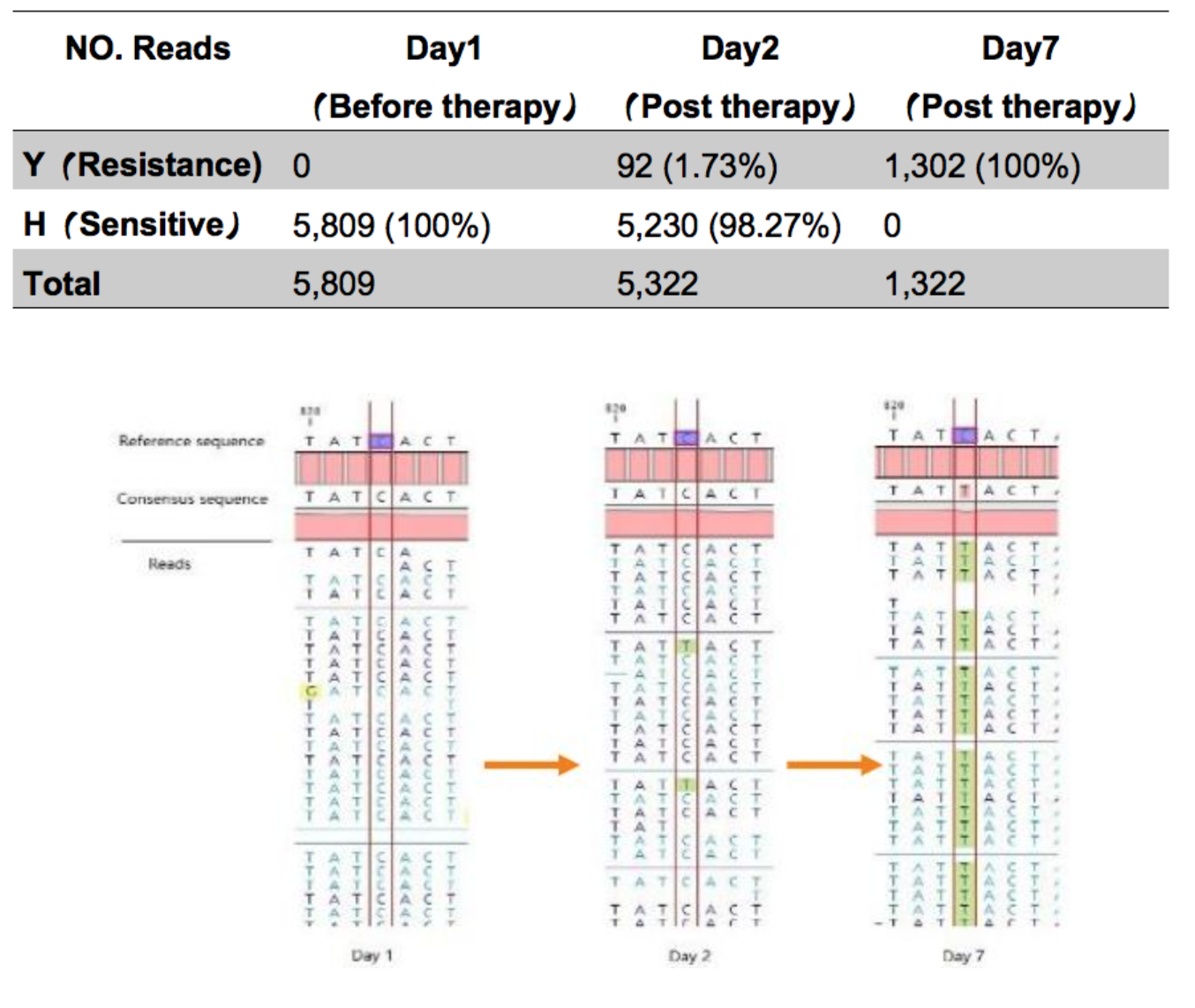
抗病毒治疗前无H274Y耐药突变。H274Y突变在抗病毒治疗后第2天出现并在第7天取代野生型病毒。在第7天的时候整个突变达到了70%以上,也就是说可以检测突变的频率。
二代测序对H7N9耐药位点的检测
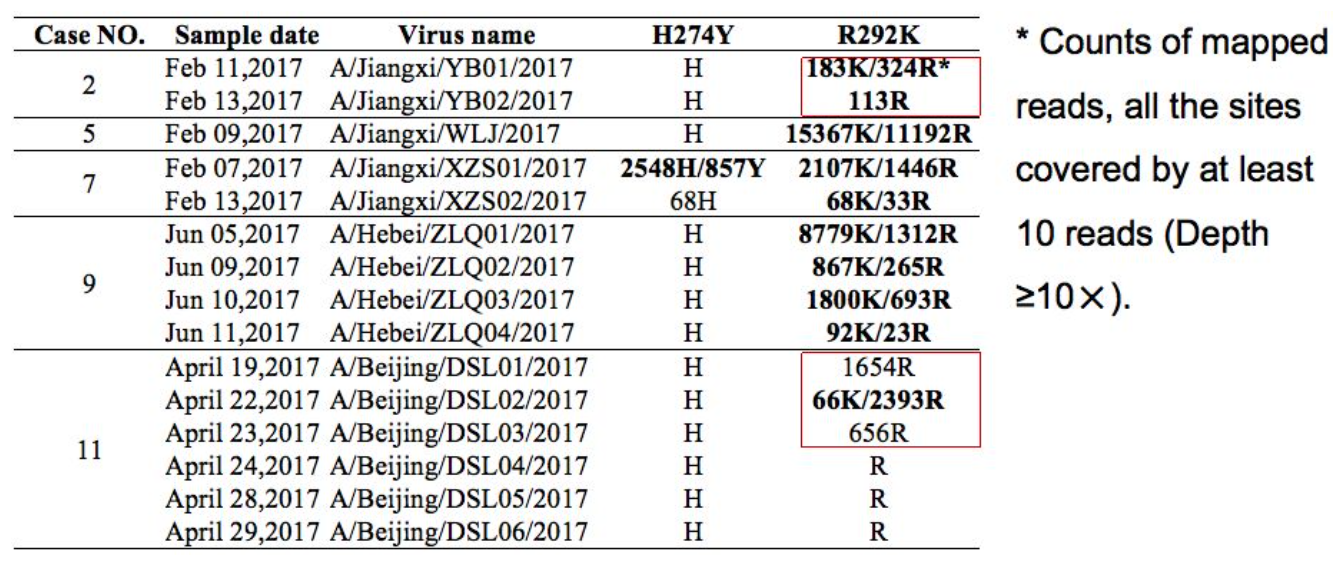
这也是中日医院曹彬团队做的一个研究。研究了二代测序技术对H7N9耐药位点的检测。其中有几个病例,我们可以看到,在治疗的过程中,一开始没有突变,后来出现突变,这样的过程需要使用二代测序技术进行追踪。
覆盖流感病毒所有已知的耐药位点:R118K,E119V,D151E,R152K,I222V,R224K,H274Y,E276D,R292K,N294S,and R371K,其中R292K突变最多。
H10N8新型禽流感病毒鉴定
这篇文章是对一个新的亚型,即H10N8新型禽流感病毒鉴定。刚才提到,如果对新型的、未知的流感的亚型,一定要使用测序技术进行确定。
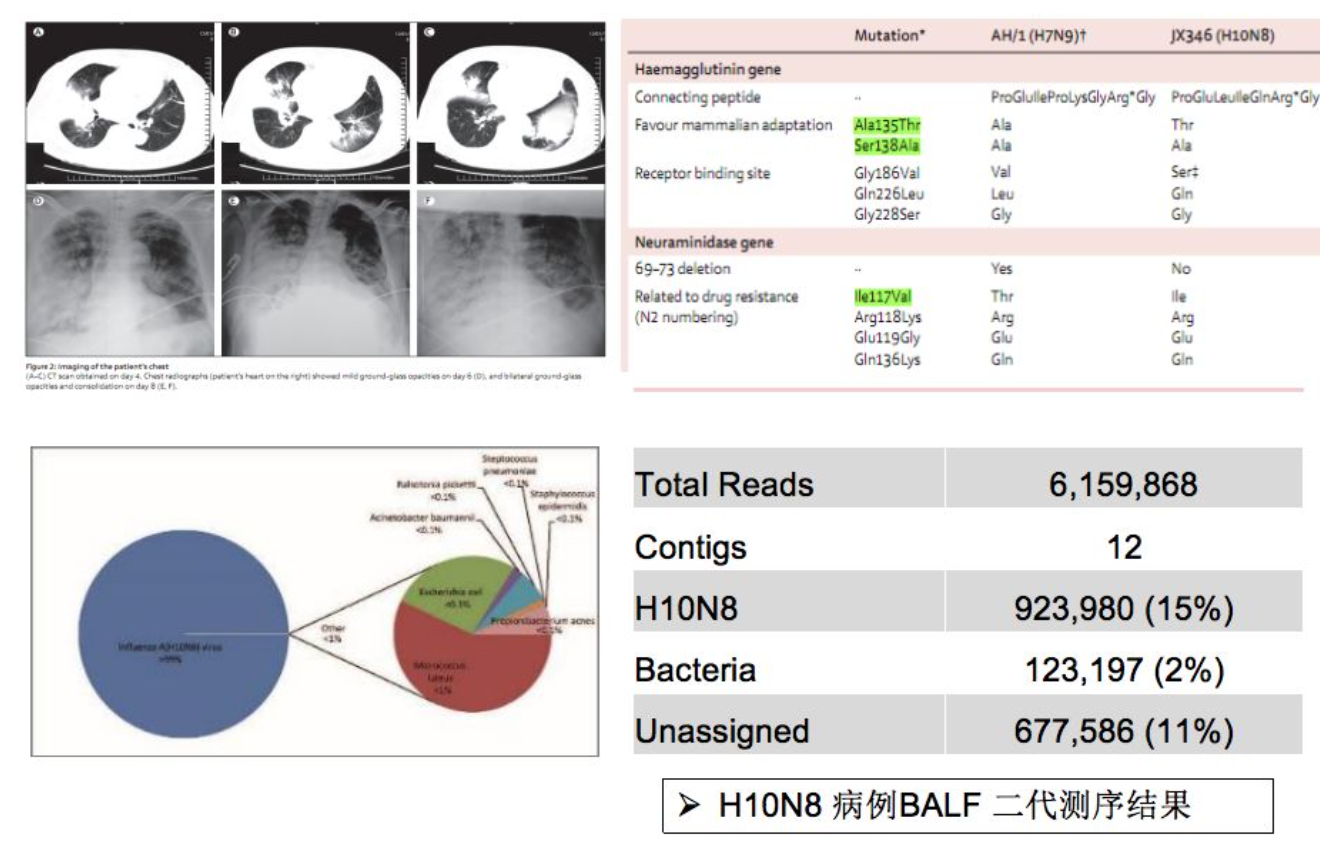
二代测序直接获得病毒的全基因组序列,并获得各关键位点突变信息。流感病毒序列占到非宿主序列的99%以上。
二代测序有什么缺点?
由于所有片段共用通用引物,容易导致基因组短的片段扩增加强,长片段扩增不足,覆盖率差异大;二代测序片段较短,无法获得长片段上的连锁突变(haplotype);PCR扩增可能引入假突变;运行时间长,从文库构建到数据产出需要36-48h,需要测序完成后数据才能下机使用。
三代测序:单分子实时测序
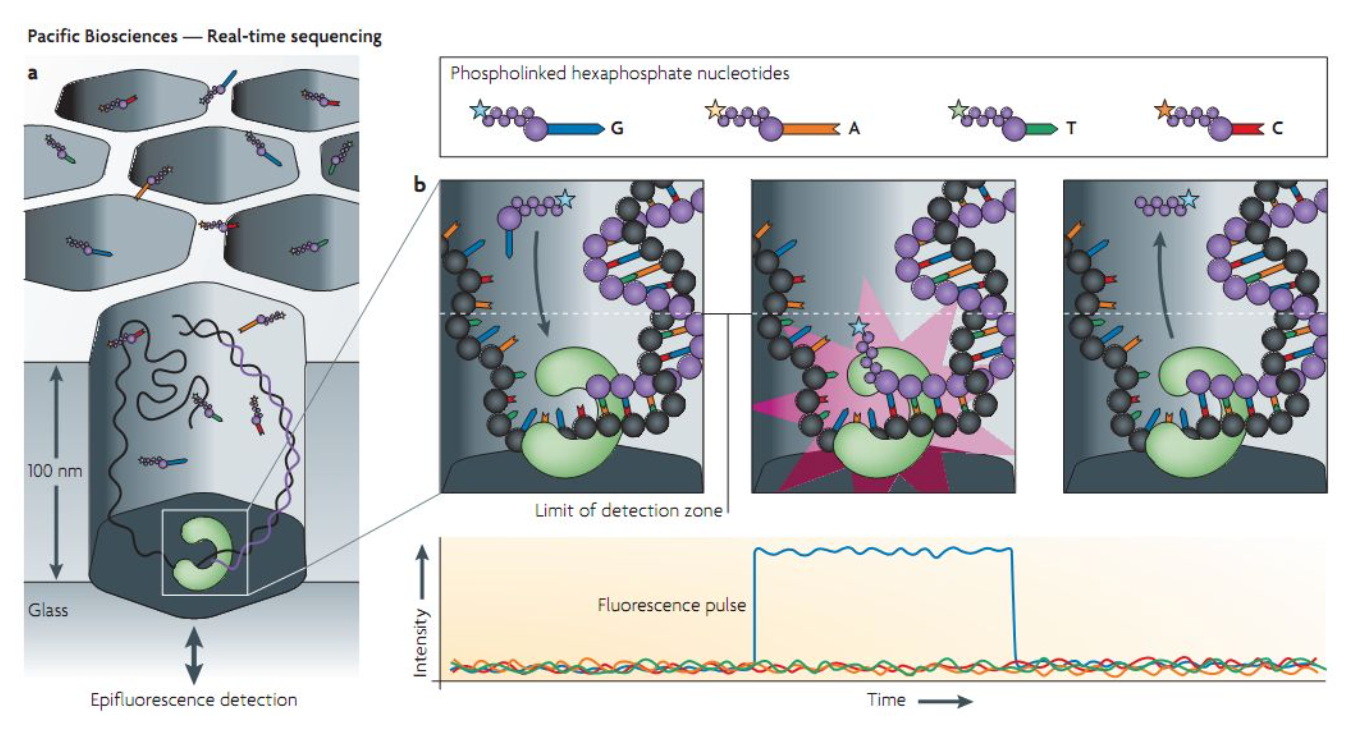

三代测序的基因组无需打断,提取的核酸直接测序。可以实现测序数据实时测序实时分析。并且,单条序列长,容易组装和后续分析。但是准确率低于二代测序。
三代纳米孔测序流感病毒
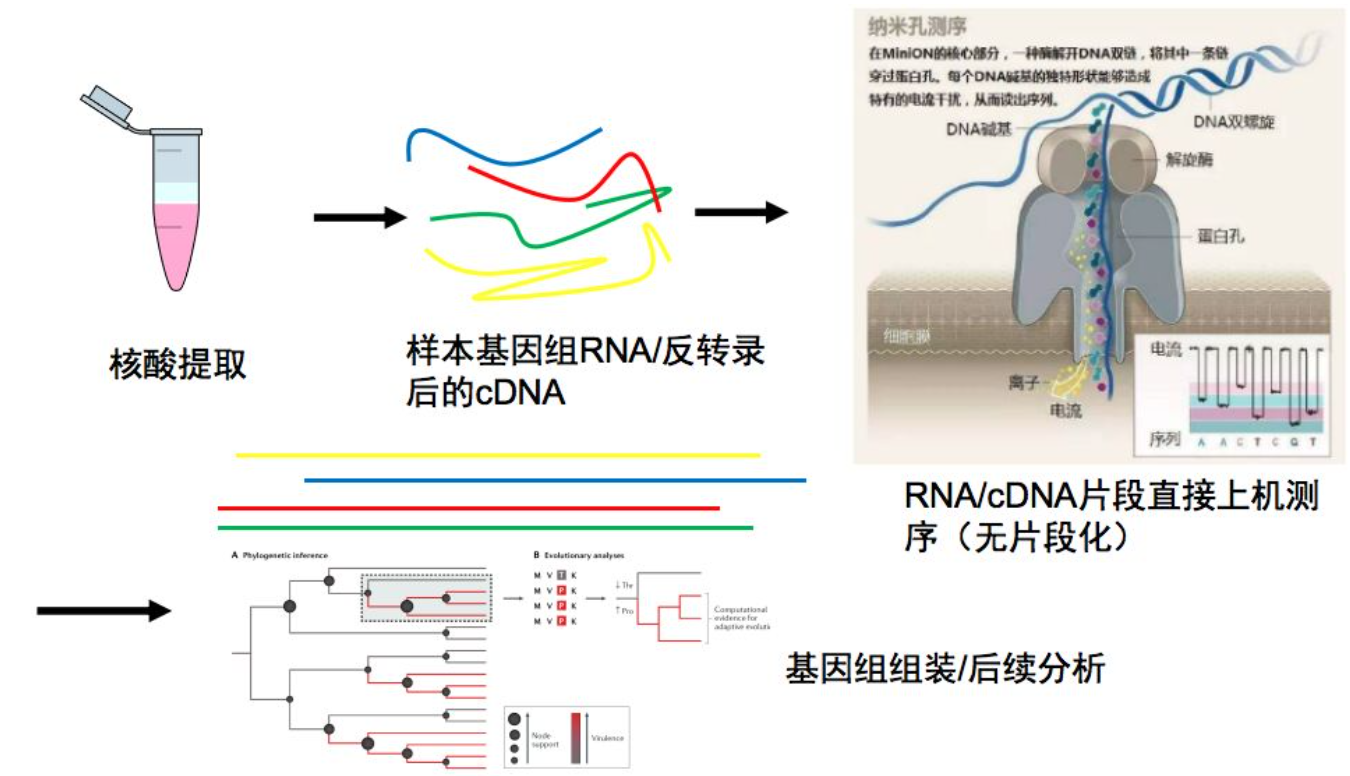
我认为三代纳米孔测序比较有前景。因为它可以实时读取结果,读到一定长度的时候就可以停止。可以直接进行RNA测序,因此样本无需RNA反转录成DNA然后测序。准确率有待提高(97%~99%)。
三代纳米孔结合SISPA等温扩增检测流感病毒

三代纳米孔直接测序流感病毒RNA
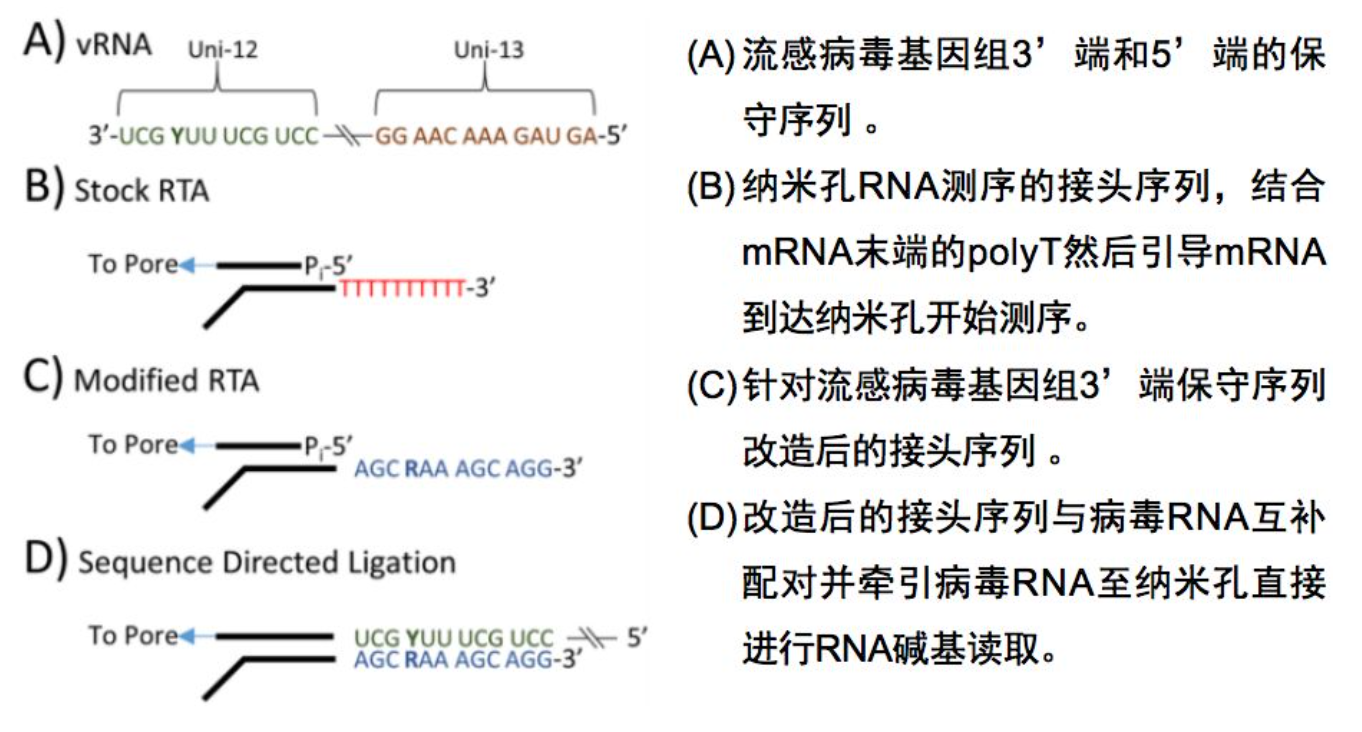
三代测序 VS 二代测序
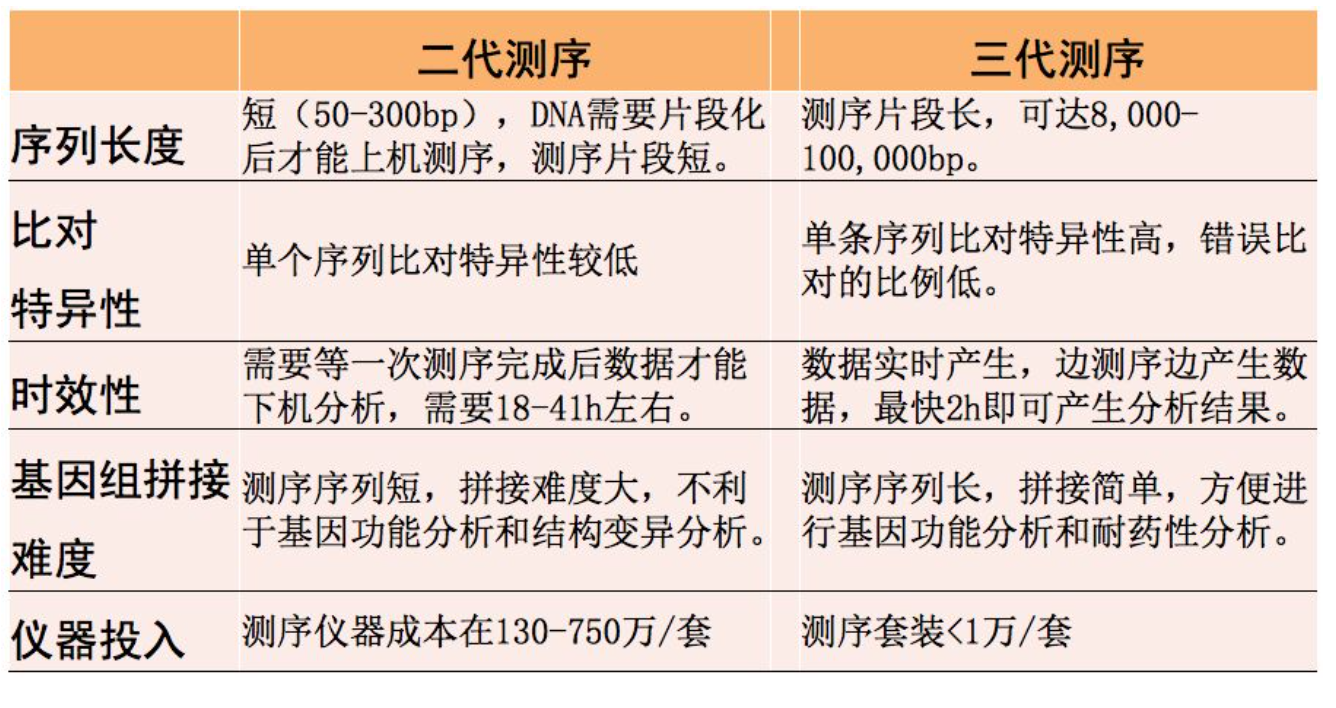
最后,总结一下二代测序与三代测序之间的差异。总体来说,二代测序读长较短,大概在50-300bp之间,而三代测序的读长可达8000-100,000bp。有关序列的特异性,二代测序的准确性可能会高一些,三代测序因为中间会引入一些错误,所以准确性要稍微差一些。从时效性来说,三代测序是对单分子进行测序,所以三代的测序技术相对来讲可以实时出结果,比二代测序要快。从仪器的投入来看,都比较贵。目前测一个宏基因组大概是3000多块的情况下,很多医院的医生都在送检标本去做检测,现在在各种论坛、ICU领域、呼吸领域中,都在谈论高通量测序技术,我们也希望未来对测序技术有一个正确合理的评价。
参考文献
[1]Robert G.Webster,et al.Textbook of influenza, 2nd edition. P236
[2]Baas C,et al. Euro Surveill.2013;18(21); Aeron C. et al. JCV. 39 (2007) 132–135
[3]Krammer F.. Nature Reviews Immunology, 2019: 1.
[4]Xiaohui Zou, et al. International Journal of Infectious Diseases 80 (2019) 92–97
[5]Catharine Paules, Kanta Subbarao, Influenza, The Lancet, Volume 390, Issue 10095, 2017, Pages 697-708
[6]Escobar-Zepeda, et al. Front Genet. 2015; 6: 348.
[7]Xiaohui Zou, et al. J Infect Dis, 2018
[8]Chen H Y, et al.The Lancet, 2014, 383(9918): 714-721.
[9]Michael.et al. Nat reviews.2010
[10]Lewandowski K, et al. bioRxiv, 2019: 676155.
[11]Keller, et al.Scientific reports8 (2018).
专家介绍
王辉

医学博士,博士生导师,教授,研究员。现任北京大学人民医院检验科主任,北京大学医学部检验学系主任,国家杰出青年基金获得者。作为亚洲唯一代表,担任美国临床和实验室标准化协会(CLSI)药敏折点制定工作组委员,担任亚洲耐药菌监测网(ANSORP)委员会常务委员、全球华人临床和感染病学会常务理事、中华医学会微生物学与免疫学分会常务委员、秘书长和临床微生物学组组长、中华医学会检验医学分会委员和临床微生物学组组长等。


