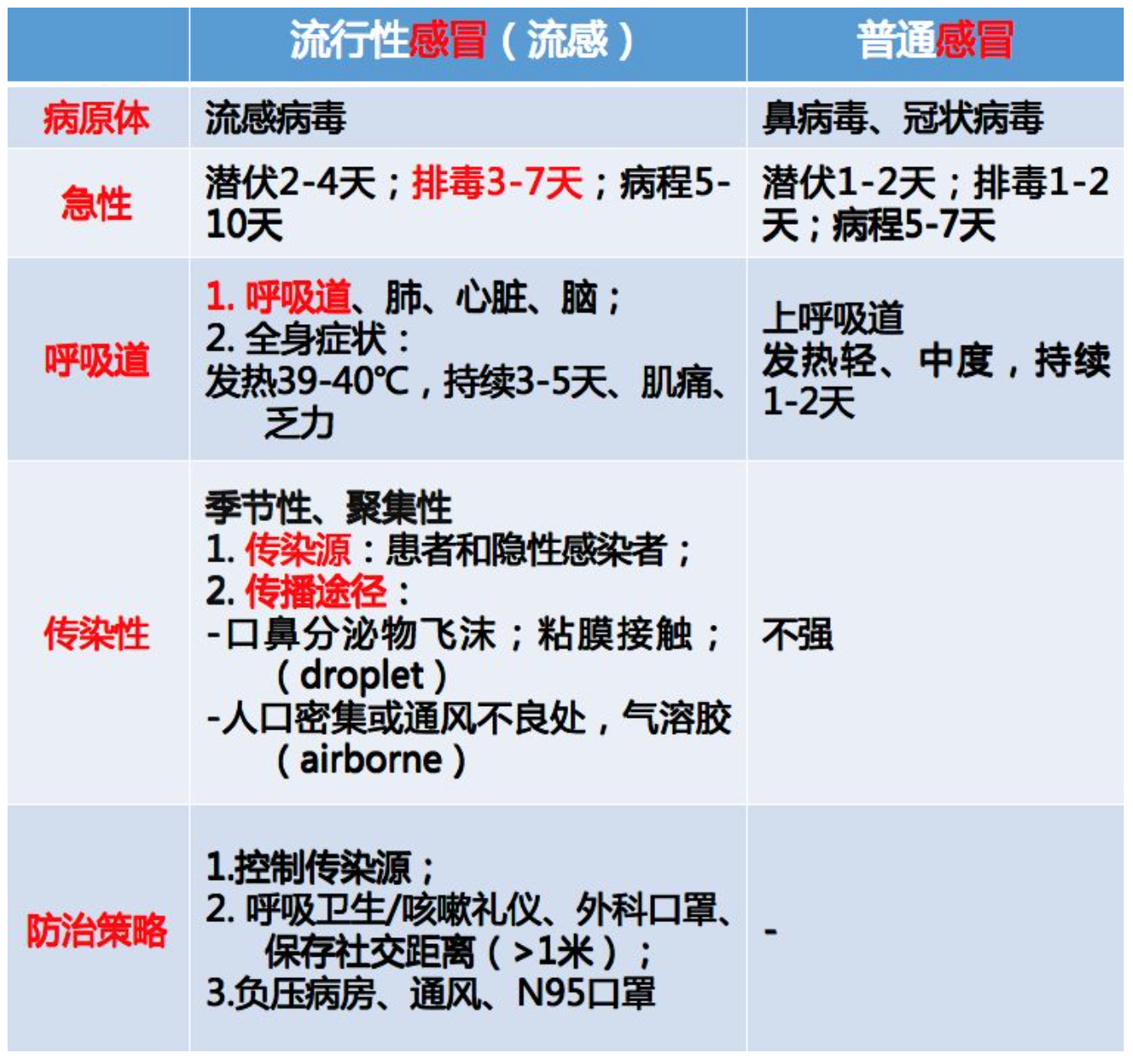
在临床上,感冒是一种最常见的疾病。感冒分为流行性感冒(即流感)和普通感冒。谈到流感大家一定深有感触,在每年的冬春季,伴随着临床大量的流感样病例的就诊以及工作负荷的增加,我们知道流感来了。
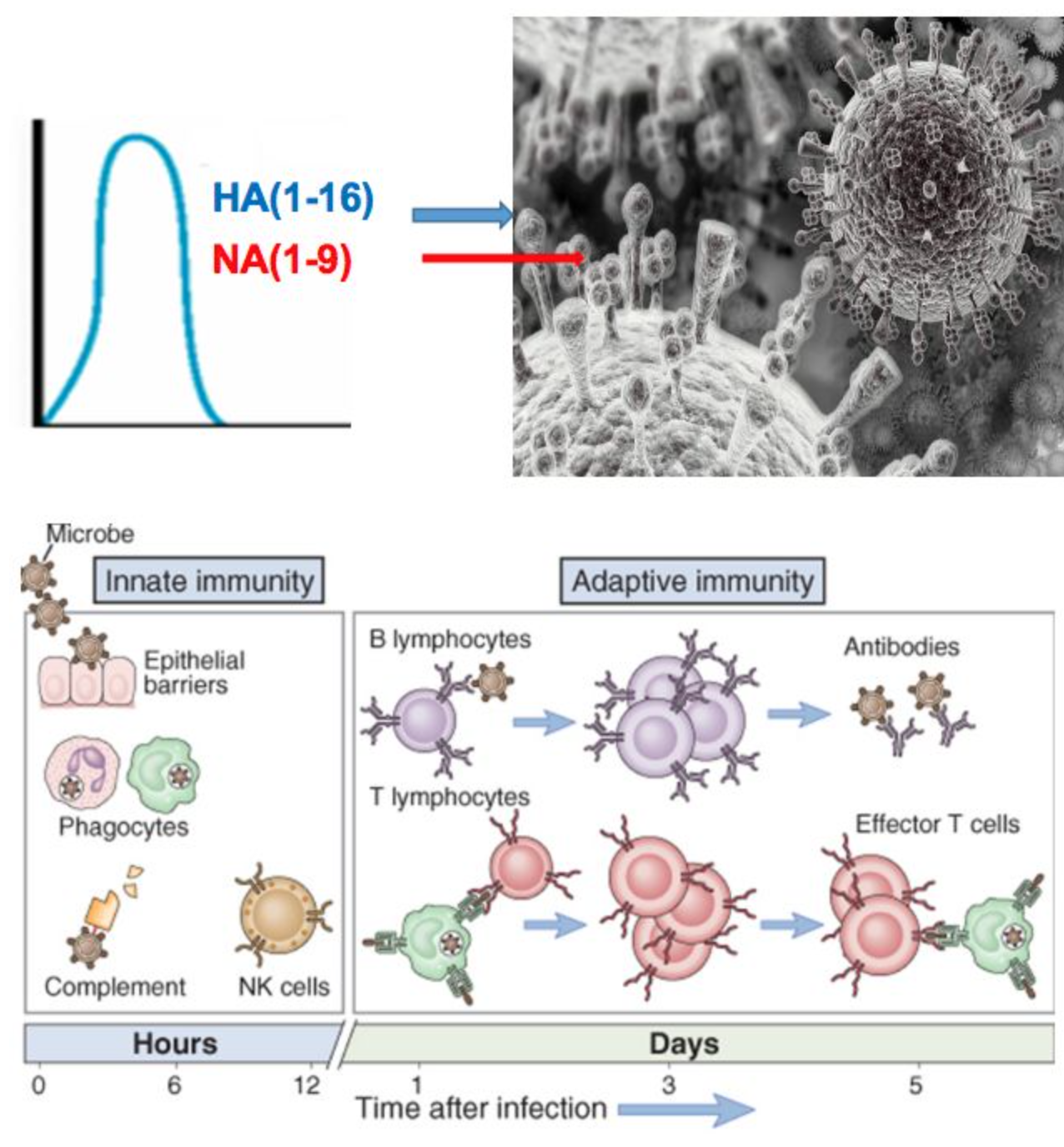
流感是急性呼吸道感染性疾病
从定义我们可以看到这五点信息。
第一,流感的病原体是流感病毒,非常明确。感染人的流感病毒主要是甲型流感病毒和乙型流感病毒,根据流感病毒表面的糖蛋白HA和NA又分为不同的亚型流感。A型流感主要有16种亚型,而B型流感感染人的主要是Bv By。
第二,流感是急性的感染性疾病。在机体接触病原体后,病原在机体潜伏2~4天,然后随着可以检测到病毒的核酸病毒颗粒,体内的病毒载量逐步升高,伴随着机体的免疫应答,病毒载量又迅速降低,所以排毒期为3~7天,而病程是5~10天。
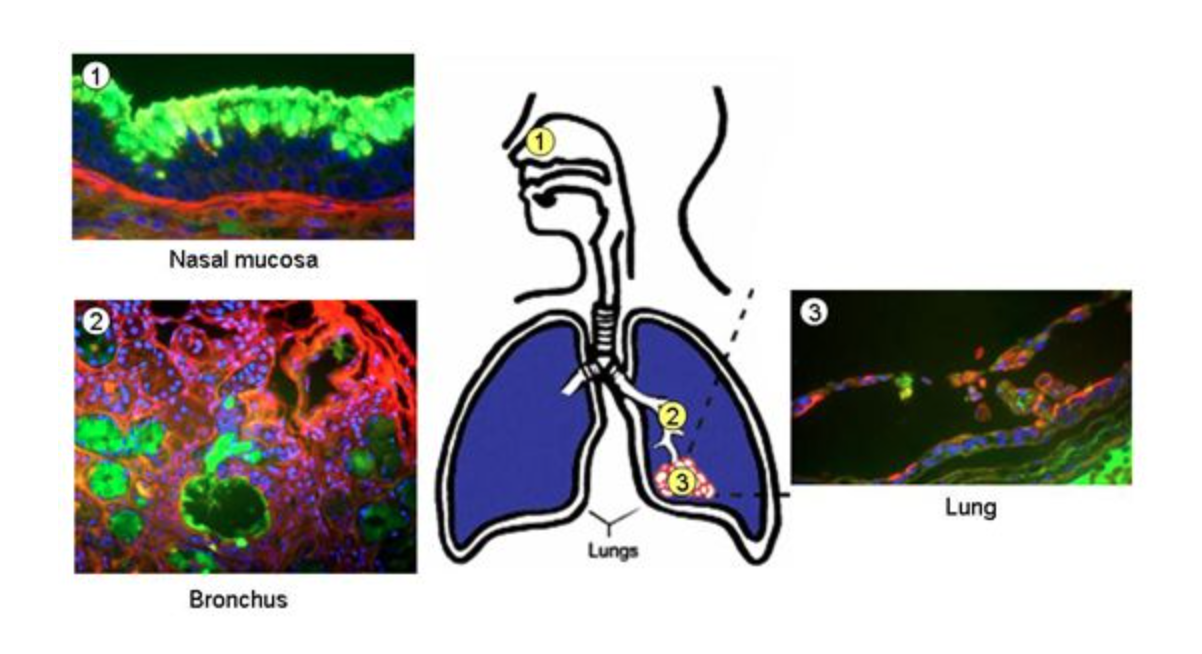
第三,流感感染的靶细胞主要是呼吸道的上皮细胞。当流感病毒感染呼吸道上皮细胞后,上皮细胞可以释放很多趋化因子,从而募集体内天然免疫的吞噬细胞以及NK细胞,这样大量的趋化因子以及炎性因子就可以介导全身的中毒症状,产生中高度的发热以及肌痛和乏力。
第四,流感病毒具有传染病基本要素。传染源是患者和隐性感染者,传播途径包括飞沫传播以及气溶胶介导的空气传播。
第五,对于流感这种传染病来说,它的防治策略非常明确。首先要控制传染源;其次针对飞沫可以保持社交距离以及物理隔离,从而控制携带病毒的口鼻分泌物污染;还有通过负压装置,可以将病原体集中在一个可以控制的区间内。
流感防治的重点是什么?
突发、重症、传播快、涉及范围广的流感是流感防治的重点。流感对人类的威胁主要有三种形式,包括季节性流感、流感大流行以及人感染动物流感病毒。
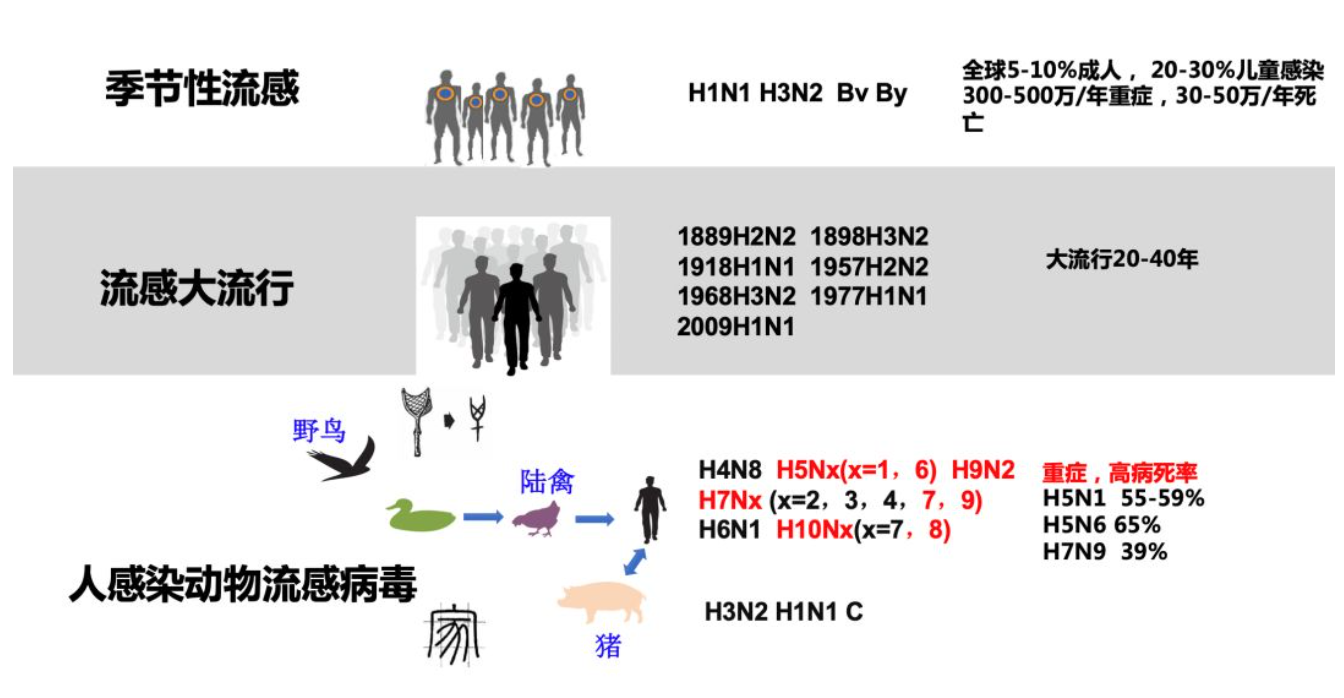
从这张图可以看到,流感病毒包括不同的型和亚型,特别是感染人的动物流感病毒主要是甲型流感病毒,丙型流感病毒也可以感染儿童。关于流感的防治,特别是临床中最主要的是有效降低流感造成的巨大的疾病负担,以及减轻临床的重症病例,降低病死率。
临床如何有效控制传染源?
临床有效控制传染源有这三点:及时发现、诊断病例、进行治疗,特别是对重症病例尽早抗病毒治疗。大家已经明确知道以下五类人群是容易发生合并症、重症的高危人群,所以是我们抗病毒治疗的靶向人群。
- 年龄<5岁的儿童(<2岁更易发生严重并发症);
- 年龄≥65岁的老年人;
- 伴有以下疾病:慢性呼吸系统疾病、心血管系统疾病、肾病、肝病、血液系统疾病、神经系统及神经肌肉疾病、代谢及内分泌系统疾病、恶性肿瘤、免疫功能低下或抑制;
- 肥胖者(BMI>30);
- 妊娠及围产期妇女。
抗流感病毒策略有哪些?
抗流感病毒的策略主要有两类,一类是靶向宿主,另一类是靶向病毒。靶向宿主包括疫苗、病毒受体、宿主因子。
靶向病毒主要分为免疫治疗(immunotherapy)和化学治疗(chemotherapy),化学治疗主要是利用一些小分子药物,靶向参与病毒感染、复制重要生命周期的重要的功能蛋白,如流感病毒的HA蛋白介导病毒的吸附过程,M2蛋白介导病毒的脱衣壳的过程,RNA依赖的RNA聚合酶(RdRps)介导病毒的复制,NA介导病毒从靶细胞脱落释放到组织间隙中。
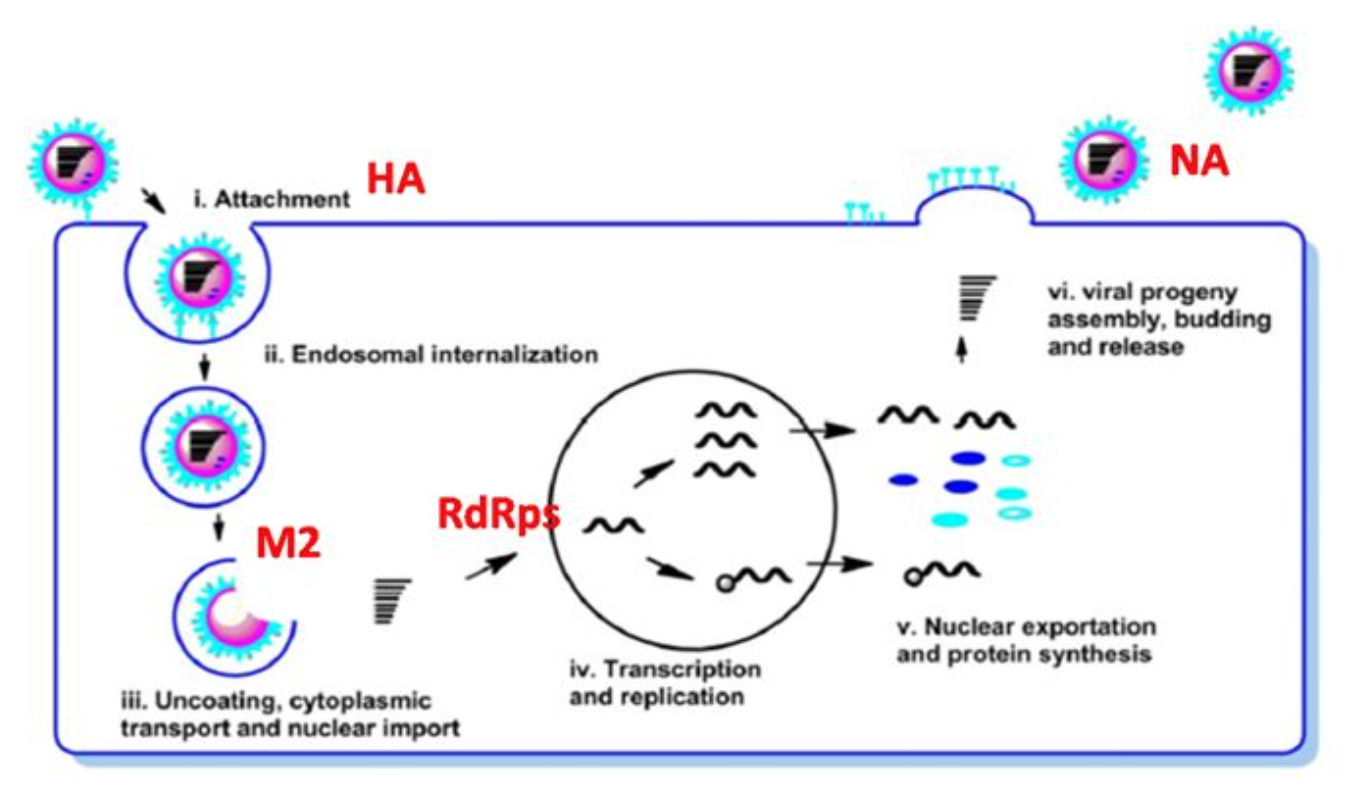
我们再来了解抗流感病毒药物
这是目前处于临床试验的抗流感病毒药物
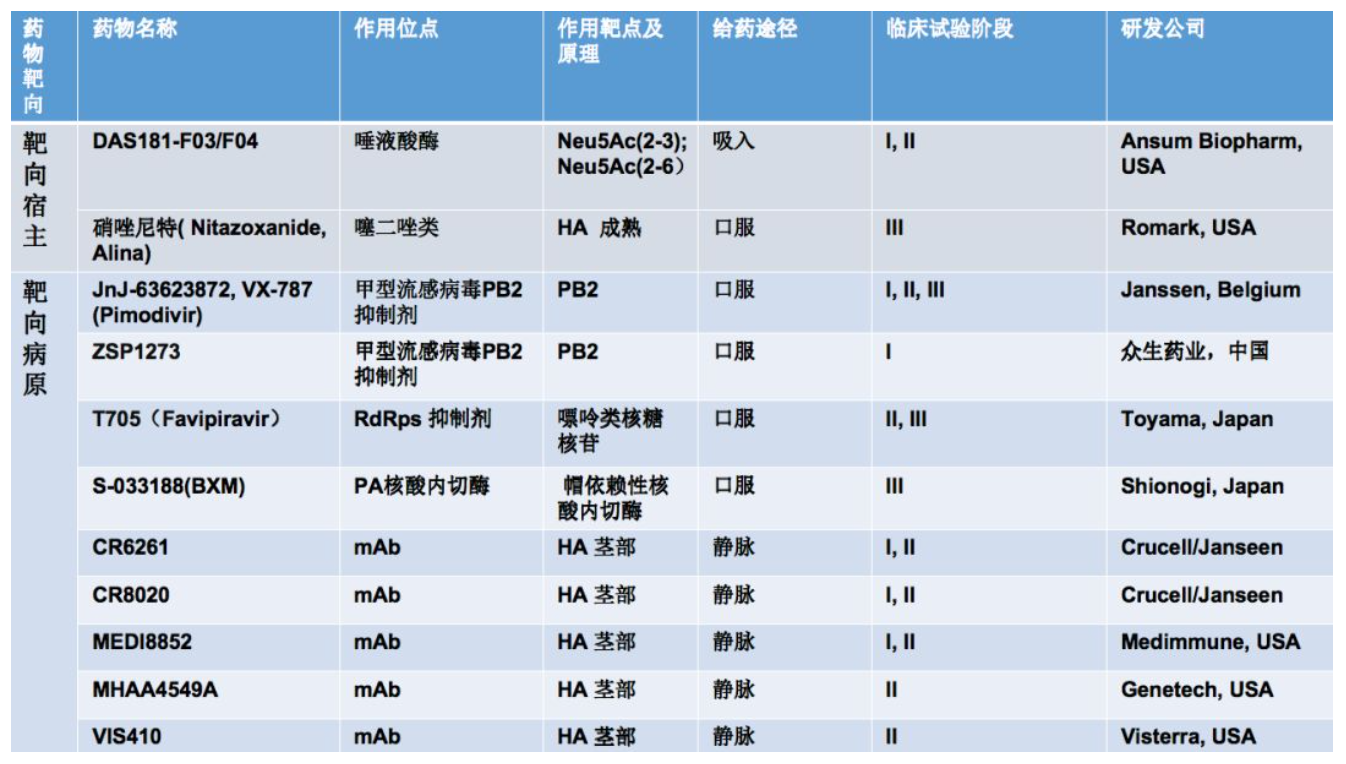
针对靶向宿主的药物主要有唾液酸酶以及抗寄生虫药物,这类药物可以抑制HA在宿主细胞的成熟。另一类主要是靶向病原,这类目前主要是集中抑制流感病毒的复制。还有一类是针对HA进步的广谱中和抗体。
这是临床已批准的三类药物
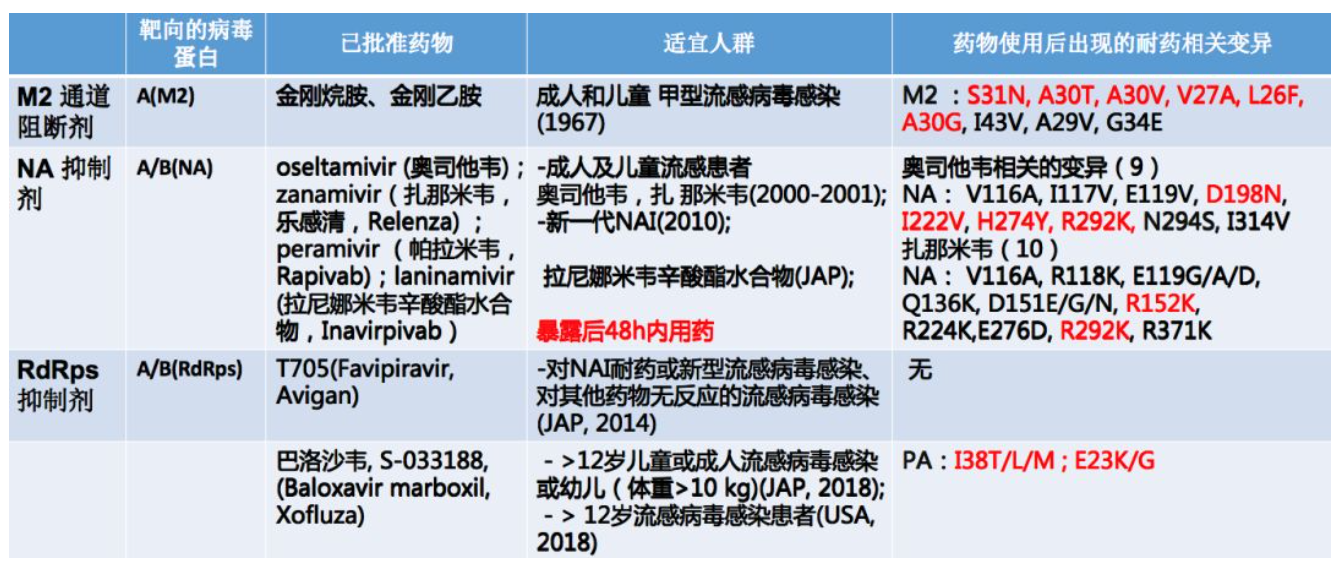
第一类是M2通道阻断剂,这类药物主要针对甲型流感M2蛋白的跨膜区,代表药物有金刚烷胺和金刚乙胺。在1967年就被批准适用于成人和儿童甲型流感病毒感染,但是随着跨膜区蛋白M2区域出现多个氨基酸位点的变异,它的耐药在甲型流感病毒非常广泛,所以目前不被推荐用于甲型流感病毒的治疗。
第二类是NA抑制剂,也是目前应用最广泛的药物。主要针对甲型以及乙型流感病毒的NA蛋白,包括奥司他韦、扎那米韦、帕拉米韦、拉尼娜米韦这四种药物,前三种药物在我国临床是被批准使用的。它的重点就是在暴露后48小时内用药,儿童甚至可以提前到36小时内。有关奥司他韦以及扎那米韦跟药物耐药的变异位点有D198N,I222V,H274Y,R292K,R152K,R292K,这是临床标本中常发现的变异。
第三类就是RdRps抑制剂,这是最新的针对病毒复制的药物。主要针对甲型和乙型流感病毒,包括核苷酸类似物T705,这类药物主要在日本被批准使用;还有巴洛沙韦,巴洛沙韦已经在日本和美国被批准使用了。在临床标本中发现使用巴洛沙韦之后,可以在PA蛋白38位和23位出现变异。
HA/NA在流感病毒生命周期中的作用
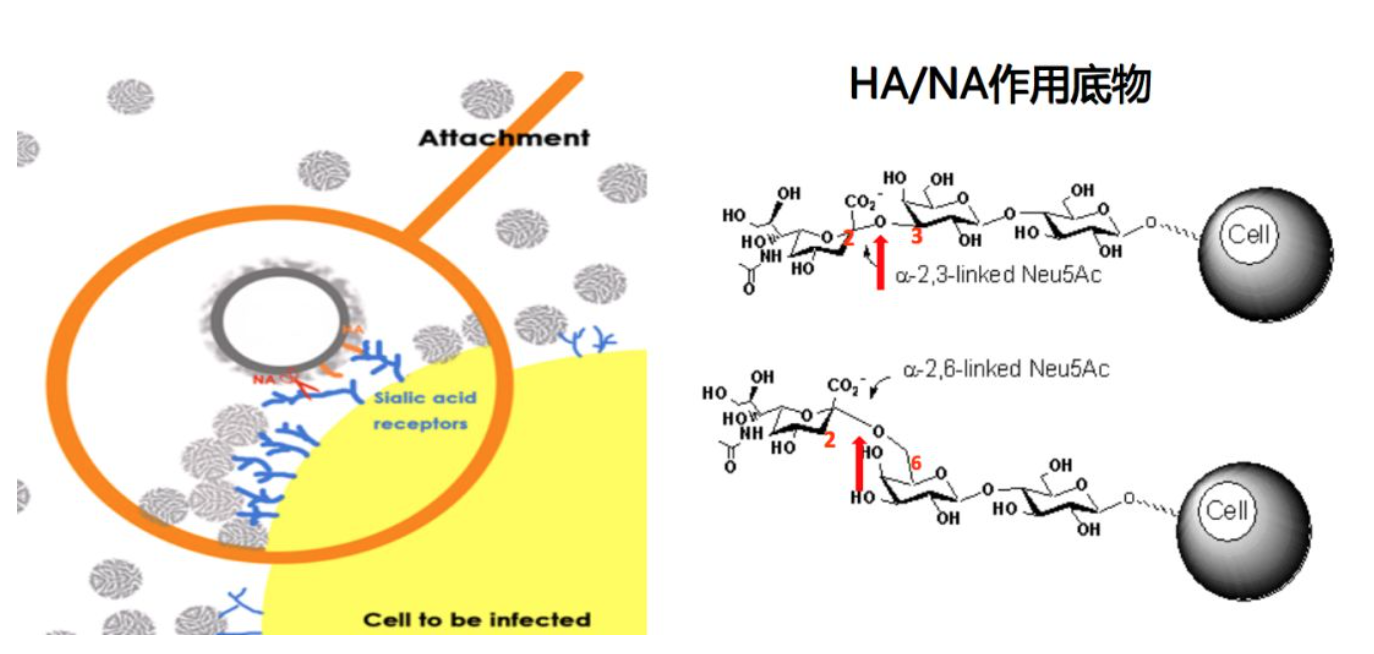
HA和NA是流感病毒重要的功能蛋白,HA主要是识别靶细胞上的唾液酸受体。从图中看出,唾液酸受体在糖受体的最外端,它是由9个碳原子组成的唾液酸,第二个糖是半乳糖。我们常说的2,3连接和2,6连接就是指唾液酸第2位碳原子和半乳糖之间的连接,NA切割位点也是这一个。所以说HA和NA的功能是平衡作用,当NA酶活降低时,HA对唾液酸的亲和力也会降低。
这是临床上已批准使用的神经氨酸酶抑制剂(NAI)
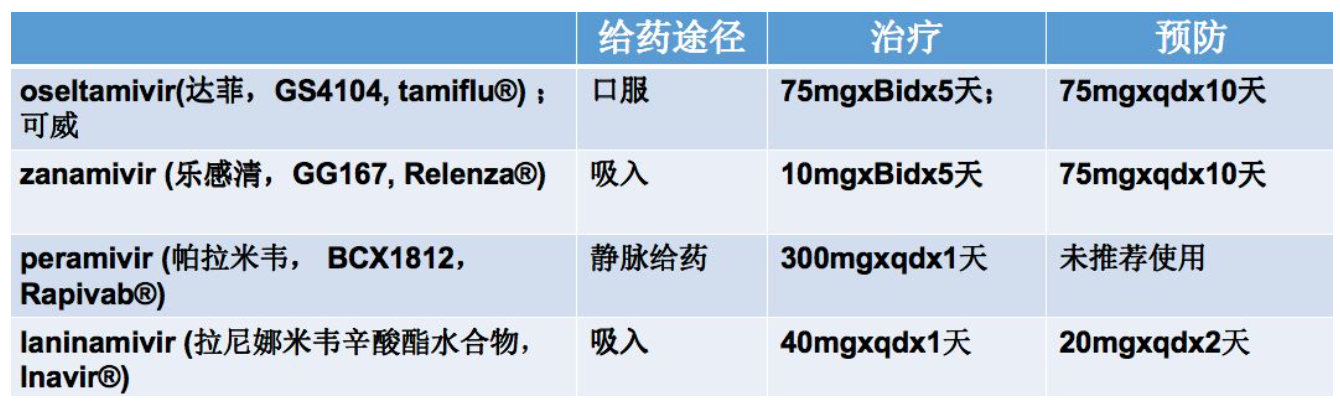
NA抑制剂既适用于临床治疗,也用于暴露后的预防。NA抑制剂的共同特点是同唾液酸有类似结构。
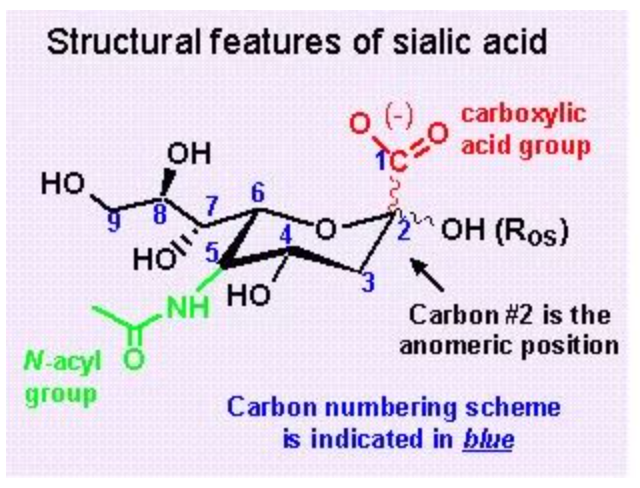
从这张图上可以看到,机体里的唾液酸由9个碳原子组成,在第1位、第4位、第5位、第8位以及第9位碳原子连的基团都是通过这些基团同机体的NA蛋白相互作用,因此利用这些相连的基团的特性,我们进行药物的改造。亲水基团主要是第1位的羧基基团和第4位的氨基/胍基基团,疏水基团主要是第3位的丙基基团或戊氧基基团。所以利用这个原理,我们就知道它的耐药发生机制。
NAI药代动力学
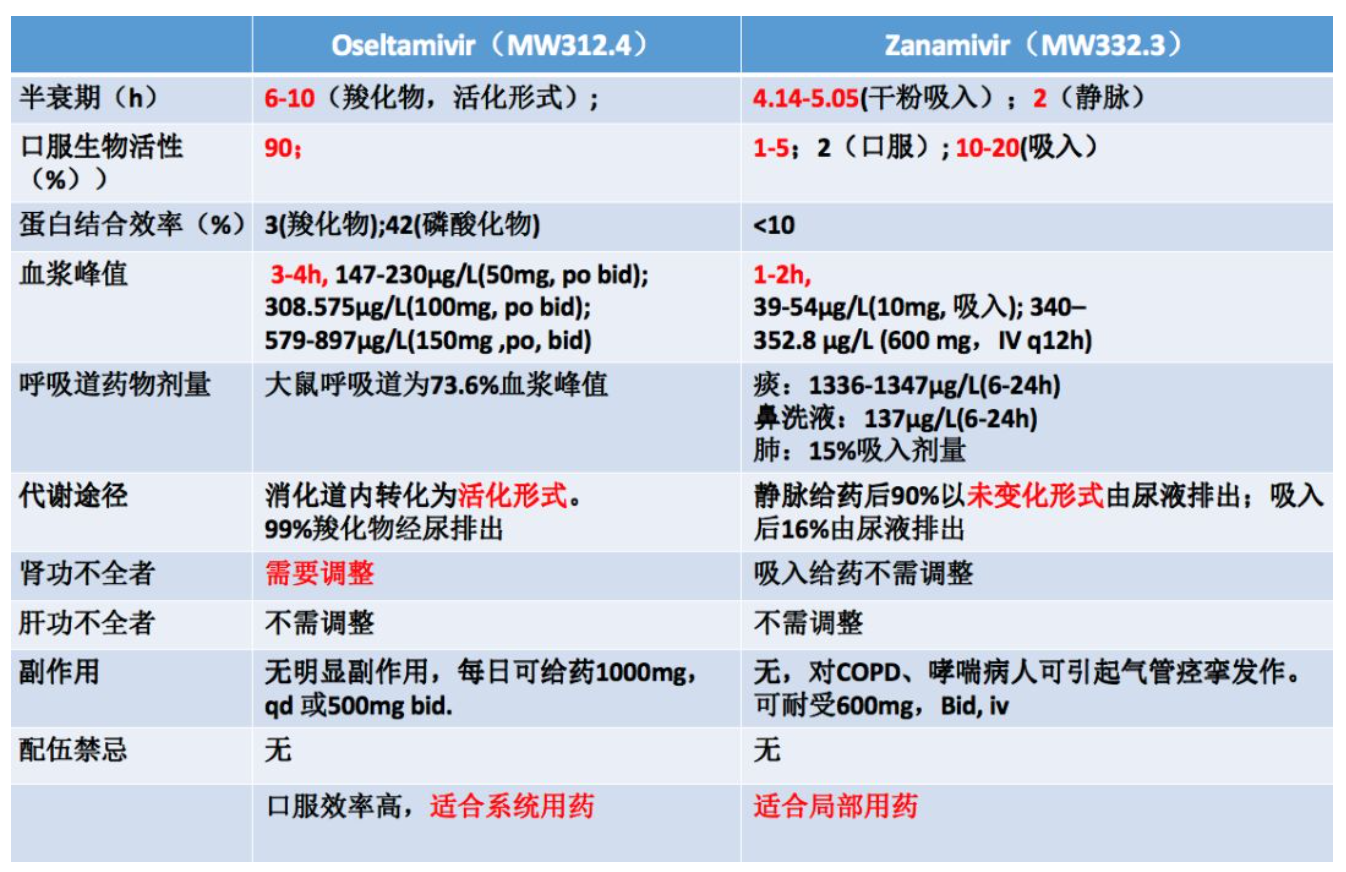
奥司他韦主要是口服药物,口服之后经肠道上皮的酶的作用后,把磷酸切割,它的活性位点就会暴露转化成活化形式。所以口服3~4个小时,血药浓度达到峰值,它的半衰期是6~10个小时。主要通过肾脏代谢,对于肾功不全者需要调整给药剂量。而扎那米韦的给药方式是以吸入的方式,它的生物转化活性效率是最高的,大概吸入1~2个小时后达到血浆峰值,半衰期可以维持4~5个小时。吸入后的代谢途径是16%由尿液排出,所以对于肾功不全者,吸入给药不需要调整剂量,因此扎那米韦是适合呼吸道给药的。
儿童流感奥司他韦用药有哪些特点?

儿童使用奥司他韦有注意事项,由于儿童肠道对奥司他韦的活性转化功能较低,所以儿童使用的剂量比成人高。成人75mg/kg,相当于1mg/kg剂量,而儿童是可以高达3mg-3.5mg/kg。但是对于需要血液透析的儿童,需要调整剂量。另外,我们经常在儿童给药的时候会同牛奶一起服用,这时药物的生物活性会明显降低(从32.5%降到11.7%)。如果高脂饮食或者抑制肠道细胞内的转肽酶,药物的生物活性也会降低。
那么,临床是如何发现NA抑制剂的呢?
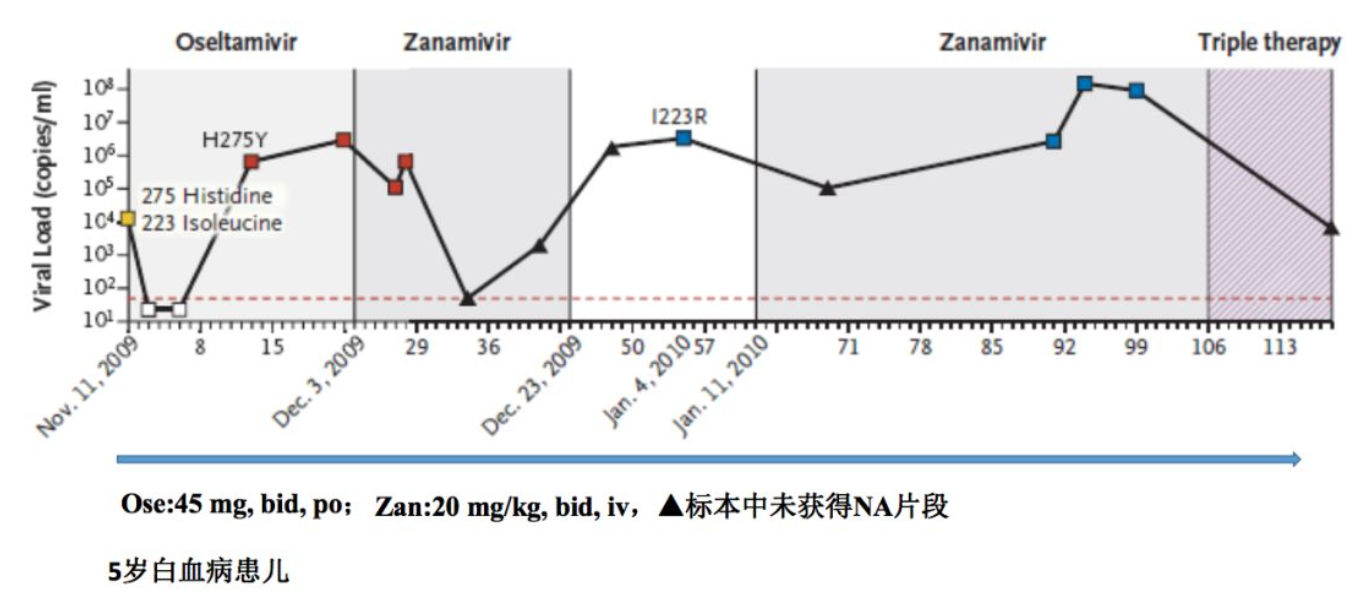
这张图显示的是荷兰研究团队在2010年报道的一例5岁白血病患儿感染2009H1N1病毒的病例。入院时患儿的病毒载量已经很高了,给予口服奥司他韦治疗后,病毒载量迅速降低,但是随后病毒载量又增加,研究人员检测到了H275Y变异,同时给予扎那米韦治疗,病毒载量再次降低,但是在这个过程中能够测到病毒载量增加。由于试验,始终没有发现NA片段,直到停药扎那米韦后,又发现了I223R突变,这个变异始终维持高病毒载量。从这个过程中我们发现,如果单一使用NA抑制剂,或者是在检测中忽略了对NA片段的变异的监测,临床上有可能出现NAI耐药毒株。
下面来了解NAI耐药的发生机制
NA重要功能区(以N2/Bv蛋白氨基酸序号为参考)
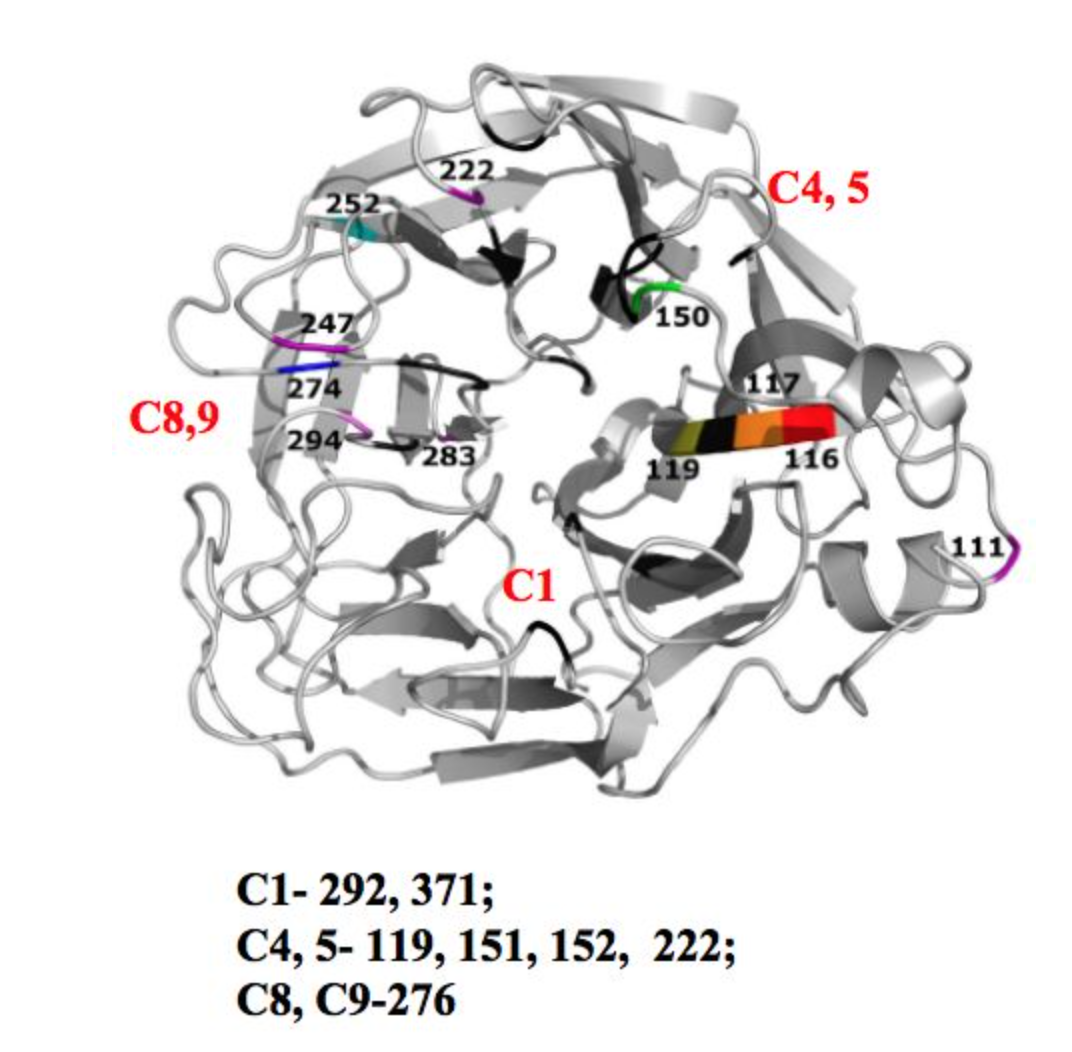
对于NAI耐药需要重点了解的是NA蛋白的功能,NA蛋白有酶活中心,刚才我们提到唾液酸的第1位、第4位、第5位、第8位以及第9位碳原子连的基团是会同NA酶活中心的重要基团相互作用的,特别是结合底物位点,包括R118,D151,R152,R224,E276,R292,R371,Y406这8个位点,而这8个位点在不同的型和亚型流感病毒是非常高度保守的,也就是说当这些位点变异时,会影响病毒的复制力和传播力,也就是我们常说的病毒的适应能力。而E119,R156,W178,S179,D198,I222,E227,H274,E277,N294,E425这11个位点是支撑NA的酶活中心位点,它的变异对病毒的适应能力影响不大。
NAI(唾液酸类似物)耐药机制-与NA作用的重要基团
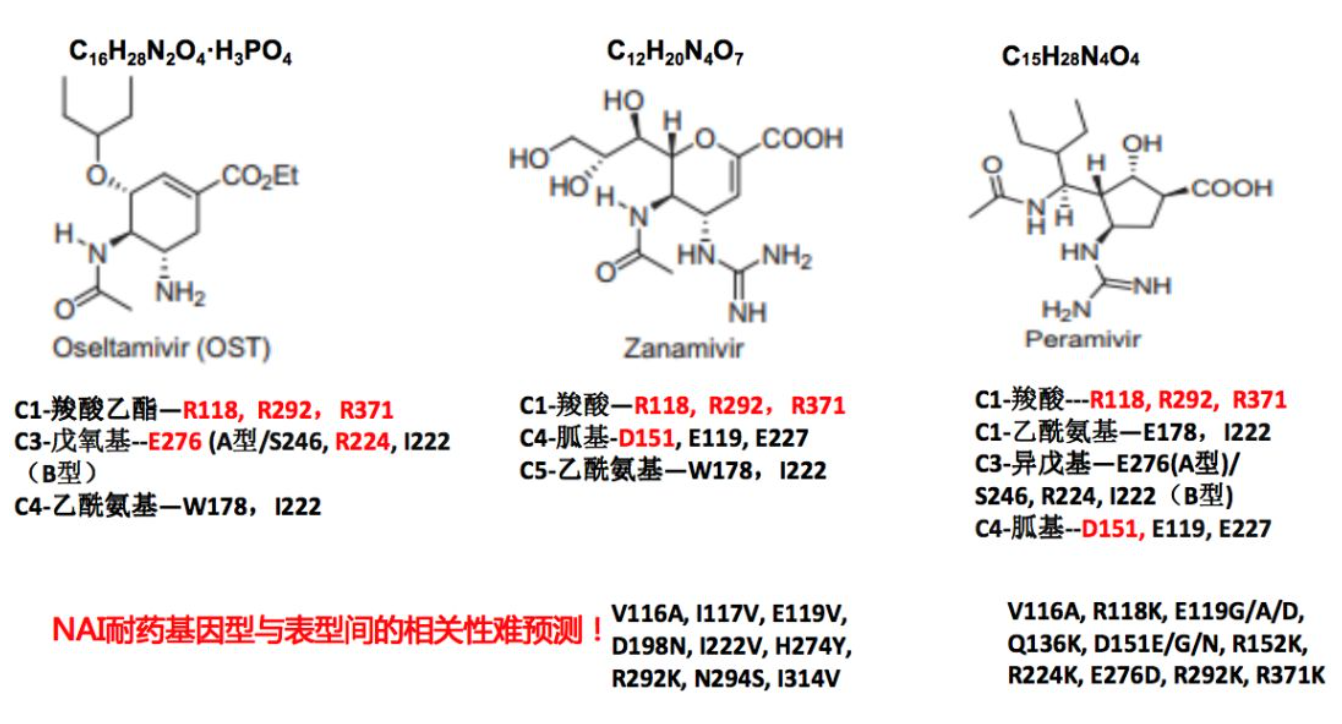
从这张图我们可以看到,奥司他韦主要的功能区域基团集中在第1位碳原子连的羧基乙基、第3位碳原子连的疏水的戊氧基或丙氧基基团或乙酰氨基基团,而扎那米韦在第4位碳原子引入了亲水的胍基基团。因此通过这些基团同NA不同位点的相互作用,当发生耐药时,常常是这些相互作用的NA位点发生变异。但是我们需要记住的一点就是NAI耐药基因型与表型间的相关性难预测,所以我们必须在体外进行生物活性的检测,也就是我们常说的生物表型的检测。
NAI耐药机制
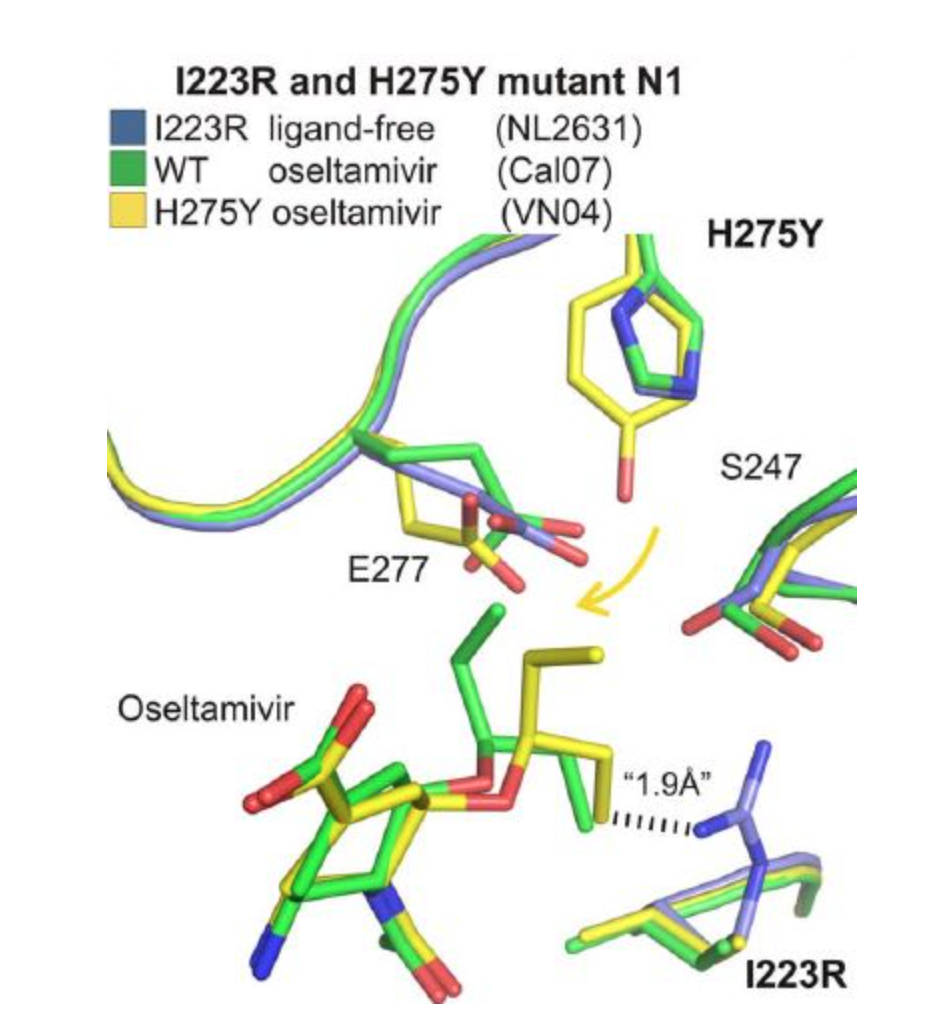
我们常说的274变异是什么意思?这就是H275Y变异,以N1蛋白氨基酸序列来排序,它是275;如果是以N2蛋白氨基酸序列来排序的话,它就是在274。当H到Y变异的时候,由于疏水性的作用,它使奥司他韦同NA蛋白的距离增加。奥司他韦距离NA更远后,奥司他韦同NA蛋白的结合是缓慢结合,但同时由于侧链构象扭曲,使它的结合不稳定,因此它会出现缓慢结合又快速分离。所以要让NA抑制剂同NA相互作用的话,它需要更高浓度的NA抑制剂,就是我们常说的耐药。
其他在研NAI-与NA共价相连的NAI
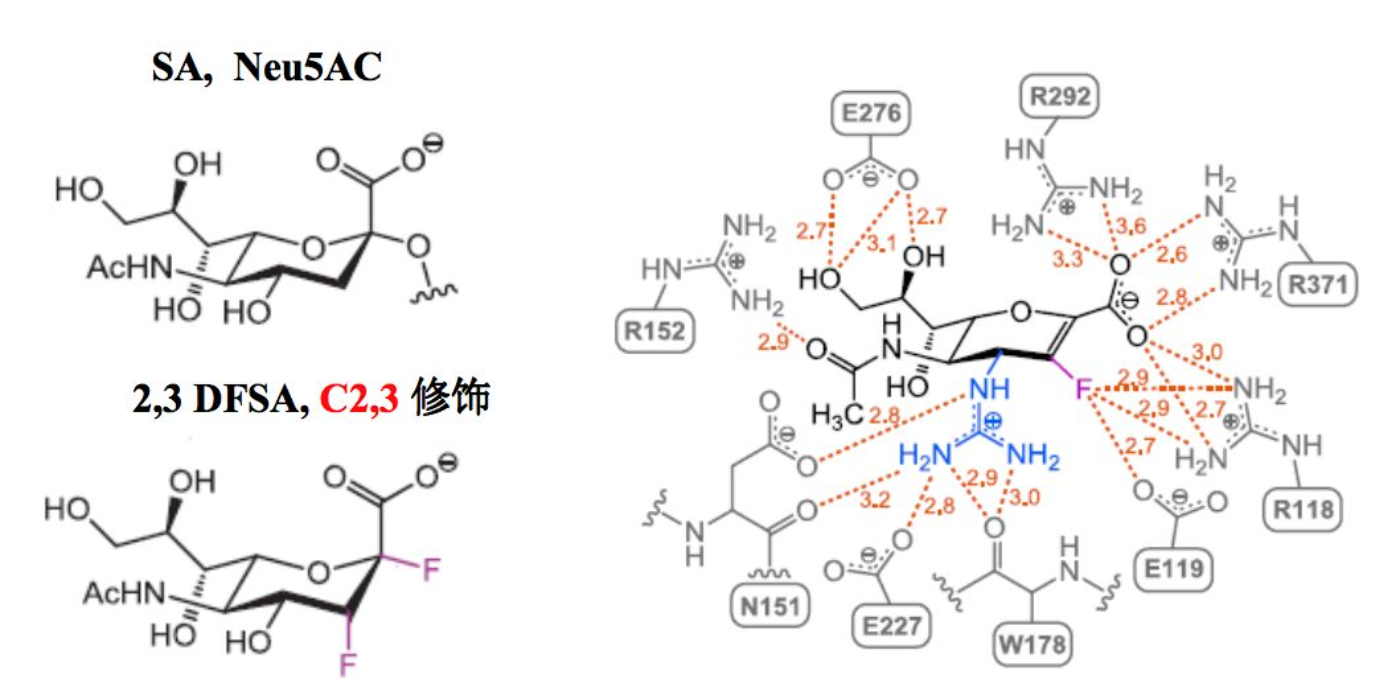
因此基于结构生物学,大家就想能够发现一些共价作用的NA抑制剂。基于唾液酸的结构,在唾液酸的第2位和第3位引入氟原子,有发现一些共价结合的NA抑制剂。这项研究主要是集中在动物实验和体外实验,还没有进入临床实验。
NAI耐药的表型检测
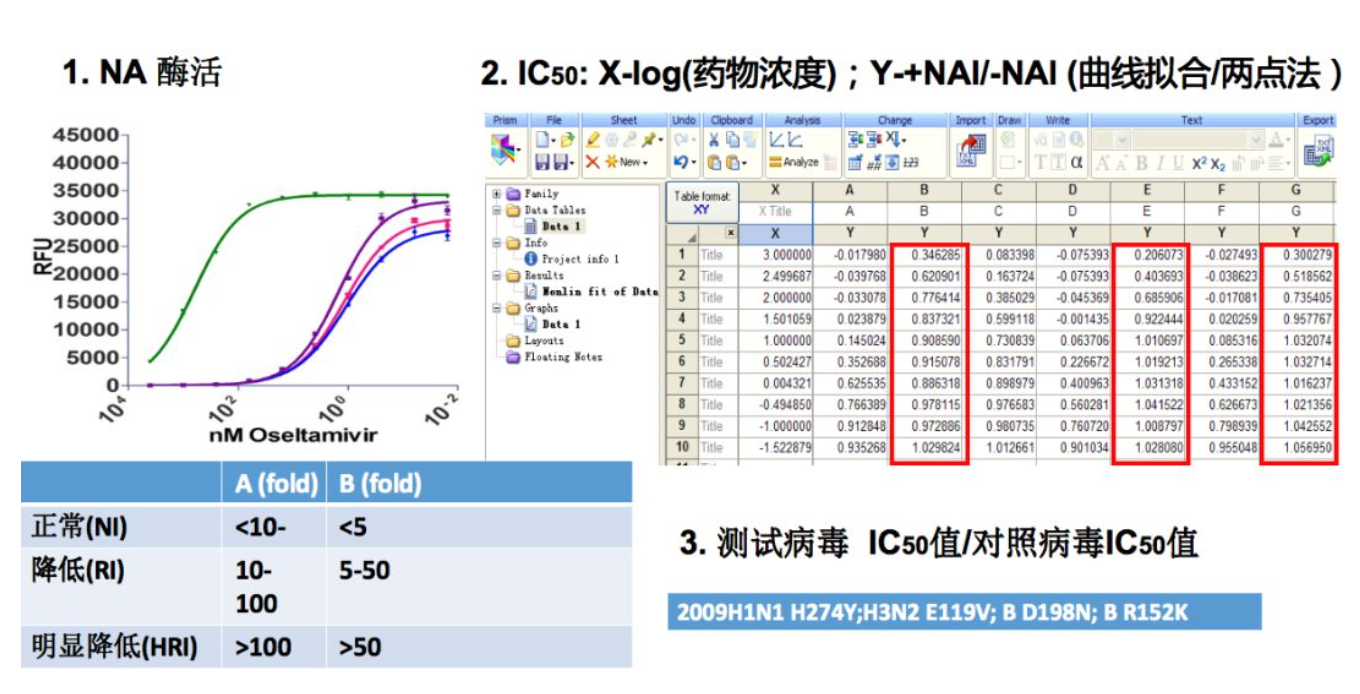
NAI进行生物表型检测是非常必要的,它的生物表型检测主要分为两类。首先是对病毒的酶活测定,然后测定在不同药物浓度下病毒酶活的变化,从而计算出药物的半数抑制浓度,同时对测试病毒的IC50值与对照病毒IC50值进行比值的计算。这些所列出的病毒常常是作为耐药病毒的阳性对照。WHO对表型的判定进行了界定,对于甲型流感病毒,如果它的倍数增加在10~100之间,我们叫做它的敏感性降低(RI),如果超过100,我们叫做明显降低(HRI);对于乙型流感病毒,由于乙型流感病毒的NA酶活比甲型低,所以它的波动比例是在5~50和大于50。
季节性流感病毒的NAI耐药情况如何?
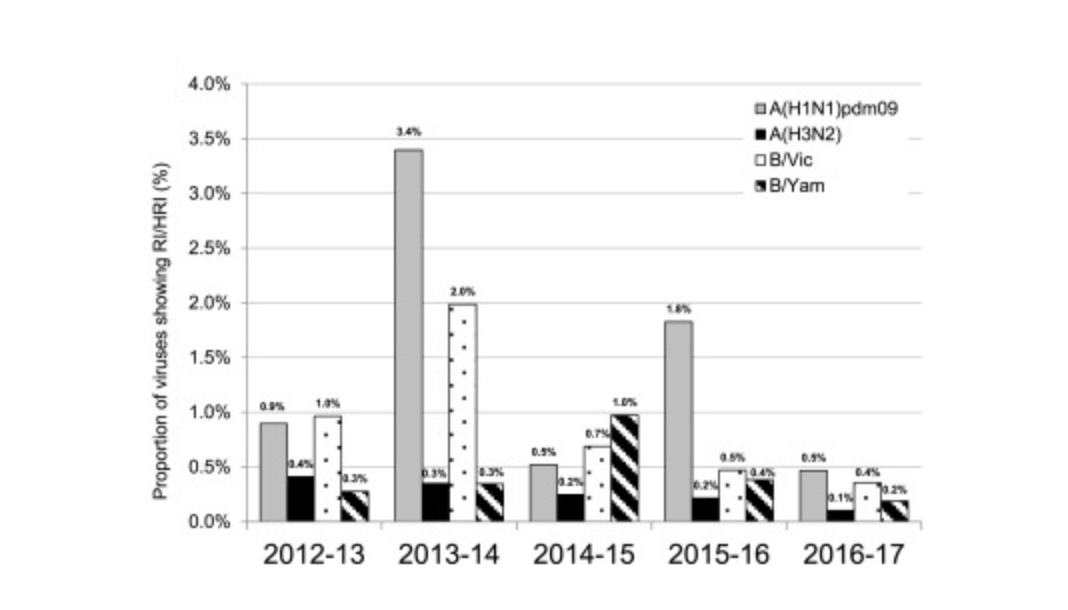
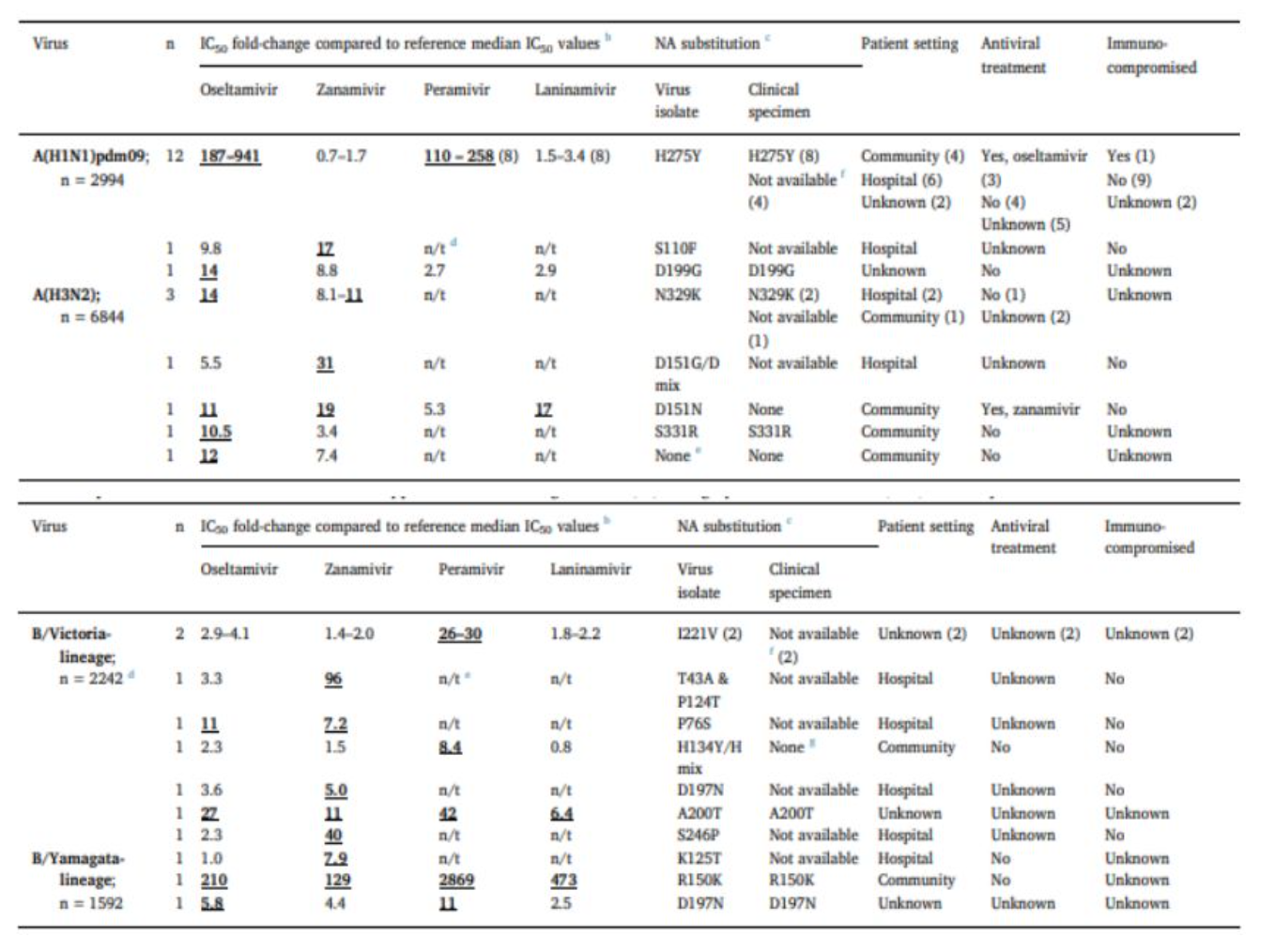
从这张图上可以看出,从自然界分离的流感病毒的耐药比例非常低,包括明显降低和降低。这些耐药比例常常是针对奥司他韦耐药,对奥司他韦耐药的流感成人占0.32%,儿童占4.1%。不同型、亚型对NAI耐药的流感病毒变异不同。临床分离株常见变异:A(H1N1)H275Y;A(H3N2)D199G,N292K;B;A200T,R150K,D197N。
那么,有没有自然发生的耐药?
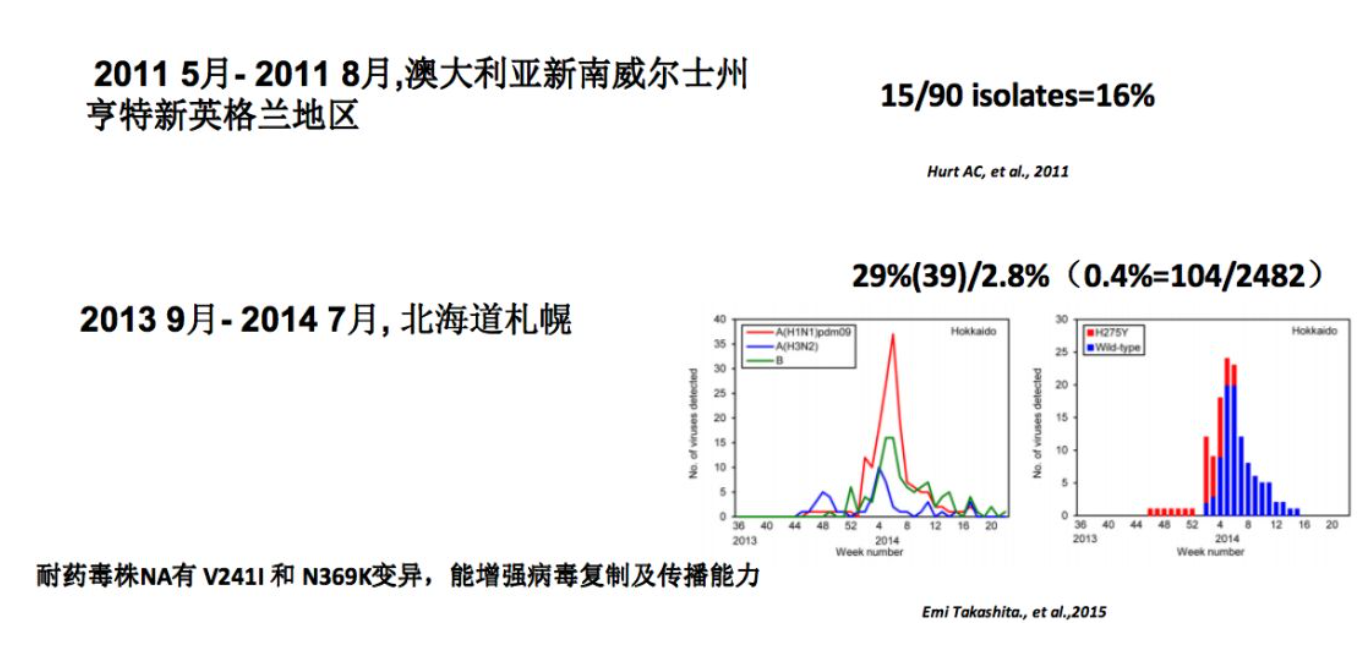
从既往报道发现,自然发生的H274Y变异的2009pdmH1N1耐药株的聚集性流行。
临床发现的NAI耐药的H7N9禽流感病毒
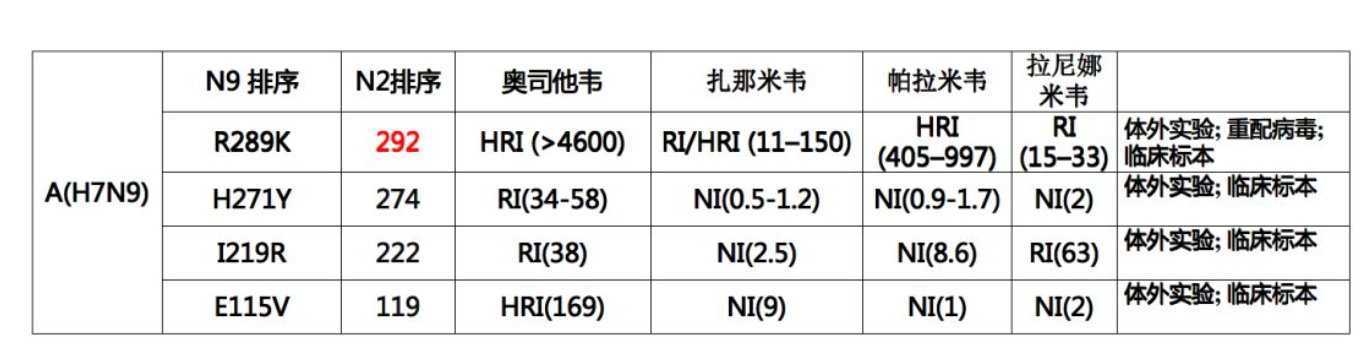
在我国,临床常常使用NA抑制剂治疗H7N9禽流感病毒的感染。在药物的作用下,特别是在奥司他韦的作用下,我们从病人的分离株发现它的NA蛋白有很多氨基酸位点的变异,在体外进行表型测试,发现主要是292,274,222,119位点变异,同它的生物表型密切相关,特别是292位点变异,它可以引起多重耐药的表现。并且我们发现如果使用扎那米韦在体外对H7N9病毒进行培养传代,未发现耐药变异。NAI耐药性变异对珠三角分支的H7N9病毒NA酶功能影响小。
总体来说,大家要记住以下五点
1.NAI应尽早给药,并且选择生物活性高的药物或给药方式;
2.目前季节性流感病毒自然发生的NAI耐药变异低,而H274Y变异不降低2009H1N1病毒传播力;
3.H7N9在奥司他韦作用下易发生变异,建议考虑联合用药;R292K降低病毒适应性;
4.快速发现NAI耐药:随时监测病毒载量、病毒基因型;生物表型实验后期核实;
5.NAI在特定情况下可选用于暴露后预防性用药。
下面简单介绍RdRps抑制剂
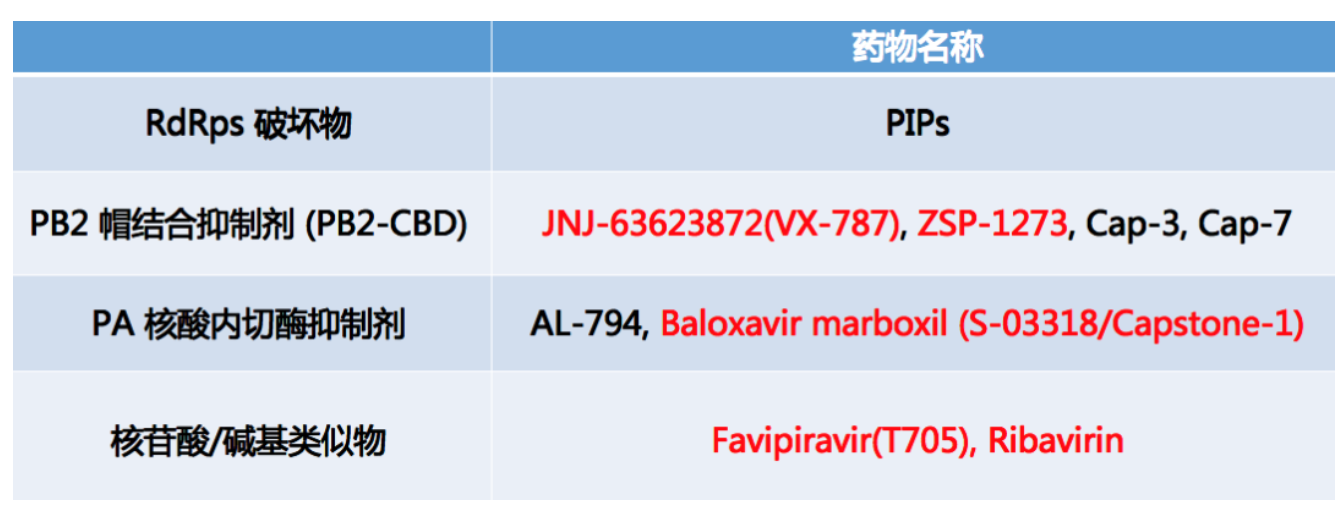
这是目前最有进展和前景的抑制流感病毒复制的RNA依赖的RNA聚合酶(RdRps)抑制剂。这是高度保守的区域,而且针对病毒RNA复制及转录,因此它是一个极其有效的抗病毒药物。
1、T705(6-fluoro-3hydroxy-2-pyrazinecarboxamide,favipiravir)
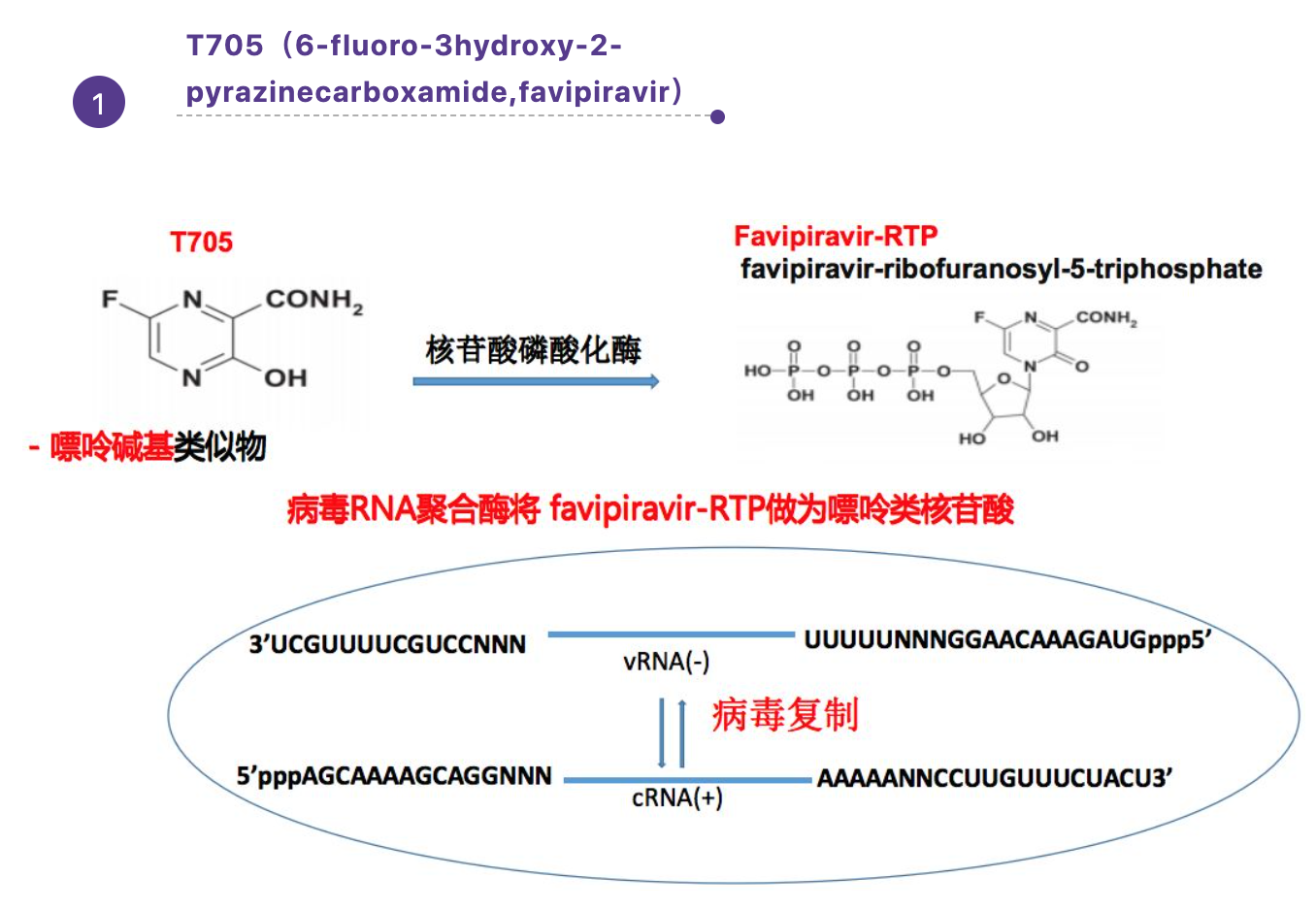
现在主要有嘌呤碱基类似物T705,服用T705后,主要是在细胞内转化成一个活化形式的T705 RTP,然后病毒RNA聚合酶就会把T705 RTP和嘌呤类核苷酸类似物误认为是机体里正常的嘌呤类核苷酸,所以它主要干扰病毒的复制过程。
• T705是广谱抗RNA病毒药物
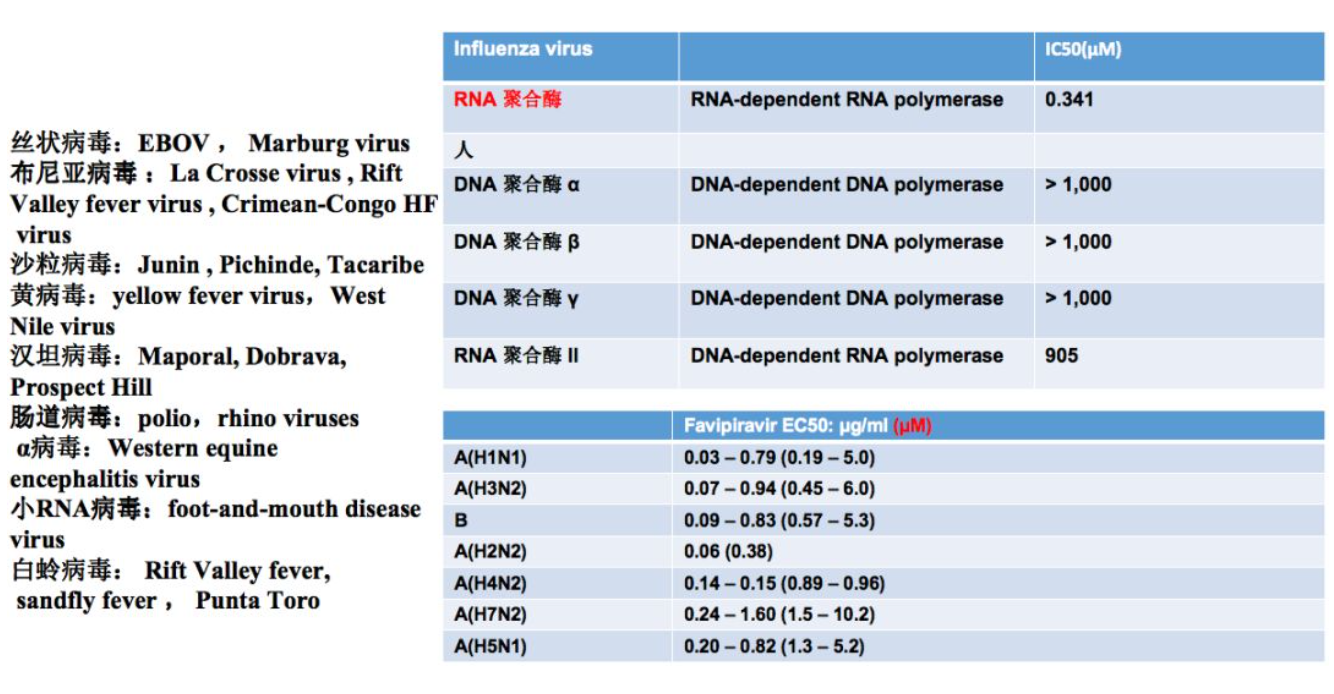
T705可以针对多种数的RNA病毒,并且针对不同型和亚型的流感病毒,它的体外抑制效率大概是微摩尔水平。
2、利巴韦林(Ribavirin)
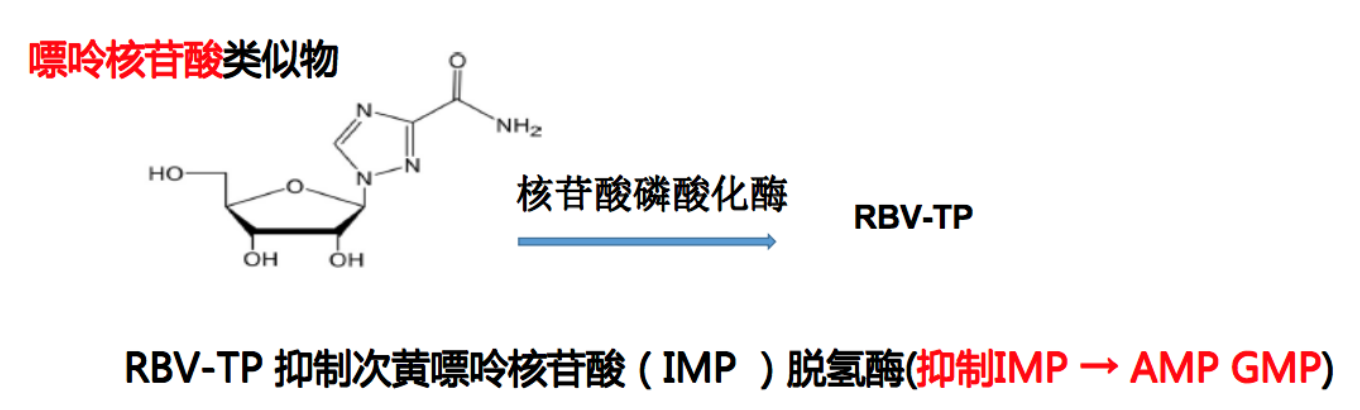
另一类药物是已经在临床使用非常多的利巴韦林,它也是嘌呤核苷酸类似物,但主要是抑制宿主脱氢酶,所以它的抑制效率比T705低,抗流感病毒并不推荐使用。
3、巴洛沙韦(Baloxavir marboxil)
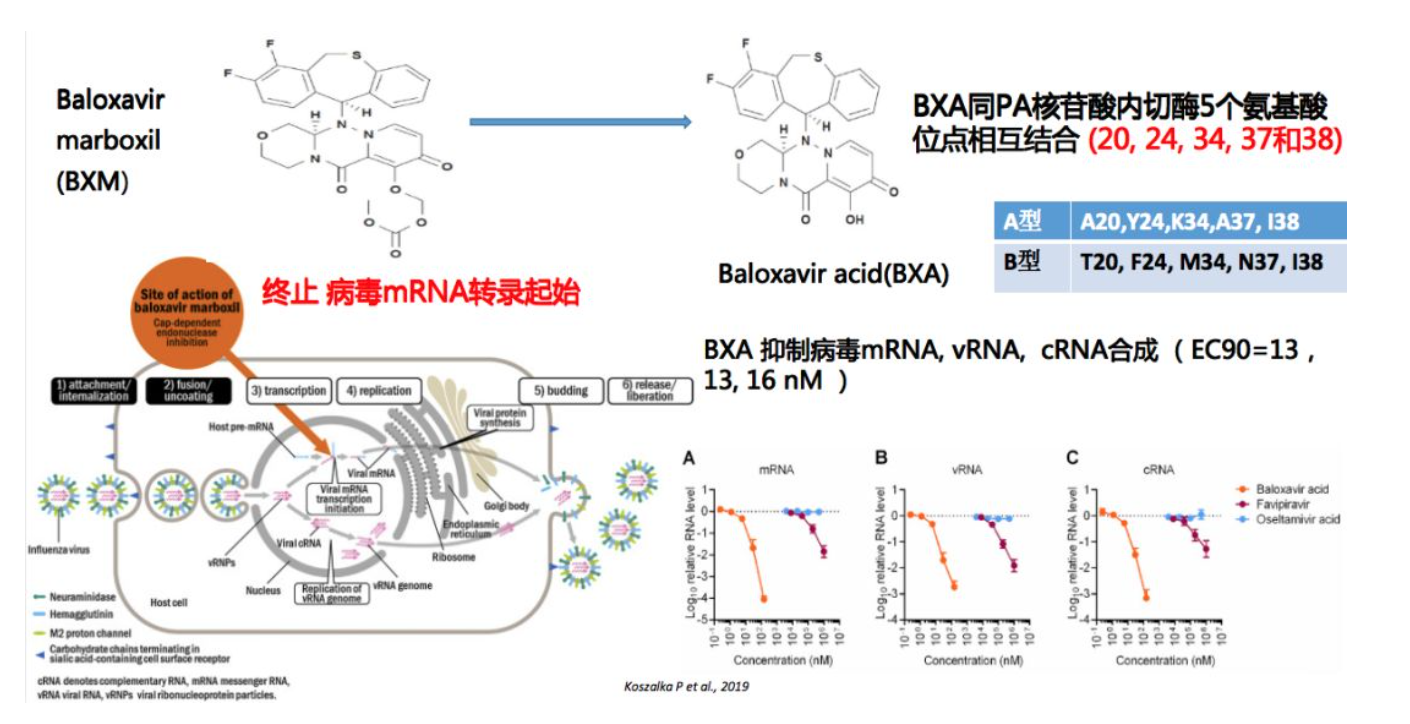
还有一种非常有效的药物是巴洛沙韦(BXM)。口服巴洛沙韦后,会快速在血浆内转化成一个活化形式的巴洛沙韦酸(BXA),它的结构像蝴蝶一样对称,所以巴洛沙韦酸主要同PA核苷酸内切酶重要的5个氨基酸位点相互结合(20、24、34、37和38)。尽管A型流感和B型流感在这些位点不同,但是巴洛沙韦抑制A型和B型的效率基本相近,它主要是终止病毒mRNA转录起始,在终止mRNA转录的同时抑制病毒复制,也就是vRNA和cRNA的合成会明显降低。
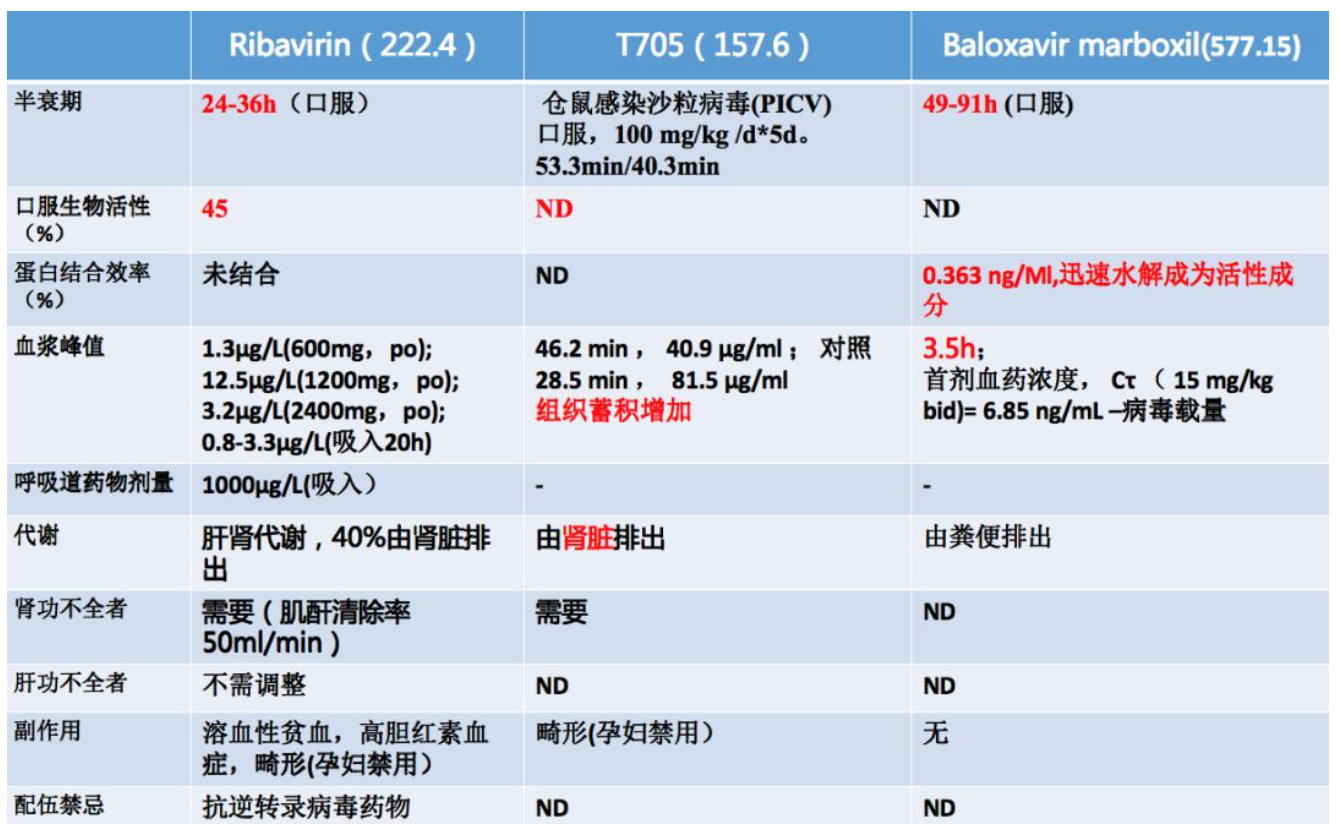
目前对这些药物的药代动力学研究资料并不多,特别是T705,主要是在动物实验。研究发现,病毒感染会影响药物服用到达的有效的血药浓度,并且药物可以在组织里蓄积。而巴洛沙韦是一个非常有效的药物,服用大概3.5个小时就可以快速到达血药浓度,而且可以持续49~91个小时,它主要由粪便排出,所以它的治疗效果非常好。
我们再来看看RdRps抑制剂的耐药情况
目前临床没有发现T705耐药
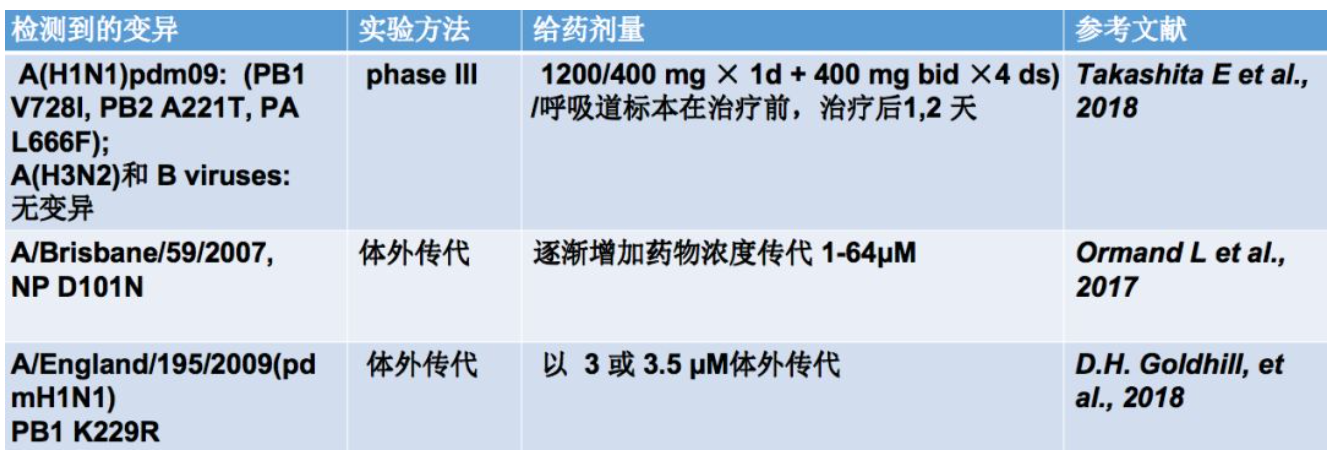
巴洛沙韦耐药相关变异
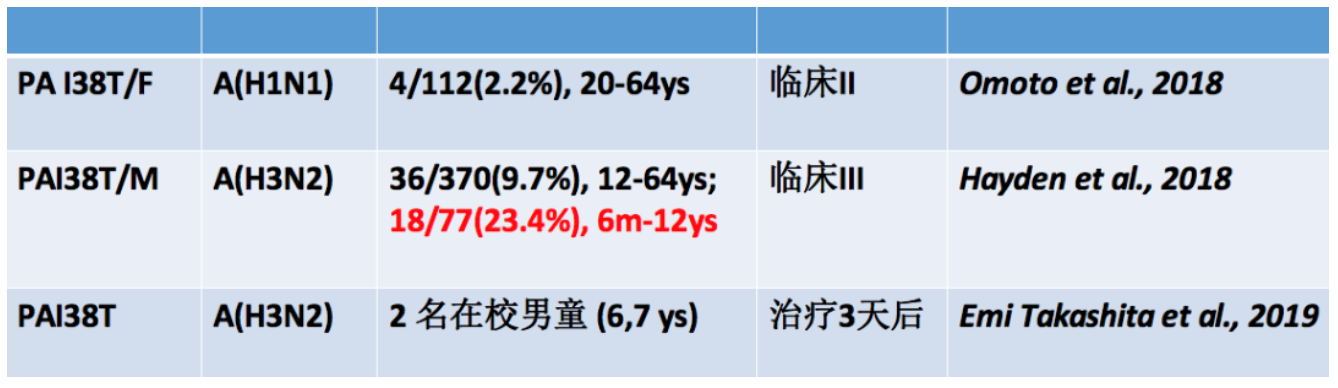
通过巴洛沙韦的临床Ⅱ期以及Ⅲ期试验,可以看到较H1N1和B型流感,H3N2病毒中出现PA I38变异更频繁,并且小年龄儿童患者更容易发生耐药性变异。
生物表型检测
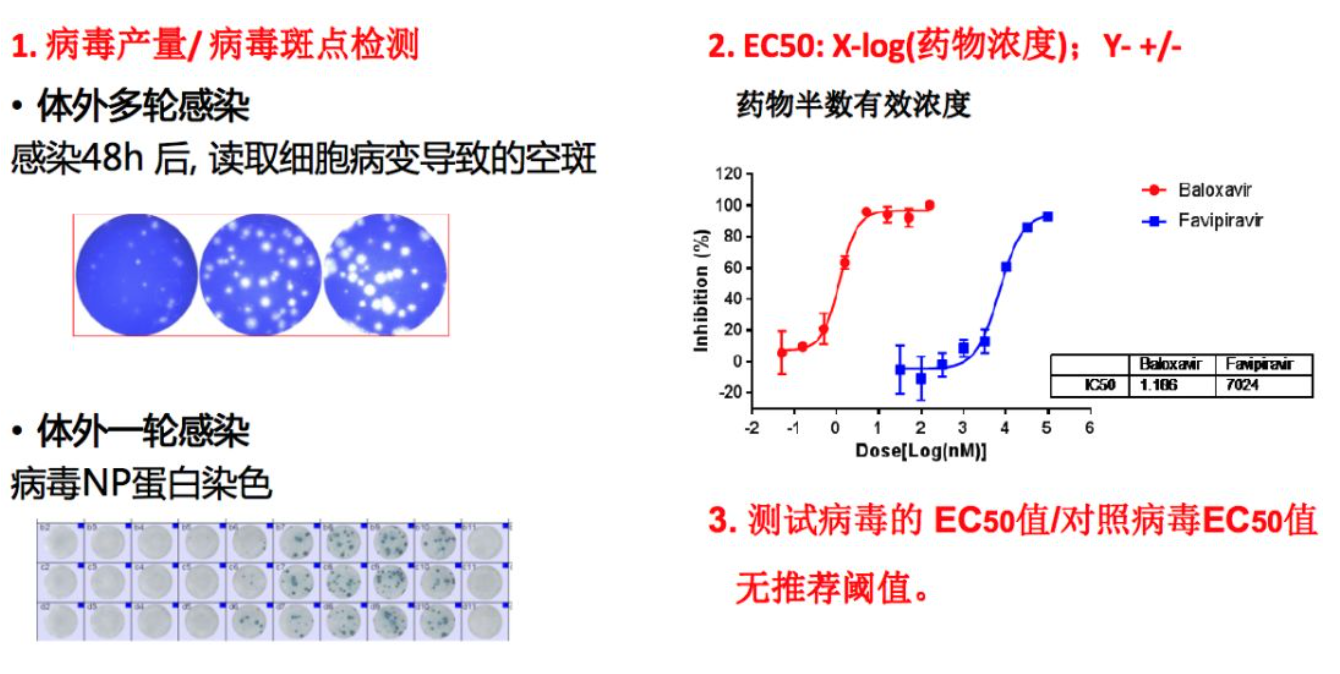
我们强调在进行耐药基因型的同时一定要做生物表型的验证。对于抑制病毒复制的药物,它的生物表型检测主要有两种方法,一种是通过体外多轮感染来测试,另一种是通过体外一轮感染来测试,同时像NA抑制剂一样要计算出它的EC50的变化情况,但是目前WHO没有推荐阈值。
BXA耐药阈值?>3?
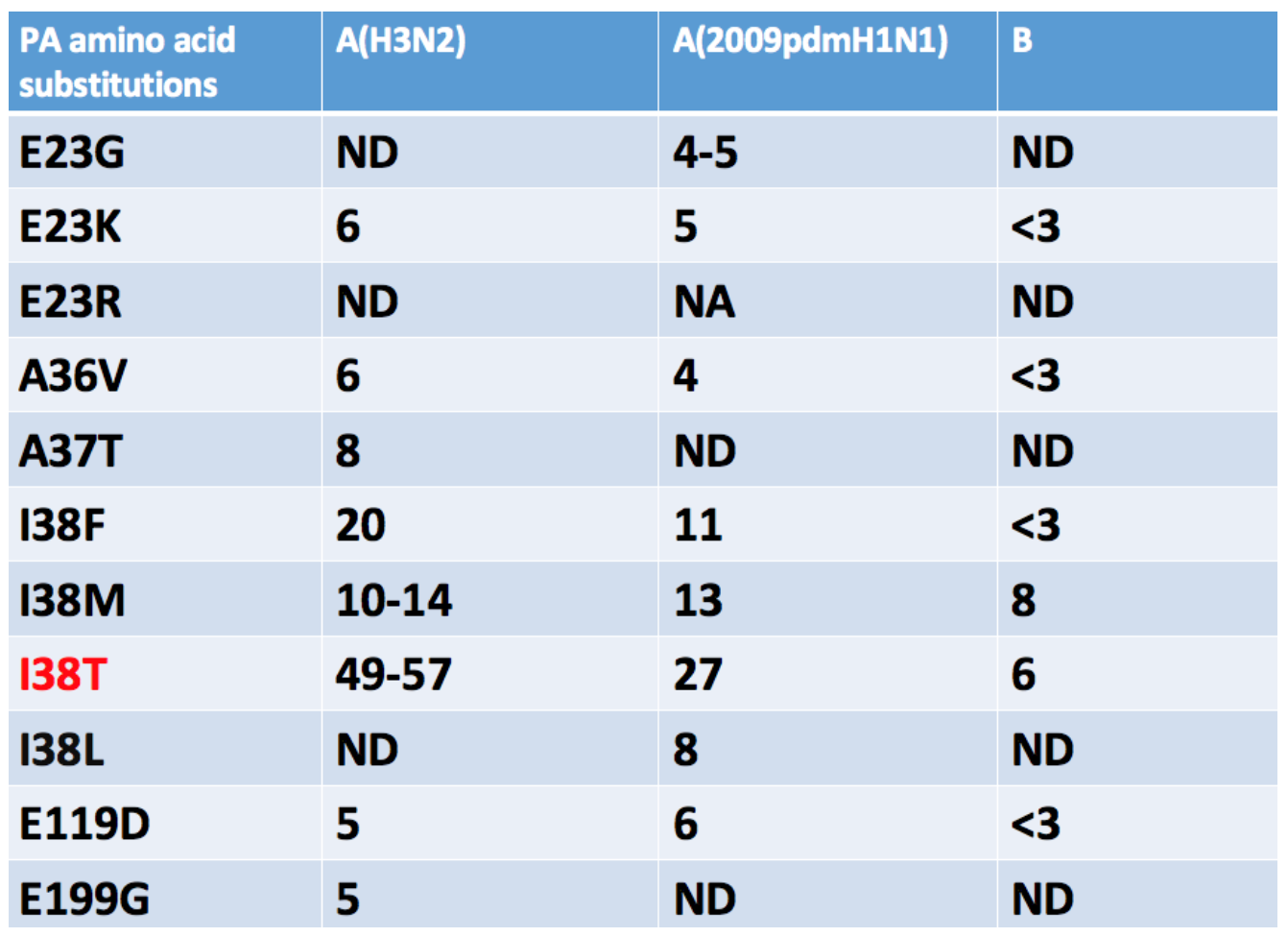
所以结合临床现有的分离株和体外实验来进行表型和基因型的关联,无论是在H3N2、H1N1以及B型流感,最常见的变异是I38T变异。目前以三倍的差别作为BXA耐药的判断。
BXA耐药的监测资料主要来源于美国和日本的数据
美国在2016年、2017年、2018年的流感流行季节,发现巴洛沙韦的耐药变异率非常低。在美国的2009H1N1病毒分离株的耐药主要是I38T/L变异,而I到T的变异会影响H1N1病毒的适应能力。I38L变异的相关实验还正在进行。
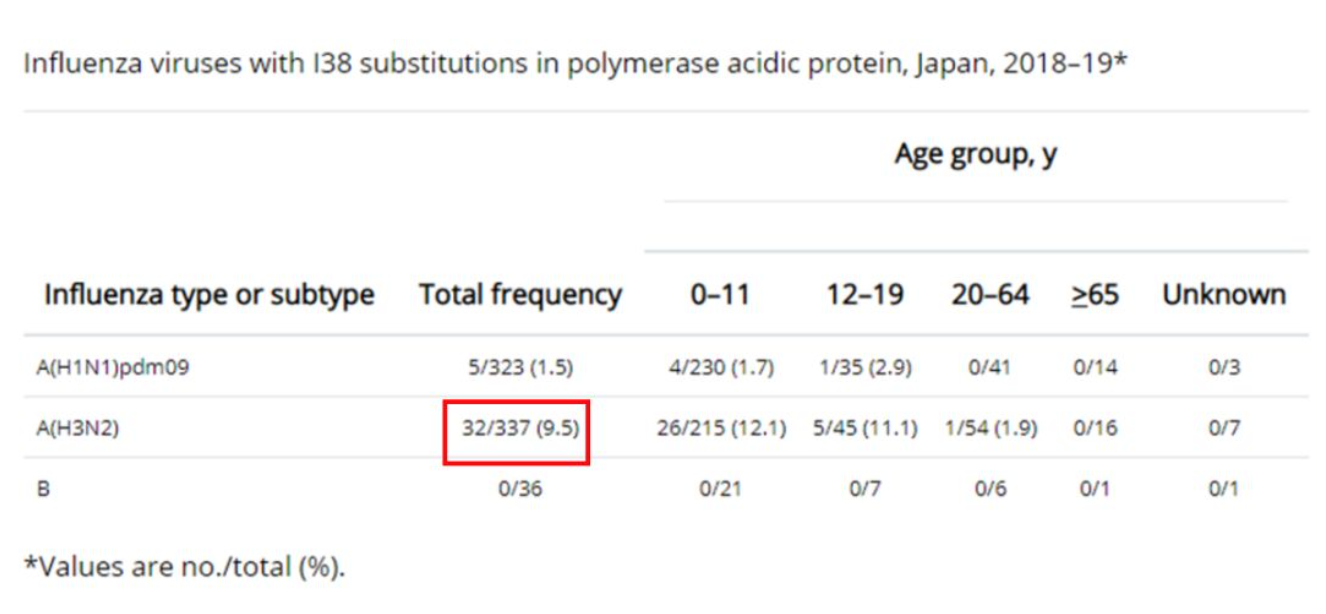
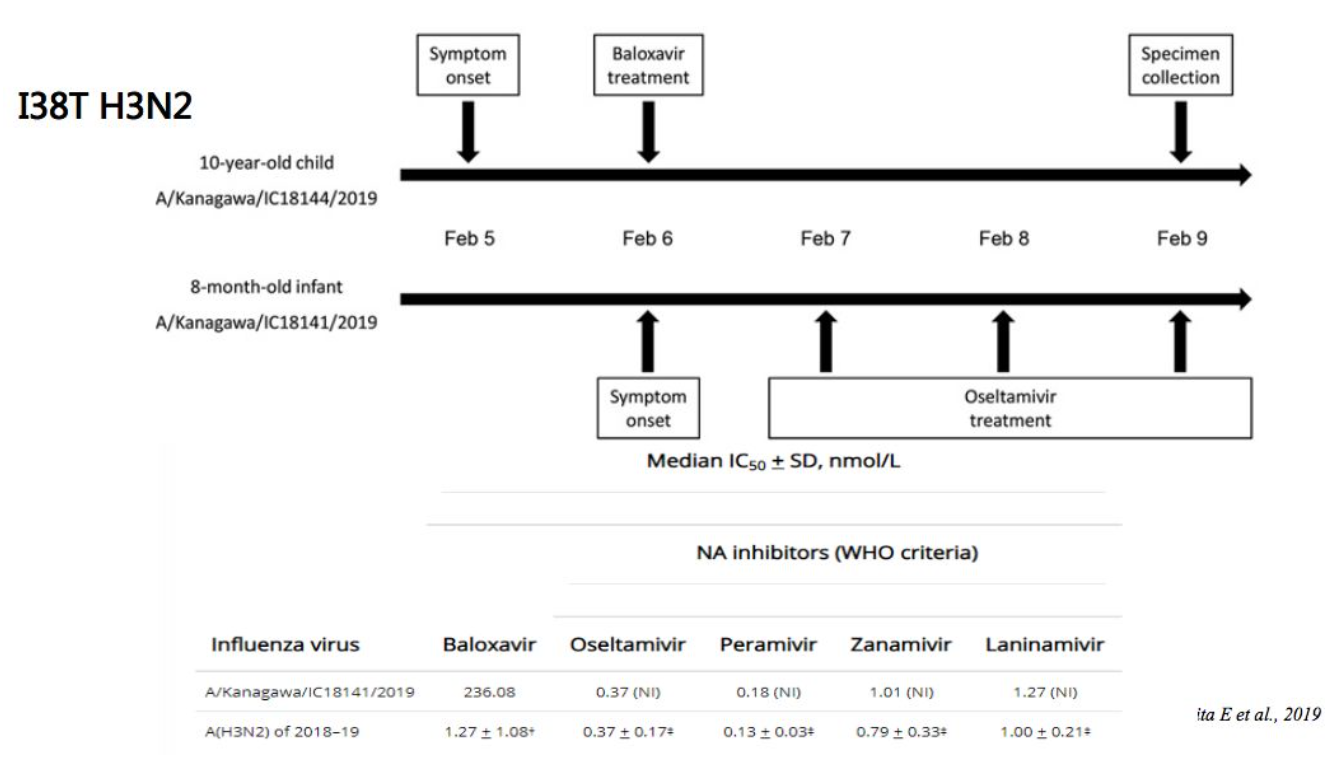
日本报道2018-19年流感流行季节,H3N2耐药比例明显高于H1N1和B型流感。并且在一个家庭的感染病例中发现10岁儿童和8个月大的婴儿都是感染了耐药的PA I38T变异,而且这个病毒分离出来发现直接对巴洛沙韦明显耐药,因此提示这个变异的病毒可以流行传播。
小结RdRps抑制剂
1.对于抑制流感病毒复制的药物T705,它是多次给药能有效降低病毒载量,目前未发现耐药相关变异,但是缺乏药代动力学。
2.巴洛沙韦一次给药就能有效降低病毒载量,但是在儿童中容易发生耐药变异。值得关注的是I38T的变异,它可以明显降低2009H1N1病毒的复制力和传播力,但是对H3N2病毒的传播力不受影响。
3.目前快速筛选方案同NA抑制剂筛选方案一样的是测定病毒载量、病毒基因型,同时进行重化病毒的分离,对生物表型进行后期的核实验证。
参考文献
[1]P Koszalka., 2017
[2]Susanna Esposito & Nicola Principi., 2016
[3]Erhard van der Vries。, et al., nengl j med. 2010
[4]van der Vries E, et al., 2012
[5]Kim., et al., 2013
[6]Weekly epidemiological record ., 2012
[7]http://www.who.int/influenza/gisrs_laboratory/antiviral_susceptibility/en/
[8]Emi Takashita., et al.,2015
[9]Kiso et al.,2010 & Takahashi et al., 2011; Furuta Y., et al.,2013
[10]XOFLUZATM. 2018; Hayden FG, 2018; Gubareva LV., 2019; Omoto et al., 2018;Takashita E et al., 2018
[11]Gubareva LV., 2019
[12]Takashita E et al., 2019
专家介绍

周剑芳
中国疾病预防控制中心病毒病预防控制所,研究员,博士生导师。自2003年起至今,致力于流感病毒的研究,涉及病毒重配进化、致病机制及宿主免疫反应和抗病毒治疗等领域。承担多项国家级课题包括863、973、自然科学基金等资助项目。参与新发流感病毒包括2009H1N1、H7N9、H10N8禽流感病毒的发现及其生物学特性、致病机制等领域研究。目前主要研究方向是流感病毒广谱中和抗体的检测、筛选及遗传基础。


