摘要
本文通过1例急性早幼粒细胞白血病诱导分化治疗过程中出现的凶险的弥漫性肺泡出血,从影像学可看到病变急起、进展迅速且弥漫分布,经俯卧位通气,有创机械通气及药物治疗后病变较快吸收的动态演变过程,并结合文献讨论急性早幼粒细胞白血病合并弥漫性肺泡出血的发病、影像和治疗,为临床诊断和治疗提供参考。
患者男,46岁,因「乏力3周,皮肤多发瘀斑、牙龈出血1周」于2021年11月4日入院。患者于3周前无明显诱因出现乏力,活动后为著,1周前突发左手背皮肤大片瘀斑及大腿内侧小块青紫色瘀斑,伴四肢散在出血点及自发性牙龈出血,外院血常规检查可见白细胞计数为4.27×10^9/L,血红蛋白为120 g/L,血小板计数为8.00×10^9/L,单核细胞百分比为54.84%,中性粒细胞百分比为23.44%,网织红细胞绝对值为14.9×10^9/L,网织红细胞百分比为0.35%,外周血幼稚细胞为70%,为进一步明确诊断收入血液科。
既往史:「胃溃疡」病史7年余。过敏史、个人史及家族史未诉明显异常。
入院体格检查:体温36.3 ℃,脉率88次/min,呼吸频率20次/min,血压136/79 mmHg(1 mmHg=0.133 kPa),浅表淋巴结无肿大,前胸可见散在小出血点,左手手背可见片状青紫色瘀斑,双侧大腿内侧可见4 cm×4 cm瘀斑,左小腿胫骨前方可见手掌大瘀斑。双肺呼吸音清,未闻及干湿性啰音。心律齐,各瓣膜区未闻及病理性杂音,腹平软,无压痛,双下肢无浮肿。
实验室检查:血常规示白细胞计数为7.98×10^9/L,血红蛋白为110 g/L,血小板为6.00×10^9/L。C反应蛋白 10.1 mg/L;凝血酶原时间为13.6 s,活化部分凝血活酶时间为24 s,纤维蛋白原为1.15 g/L,D-二聚体为10.31 μg/L。肝、肾功能、ESR、降钙素原、HIV、梅毒、肝炎全套、G实验、GM实验均正常;心脏彩超提示二尖瓣中度反流,余未见异常。骨髓穿刺结果提示增生明显活跃,粒系以异常早幼粒细胞为主,可见柴捆细胞,红系少见,成熟红细胞无明显形态异常,全片巨核少见,血小板少见。染色体核型分析检查结果:20个中期相细胞,细胞核型均存在15号和17号染色体易位。胸部CT可见双肺散在斑片、实变影(图1,2)。
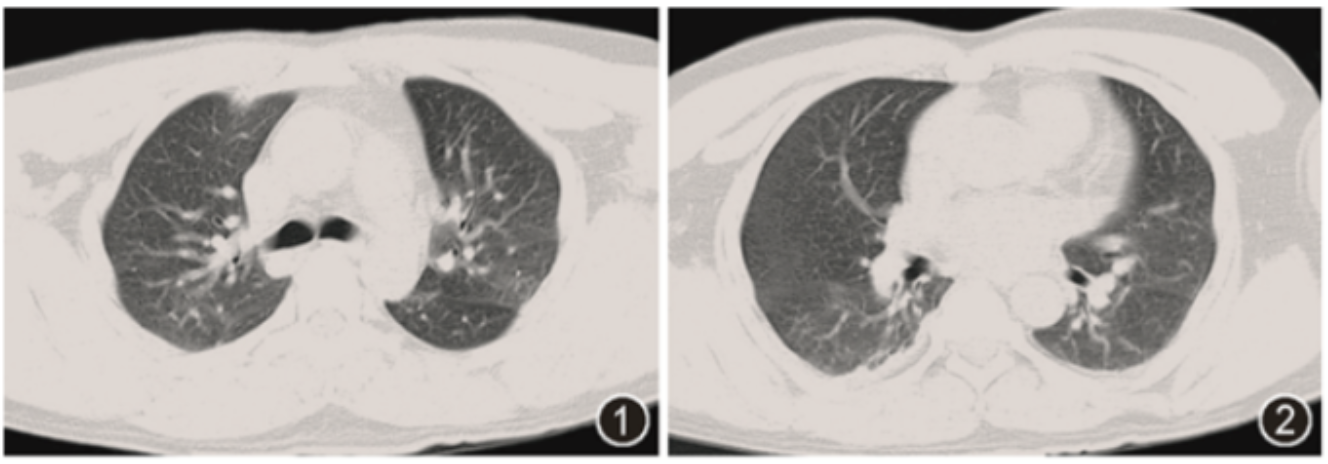
图1,2 胸部CT平扫(2021年11月4日)可见双肺散在斑片、实变影
患者入院后诊断急性早幼粒细胞白血病明确,于2021年11月4日开始给予维A酸(20 mg,2次/d)口服,并给予吡柔比星(30 mg,1次/d,共3 d)化疗及美罗培南(1.0 g,3次/d)抗感染治疗,间断输注新鲜冰冻血浆和纤维蛋白原,每天检测血常规和凝血功能。
患者有间断发热,11月14日复查X线胸片示双肺散在斑片影(图3),患者于11月21日突发左下胸痛伴气促,伴指脉氧进行性下降,次日转入呼吸重症监护室,患者有明显呼吸困难伴咯血1次,为血痰,量约2 ml,双肺可闻及湿啰音,给予高流量湿化氧疗(氧流量45 L/min,氧浓度70%),查动脉血气分析结果示:pH值为7.470,PaCO2 为31.0 mmHg,PaO2 为110.0 mmHg,乳酸值为0.9 mmol/L,血氧饱和度为99%,氧合指数为157 mmHg。
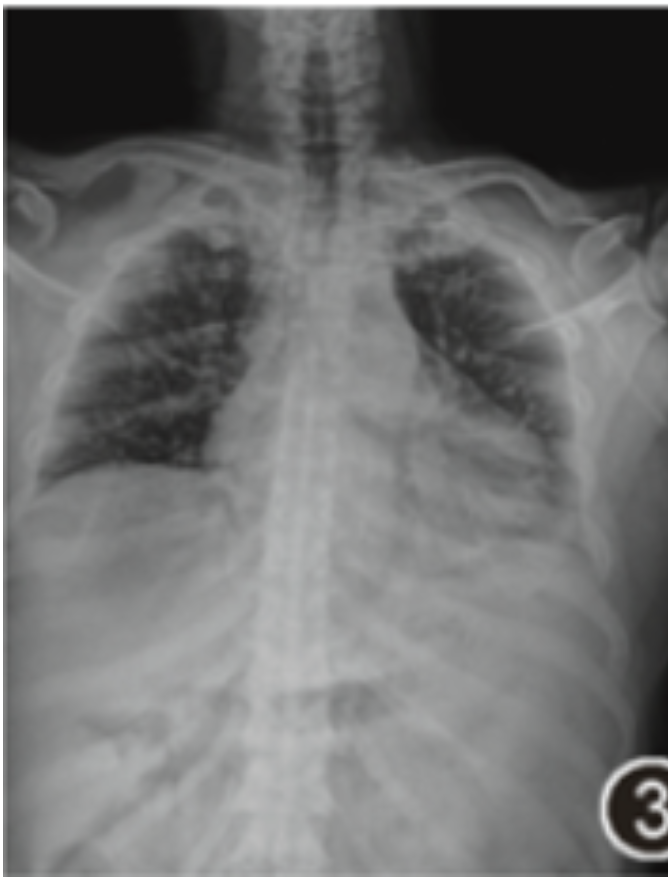
图3 X线胸片(2021年11月14日)示双肺散在斑片影
当晚患者呼吸困难进行性加重,指脉氧进行性下降,上调氧浓度为100%,查动脉血气分析结果示:pH值为7.480,PaCO2 为38.0 mmHg,PaO2 为69.0 mmHg,乳酸值为1.4 mmol/L,血氧饱和度为95%,氧合指数69,立即行经鼻气管插管及有创机械通气[APV-CMV模式,呼吸频率 22次/min,潮气量450 ml,PEEP为8 cmH2O(1 cmH2O=0.098 kPa),氧浓度100%],插管后复查动脉血气分析:pH值为7.450,PaCO2 为38.0 mmHg,PaO2 为91.0 mmHg,乳酸值为1.1 mmol/L,血氧饱和度为 97%,氧合指数为91 mmHg,血常规:白细胞计数为3.12×10^9/L,血红蛋白为63 g/L,血小板为17.00×10^9/L,凝血酶原时间:14.3 s,活化部分凝血活酶时间:57.8 s,纤维蛋白原:8.74 g/L,D-二聚体:2.07 μg/L,床旁X线胸片提示双肺弥漫性病变(图4),床旁气管镜于多叶段回收见血性灌洗液(图5),送检肺泡灌洗液行细菌培养、GM实验未见明显异常。
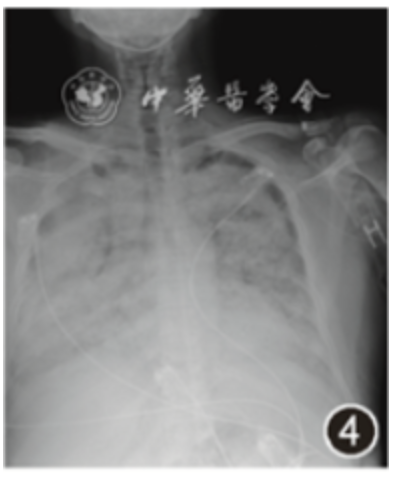
图4 X线胸片(2021年11月22日)示双肺斑片影较前明显增多
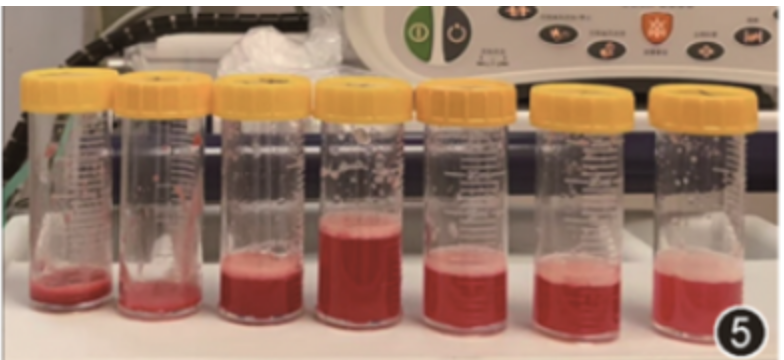
图5 多叶段肺泡灌洗液外观示血性灌洗液
结合临床资料,考虑诊断弥漫性肺泡出血(diffuse alveolar hemorrhage,DAH),给予持续有创机械通气,治疗方案为美罗培南(1.0 g,3次/d)及伏立康唑(250 mg,2次/d)抗感染,地塞米松(10 mg,2次/d)及每日输注新鲜冰冻血浆、血小板、悬浮红细胞,11月23日因患者指脉氧波动于80%~90%,氧合指数仍小于100 mmHg,给予充分镇静镇痛后行俯卧位通气治疗16 h,俯卧位后复查动脉血气分析:pH值为7.4,PaCO2为43.0 mmHg,PaO2为113 mmHg,乳酸值为1.3 mmol/L,血氧饱和度为98%,氧合指数为113 mmHg,11月24日复查X线胸片提示病变较前吸收(图6),逐渐下调呼吸支持,动态复查动脉血气分析提示氧合指数逐渐上升至200 mmHg以上,于11月26日成功脱机拔管,11月29日复查肺部CT(图7,8)可见双肺斑片影较前吸收,并转回血液内科继续治疗,并于12月5日出院。其后随访患者在血液内科规律化疗(维A酸片及亚砷酸),病情平稳。
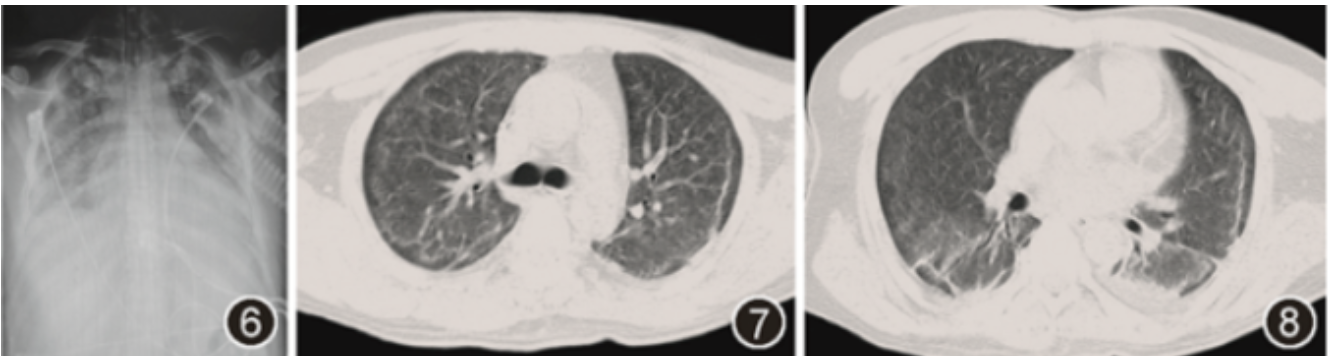
图6 X线胸片(2021年11月24日)示经治疗后双肺斑片影较前减少
图7,8 胸部CT平扫(2021年11月29日)可见双肺斑片影较前吸收
讨论
急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)是急性髓细胞白血病的一种特殊亚型,其具有严重的出血倾向,早期死亡与弥散性血管内凝血(disseminated intravascular coagulation,DIC)、出血并发症密切相关[1]。全反式维甲酸(all-trans-retinoic-acid,ATRA)和三氧化二砷(arsenic trioxide,ATO)的应用使其从一类高致死性疾病发展为一种高度可治愈的疾病。ATRA可诱导幼稚细胞分化成熟,其最常见的并发症是分化综合征(differentiation syndrome,DS)。DS的发生和肺出血之间存在关联[2]。DAH是维甲酸诱导缓解治疗导致的DS中少见,易被忽略且严重威胁生命的并发症之一[3]。
DAH是以咯血、与咯血量不平行的贫血、低氧血症和胸部影像学呈弥漫性肺泡浸润为特征的临床综合征。DAH病情凶险,病因包括血管炎、感染、凝血功能异常、药物相关及骨髓移植。该患者症状加重出现在诱导治疗后17 d,系DS好发时间窗,且因患者经治疗后纤维蛋白原浓度升高,无全身其他部位出血倾向,不考虑DIC所致弥漫性肺泡出血。APL患者发生DAH的具体机制尚不清楚,目前认为和诱导分化治疗过程中中性粒细胞释放细胞因子和细胞浸润有关[2] ,其病理改变为肺毛细血管炎[4] 。在临床上需与肺炎、心力衰竭和DIC相关的肺出血鉴别[5] 。研究指出恶性血液系统疾病患者化疗后合并DAH通常发生在化疗后2~3周,这与患者粒系造血恢复时间一致[6] 。
DAH影像征象可包括:片状磨玻璃、磨玻璃结节、马赛克征、铺路石征、片状实变、实性结节、网格征、蜂窝征[7] 。根据出血的速度和范围及肺泡腔内填充的程度,影像学初期可表现为磨玻璃及斑片影,进展迅速,后期可出现实变影,经有效治疗后,病变可绝大部分吸收。除外血液填充之外,各种原因导致的渗出液填充亦可表现为上述影像改变,如心力衰竭、肺炎、ARDS。该患者无基础心脏病,且未予抗心力衰竭治疗后病变好转。另外患者病原学培养均为阴性,且经治疗后影像学较快吸收,而肺部感染性病变经治疗后病变通常表现为吸收延迟,因此不符合该患者影像学演变特点。
急性早幼粒细胞白血病合并DAH治疗主要包括糖皮质激素治疗和积极的支持治疗。本例患者因行有创机械通气后氧合仍无法维持于90%,氧合指数<100 mmHg,故行俯卧位通气改善氧合。既往文献亦有报道俯卧位通气能改善弥漫性肺泡出血患者肺力学和死腔分数[8] ,提示可作为DAH合并顽固性缺氧的抢救治疗措施之一。
参考文献(略)
作者:龙颖姣 王瑶辉 崔亚娟 罗红;单位:中南大学湘雅二医院呼吸与危重症医学科;中南大学湘雅二医院血液科
本文转载自订阅号「中华结核和呼吸杂志」
原链接戳:【读片园地】弥漫性肺泡出血
引用本文: 龙颖姣, 王瑶辉, 崔亚娟, 等. 弥漫性肺泡出血 [J] . 中华结核和呼吸杂志, 2022, 45(5) : 525-527. DOI: 10.3760/cma.j.cn112147-20220111-00038.


