严重急性呼吸道感染(SARI)疾病(如SARS、MERS、pH1N1等)的部分患者可进展为急性呼吸衰竭[1, 2],19%~32% SARS患者需要住ICU接受呼吸支持治疗[3, 4]。呼吸支持技术是SARI患者最重要的生命支持手段,而呼吸支持相关设备与技术不恰当应用是导致院内医务人员和非医务人员感染SARI病原菌的重要原因,因此,加强呼吸支持技术的规范化应用以及预防相关的院内交叉感染是SARI患者呼吸管理的关键[1]。目前未见针对武汉2019新型冠状病毒(2019-nCov)肺炎公开发布的相关临床数据,但其临床表现与管理与既往SARI有类同之处,故本文主要根据既往全球SARI爆发流行时临床数据,并结合目前一线工作医务人员的临床经验进行阐述,供相关医务及管理人员参考。
* 本文仅代表作者个人专业观点,具体实施请结合病人个体情况及当时医疗环境。
一、普通氧疗(supplemental oxygen therapy)
1、临床指针与操作
普通氧疗装置包括鼻导管、普通面罩、文丘里面罩和非重复呼吸的储氧面罩等(图1)。当SARI患者出现以下情况时应立即考虑氧疗:低氧血症(PaO 2 <60mmHg或SpO 2 <90%);呼吸窘迫(呼吸频率>24次/分);低血压(收缩压<100mmHg)。初始氧流量设置为5 L/min,随后滴定氧流量使SpO 2 维持在 94%~98%(孕妇患者至少95%以上),合并慢阻肺等慢性高碳酸血症病史的患者应维持SpO 2 在88%~92% [1, 5] 。
为保证氧疗安全,收治SARI的病房应常规配备心电监护设备(或至少备用便携式氧饱和度仪)和多种普通氧疗装置;当患者存在低氧血症时,尽可能立即给予血气分析检查以评估低氧程度、通气功能和酸碱平衡情况;如果患者初始SpO 2<85%,应首选非重复呼吸的储氧面罩(氧流量>12L/min)尽快纠正低氧状态;严密监测氧疗效果(如SpO 2、呼吸形式和生命体征等),若1~2小时后无改善或恶化应立即更换其他呼吸支持方式。
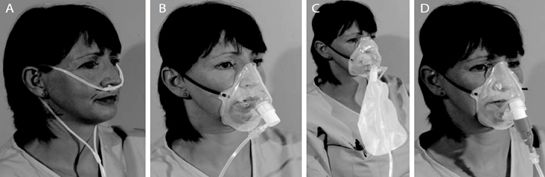
【图1】普通氧疗装置 A 双腔鼻导管;B 普通氧疗面罩;C 储氧面罩;D 文丘里面罩
2、院感防控
(1)氧疗装置易被患者气道内分泌物及其气溶胶污染,接触氧疗装置时应严格进行个人防护;
(2)氧疗装置必须一次性单人使用,若有痰液、血渍污染应立即更换;
(3)不能使用雾化装置对进行普通氧疗时的患者行气道湿化治疗;
(4)普通氧疗时尽可能不进行吸入气体的湿化,以免增加气溶胶的产生,尤其当流量超过6 L/min时湿化瓶内易产生气溶胶;
(5)鼻导管吸氧时应嘱患者佩戴外科口罩。
二、经鼻高流量氧疗(high flow nasal cannula, HFNC)
1、临床指针与操作
HFNC是一种新型呼吸支持方式 [6],气体流量最大可调至60 ~80L/min,FiO 2 0.21~1.0可调(图2)。与普通氧疗相比,HFNC能够降低低氧性呼吸衰竭患者的气管插管率和病死率 [7]。因此,当普通氧疗装置不能纠正低氧血症、不耐受无创正压通气或出现以下情况时可以选择HFNC治疗:轻中度低氧血症 (100 mmHg ≤ PaO 2/FiO 2 < 300 mmHg);无紧急气管插管指征;生命体征相对稳定;对伴有轻度通气功能障碍(pH≥7.3)患者可以谨慎应用,但要做好随时更换为无创或有创正压通气的准备 [6]。
应用HFNC治疗后应严密(1~2小时)监测疗效反应,若持续出现以下情况应及时更换为无创或有创正压通气:呼吸频率>35次/分;SpO 2<88%~90%;胸腹矛盾呼吸或(和)持续辅助呼吸肌肉活动;pH<7.35;PaCO 2>45 mmHg。HFNC具体操作可参见中华医学会呼吸病学分会和中国医师协会呼吸医师分会在2019年联合发表的《成人经鼻高流量湿化氧疗临床规范应用专家共识》 [6]。

【图2】经鼻高流量氧疗(HFNC)装置和参数设置界面
2、院感防控
(1)HFNC治疗应使用一次性的高流量鼻塞和管路,单人使用;
(2)使用中嘱患者尽可能闭口呼吸,佩戴外科口罩;
(3)回路中有冷凝水时,应及时清理,避免高流量气体导致气溶胶的产生以及冷凝水进入鼻腔刺激患者呛咳;
(4)最近证据显示HFNC治疗时呼气气体分散距离很有限,空气传播风险低。但HFNC与鼻塞连接不紧密会显著增加呼出气体的分散距离(从172mm增加至620mm) [8, 9],因此,应注意正确安装和佩戴高流量鼻塞(图3);
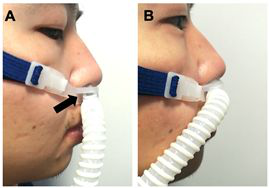
【图3】HFNC与鼻塞连接处 A显示连接不紧密,B为正确连接方式
三、无创正压通气(non-invasive positive pressure ventilation, NPPV)
1、临床指针与操作
NPPV可降低气管插管率,因而理论上能够降低医务人员在为SARI患者行气管插管和人工气道管理中的感染风险 [4],是一种较为理想的SARI患者呼吸支持方式。NPPV治疗SARI(如SARS、MERS、pH1N1等)的疗效证据较少 [10, 11],且NPPV治疗低氧性呼吸衰竭的整体失败率较高(约50%) [12],目前指南[13]未对NPPV治疗低氧性呼吸衰竭做出推荐意见,因此,NPPV不能作为纠正SARI患者呼吸衰竭的一线治疗手段。国内经验显示 [14, 15],对于经过严格选择的早期轻度(PaO 2/FiO 2>200mmHg)低氧性呼吸衰竭的SARI(SARS)患者,NPPV能够避免气管插管的发生,建议可以短时(1~2小时)试用NPPV [1, 16],病情无改善时应立即气管插管;另外,早期识别NPPV治疗低氧性呼吸衰竭失败的高危因素(表1)能够提高NPPV治疗SARI的安全性 [17-19]。

2、院感防控
值得关注的是,NPPV在使用中可能导致气溶胶传播,体外模拟实验发现NPPV会导致患者1米范围内呼出气体气溶胶的扩散,而且随着漏气量的增加和吸气压力的增高,扩散范围亦会扩大 [20],因此WHO认为NPPV是病房内产生气溶胶传播的重要方式之一。但目前在临床研究中未发现床旁操作NPPV增加医务人员感染SARI病原菌的风险 [10, 14, 15],NPPV面罩可能还会减少患者咳嗽时气溶胶的排出;另外,近期研究显示,在NPPV连接方式佩戴良好情况下,NPPV是一种低风险的空气传播途径 [1, 8]。因此,NPPV是否会增加SARI院感风险,目前仍不明确 [10]。NPPV治疗时仍需要严格控制医疗环境,并时刻警惕和监测医务人员的感染风险。NPPV时院感主要防控措施如表2。

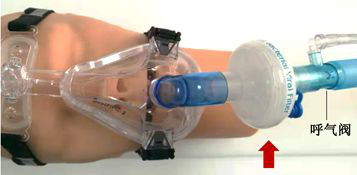
【图4】无创正压通气时细菌/病毒过滤器的安装位置(位于面罩与呼气阀之间)
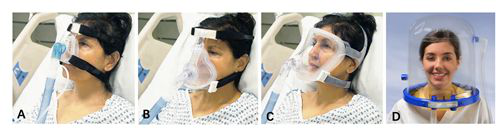
【图5】无创正压通气常见的连接方式(A 鼻罩;B 口鼻面罩;C 全脸面罩;D 头盔)
(N Engl J Med 2015;372:e30)

【图6】NPPV空气过滤器
四、有创正压通气(invasive positive pressure ventilation,IPPV)
1、临床指针与操作
SARI可导致ARDS [2]。如果上述呼吸支持方式均难以纠正SARI患者呼吸衰竭,出现进行性加重的低氧血症、呼吸困难或窘迫症状,或者出现二氧化碳潴留(PaCO 2>45mmHg),或者血流动力学不稳定时,应立即考虑早期气管插管和有创正压通气。有创机械通气的具体管理策略可以参见国内外制定的ARDS机械通气指南 [16, 21]。
(1)小潮气量通气
强烈推荐使用小潮气量(4-8ml/kg理想公斤体重)和低平台压通气(<30cmH 2O)改善ARDS患者预后 [16, 21]。初始潮气量可以设置6 ml/kg,如果存在通气不足情况,可以适当增加潮气量至8 ml/kg,但同时保证平台压低于30 cmH 2O。为降低肺容积伤的发生,可以采用「允许性高碳酸血症」策略,尽可能降低潮气量,保证pH>7.25即可。虽然目前认为驱动压(平台压-呼气末正压)与ARDS患者预后密切相关 [22],但未有对照性研究证实最佳的目标驱动压,目前认为应尽可能低于13.5 cmH 2O。如果自主呼吸过强导致潮气量过大(>8 ml/kg),可以适当增加镇静镇痛药物剂量,甚至短时间使用肌松剂 [23]。
(2)呼气末正压(PEEP)
目前认为高水平PEEP(>12 cmH 2O)不能改善整体ARDS患者的病死率,但可能有益于中重度ARDS患者 [24],如何个体化设置PEEP最佳目前仍不明确。建议根据肺的可复张性调节PEEP水平 [16, 25-27],若患者出现了下列情况之一,即可认为肺可复张性高:①PaO 2/FiO 2在PEEP 5cmH2O时<150 mmHg;②PEEP由5 cmH 2O增加至15 cmH 2O 20 min后,患者出现两种或以上的下述情况:PaO 2增加、呼吸系统顺应性增加和死腔量降低。对于肺泡可复张性较差的患者,建议给予低水平PEEP设置;相反,应给予高水平PEEP设置 [16, 27]。
(3)俯卧位通气
对于常规通气参数调节未能改善氧合的重度ARDS患者(PFR<100 mmHg),尤其病变呈不均一性分布时,推荐常规实施俯卧位通气,且俯卧位通气时间至少大于12小时 [28, 29]。
(4)肌松药物
对于中重度ARDS患者(PFR<150 mmHg),目前认为不必常规给予肌松剂治疗 [30]。当患者出现严重的呼吸窘迫症状和人机不协调、呼吸驱动过强导致难以实施小潮气量通气、难治性低氧血症或高碳酸血症时可以考虑使用肌松剂 [31]。
(5)肺复张手法
肺复张手法(RM)主要应用难治性低氧血症患者的补救措施,不能常规应用于ARDS患者;过高水平RM(最大气道压 60cmH 2O,2min)会恶化ARDS患者预后 [32],尤其对于存在血流动力学不稳定的患者。
(6)高频振荡通气
目前证实高频振荡通气(HFOV)不能常规应用于ARDS患者 [16, 21],而且HFOV可能会导致病房内气溶胶的污染 [2, 33]。若常规正压通气不能维持氧合,又无条件行ECMO,可考虑给予HFOV。
2、院感防控
既往SARI数据显示,10%~30% SARI患者需要进行气管插管和有创机械通气 [2, 33],而这是导致医务人员感染SARI病原菌的最常见的操作 [34],气道分泌物的气溶胶或飞沫传播是最重要的途径 [33]。因此,对于有创正压通气的SARI患者,医务人员应更加关注SARI相关的院感防控措施和及时加深对SARI疾病的认识。与气管插管和有创正压通气相关的院感防控措施见表3 [4, 33]。


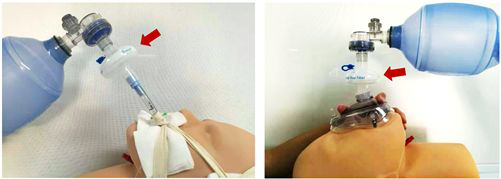
【图7】使用简易呼吸器时细菌/病毒过滤器的位置(图中箭头为过滤器位置)

【图8】动力型空气净化装置(power air purifying respirator, PAPR)
a 佩戴者前面;b 佩戴者后面为电池、HEPA过滤器以及输送纯净气体至头罩的管路 [4]
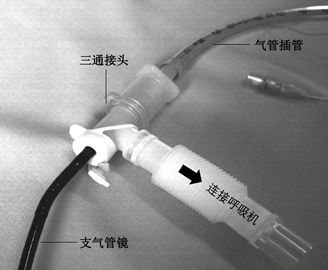
【图9】有创正压通气时支气管镜连接示意图

【图10】有创正压通气时细菌/病毒过滤器安装位置
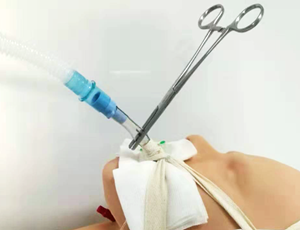
【图11】断开有创呼吸机回路前,短暂夹闭气管插管后再连接呼吸机
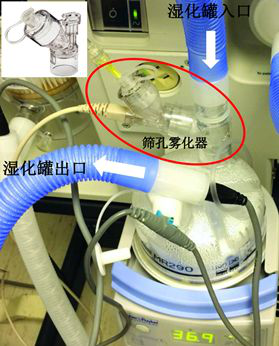
【图12】有创正压通气时筛孔雾化器的放置位置
参考文献
1. World Health Organization: Clinical management of severe acute respiratory infection when Novel coronavirus (nCoV) infection is suspected: Interim Guidance. 2020. https://www.who.int/docs/default-source/coronaviruse/clinical-management-of-novel-cov.pdf?sfvrsn=bc7da517_2.
2. Phua GC and Govert J. Mechanical ventilation in an airborne epidemic. Clin Chest Med, 2008, 29(2): 323-8, vii.
3. Lee N, Hui D, Wu A, et al. A major outbreak of severe acute respiratory syndrome in Hong Kong. N Engl J Med, 2003, 348(20): 1986-94.
4. Yam LY, Chen RC, and Zhong NS. SARS: ventilatory and intensive care. Respirology, 2003, 8 Suppl: S31-5.
5. O'Driscoll BR, Howard LS, Earis J, et al. BTS guideline for oxygen use in adults in healthcare and emergency settings. Thorax, 2017, 72(Suppl 1): ii1-ii90.
6. 中华医学会呼吸病学分会呼吸危重症医学学组. 成人经鼻高流量湿化氧疗临床规范应用专家共识. 中华结核和呼吸杂志, 2019, 42(2): 83-91.
7. Frat JP, Thille AW, Mercat A, et al. High-flow oxygen through nasal cannula in acute hypoxemic respiratory failure. N Engl J Med, 2015, 372(23): 2185-96.
8. Hui DS, Chow BK, Lo T, et al. Exhaled air dispersion during high-flow nasal cannula therapy versus CPAP via different masks. Eur Respir J, 2019, 53(4).
9. Leung CCH, Joynt GM, Gomersall CD, et al. Comparison of high-flow nasal cannula versus oxygen face mask for environmental bacterial contamination in critically ill pneumonia patients: a randomized controlled crossover trial. J Hosp Infect, 2019, 101(1): 84-87.
10. Esquinas AM, Egbert Pravinkumar S, Scala R, et al. Noninvasive mechanical ventilation in high-risk pulmonary infections: a clinical review. Eur Respir Rev, 2014, 23(134): 427-38.
11. McCracken J. Should noninvasive ventilation be considered a high-risk procedure during an epidemic? Cmaj, 2009, 181(10): 663-4.
12. Brochard L, Lefebvre JC, Cordioli RL, et al. Noninvasive ventilation for patients with hypoxemic acute respiratory failure. Semin Respir Crit Care Med, 2014, 35(4): 492-500.
13. Rochwerg B, Brochard L, Elliott MW, et al. Official ERS/ATS clinical practice guidelines: noninvasive ventilation for acute respiratory failure. Eur Respir J, 2017, 50(2).
14. Cheung TM, Yam LY, So LK, et al. Effectiveness of noninvasive positive pressure ventilation in the treatment of acute respiratory failure in severe acute respiratory syndrome. Chest, 2004, 126(3): 845-50.
15. Yam LY, Chan AY, Cheung TM, et al. Non-invasive versus invasive mechanical ventilation for respiratory failure in severe acute respiratory syndrome. Chin Med J (Engl), 2005, 118(17): 1413-21.
16. 中华医学会呼吸病学分会呼吸危重症学组. 急性呼吸窘迫综合征患者机械通气指南(试行). 中华医学杂志, 2016, 96(6): 404-424.
17. Antonelli M, Conti G, Esquinas A, et al. A multiple-center survey on the use in clinical practice of noninvasive ventilation as a first-line intervention for acute respiratory distress syndrome. Crit Care Med, 2007, 35(1): 18-25.
18. Frat JP, Ragot S, Coudroy R, et al. Predictors of Intubation in Patients With Acute Hypoxemic Respiratory Failure Treated With a Noninvasive Oxygenation Strategy. Crit Care Med, 2018, 46(2): 208-215.
19. Rana S, Jenad H, Gay PC, et al. Failure of non-invasive ventilation in patients with acute lung injury: observational cohort study. Crit Care, 2006, 10(3): R79.
20. Hui DS, Hall SD, Chan MT, et al. Noninvasive positive-pressure ventilation: An experimental model to assess air and particle dispersion. Chest, 2006, 130(3): 730-40.
21. Fan E, Del Sorbo L, Goligher EC, et al. An Official American Thoracic Society/European Society of Intensive Care Medicine/Society of Critical Care Medicine Clinical Practice Guideline: Mechanical Ventilation in Adult Patients with Acute Respiratory Distress Syndrome. Am J Respir Crit Care Med, 2017, 195(9): 1253-1263.
22. Amato MB, Meade MO, Slutsky AS, et al. Driving pressure and survival in the acute respiratory distress syndrome. N Engl J Med, 2015, 372(8): 747-55.
23. Slutsky AS and Ranieri VM. Ventilator-induced lung injury. N Engl J Med, 2013, 369(22): 2126-36.
24. Briel M, Meade M, Mercat A, et al. Higher vs lower positive end-expiratory pressure in patients with acute lung injury and acute respiratory distress syndrome: systematic review and meta-analysis. Jama, 2010, 303(9): 865-73.
25. Cressoni M, Chiumello D, Algieri I, et al. Opening pressures and atelectrauma in acute respiratory distress syndrome. Intensive Care Med, 2017, 43(5): 603-611.
26. Gattinoni L, Caironi P, Cressoni M, et al. Lung recruitment in patients with the acute respiratory distress syndrome. N Engl J Med, 2006, 354(17): 1775-86.
27. van der Zee P and Gommers D. Recruitment Maneuvers and Higher PEEP, the So-Called Open Lung Concept, in Patients with ARDS. Crit Care, 2019, 23(1): 73.
28. Guerin C, Reignier J, Richard JC, et al. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med, 2013, 368(23): 2159-68.
29. Lee JM, Bae W, Lee YJ, et al. The efficacy and safety of prone positional ventilation in acute respiratory distress syndrome: updated study-level meta-analysis of 11 randomized controlled trials. Crit Care Med, 2014, 42(5): 1252-62.
30. Moss M, Huang DT, Brower RG, et al. Early Neuromuscular Blockade in the Acute Respiratory Distress Syndrome. N Engl J Med, 2019, 380(21): 1997-2008.
31. Hraiech S, Yoshida T, and Papazian L. Balancing neuromuscular blockade versus preserved muscle activity. Curr Opin Crit Care, 2015, 21(1): 26-33.
32. Cavalcanti AB, Suzumura EA, Laranjeira LN, et al. Effect of Lung Recruitment and Titrated Positive End-Expiratory Pressure (PEEP) vs Low PEEP on Mortality in Patients With Acute Respiratory Distress Syndrome: A Randomized Clinical Trial. Jama, 2017, 318(14): 1335-1345.
33. Lapinsky SE and Hawryluck L. ICU management of severe acute respiratory syndrome. Intensive Care Med, 2003, 29(6): 870-875.
34. Caputo KM, Byrick R, Chapman MG, et al. Intubation of SARS patients: infection and perspectives of healthcare workers. Can J Anaesth, 2006, 53(2): 122-9.
作者:夏金根、詹庆元 - 中日友好医院呼吸与危重症医学科;程真顺 - 武汉大学中南医院呼吸与危重症医学科
本文转载自订阅号「重症与康复」(ID:CriticalAndRehabCare)
原链接戳:SARI的呼吸支持:临床指针与院感防控


