摘要
实体器官移植后发生淋巴瘤属于移植后淋巴增殖性疾病(PTLD)的一种。本文报道1例双肺移植后10个月余、以间断发热为首要表现的EB病毒阴性弥漫大B细胞淋巴瘤,同时合并噬血细胞综合征,给予利妥昔单抗联合依托泊苷化疗后,实现完全缓解。
患者男,39岁,因「肺移植术后10个月余,间断发热2周」就诊于中日友好医院。患者入院前10个月余因「间质性肺疾病、肺动脉高压、呼吸衰竭」在静脉-静脉体外膜肺氧合(venovenous extracorporeal membrane oxygenation,VV-ECMO)辅助下序贯双肺移植术,术后给予泼尼松+他克莫司+吗替麦考酚酯三联抗排异治疗,7个月前查血常规发现淋巴细胞增高,绝对值波动于(3.50~5.03)×109/L,查血浆EB病毒、人巨细胞病毒(cytomegalovirus,CMV)核酸均阴性。5个月前因外周血淋巴细胞升高行骨髓穿刺及活检结果未见淋巴系统异常增殖证据。2周前患者无明显诱因出现午后低热,伴明显乏力、双下肢肌肉酸痛。既往史无特殊。体检生命体征平稳,全身浅表淋巴结未触及肿大,双肺呼吸音清,肝脾肋下未及。
辅助检查:血常规示白细胞7.62×109/L,中性粒细胞百分比49.0%,淋巴细胞3.10×109/L,淋巴细胞百分比40.7%,血红蛋白72 g/L,血小板91×109/L;血生化示肝肾功能正常,甘油三酯3.71 mmol/L,乳酸脱氢酶(lactate dehydrogenase,LDH)899 U/L;降钙素原(procalcitonin,PCT)正常;C反应蛋白(C-reactive protein,CRP)8.15 mg/dl;ESR为86 mm/1 h。胸部CT正常,腹部CT提示脾脏饱满。3次血培养+1次骨髓培养均阴性,支气管肺泡灌洗液病原学检测均阴性,血结核淋巴细胞干扰素释放试验、G试验、GM试验、隐球菌荚膜抗原阴性,布氏杆菌乳胶凝集试验阴性,血浆CMⅤ、EB病毒核酸阴性;群体反应性抗体(population reactive antibody,PRA)阴性。入院后监测血红蛋白迅速降低(4 d内由72 g/L降至58 g/L),考虑不除外血液系统肿瘤,行正电子发射计算机断层显像(positron emission tomography-computed tomography,PET/CT)检测可见视野内骨弥漫性代谢增加,肝脏多发高代谢灶,右侧肾上腺增厚伴代谢增加,脾脏略大(图1)。
为明确骨髓病变,行骨髓穿刺及活检回报:
(1)骨髓细胞形态学:15.5%异常淋巴细胞,考虑淋巴系统恶性疾病;
(2)骨髓组织病理:髓腔内充满CD20阳性B淋巴细胞(图2),其间散在三系造血灶,结合免疫组织化学符合B细胞淋巴瘤,弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)可能性大;免疫组织化学结果:CD138(散在+),CD20(弥漫+),CD3(散在+),CD5(散在+),CD235a(红系+),CD61(巨核系+),CD79α(弥漫+),CD34(-),MPO(髓系+),PGM-1(散在+),CD117(-),CD10(部分+),CD30(-),Bc16(部分+),Ki67(MIB-1)约(60%+),MUM1(+),EB病毒编码的小RNA(Epstein-Barr virus-encoded small RNA,EBER)原位杂交(-)。
(3)骨髓流式细胞免疫分型:成熟淋巴细胞占有核细胞比例为40.7%,见异常表型B淋巴细胞占有核细胞的2.3%,免疫表型为CD5-CD10-CD19+CD20+ FMC-7+CD22+CD200-CD79b+CD23-CD25+CD103+CD11c-KAPPA+LAMBDA-CD45+,T淋巴细胞免疫表型为CD2+CD3+CD5+CD7+CD38-CD56-CD57+-,CD4+/CD8+比例正常。
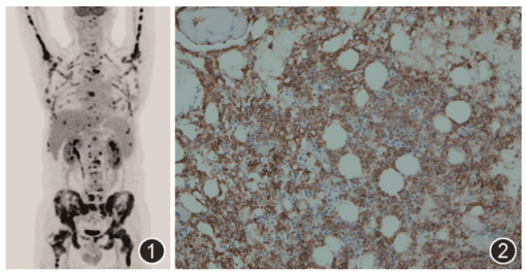
图1 患者PET/CT检查可见视野内骨弥漫性代谢增加,肝脏多发高代谢灶,脾脏略大
图2 患者骨髓活检病理可见骨髓腔内充满CD20染色(+)异形B淋巴细胞,散在及簇状分布 EnVision法 高倍放大
综上,患者诊断DLBCL明确。同时查血清铁蛋白>1 500 μg/L,可溶性CD25(soluble CD25,sCD25)>44 000 ng/L,考虑DLBCL继发噬血细胞综合征。针对淋巴瘤,给予下调免疫抑制剂(停用吗替麦考酚、降低他克莫司血药浓度)、利妥昔单抗单药6周期化疗;针对噬血细胞综合征,给予依托泊苷6周期化疗。
化疗后第2天患者体温降至正常,双下肢酸痛逐渐好转。
4个月后复查骨髓穿刺及活检、流式细胞分析提示DLBCL完全缓解,血清铁蛋白、LDH、甘油三酯降至正常,复查PET/CT提示全身多发骨弥漫性代谢增加及肝脏、肾上腺多发高代谢灶均消失,脾脏较前缩小(图3、4)。
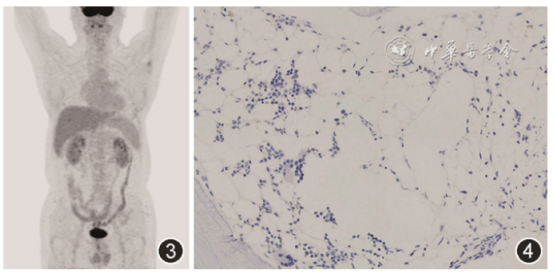
图3 患者化疗后复查PET/CT可见高代谢灶均消失,脾脏较前缩小
图4 患者化疗后复查骨髓活检病理未见CD20染色(+)异形B淋巴细胞 EnVision法 高倍放大
讨论
王诗尧(呼吸与危重症医学科):
本例特点:(1)青年男性,肺移植术后10个月;(2)急性起病,以不明原因发热为主要表现;(3)体检无明显阳性体征;(4)实验室检查包括多次血培养、骨髓培养、血清G试验、GM试验、CMV、EB病毒核酸、支气管肺泡灌洗液病原学检查等均阴性,系统性感染证据不足;(5)患者LDH升高,外周血淋巴细胞数增加,血红蛋白进行性减低,PET/CT示全身骨弥漫性代谢增加,骨髓穿刺及活检明确诊断弥漫大B细胞淋巴瘤,同时血清铁蛋白及sCD25明显升高,合并诊断噬血细胞综合征。
综上,患者弥漫大B细胞淋巴瘤合并噬血细胞综合征诊断明确,实体器官移植或异基因造血干细胞移植后发生淋巴瘤属于移植后淋巴增殖性疾病(post-transplant lymphoproliferative disease,PTLD)的范畴,本例患者肺移植后的突出特点为早期出现外周血淋巴细胞增高,在较强免疫抑制前提下出现持续的淋巴细胞增高,需警惕PTLD,患者在发现淋巴细胞增高2个月后曾行骨髓穿刺及活检排查PTLD,结果未见明显异常,但在后续的随访中患者出现不明原因发热,充分排查感染(部位包括肺、腹部、泌尿系、骨髓,病原类型包括细菌、真菌、病毒)后基本除外感染性疾病,结合既往淋巴细胞增高病史,需考虑血液系统肿瘤可能,后完善PET/CT及复查骨髓穿刺活检后明确诊断为弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)。
富丽萍(核医学科):
本例患者18F-FDG PET/CT检查见四肢骨及中轴骨存在弥漫放射性摄取,于放射性摄取强度极高处,骨质仍然完整,未见皮质骨破坏,符合血液系统肿瘤骨髓浸润特点,即骨骼中异常放射性浓聚。但患者全身未见肿大及异常放射性摄取的淋巴结,仅存在结外受累,与淋巴瘤一般特征不符,需要病理明确诊断。患者肝包膜下、肝实质内多发异常放射性摄取结节,右侧肾上腺增厚伴代谢增加,性质难以判断,需化疗后再次行PET/CT评价肝内及肾上腺病灶。经化疗后患者肝内异常放射性摄取结节消失,考虑淋巴瘤肝脏受累。患者虽脾脏异常增大,但不存在明显代谢增高,可能为继发于血液系统疾病的表现,经治疗后患者脾脏明显缩小。18F-FDG PET/CT在实体器官移植后患者出现不明原因炎症反应或发热时具备一定诊断价值,既往有研究发现该类患者约1/3(18/58)经18F-FDG PET/CT检查后提示阳性发现,其中有3例患者诊断淋巴瘤[1]。
钟定荣(病理科):
患者骨髓活检示髓腔内充满大的异形淋巴细胞,免疫组织化学提示为CD20染色阳性B淋巴细胞,散在或小簇状分布,其间散在三系造血灶,考虑DLBCL可能性大,流式细胞免疫分型见2.3% CD5-CD10-单克隆B淋巴细胞,确诊为DLBCL。患者DLBCL发生于双肺移植后,属于PTLD的一种。PTLD是移植后最常见的恶性肿瘤类型之一,也是具有潜在致命性的并发症,预后不良[2, 3]。PTLD分为早期病变、多形性PTLD、单形性PTLD三个连续状态[4]。大多数PTLD均与EB病毒感染有关,但亦有约20%的PTLD与EB病毒感染无关[5],EB病毒阴性的PTLD一般发病距离移植时间更晚、组织学更倾向于表现为单形性PTLD且更常见高侵袭性淋巴瘤、更易累及骨髓、预后更差[6, 7]。患者移植后1年内即出现EB病毒阴性淋巴瘤,不除外术前即存在淋巴瘤可能。
李振玲(血液科):
PTLD的发生取决于移植术后抗排异强度和EB病毒感染情况。一般来说淋巴增殖的发生是连续的过程。患者在诊断淋巴瘤5个月前因存在持续淋巴细胞增高,行骨髓穿刺筛查疾病性质,当时无明显异常发现,后因发热、血红蛋白进行性减低再次行骨髓穿刺+活检,形态学考虑淋巴瘤可能性大,依靠免疫组织化学及流式细胞分析明确诊断DLBCL。需要注意仅依靠骨髓穿刺及活检难以确诊淋巴瘤,基因重排和免疫分型、流式细胞分析可协助确定诊断,因此当患者在随访怀疑PTLD时,可在形态学基础上加做如上检查,提高疾病诊断的敏感度。
噬血细胞综合征(hemophagocytic lymphohistiocytosis,HLH)是一种危及生命的以巨噬细胞活化为主要特征的过度炎症反应状态,可分为原发性与继发性。继发性HLH指没有家族性基因突变的HLH,多继发于病毒感染、自身免疫性疾病、淋巴瘤,部分研究显示HLH亦与移植后状态有关[8]。本例患者中,根据发热症状,血红蛋白下降,TG、LDH、血清铁蛋白、sCD25上升,可明确诊断HLH,因患者同时诊断淋巴瘤,考虑HLH继发于淋巴瘤。
对于明确诊断单形性PTLD的患者,应考虑行淋巴瘤标准治疗。利妥昔单抗目前已成为多形性PTLD及单形性DLBCL对降低免疫抑制强度无反应的标准治疗,其作为一线治疗时可明显改善患者的总生存期[9]。有研究显示单药给予利妥昔单抗4周期后总反应率为44%~79%,完全缓解率为20%~55%,在此基础上继续单药利妥昔单抗巩固治疗,可增加完全缓解率[10]。本例患者中,考虑同时存在HLH,且为肺移植后状态,DLBCL标准化疗药物毒性及继发性感染风险极高,故选择方案为利妥昔单抗单药治疗,同时加用依托泊苷治疗HLH。患者诱导治疗后达到完全缓解,后续可利妥昔单抗单药维持治疗,另患者存在可疑淋巴瘤肾上腺受累,为中枢神经系统淋巴瘤受累的高危因素,故可予鞘内注射甲氨蝶呤及地塞米松治疗。
陈文慧(肺移植科):
在肺移植受者中,PTLD的累积发病率在1年时为1.1%,10年时为4.1%,有接近50%的患者发生在肺移植后第1年内。PTLD发生的危险因素包括年龄、移植前存在恶性肿瘤、EB病毒血清学错配(D+/R-)、原发病为间质性肺疾病、使用免疫诱导等[11]。PTLD的初始治疗为降低免疫抑制强度,但单形性PTLD患者单纯降低免疫抑制强度多数无效,对于CD20+单形性PTLD患者,应在降低免疫抑制强度前提下加用抗CD20单抗(利妥昔单抗)进行治疗,或者在此基础上加用化疗(多选择CHOP方案),可同时或序贯应用[10];CD20-的单形性PTLD患者不适合使用利妥昔单抗治疗,可在减少免疫抑制强度前提下联合化疗。
肺移植后PTLD国内报道较少,目前仅见3例报道,病理均诊断为单形性PTLD(DLBCL),均与EB病毒感染相关(EBER原位杂交阳性)[12]。本例患者肺移植术后10个月确诊DLBCL,为单形性PTLD表现,患者外周血EB病毒核酸及病理EBER原位杂交均阴性,为EB病毒阴性PTLD。本例虽以骨髓受累为主要特征,但发病时间距离移植较短,较为罕见。本例在确诊PTLD后迅速降低免疫抑制强度,但考虑到单形性PTLD多数需要联合化疗,且患者合并HLH,故予利妥昔单抗联合依托泊苷化疗,4个月后评估病情提示患者对该方案反应良好。PTLD是实体器官移植后危及生命的并发症,需在随访时密切关注,尤其当出现不明原因发热等表现时,需仔细与感染性疾病鉴别。如PTLD确诊应及时启动治疗,尽可能延长移植受者的存活时间。
参考文献(略)
作者:王诗尧 李振玲 富丽萍 钟定荣 陈文慧
单位:中日友好医院呼吸与危重症医学科 国家呼吸医学中心 国家呼吸临床研究中心 中国医学科学院呼吸病学研究院;中日友好医院血液科;中日友好医院核医学科;中日友好医院病理科;中日友好医院肺移植科 国家呼吸医学中心 国家呼吸临床研究中心 中国医学科学院呼吸病学研究院
本文转载自订阅号「中华结核和呼吸杂志」
原链接戳:【临床病例(理)讨论】双肺移植后早期EB病毒阴性弥漫大B细胞淋巴瘤1例
引用本文: 王诗尧, 李振玲, 富丽萍, 等. 双肺移植后早期EB病毒阴性弥漫大B细胞淋巴瘤1例[J]. 中华结核和呼吸杂志, 2022, 45(3): 289-292. DOI: 10.3760/cma.j.cn112147-20210812-00560.


