64岁男性患者,因间断发热半月,双下肢水肿5天入院,2年前曾出现EB病毒感染,此次发热时间长,治疗效果差。病原学检查未见阳性回报,RBC、PLT、Fib下降,血清铁蛋白、sCD25显著升高。该患者考虑哪些诊断?治疗方案如何选择?
临床资料
一般资料
患者,男性,64岁,主因「间断发热半月,双下肢水肿5天」于2018年9月11日入院。
现病史
患者半月前(2018年8月25日)室内游泳后(曾有呛咳、受寒)出现发热,体温最高38.6℃,伴畏寒、咽痛、咳嗽,咳少量白痰,无其他系统伴随症状,当地诊所予抗病毒及化痰治疗(具体用药不详),发热无改善,并逐渐出现呼吸困难。
10余天前(2018年8月28日)于当地医院查血常规示WBC 8.96×109/L,NEU% 75%,PCT正常,血清支原体IgM抗体(+),予静脉点滴「头孢唑啉+依诺沙星+阿奇霉素」治疗1周,发热及呼吸困难仍未缓解。
5天前(2018年9月6日)转至某三甲医院,化验血常规示WBC 7.34×109/L、NEU% 87.7%、LYM 0.43×109/L、Hb及PLT正常,CRP 340 mg/L,铁蛋白>2000 ng/ml(参考范围30~400 ng/ml);胸部CT示:双肺多发斑片高密度影,左肺为著,双侧胸腔积液,纵隔及肺门多发淋巴结增大(图1):
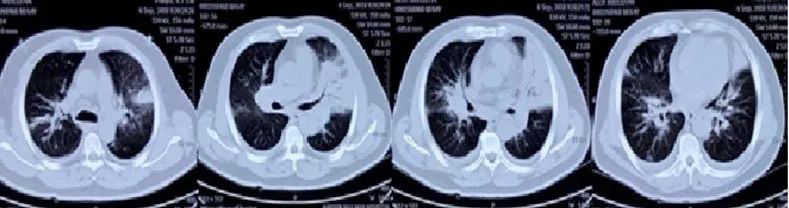
图1:外院胸部CT(2018年9月6日)
诊断为「肺部感染、胸腔积液」,先后予「更昔洛韦、美罗培南、亚胺培南、利奈唑胺、伏立康唑」抗感染治疗,患者体温较前无明显下降,咳痰量增多、呼吸困难加重,并出现双下肢凹陷性水肿。
既往史
既往2型糖尿病17年,平素注射胰岛素降糖,空腹血糖平素控制在7~9 mmol/L。2年前曾因「发热」于多家医院血液科就诊,发现纵隔及浅表淋巴结肿大、血EBV-DNA(+)、CD4+及CD8+T细胞计数减低,予抗病毒等治疗后未再发热,自述淋巴结肿大消退。
入院查体
T 39.4℃,P 102次/min,R 22次/min,BP 120/75 mmHg(1 mmHg=0.133 kPa),SpO2 88%(FiO2 0.45)。神清,精神欠佳。口唇无发绀,颈静脉无怒张,全身浅表淋巴结未触及。呼吸急促,双肺呼吸音清,双肺可闻及哮鸣音,无胸膜摩擦音。心律齐,各瓣膜听诊区未闻及杂音,无心包摩擦音。腹软,无压痛,肝脾肋下未触及,墨菲征阴性,双下肢指凹性水肿。
辅助检查(9月11日)
入院时鼻导管吸氧(FiO2 0.45)状态下动脉血气:pH 7.49、PaCO2 31.6 mmHg,PaO2 79 mmHg,HCO3- 23.2 mmol/L,BE 0.6 mmol/L,Lac 4.3 mmol/L。
血常规:WBC 8.42×109/L,NEU% 93.7%(↑),LYM 0.42×109/L(↓),Hb 129 g/L,PLT 212×109/L。
炎症指标:PCT 0.56 ng/ml(↑),ESR 39 mm/h(↑),CRP 17.4 mg/dl(↑)。
生化:ALT 93 IU/L(↑),AST 186 IU/L(↑),ALB 29.3 g/L(↓),ALP 269 IU/L(↑),γ-GT 362 IU/L(↑),K+ 3.3 mmol/L(↓),Na+ 130 mmol/L(↓),Cr 70.8 μmol/L,LDH 894 IU/L(↑)。
淋巴细胞亚群:淋巴细胞计数290 cell/μl(↓)(1000~3000 cell/μl),T淋巴细胞155 cell/μl(↓)(808~2072 cell/μl),T辅助/诱导96 cell/μl(↓)(380~1028 cell/μl),T抑制/杀伤64 cell/ul(↓)(229~982 cell/μl)。
诊疗过程
入院诊断
患者入院诊断考虑发热、肺部阴影、纵隔淋巴结肿大原因待查,Ⅰ型呼吸衰竭,结合其社区急性起病,以发热伴咳嗽、咳痰、呼吸困难为主要表现,肺部听诊可及痰鸣音、干啰音,NEU%、PCT、CRP及ESR升高,入院后首先考虑感染性发热、肺部感染可能性大。
治疗措施
给予哌拉西林他唑巴坦4.5 g q8h、左氧氟沙星0.5 g qd静脉滴注,预防量联磺甲氧苄啶口服预防PCP。治疗1周后,患者仍反复发热,每日热峰38.5~39℃。
病原学检查未见阳性回报:血培养多次阴性,血G、GM试验、T-SPOT均阴性;痰标本(9月12日、16日2次)细菌涂片及培养、真菌及抗酸杆菌涂片均阴性,真菌培养示白念珠菌少量(1次),Gene-Xpert试验阴性,肺炎支原体、肺炎衣原体、军团菌、巨细胞病毒、腺病毒、呼吸道合胞病毒、甲/乙流病毒核酸均阴性;BALF(9月18日)GM 2.38(↑)、EB病毒核酸阳性(CT值20.12),其余细菌及真菌培养、Gene-Xpert试验、包括腺病毒在内的多种病毒核酸、不典型病原体核酸均阴性,BALF细胞分类示淋巴细胞和中性粒细胞比例升高(分别为12%和82%)。
患者呼吸困难加重,双肺听诊可闻及明显哮鸣音,复查胸部CT示双肺病变明显进展(图2)。
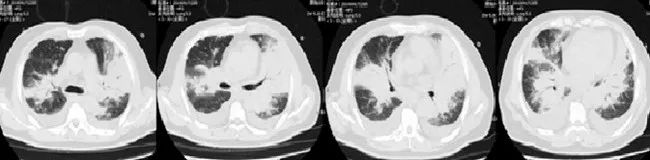
图2 我院胸部CT(2018年9月17日)
氧合指数最低降至70~80 mmHg,无创呼吸支持无法维持氧合,于9月17日转入MICU,行气管插管、有创机械通气,完善床旁支气管镜示双肺各叶段支气管黏膜充血水肿明显,少许血性泡沫样分泌物,左、右主支气管及各叶段支气管开口略狭窄。
综合患者病情特点,考虑非感染性发热可能性大,加用甲泼尼龙静脉滴注(80 mg第1天→40 mg第2天→120 mg第3~7天),调整抗生素方案为左氧氟沙星+美罗培南+伏立康唑,进一步完善化验检查示血清铁蛋白>15000 ng/ml(↑),血EB病毒核酸3.27×104 copies/ml(参考范围<5×102 copies/ml),肺穿刺活检示肺泡腔内充满纤维素性渗出物,局部见机化,肺泡间隔不宽,可见急/慢性炎细胞浸润,符合急性纤维素性机化性肺炎;骨髓涂片可见噬血现象,骨髓活检提示感染骨髓象。
患者自9月19日起出现血细胞计数减低(Hb、PLT两系为主)、Fib进行性降低,结合存在发热、超高铁蛋白、sCD25水平升高、脾大、骨髓涂片噬血现象,诊断为噬血细胞综合征,考虑与慢性活动性EBV感染有关,予人丙种球蛋白0.4 g/kg(疗程5天)、地塞米松10 mg/m2 qd静脉滴注、更昔洛韦抗病毒治疗。患者自9月17日加用糖皮质激素后未再发热,复查胸部CT示双肺实变较前明显吸收(图3),纵隔淋巴结肿大亦较前缩小(图4),氧合明显改善,转呼吸科普通病房继续住院治疗。
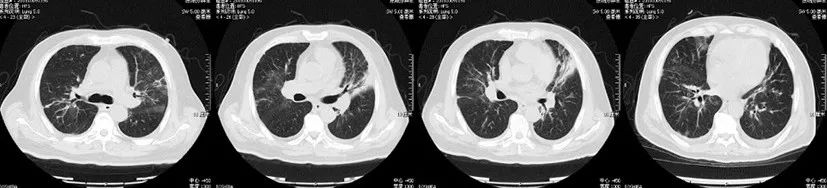
图3 治疗好转后胸部CT(2018年10月9日)
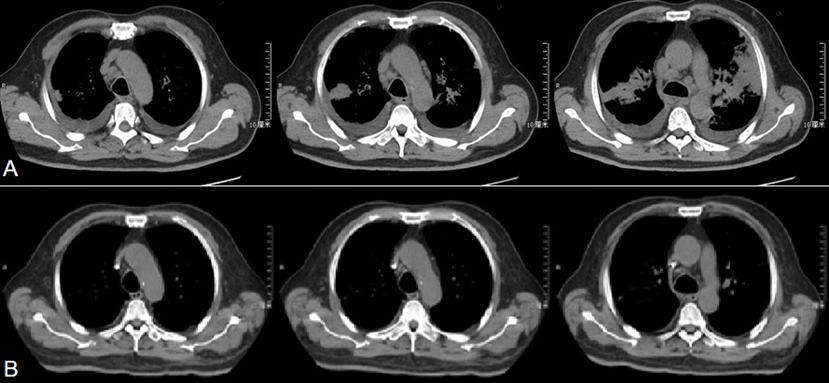
图4 治疗后纵隔淋巴结较前缩小
注:A为2018年9月17日,B为2018年10月9日
急性纤维素性机化性肺炎(AFOP)预后差,临床诊断困难。噬血细胞综合征(HPS)可继发于多种疾病,早期识别、及时治疗可改善预后。本患者病程中先后出现AFOP和HPS,通过何种方法能尽快作出判断?是否与慢性活动性EB病毒感染有关?
噬血细胞综合征(HPS)又称噬血细胞性淋巴细胞组织增生症(HLH),是一组由多种病因诱发细胞因子瀑布式释放、组织细胞增生伴随其吞噬各种造血细胞为特征的综合征,临床以持续发热、肝/脾大、全血细胞减少以及骨髓、肝、脾、淋巴组织发现噬血现象为主要特征。目前公认的HLH诊断标准由国际组织细胞协会于2004年修订[1],符合以下两条标准中任何一条时可以诊断HLH:①分子诊断符合HPS。②符合以下8条指标中的5条:a. 发热:体温>38.5℃,持续>7 d;b. 脾大;c. 血细胞减少(累及外周血两系或三系):Hb<90 g/L,PLT<100×109/L,NEU<1.0×109/L且非骨髓造血功能减低所致;d. 高甘油三酯血症和/或低纤维蛋白原血症:TG≥3 mmol/L,Fib≤1.5 g/L;e.在骨髓、脾脏或淋巴结中找到噬血细胞;f. 血清铁蛋白>500 μg/L;g. NK细胞活性降低或缺如;h. 可溶性白细胞介素-2受体(sCD25)≥升高2400 U/ml。HPS分为原发性和继发性,其中继发性HPS由感染、肿瘤、自身免疫病引起居多,感染相关性HPS最常见,其中EB病毒感染占大部分,其次,恶性肿瘤相关性HPS也较为常见,尤其是淋巴瘤相关性噬血细胞性淋巴组织细胞增生症[2]。
本例患者2年前曾出现过EB病毒感染,此次发热时间长,治疗效果差,外院查血清铁蛋白显著升高,当时虽未出现血细胞减少,但应高度警惕HPS。转入我科后,当出现RBC、PLT、Fib下降趋势时,完善骨髓涂片可见噬血现象,血清铁蛋白、sCD25显著升高,诊断为HPS,早期给予诱导治疗,并积极治疗原发病,进而使患者病情得到控制。
HPS是一种进展迅速的高致死性疾病,及时发现HPS疑似病例并正确诊断至关重要,当患者出现持续发热、血细胞减少、肝/脾大或不明原因的严重肝功能损伤、铁蛋白显著升高时应怀疑HPS,对于疑似患者应及时完善相关检查。本例患者发热、肺内阴影、呼吸衰竭发生在前,噬血现象在后,且血EBV-DNA显著升高,提示继发性HPS,原因考虑与EB病毒感染相关。HPS病因治疗与疾病的预后转归关系密切,因此需早期识别病因。
急性纤维素性机化性肺炎(AFOP)由Beasley等[3]在2002年最先提出,不同于传统弥漫性肺泡损伤(DAD)、隐源性机化性肺炎(COP)及嗜酸细胞性肺炎(EP),组织病理学表现为肺泡腔内大量纤维素沉积并伴有机化的疏松结缔组织,缺乏DAD的典型表现,即透明膜形成,无肉芽肿,不伴有明显的嗜酸性粒细胞浸润。临床主要表现为呼吸困难,可伴有发热、咳嗽等症状,呈急性或亚急性起病,急性起病者多迅速发展为呼吸衰竭,需机械通气治疗,病死率高;影像学表现为双肺多发的边界不清的结节影和实变影,以基底部和支气管血管周围分布为主。由于AFOP的临床表现及影像学表现并无特异性,确诊主要依靠大块肺组织病理。多数病例对糖皮质激素及免疫抑制剂反应良好,但尚无一致治疗方案。患者发热、肺部阴影、呼吸衰竭,临床考虑为重症社区获得性肺炎,但反复完善血、痰、BALF病原学均阴性,外院及我院反复多种抗感染方案无效,需及时考虑非感染性疾病,及时完善肺组织病理学检查,明确诊断,及时治疗,改善预后。病因方面,AFOP可以是特发的,也可以有继发因素或合并其他疾病,总结近年国内外有关AFOP的病例报道,可能的继发性因素主要包括免疫相关疾病、未分类结缔组织病、造血干细胞移植术后、细菌感染、病毒感染、真菌感染(主要为PCP)、血液系统疾病、药物因素等[4]。其中,已报道与AFOP有关的病毒感染包括H1N1[5]、HIV[6]、冠状病毒[7]、CMV[8],尚无EB病毒感染与AFOP相关的文献报道。本患者病程中先后出现AFOP和HPS,AFOP是否同样与慢性活动性EB病毒感染有关,仍有待进一步的观察和研究证实。
总结
AFOP是一类诊断不足的临床病理疾病,表现多样,大部分AFOP患者有明显的发热及肺部阴影,临床易误诊为社区获得性肺炎。急性起病的AFOP患者多迅速发展为呼吸衰竭,需机械通气治疗,病死率高。当反复化验、无阳性病原学证据、使用多种抗感染药物无效时,需考虑该病,及时完善组织病理学检查以明确诊断。此外,EB病毒也可能引起AFOP。HPS是一种进展迅速的高致死性疾病,及时发现HPS疑似病例并正确诊断至关重要,HPS病因治疗与疾病的预后转归关系密切,当患者出现持续发热、血细胞减少、肝/脾大或不明原因的严重肝功能损伤、铁蛋白显著升高时应怀疑HPS。对于疑似患者应及时完善相关检查。这类患者临床可合并多种疾病,要及时识别、早期治疗。
参考文献
[1] Henter J I, Horne A, Aricó M, et al. HPS-2004: Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis[J]. Pediatr Blood Cancer, 2007, 48(2):124-131.
[2] 噬血细胞综合征中国专家联盟. 噬血细胞综合征诊治中国专家共识[J]. 中华医学杂志, 2018, 98(2):91-99.
[3] Beasley M B, Franks T J, Galvin J R, et al. Acute fibrinous and organizing pneumonia: a histological pattern of lung injury and possible variant of diffuse alveolar damage[J]. Arch Pathol Lab Med, 2002, 126(9):1064-1070.
[4] Gomes R, Padrão E, Dabó H, et al. Acute fibrinous and organizing pneumonia: A report of 13 cases in a tertiary university hospital[J]. Medicine (Baltimore), 2016, 95(27):e4073.
[5] Otto C, Huzly D, Kemna L, et al. Acute fibrinous and organizing pneumonia associated with influenza A/H1N1 pneumonia after lung transplantation[J]. BMC Pulm Med, 2013, 13:30.
[6] Heo J Y, Song J Y, Noh J Y, et al. Acute fibrinous and organizing pneumonia in a patient with HIV infection and Pneumocystis jiroveci pneumonia[J]. Respirology, 2010, 15(8):1259-1261.
[7] Cincotta D R, Sebire N J, Lim E, et al. Fatal acute fibrinous and organizing pneumonia in an infant: The histopathologic variability of acute respiratory distress syndrome[J]. Pediatr Crit Care Med, 2007, 8(4):378-382.
[8] Arnaud D, Surani Z, Vakil A, at al. Acute fibrinous and organizing pneumonia (AFOP)[J]. Am J Case Rep, 2017, 18:1242-1246.
作者:蔡莹,王可婧,吴小静,詹庆元;单位:中日友好医院呼吸中心,中日友好医院呼吸与危重症医学科,国家呼吸疾病临床研究中心
本文转载自订阅号「重症肺言」(ID:RCCRC_0067)
原链接戳:持续发热伴肺实变及纵隔淋巴结肿大一例


