摘要
肺电阻抗断层成像(EIT)作为一项相对较新且快速发展的技术,实现了床旁可视化肺通气和肺灌注监测,越来越被临床接受和应用,在重症呼吸管理中具有重要实用价值。但我国尚缺少EIT相关临床应用共识标准。中国卫生信息与健康医疗大数据学会重症医学分会标准委员会、北京肿瘤学会重症医学专业委员会、中国重症肺电阻抗工作组经过系统性文献复习EIT相关的动物和临床研究,广泛征求国内多学科专家意见,通过改良德尔菲法组织专家讨论,形成关于EIT方法与图像分析、重症呼吸治疗应用、存在问题与技术进展三方面,共计23条推荐意见,以促进EIT在重症呼吸管理中的应用。
肺电阻抗成像(electrical impedance tomography,EIT)是一种可在床旁实施的无创、无辐射肺通气监测技术,其基本原理是通过局部电极施加微弱电流,感应呼吸过程中胸腔生物电阻抗变化,再利用相应的成像算法监测肺不同区域内通气功能状态,以实时动态肺断层通气图像呈现。EIT肺通气监测已被广泛应用于重症呼吸管理,如呼气末正压(positive end-expiratory pressure,PEEP)设置、围手术期肺通气监测、指导肺部物理治疗等。同样基于电阻抗变化,近来使用高渗盐水增强造影EIT肺灌注成像在临床应用开展也日益增加,受到广泛关注。EIT作为一项相对较新且快速发展的技术,越来越被临床接受和应用,但相关技术规范和临床应用共识标准需要进一步统一。为此,专家组根据多年来应用和推广经验,制定了本共识,以推动该技术在重症呼吸管理中的应用。
一、共识形成
2021年10月组织了国内10名重症医学及生物工程学专家召开工作会议,讨论该技术临床应用的相关问题。经专家讨论,EIT作为床旁可视化肺通气和血流的重要监测技术,目前有必要并有条件形成共识,以促进重症呼吸管理水平的提高。根据既往工作经验、会议讨论和沟通结果,经过系统性文献复习(从Pubmed,Embase,Medline等数据库中搜索1990年至2021年与肺电阻抗相关技术在重症呼吸管理中的临床研究、个案报道、综述和相关的动物实验等,并结合条目内容补充完善相关文献)、讨论,征集专家意见,形成23条基本条目。
2021年11月通过电子问卷的形式将共识基本条目发给30名重症医学、呼吸与危重病医学、麻醉学、急诊医学等相关领域专家。根据共识条目的理论依据、科学性、可行性进行综合评分。最终综合评分以0~9分计数,确定各条目的推荐强度。其中,0~3分为不推荐,4~6分为弱推荐,7~9分为推荐[1-2]。然后通过改良的德尔菲法,组织6名专家召开会议,结合最新的临床医学证据和重症呼吸治疗管理的发展前沿,分别对共识条目的相关专题进行审阅。之后,共识条目撰写小组根据会议意见,在综合评分的基础上,再次查阅及增补最新文献,形成最终推荐意见,于2021年11月底召开全体专家讨论,对条目进行优化修订,将23条条目归纳为3个方面,即技术方法与图像分析、重症呼吸治疗应用、存在问题与技术进展。
二、EIT的技术方法与图像分析
推荐意见1
需考虑不同电极测量平面以及体位对肺通气图像的影响,应在同一平面进行动态比较评估。[推荐强度:(7.80±1.28)分]
电极缚带位置对EIT功能成像影响显著,不同EIT电极缚带位置反映不同断层的肺通气功能[3-6]。第3肋间平面侧重反映双上肺通气,心脏信号多数情况不出现在该断层范围内,通气图像受其影响较小;第4~5肋间平面侧重反映下肺通气,心脏信号可出现在该断层位置,需考虑心脏对通气图像的影响。低于第6肋间时,可检测到膈肌周期性的负向电阻信号(图像上呈现紫色区域),一般不建议缚带位置低于第6肋间。此外,不同体位变换(平卧位、半坐位、高侧位等)也可影响肺通气图像[7-8]。在临床实践中,EIT肺通气显像解读时应注明测量的肋间平面以及体位,对于单一患者多次测量动态比较,建议对电极缚带位置进行体表标记,以确保在同一平面进行评估。
推荐意见2
建议第4~5肋间作为反映呼气末肺容积以及潮式通气的测量平面,但在膈肌抬高时,电极缚带位置可适当升高。[推荐强度:(7.57±1.22)分]
研究发现在平卧位时第 4~5肋间测量的相关胸腔电阻最能反映全肺呼气末肺容积以及潮气量的变化[4]。一项研究应用肺功能仪和EIT分别记录肺容积和肺阻抗,比较了健康志愿者坐位时EIT电极缚带位置在第3~4肋间、第5肋间和第6~7肋间的区别,发现吸气相和呼气相的肺阻抗/容积比在第5肋间较稳定,而在第3~4肋间和第6~7肋间有显著差异,提示在第5肋间电阻抗变化能较好地反映肺容积变化[6]。
但需要指出的是,肥胖患者、腹腔高压或急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)患者可出现膈肌位置上抬,在第5肋间即可出现膈肌信号,此时应将电极缚带位置适当升高。有学者报道在上腹部大手术及腹腔镜胃减容术中,EIT电极缚带放在第2~4肋间也是可选择方法之一[9-10]。
推荐意见3
肥胖可导致EIT肺通气图像呈“左右肺融合单一类圆型轮廓”,但不影响EIT连续动态的肺通气监测能力。[推荐强度:(7.35±1.31)分]
肥胖患者[体质指数(body mass index,BMI)>30 kg/m2]由于胸廓脂肪密度增高且分布不均、双侧胸壁电阻增加等因素可以影响EIT通气图像的建构。肥胖患者的肺通气图像可表现为左右肺融合单一样类圆形通气区域,而非常见的左-右侧肺通气的轮廓区域(图1)。因此,临床在解读非胸廓畸形出现的肺通气“左右肺融合样畸形轮廓”分布,在排除胸腔实质性病变后,需要考虑到肥胖因素的可能。部分EIT设备建议肺通气显像不能应用于BMI>50 kg/m2的患者。但需要指出的是,虽然肥胖可能导致EIT通气图像轮廓异常,但并不影响其反映肺通气的能力,可用于连续动态监测肺通气功能。临床研究支持EIT可用于监测肥胖患者(BMI:39~60 kg/m2)胃减容术围手术期的肺容积变化、机械通气个体化PEEP设置以及高流量氧疗等呼吸管理[11-13]。

图1 肥胖志愿者(BMI =35 kg/m2,左)和体重正常志愿者(BMI= 21 kg/m2,右)EIT肺通气图像对比
推荐意见4
EIT功能成像时间分辨率高,可实时监测肺通气的变化,判断对呼吸相关治疗的反应性,明确治疗目标与方向;但空间分辨率较低,不建议用于胸部病变的精准解剖学定位。[推荐强度:(7.69±1.12)分]
EIT 功能成像采样频率可达20~50 Hz,相当于1 s可以采集20~50帧图像,时间分辨率高,提供实时动态的肺通气功能,可以敏感地反映呼吸治疗对肺通气的作用,有助建立肺通气目标导向的呼吸管理策略[3]。EIT断层图像平面由32×32像素矩阵组成,通过1 024个像素点来反映肺各区域通气功能。部分EIT机器通过插值等数学算法增加成像像素点的数量,但空间分辨率没有实质性的提高。需要指出的是,EIT功能成像并不能提供组织的精确解剖学定位。首先,EIT图像主要集中反映电极平面附近约5 cm层厚肺的通气状态;其次,由于目前商用机型测量电流通过相邻或者相近电极对注入,体表电流密度大于胸腔中心的电流密度,因此越接近胸腔中央部位,空间分辨率越低;电极平面所显示的形状并非完全与患者形体相吻合。
推荐意见5
建议肺通气/灌注电阻抗断层图像按“自腹侧到背侧的层次分布”以及“以图像中心为原点的四象限分布”进行区域划分。[推荐强度:(7.86±0.96)分]
在临床应用中,可将 EIT肺通气图像人为划分成几个平行区域或几个象限,即定制感兴趣区(region of interest,ROI)(图2)。通过调整 ROI 的位置和尺寸,可定制状态图像的区域量化。各 ROI覆盖的区域由相应的区域阻抗波形显示。与全局阻抗波形相比,区域阻抗波形显示特定 ROI 内阻抗变化的总和,并可对肺部不同区域内的阻抗变化进行比较,即比较肺的区域通气分布情况。常将 EIT 设定为四层模式,并将ROI 3~ROI 4 区认定为肺重力依赖区。当患者发生体位变化时,可导致肺重力依赖区的改变,从而影响肺整体和局部通气的分布。
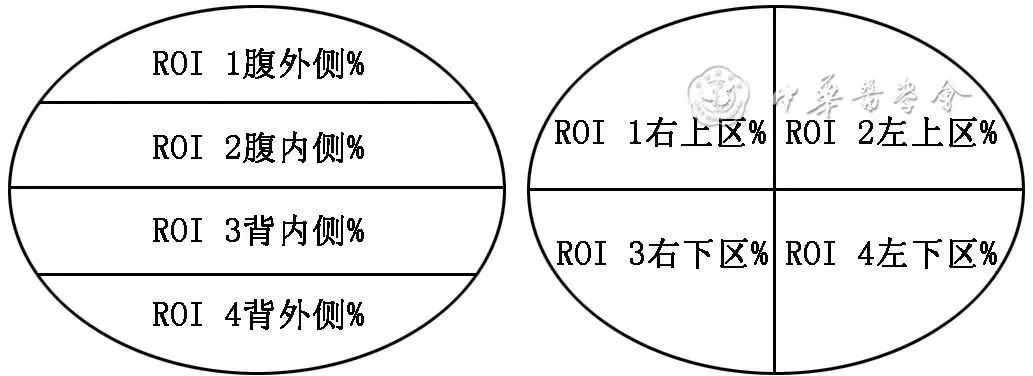
图2 电阻抗成像(EIT)肺通气层次分布及象限分布图
推荐意见6
通过分析呼吸过程中图像区域像素点电阻-时间曲线的变化,可评估全局和局部呼吸力学及其对肺区域的作用效应(通气均一性、通气中心、区域通气延迟、区域肺复张/过度膨胀、气道陷闭等)。[推荐强度:(7.42±1.25)分]
目前市场上常用的EIT成像设备主界面仅显示各ROI的通气比例,但关于局部通气信息的呈现缺乏一致的标准和参考阈值。EIT图像中的每个像素点都具备存储该像素电阻-时间变化曲线的能力,其中包含丰富的局部通气信息,未来需要进一步统一解读。结合呼吸生理进行分析,运用适当的算法可将这些信息转化为反映局部呼吸力学特征的量化指标。例如,计算各像素点潮气电阻变化值离散程度获得的总不均一指数(global inhomogeneity index,GI)[14],可用于反映区域肺通气的异质性。根据各像素点潮气电阻变化值在空间位置上的加权平均计算的通气中心(center of ventilation,COV)[15],旨在量化各种治疗措施引起腹背侧垂直方向上的通气分布变化。有时,局部区域吸气相电阻-时间曲线开始上升的时刻较整体电阻-时间曲线有所延迟,基于局部滞后特性而衍生的区域通气延迟(regional ventilation delay,RVD)[16],与CT观察到的区域肺泡复张存在相关性。利用RVD分布离散程度计算的RVD指数[17],与潮式肺复张密切相关。EIT设备与呼吸机连接还可获得局部压力-容积曲线,有助于识别气道陷闭现象[18]。需要注意的是,EIT通气信息需要结合受试者的实际情况,通过合理的解析才能获得正确反映局部呼吸力学特征的EIT参数。而这些参数的正常范围和临床实用性,有待在更大样本的重症患者群体中进一步验证。
推荐意见7
根据高渗盐水注射后电阻-时间曲线的变化建构EIT肺灌注图像时,应注意排除呼吸因素的干扰。[推荐强度:(7.37±1.54)分]
高渗盐水造影EIT肺灌注技术基于造影剂首次通过成像原理,通过“弹丸”式注射高电导率的造影剂(高渗盐水)引起胸腔电阻抗变化来反映区域肺灌注情况[19]。盐水注射导致某一肺区域电阻下降明显,提示流经该区域造影剂多,即血流灌注多;反之,电阻下降不明显,血流灌注少。为减少呼吸对电阻的干扰,盐水注射要求在呼吸暂停期间实施。呼吸屏气时胸腔总电阻相对维持不变,可以较好地体现盐水注射造影的效应。因此,通过分析呼吸暂停时高渗盐水弹丸式注射引起的电阻-时间曲线(斜率拟合或电阻下降最大幅度),可以建构肺灌注图像。但如果纳入分析的电阻-时间造影曲线受到了呼吸因素的干扰,可能出现灌注显像与通气显像高度吻合的情况。在此,强调EIT肺灌注显像分析时,对盐水电阻-时间曲线进行初始质控评估,注意排除盐水注射期间是否受呼吸因素的干扰[20]。
三、EIT的重症呼吸治疗应用
推荐意见8
EIT可监测与自主呼吸相关性肺损伤有关的呼吸钟摆现象,但应排除膈肌与胸腔积液所致反向电阻变化信号对钟摆现象识别的干扰。[推荐强度:(7.13±1.37)分]
呼吸钟摆是由于肺泡不同步通气造成肺内气体重分布的现象,常见于连枷胸、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、ARDS等疾病。对于实施ICU内机械通气的急性呼吸衰竭或ARDS患者,保留适度的自主呼吸有助于改善重力依赖区通气、提高氧合和预防膈肌萎缩。然而,过强的吸气努力却有可能通过呼吸钟摆机制加重肺损伤[21]。由于钟摆现象仅涉及肺内气体重分布,其本身不改变潮气量,这也就意味着对于存在肺损伤的重症患者而言,即使已经采取小潮气量通气策略,钟摆现象仍有可能造成局部区域肺过度膨胀,成为肺损伤加重的隐性来源[22]。EIT监测技术可实现对钟摆现象的床旁识别[23]和钟摆体积的定量评估[24-25]。识别钟摆现象有助于半定量评估自主吸气努力的程度,联合食道压等监测手段有助于指导临床医师调整呼吸治疗。
推荐意见9
EIT可动态评估机械通气患者撤机过程中区域肺通气的变化,有助于预测撤机结局。[推荐强度:(6.97±1.48)分]
自主呼吸试验(spontaneous breathing trial,SBT)是目前临床上最常用的撤机方法,但SBT 通过的患者中仍有约13%因撤机失败而被迫再插管[26],说明SBT 用于评估撤机存在不足,这可能与SBT时间较短、不能准确反映患者肺功能有关。EIT通过实时、动态监测肺通气变化,为肺功能的多维度评估提供了定量指标。有研究根据患者SBT时的吸气相气体分布特点分类为经典模式(随着通气支持水平降低,背侧通气分布比例升高)和非经典模式,表现为经典模式的患者撤机失败率明显低于非经典模式(1/13比8/17,P<0.05)[27]。也有研究以呼气末肺电阻变化(delta end-expiratory lung impedance,dEELI)明显下降预测患者T管撤机失败[28]。SBT失败的患者中观察到呼吸钟摆现象并不少见,该现象通常提示患者吸气努力过强,撤机失败风险增加[25]。而GI作为评价肺通气异质性的指标,也有助于预测已经多次撤机失败的患者是否可耐受下一次SBT[29]。虽然以上指标都有助于预测撤机结局,但也存在研究样本量较少和预测价值不理想的问题。在未来需要进一步大样本研究证实EIT指导脱机的价值。
推荐意见10
EIT可用于术前、麻醉诱导、术中和术后等不同阶段的肺通气功能评估,有助于围手术期全流程呼吸管理。[推荐强度:(6.95±1.62)分]
针对肥胖、结构性肺病等术后肺部并发症高危患者的呼吸管理应贯穿围手术期。COPD和哮喘患者术前应用EIT可动态评估呼气流速受限的严重程度和对支气管扩张剂的疗效,以指导围手术期用药[30-31]。病态肥胖患者麻醉诱导时由于呼吸肌张力下降和胸腹部脂肪压迫,常出现明显的功能残气量(functional residual capacity,FRC)降低,可导致严重低氧血症[32]。EIT可监测麻醉诱导后的FRC降低,表现为呼气末电阻下降和重力依赖区通气比例下降,并通过合适的PEEP设置恢复肺容积[33]。胸科手术需要插入双腔气管导管,传统上应用纤支镜进行插管定位。EIT可显示双肺通气分布,从而辅助判断插管位置[34]。一些研究应用EIT实时监测腹部手术患者术中肺通气状态,优化机械通气模式选择和PEEP设置有助于避免肺塌陷、改善氧合和呼吸系统顺应性、降低驱动压,甚至降低术后肺部并发症发生率[11,35-36]。EIT应用于术后呼吸管理相对成熟,但未来有必要强调将个体化呼吸管理的时机前移,实现围手术期全流程呼吸管理,以期降低术后肺部并发症的发生率和严重程度。需要注意的是,术中使用电刀或电凝时,需要暂时断开电极缚带与主电缆之间的连接线,以免可能造成的EIT设备损坏。
推荐意见11
EIT指导ARDS患者个体化PEEP滴定有助于更好地实施肺保护,可能有助改善ARDS患者预后。[推荐强度:(7.43±1.43)分]
针对肺部高度异质性如何选择合适的PEEP一直是ARDS患者实施个体化机械通气的难题。EIT提供了肺区域性呼吸力学相关信息,理论上相较于传统的整体呼吸力学参数更好地实现个体化PEEP设置,有利于肺保护。一些研究评价了基于EIT的PEEP滴定方法在ARDS患者中应用的可行性和安全性[37-39]。数个前瞻性研究比较了ARDS患者应用EIT和传统方法(Pressure-Volume曲线法、PEEP-FiO2表法)滴定PEEP的差别[40-44]:基于EIT的“最佳PEEP”和FiO2之间通常无明显相关性,可能更符合个体化,数个随机对照试验报道了基于EIT的PEEP滴定方法有助于改善氧合、提高呼吸系统顺应性、降低驱动压以及促进器官功能恢复。
推荐意见12
EIT滴定PEEP的方法有多种,目前临床最常用的基于PEEP滴定过程中区域肺泡复张和过度膨胀平衡的PEEP滴定方法。[推荐强度:(7.20±1.22)分]
选择合适的PEEP水平是肺保护性通气策略中十分重要的一环。最佳的PEEP水平旨在减少肺泡塌陷的同时避免肺泡过度膨胀。EIT能够通过床旁实时监测肺局部通气情况用于ARDS患者的PEEP滴定。目前基于EIT的PEEP滴定方法众多,包括:过度膨胀与塌陷(overdistension and collapse,OD/CL)法[45]、呼气末肺电阻抗(end-expiratory lung impedance,EELI)法[11,46]、GI法[40]和RVD法[16,33,47],基于不同EIT方法滴定的“最佳PEEP”存在差异[48],方法的选择尚缺乏统一的标准。多个临床研究证实基于局部顺应性变化的OD/CL法进行ARDS患者PEEP滴定是安全可行的[37-39,41,44]。通过EIT能计算出不同PEEP水平的塌陷率和过度膨胀率,根据塌陷与过度膨胀率选择“最佳PEEP”的方法在不同文献中有所不同。有学者较关心塌陷,故选择满足塌陷率≤10%[45]或≤15%[49]条件下,过度膨胀率最低的PEEP水平;而有学者更关心过度膨胀,希望过度膨胀率≤10%[50];当然也有学者直接选择塌陷与过度膨胀曲线交点对应的PEEP作为两者的权衡[40,51-52]。两种或多种EIT参数的综合应用,或有助于提供更全面的通气评估,更好地指导“最佳PEEP”的设定。已有临床研究支持OD/CL法和GI作为PEEP滴定的共同参考指标,分别应用于ARDS的动物模型和临床病例中[40,50]。使用OD/CL法PEEP滴定时,为了减少人为手动选取对比点位造成的差异,建议统一选择每个PEEP的末段通气至少5个呼吸周期作为采样窗进行分析。需要指出的是,OD/CL法中的肺塌陷/过度膨胀是基于区域顺应性变化的相对值,受到最高或最低PEEP水平的影响,如最高PEEP过低,无法达到充分的肺复张,会低估塌陷率;同理,最低PEEP水平过高,可低估过度膨胀率。
推荐意见13
通过监测呼气末肺容积、RVD等参数,EIT有助于指导重症COPD或哮喘等阻塞性肺部病患者的PEEP设置。[推荐强度:(6.81±1.24)分]
严重COPD或哮喘时可造成呼气流速受限和动态肺充气,形成内源性PEEP(intrinsic positive end-expiratory pressure,PEEPi),导致患者呼吸功和通气异质性增加,并且使血流动力学受损。合理地设置外源性PEEP有助于降低气道阻力和PEEPi,减轻肺过度膨胀。三篇个案报道中,RVD和EELI分别被用于指导COPD和哮喘的外源性PEEP优化[47, 53-54]。结果显示,RVD最低时患者对应的呼出潮气量最大且气道阻力最低,增加外源性PEEP后EELI反而下降提示肺过度膨胀得到缓解。另有小样本研究探索EIT测量区域时间常数,并用该参数指导COPD患者PEEP设置的可行性[55]。综上,EIT联合传统呼吸力学指标和血气监测有助于优化重症COPD或哮喘等阻塞性肺疾病患者的外源性PEEP设置。
推荐意见14
EIT可评估俯卧位对区域肺通气、血流的作用以及滴定个体化的PEEP,有助于指导俯卧位时的呼吸管理。[推荐强度:(7.40±1.22)分]
EIT可评估ARDS患者的肺复张潜能,发现通气分布异常以及通气血流不匹配。对于以重力依赖区病变为主的ARDS患者,俯卧位可以开放背侧肺,EIT可直观地评价俯卧位前后通气分布的变化,识别俯卧位能获益的患者。此外,ARDS患者还可能存在血流分布异常,俯卧位在改变通气同时也可改善血流肺部,EIT可评估区域肺通气、血流以及通气/血流(ventilation/perfusion,V/Q)匹配(基于区域的通气/血流分布比例获得,有别于绝对意义的V/Q),从不同维度评估俯卧位治疗的作用效应[56-57]。
俯卧位期间的PEEP设置也是机械通气的一个重要内容。俯卧位期间,通过体位复张开放背侧塌陷肺泡,同时对其他肺区域肺泡过度膨胀影响不大,促使肺通气更加均一,此时应用EIT滴定个体化的PEEP,可进一步实现肺保护。研究发现俯卧时EIT滴定的最佳PEEP比仰卧位时更低,有助改善肺通气以及氧合[58-60]。
此外,EIT也可作为中止俯卧位通气治疗的方法之一。俯卧位过程中如果通气分布恢复正常,甚至持续出现腹侧通气严重减少,提示俯卧位获益有限,应结合临床情况考虑缩短或中止俯卧位通气治疗[58,61]。
推荐意见15
EIT可实时评估高流量氧疗(high-flow nasal cannula,HFNC)对区域肺通气的作用。[推荐强度:(7.09±1.81)分]
HFNC是呼吸衰竭患者的新型呼吸支持方式,较无创通气具有较好的舒适性和耐受性,关于HFNC的适应证、潜在相关肺损伤的发生及有创通气的转换时机等问题尚存在争议。EIT为HFNC治疗提供肺通气持续可视化监测,可识别治疗显著获益的患者,有助指导治疗。在健康受试者中,EIT发现HFNC可以增加EELI、功能残气量和降低呼吸频率[62]。EIT广泛用于ICU低氧性呼吸衰竭,心脏手术后不能耐受无创通气的呼吸衰竭等 HFNC治疗对肺通气改善的生理效应以及治疗反应性评估[63-66]。一项对低氧性呼吸衰竭患者的研究评估了HFNC流速>60 L/min的效应,发现肺通气异质性降低、呼气末肺容积增加、呼吸频率下降,但肺通气增加主要发生在非重力依赖区域,并且患者不适感增加[65]。研究发现HFNC治疗对肺通气的作用存在一定的个体差异性,EIT可有效识别HFNC治疗对背侧通气改善的潜能,为优化HFNC治疗提供新的思路[67-68]。
推荐意见16
EIT可用于评估早期活动、肺部物理治疗以及气道廓清等对重症患者肺通气的治疗作用,实现ROI通气目标导向性治疗策略。[推荐强度:(7.01±1.66)分]
EIT可实时评估肺区域通气分布情况以及呼气末肺阻抗的变化,反映肺通气功能及肺容积大小,提供可视化的肺通气目标,有助于指导早期运动、肺部物理治疗以及气道廓清等治疗,并评价其作用效应。EIT发现重症患者早期活动及物理治疗可改善肺背侧通气,促进肺复张,缓慢增加呼吸末肺容积[69]。研究发现,早期活动对重症患者背侧通气改善存在个体的差异性,当基线背外侧区域通气分布比例<6.5%时,提示自平卧位到下地坐轮椅活动有利于背侧肺复张和氧合改善[70]。此外,EIT还可床旁发现因气道廓清障碍导致的肺不张,用于气道廓清治疗过程的肺通气持续监测评估[71-73]。近来,研究进一步报道应用EIT评估ARDS患者支气管肺泡灌洗治疗以及大量气道分泌物重症患者的高频胸壁振荡排痰治疗对肺通气功能的影响与作用效应[74-75]。
推荐意见17
EIT可用于新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)患者肺通气和灌注床旁评估,有助指导有创及无创机械通气等呼吸管理。[推荐强度:(7.46±1.29)分]
研究表明COVID-19肺炎除了肺通气受累外,还存在血管内皮损害、凝血功能异常、微血栓形成等导致的区域肺灌注缺损[76-78]。基于呼吸力学以及V/Q改变特征,有学者将COVID-19肺炎分为下面两个极端的表型:(1)L型:肺弹性低、区域V/Q低(缺氧性肺血管收缩功能失调及局部肺血栓形成等因素导致功能性分流及死腔增加可能)、肺重量低、肺可复张性低;(2)H型:肺弹性高、右向左肺内分流高、肺重量高、肺可复张性高[79]。实时评估肺通气和灌注对机械通气的COVID-19肺炎患者具有重要指导价值。单光子发射计算机断层扫描(single photon emission computed tomography,SPECT)、CT肺动脉造影(computed tomography pulmonary angiography,CTPA)以及双源CT已被用于与评估COVID-19患者肺通气和灌注情况[76,78,80-81],而EIT方法具有简便、床旁、避免转运、实时等优势,可用重症COVID-19肺炎机械通气患者的呼吸治疗与管理。Mauri等[82]首次应用浓盐水造影EIT肺灌注成像方法评估COVID-19机械通气患者区域肺灌注以及V/Q特征,发现其肺可复张性个体差异明显,存在肺区域死腔分数增加的特征。EIT在呼吸管理治疗中得到较为广泛的应用,例如:指导无创通气[83]、支气管肺泡灌洗时肺通气监测[84]、合并肺栓塞时肺灌注评估[85]、评价PEEP以及俯卧位通气和灌注作用[86-88]、个体化的PEEP滴定[37,43]。
四、EIT存在的问题与技术进展
推荐意见18
EIT肺通气显像可用于床旁快速识别各种病因导致的肺通气缺损,但对具体病因诊断缺乏特异性,建议联合床旁胸片和(或)重症超声进一步明确。[推荐强度:(7.22±1.29)分]
急性呼吸衰竭是需要临床医师早期识别及快速处理的急危重症之一。除了仔细分析病史和系统查体,通常还需要借助影像学手段协助甄别病因,以期达到早识别、早干预的目的。危重症患者通常伴随血流动力学不稳定、转运风险大等特点,因此床旁影像学监测在重症病房较为推荐,包括床旁胸片、肺部超声和EIT[89]。床旁胸片可总览双肺轮廓和透亮度,但对局部病变性质的分辨率较差,且检查具有放射性。EIT和肺部超声作为近年兴起的床旁影像检查手段,具有便捷、无辐射、可实时动态观察的特点。当胸腔积液、肺不张、气道堵塞等病理状况导致局部肺区不通气时,EIT通气分布视图可快速识别ROI通气比例降低,即局部肺通气缺损。动物实验及临床研究显示EIT和CT在诊断通气缺损上具有很好的一致性[90-92]。但EIT的局限性在于缺乏对病变性质的特异性判断,此时可结合肺部超声协助床旁快速判别呼吸衰竭病因(表1)。

推荐意见19
EIT肺灌注联合通气显像可用于评估ARDS等呼吸衰竭患者的区域通气/血流匹配情况,有助于判断潜在原因、预后并指导治疗,必要时可完善双源CT或核素显像检查加以验证。[推荐强度:(6.71±1.54)分]
通气/血流比例失调主要包括死腔(“气多血少”或“有气无血”)和分流(“血多气少”或“有血无气”),是引起急性呼吸衰竭的重要病理生理机制。不同病因导致的通气/血流改变有所差异:肺实变或不张主要引起分流,肺动脉栓塞或COPD主要形成死腔样通气,而胸腔积液或气胸则造成相应区域通气和血流均缺失。将EIT肺灌注图像与通气图像相结合,可获得区域性肺通气/血流匹配情况的信息。有数项临床研究应用该技术评估ARDS等呼吸衰竭患者的V/Q匹配情况,分别用于急性呼吸衰竭患者的病因分型[100]、ARDS患者V/Q对PEEP反应性的评估[101]以及ARDS患者预后预测[102]。但需要指出的是,目前基于EIT的V/Q评估临床研究相对较少,需扩大研究样本以进一步证实。
推荐意见20
EIT肺灌注联合通气显像是一种潜在的床旁肺栓塞诊断技术,未来需要大样本研究证实。[推荐强度:(7.05±1.49)分]
肺栓塞是危重症患者出现急性呼吸衰竭不可忽视的病因,若不及时识别将失去最佳治疗时机。目前诊断肺栓塞的金标准是CTPA,但低氧血症的危重症患者转运风险高,尤其对于伴随血流动力学受损的高危肺栓塞患者。近年来EIT床旁肺灌注技术的发展使肺栓塞的床旁诊断成为可能。多项动物实验已证实EIT高渗盐水造影肺灌注成像与CTPA或SPECT肺灌注成像具有较好的相关性和一致性[103-107]。一些临床研究或个案报道也初步显示了EIT在肺灌注成像与CTPA具有良好的相关性[85,108-111]。一项前瞻性研究表明当EIT测得的死腔面积比例>30.37%时,预测肺栓塞的灵敏度为90.9%,特异度为98.6%[108]。尽管EIT在肺栓塞的早期诊断中展现出良好前景,但在操作层面仍然有局限性,如:患者必须具有颈内或锁骨下路径的中心静脉、必须能保持8 s左右屏气状态。高渗盐水造影EIT肺灌注成像在临床应用还处于起步阶段,未来仍需要大样本前瞻性研究补充现有的规范。此外,由于其较差的空间分辨率,EIT仅可发现大面积肺栓塞,诊断敏感性上较CTPA还存在差距。因此EIT可作为疑诊大面积肺栓塞时床旁快速筛查具有潜力的工具之一,当EIT提示死腔面积比例明显增加时,建立在病情允许的情况下联合CTPA检查确诊。
推荐意见21
EIT有助于动态监测气胸发生、进展及评价干预措施的疗效,但需要联合其他检查手段综合判断。[推荐强度:(6.88±1.31)分]
气胸是ICU机械通气常见的并发症之一,严重时可导致血流动力学不稳定,因此早期识别尤为重要。EIT用于气胸监测最早于2008年被提出,研究者通过使用注射器往实验猪的胸膜腔中注射空气制造气胸模型,EIT可对应出现特征性改变:气胸区域呼气末肺电阻增加(或亮度增加),而肺动态通气图显示该区域通气比例减少。该算法可敏感地检测到 20 ml 的气胸,灵敏度为 100%,特异性为 95% [112]。3篇个案报道应用相似的算法识别出气胸的发生[98,113-114]。一项动物实验观察了早产羔羊发生气胸前后的EIT表现,除了呼气末电阻上升,还可伴随“相位角延迟”,该现象或可早于气胸发生[115]。另有研究应用EIT监测到ARDS患者肺复张过程中发生并逐渐加重的气胸,而在胸腔闭式引流之后通气逐渐恢复也可通过EIT反映,这提示EIT可用于监测气胸发生、进展和治疗效果[99]。但一项动物实验显示在不依赖基线对比或特定图像后处理、仅凭肉眼观察EIT通气图像在诊断气胸上的准确率仍偏低[97]。未来通过算法升级有望提升EIT床旁诊断气胸的准确性。
推荐意见22
应用高渗盐水进行EIT肺灌注显像是安全可行的,但技术规范及分析标准仍需统一。[推荐强度:(7.48±1.40)分]
10 ml 5%~10% NaCl液体量和含钠量相对整个机体血容量(4~6 L)而言很小,注射后机体可快速平衡,对内环境和容量影响小[20]。目前国内外临床研究应用高渗盐水进行EIT肺灌注显像评估重症患者肺血流分布,共纳入近200例重症患者,未见不良反应报告,支持该技术是安全可行的[19]。不同研究所用造影盐水浓度不同,5%、7.5%、10% NaCl均有报道。此外,关于呼吸屏气时间和时相(呼气末屏气或吸气末屏气)亦未统一,尚存争议[116]。同时在分析方法上,关于通气和血流区域阈值的确定、灌注成像方法(最大斜率、曲线下面积、基线确定等)以及分钟通气量和心输量校正计算区域V/Q的阈值等分析标准尚未达成统一[117]。因此,高渗盐水EIT肺灌注造影显像技术及分析标准未来需要进一步统一,特别是不同疾病中的相关阈值和诊断标准还需要大样本的临床研究中进一步验证[118]。
推荐意见23
建议完善EIT操作技术培训、参数解读标准和检查报告制度。[推荐强度:(7.04±1.85)分]
床旁EIT肺通气/灌注显像检查作为一项新技术在临床应用中日益广泛,目前集中应用于重症医学、呼吸与危重病学、急诊医学、麻醉学等学科。关于EIT参数解读标准和检查报告制度尚未达成统一,有学者报道了应用EIT滴定PEEP的临床报告[40]。
操作技术目前主要依赖厂家的培训,提供的分析内容相对单一。其中EIT肺通气显像在部分地区已获批临床收费,未来需要完善EIT技术培训、参数解读标准和检查报告制度,有助统一和规范地使用EIT断层肺成像技术,提高临床应用安全性和有效性,并对结果进行统一解读。北京协和医院率先初步建立EIT肺通气显像检查报告制度,报告主要内容见表2。

最后需要指出的是,EIT技术被越来越多的学者所认可,临床应用也日益广泛,但EIT现阶段技术仍存在一些问题,比如技术的模块化、图像判别的智能化、肺灌注的无创监测等,需要进一步研究和技术攻关,以推动EIT技术的全面发展和临床应用。
项目主持者:隆云(北京协和医院重症医学科)
执笔者:何怀武(北京协和医院重症医学科);池熠(北京协和医院重症医学科);袁思依(北京协和医院重症医学科);杨莹莹(北京协和医院重症医学科);弥亮钰(北京协和医院重症医学科);程卫(北京协和医院重症医学科);周元凯(北京协和医院重症医学科);苏龙翔(北京协和医院重症医学科);汤铂(北京协和医院重症医学科);芮曦(北京协和医院重症医学科);岳朝辅(曲靖市第一人民医院重症医学科)
执笔统筹:何怀武(北京协和医院重症医学科);池熠(北京协和医院重症医学科)
共识制定专家组成员(按姓氏汉语拼音排序):池熠(北京协和医院重症医学科);丁超(中国医学科学学院肿瘤医院麻醉科);段军(中日友好医院重症医学科);段美丽(北京友谊医院重症医学科);葛慧青(浙江大学医学院附属邵逸夫医院呼吸治疗科);韩小彤(湖南省人民医院急诊科);何怀武(北京协和医院重症医学科);胡波(武汉大学中南医院重症医学科);黄晓波(四川省人民医院重症医学科);解立新(解放军总医院呼吸与危重症医学科);康焰(四川大学华西医院重症医学科);刘松桥(东南大学附属中大医院重症医学科);隆云(北京协和医院重症医学科);马四清(青海省人民医院重症医学科);潘纯(东南大学附属中大医院重症医学科);秦秉玉(河南省人民医院重症医学科);瞿洪平(上海交通大学医学院附属瑞金医院重症医学科);桑岭(广州医科大学附属第一医院重症医学科);尚秀玲(福建省立医院重症医学科);尚游(华中科技大学同济医学院附属协和医院重症医学科);孙兵(首都医科大学附属北京朝阳医院呼吸与危重症医学科);万林骏(昆明医科大学第二附属医院重症医学科);王波(四川大学华西医院重症医学科);王洪亮(哈尔滨医科大学附属第二医院重症医学科);王玉妹(首都医科大学附属北京天坛医院重症医学科);翁利(北京协和医院MICU);项龙(上海交通大学医学院附属上海儿童医学中心重症医学科,喀什地区第二人民医院新生儿科);邢学忠(中国医学科学学院肿瘤医院重症医学科);徐磊(天津市第三中心医院重症医学科);徐远达(广州医科大学附属第一医院呼吸内科);杨缙(重庆市人民医院重症医学科);尹永杰(吉林大学第二医院重症医学科);袁思依(北京协和医院重症医学科);臧彬(中国医科大学附属盛京医院重症医学科);詹庆元(中日友好医院呼吸与危重症医学科);张云辉(云南省第一人民医院呼吸与危重症医学科);招展奇(空军军医大学生物医学工程系);钟鸣(复旦大学附属中山医院重症医学科);钟雪锋(北京医院呼吸与危重症医学科);周建新(首都医科大学附属北京天坛医院重症医学科);周永方(四川大学华西医院重症医学科)
志谢 张宏民、杜微、王芊霖、张瑞在共识撰写过程中的辛勤付出及宝贵建议
利益冲突
所有作者均声明不存在利益冲突
参考文献
[1]DiamondIR, GrantRC, FeldmanBM, et al. Defining consensus: a systematic review recommends methodologic criteria for reporting of Delphi studies[J]. J Clin Epidemiol. 2014;67(4):401-409. DOI: 10.1016/j.jclinepi.2013.12.002
[2]王小亭, 刘大为, 于凯江, 等. 中国重症超声专家共识[J]. 中华内科杂志. 2016, 55(11):900-912.
[3]FrerichsI, AmatoMB, van KaamAH, et al. Chest electrical impedance tomography examination, data analysis, terminology, clinical use and recommendations: consensus statement of the TRanslational EIT development study group[J]. Thorax, 2017, 72(1):83-93. DOI: 10.1136/thoraxjnl-2016-208357.
[4]KarstenJ, StueberT, VoigtN, et al. Influence of different electrode belt positions on electrical impedance tomography imaging of regional ventilation: a prospective observational study[J]. Crit Care, 2016, 20:3. DOI: 10.1186/s13054-015-1161-9.
[5]ReifferscheidF, ElkeG, PulletzS, et al. Regional ventilation distribution determined by electrical impedance tomography: reproducibility and effects of posture and chest plane[J]. Respirology, 2011, 16(3):523-531. DOI: 10.1111/j.1440-1843.2011.01929.x.
[6]Krueger-ZiolekS, SchullckeB, KretschmerJ, et al. Positioning of electrode plane systematically influences EIT imaging[J]. Physiol Meas, 2015, 36(6):1109-1118. DOI: 10.1088/0967-3334/36/6/1109.
[7]张超, 吴佳铭, 代萌, 等. 基于EIT技术监测体姿改变对肺通气影响的实验研究[J].医疗卫生装备, 2018, 39(4):6-10. DOI: 10.7687/j.issn1003-8868.2018.04.006.
[8]FrerichsI, HahnG, HelligeG. Gravity-dependent phenomena in lung ventilation determined by functional EIT[J]. Physiol Meas, 1996, 17Suppl 4A:A149-A157. DOI: 10.1088/0967-3334/17/4a/019.
[9]Stankiewicz-RudnickiM, GaszynskiW, GaszynskiT. Assessment of ventilation distribution during laparoscopic bariatric surgery: an electrical impedance tomography study[J]. Biomed Res Int, 2016, 2016:7423162. DOI: 10.1155/2016/7423162.
[10]SchaeferMS, WaniaV, BastinB, et al. Electrical impedance tomography during major open upper abdominal surgery: a pilot-study[J]. BMC Anesthesiol, 2014, 14:51. DOI: 10.1186/1471-2253-14-51.
[11]ErlandssonK, OdenstedtH, LundinS, et al. Positive end-expiratory pressure optimization using electric impedance tomography in morbidly obese patients during laparoscopic gastric bypass surgery[J]. Acta Anaesthesiol Scand, 2006, 50(7):833-839. DOI: 10.1111/j.1399-6576.2006.01079.x.
[12]FultonR, MillarJE, MerzaM, et al. Prophylactic postoperative high flow nasal oxygen versus conventional oxygen therapy in obese patients undergoing bariatric surgery (OXYBAR Study): a pilot randomised controlled trial[J]. Obes Surg, 2021, 31(11):4799-4807. DOI: 10.1007/s11695-021-05644-y.
[13]EichlerL, TruskowskaK, DupreeA, et al. Intraoperative ventilation of morbidly obese patients guided by transpulmonary pressure[J]. Obes Surg, 2018, 28(1):122-129. DOI: 10.1007/s11695-017-2794-3.
[14]ZhaoZ, PulletzS, FrerichsI, et al. The EIT-based global inhomogeneity index is highly correlated with regional lung opening in patients with acute respiratory distress syndrome[J]. BMC Res Notes, 2014, 7:82. DOI: 10.1186/1756-0500-7-82.
[15]FrerichsI, HahnG, GolischW, et al. Monitoring perioperative changes in distribution of pulmonary ventilation by functional electrical impedance tomography[J]. Acta Anaesthesiol Scand, 1998, 42(6):721-726. DOI: 10.1111/j.1399-6576.1998.tb05308.x.
[16]WriggeH, ZinserlingJ, MudersT, et al. Electrical impedance tomography compared with thoracic computed tomography during a slow inflation maneuver in experimental models of lung injury[J]. Crit Care Med, 2008, 36(3):903-909. DOI: 10.1097/CCM.0B013E3181652EDD.
[17]MudersT, LuepschenH, ZinserlingJ, et al. Tidal recruitment assessed by electrical impedance tomography and computed tomography in a porcine model of lung injury*[J]. Crit Care Med, 2012, 40(3):903-911. DOI: 10.1097/CCM.0b013e318236f452.
[18]SunXM, ChenGQ, ZhouYM, et al. Airway closure could be confirmed by electrical impedance tomography[J]. Am J Respir Crit Care Med, 2018, 197(1):138-141. DOI: 10.1164/rccm.201706-1155LE.
[19]XuM, HeH, LongY. Lung perfusion assessment by bedside electrical impedance tomography in critically Ill Patients[J]. Front Physiol, 2021, 12:748724. DOI: 10.3389/fphys.2021.748724.
[20]HeHW, LongY, ChiY, et al. Technology specification of bedside hypertonic saline-contrast electrical impedance tomography of lung perfusion and clinical application[J]. Zhonghua Yi Xue Za Zhi, 2021, 101(15):1097-1101. DOI: 10.3760/cma.j.cn112137-20200926-02723.
[21]YoshidaT, AmatoM, KavanaghBP, et al. Impact of spontaneous breathing during mechanical ventilation in acute respiratory distress syndrome[J]. Curr Opin Crit Care, 2019, 25(2):192-198. DOI: 10.1097/MCC.0000000000000597.
[22]YoshidaT, NakahashiS, NakamuraM, et al. Volume-controlled ventilation does not prevent injurious inflation during spontaneous effort[J]. Am J Respir Crit Care Med, 2017, 196(5):590-601. DOI: 10.1164/rccm.201610-1972OC.
[23]YoshidaT, TorsaniV, GomesS, et al. Spontaneous effort causes occult pendelluft during mechanical ventilation[J]. Am J Respir Crit Care Med, 2013, 188(12):1420-1427. DOI: 10.1164/rccm.201303-0539OC.
[24]SangL, ZhaoZ, YunPJ, et al. Qualitative and quantitative assessment of pendelluft: a simple method based on electrical impedance tomography[J]. Ann Transl Med, 2020, 8(19):1216. DOI: 10.21037/atm-20-4182.
[25]CoppadoroA, GrassiA, GiovannoniC, et al. Occurrence of pendelluft under pressure support ventilation in patients who failed a spontaneous breathing trial: an observational study[J]. Ann Intensive Care, 2020, 10(1):39. DOI: 10.1186/s13613-020-00654-y.
[26]BolesJM, BionJ, ConnorsA, et al. Weaning from mechanical ventilation[J]. Eur Respir J, 2007, 29(5):1033-1056. DOI: 10.1183/09031936.00010206.
[27]ZhaoZ, PengSY, ChangMY, et al. Spontaneous breathing trials after prolonged mechanical ventilation monitored by electrical impedance tomography: an observational study[J]. Acta Anaesthesiol Scand, 2017, 61(9):1166-1175. DOI: 10.1111/aas.12959.
[28]LimaJ, FontesMS, SzmuszkowiczT, et al. Electrical impedance tomography monitoring during spontaneous breathing trial: physiological description and potential clinical utility[J]. Acta Anaesthesiol Scand, 2019, 63(8):1019-1027. DOI: 10.1111/aas.13383.
[29]BickenbachJ, CzaplikM, PolierM, et al. Electrical impedance tomography for predicting failure of spontaneous breathing trials in patients with prolonged weaning[J]. Crit Care, 2017, 21(1):177. DOI: 10.1186/s13054-017-1758-2.
[30]FrerichsI, ZhaoZ, BecherT, et al. Regional lung function determined by electrical impedance tomography during bronchodilator reversibility testing in patients with asthma[J]. Physiol Meas, 2016, 37(6):698-712. DOI: 10.1088/0967-3334/37/6/698.
[31]VogtB, ZhaoZ, ZabelP, et al. Regional lung response to bronchodilator reversibility testing determined by electrical impedance tomography in chronic obstructive pulmonary disease[J]. Am J Physiol Lung Cell Mol Physiol, 2016, 311(1):L8-L19. DOI: 10.1152/ajplung.00463.2015.
[32]HumphreysS, PhamTM, StockerC, et al. The effect of induction of anesthesia and intubation on end-expiratory lung level and regional ventilation distribution in cardiac children[J]. Paediatr Anaesth, 2011, 21(8):887-893. DOI: 10.1111/j.1460-9592.2011.03547.x.
[33]NestlerC, SimonP, PetroffD, et al. Individualized positive end-expiratory pressure in obese patients during general anaesthesia: a randomized controlled clinical trial using electrical impedance tomography[J]. Br J Anaesth, 2017, 119(6):1194-1205. DOI: 10.1093/bja/aex192.
[34]SteinmannD, StahlCA, MinnerJ, et al. Electrical impedance tomography to confirm correct placement of double-lumen tube: a feasibility study[J]. Br J Anaesth, 2008, 101(3):411-418. DOI: 10.1093/bja/aen166.
[35]GirrbachF, PetroffD, SchulzS, et al. Individualised positive end-expiratory pressure guided by electrical impedance tomography for robot-assisted laparoscopic radical prostatectomy: a prospective, randomised controlled clinical trial[J]. Br J Anaesth, 2020, 125(3):373-382. DOI: 10.1016/j.bja.2020.05.041.
[36]PereiraSM, TucciMR, MoraisC, et al. Individual positive end-expiratory pressure settings optimize intraoperative mechanical ventilation and reduce postoperative atelectasis[J]. Anesthesiology, 2018, 129(6):1070-1081. DOI: 10.1097/ALN.0000000000002435.
[37]PerierF, TuffetS, MaraffiT, et al. Electrical impedance tomography to titrate positive end-expiratory pressure in COVID-19 acute respiratory distress syndrome[J]. Crit Care, 2020, 24(1):678. DOI: 10.1186/s13054-020-03414-3.
[38]PuelF, CrognierL, SouléC, et al. Assessment of electrical impedance tomography to set optimal positive end-expiratory pressure for veno-venous ECMO-treated severe ARDS patients[J]. J Crit Care, 2020, 60:38-44. DOI: 10.1016/j.jcrc.2020.06.017.
[39]BecherT, BuchholzV, HasselD, et al. Individualization of PEEP and tidal volume in ARDS patients with electrical impedance tomography: a pilot feasibility study[J]. Ann Intensive Care, 2021, 11(1):89. DOI: 10.1186/s13613-021-00877-7.
[40]ZhaoZ, ChangMY, ChangMY, et al. Positive end-expiratory pressure titration with electrical impedance tomography and pressure-volume curve in severe acute respiratory distress syndrome[J]. Ann Intensive Care, 2019, 9(1):7. DOI: 10.1186/s13613-019-0484-0.
[41]HsuHJ, ChangHT, ZhaoZ, et al. Positive end-expiratory pressure titration with electrical impedance tomography and pressure-volume curve: a randomized trial in moderate to severe ARDS[J]. Physiol Meas, 2021, 42(1):014002. DOI: 10.1088/1361-6579/abd679.
[42]SellaN, ZarantonelloF, AndreattaG, et al. Positive end-expiratory pressure titration in COVID-19 acute respiratory failure: electrical impedance tomography vs. PEEP/FiO(2) tables[J]. Crit Care, 2020, 24(1):540. DOI: 10.1186/s13054-020-03242-5.
[43]van der ZeeP, SomhorstP, EndemanH, et al. Electrical impedance tomography for positive end-expiratory pressure titration in COVID-19-related acute respiratory distress syndrome[J]. Am J Respir Crit Care Med, 2020, 202(2):280-284. DOI: 10.1164/rccm.202003-0816LE.
[44]HeH, ChiY, YangY, et al. Early individualized positive end-expiratory pressure guided by electrical impedance tomography in acute respiratory distress syndrome: a randomized controlled clinical trial[J]. Crit Care, 2021, 25(1):230. DOI: 10.1186/s13054-021-03645-y.
[45]CostaEL, BorgesJB, MeloA, et al. Bedside estimation of recruitable alveolar collapse and hyperdistension by electrical impedance tomography[J]. Intensive Care Med, 2009, 35(6):1132-1137. DOI: 10.1007/s00134-009-1447-y.
[46]EroniaN, MauriT, MaffezziniE, et al. Bedside selection of positive end-expiratory pressure by electrical impedance tomography in hypoxemic patients: a feasibility study[J]. Ann Intensive Care, 2017, 7(1):76. DOI: 10.1186/s13613-017-0299-9.
[47]KostakouE, BarrettN, CamporotaL. Electrical impedance tomography to determine optimal positive end-expiratory pressure in severe chronic obstructive pulmonary disease[J]. Crit Care, 2016, 20(1):295. DOI: 10.1186/s13054-016-1475-2.
[48]ZhaoZ, LeeLC, ChangMY, et al. The incidence and interpretation of large differences in EIT-based measures for PEEP titration in ARDS patients[J]. J Clin Monit Comput, 2020, 34(5):1005-1013. DOI: 10.1007/s10877-019-00396-8.
[49]FranchineauG, BréchotN, LebretonG, et al. Bedside contribution of electrical impedance tomography to setting positive end-expiratory pressure for extracorporeal membrane oxygenation-treated patients with severe acute respiratory distress syndrome[J]. Am J Respir Crit Care Med, 2017, 196(4):447-457. DOI: 10.1164/rccm.201605-1055OC.
[50]HochhausenN, BienerI, RossaintR, et al. Optimizing PEEP by electrical impedance tomography in a porcine animal model of ARDS[J]. Respir Care, 2017, 62(3):340-349. DOI: 10.4187/respcare.05060.
[51]KarstenJ, GrusnickC, PaarmannH, et al. Positive end-expiratory pressure titration at bedside using electrical impedance tomography in post-operative cardiac surgery patients[J]. Acta Anaesthesiol Scand, 2015, 59(6):723-732. DOI: 10.1111/aas.12518.
[52]KarstenJ, VoigtN, GillmannHJ, et al. Determination of optimal positive end-expiratory pressure based on respiratory compliance and electrical impedance tomography: a pilot clinical comparative trial[J]. Biomed Tech (Berl), 2019, 64(2):135-145. DOI: 10.1515/bmt-2017-0103.
[53]MauriT, BellaniG, SalernoD, et al. Regional distribution of air trapping in chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2013, 188(12):1466-1467. DOI: 10.1164/rccm.201303-0463IM.
[54]HeH, YuanS, YiC, et al. Titration of extra-PEEP against intrinsic-PEEP in severe asthma by electrical impedance tomography: a case report and literature review[J]. Medicine (Baltimore), 2020, 99(26):e20891. DOI: 10.1097/MD.0000000000020891.
[55]KaragiannidisC, WaldmannAD, RókaPL, et al. Regional expiratory time constants in severe respiratory failure estimated by electrical impedance tomography: a feasibility study[J]. Crit Care, 2018, 22(1):221. DOI: 10.1186/s13054-018-2137-3.
[56]TomasinoS, SassanelliR, MarescalcoC, et al. Electrical impedance tomography and prone position during ventilation in COVID-19 pneumonia: case reports and a brief literature review[J]. Semin Cardiothorac Vasc Anesth, 2020, 24(4):287-292. DOI: 10.1177/1089253220958912.
[57]PerierF, TuffetS, MaraffiT, et al. Effect of positive end-expiratory pressure and proning on ventilation and perfusion in COVID-19 acute respiratory distress syndrome[J]. Am J Respir Crit Care Med, 2020, 202(12):1713-1717. DOI: 10.1164/rccm.202008-3058LE.
[58]KotaniT, TanabeH, YusaH, et al. Electrical impedance tomography-guided prone positioning in a patient with acute cor pulmonale associated with severe acute respiratory distress syndrome[J]. J Anesth, 2016, 30(1):161-165. DOI: 10.1007/s00540-015-2084-y.
[59]ScaramuzzoG, SpadaroS, Dalla CorteF, et al. Personalized positive end-expiratory pressure in acute respiratory distress syndrome: comparison between optimal distribution of regional ventilation and positive transpulmonary pressure[J]. Crit Care Med, 2020, 48(8):1148-1156. DOI: 10.1097/CCM.0000000000004439.
[60]MartinssonA, HoultzE, WallinderA, et al. Lung recruitment in the prone position after cardiac surgery: a randomised controlled study[J]. Br J Anaesth, 2021, 126(5):1067-1074. DOI: 10.1016/j.bja.2020.12.039.
[61]FranchineauG, BréchotN, HekimianG, et al. Prone positioning monitored by electrical impedance tomography in patients with severe acute respiratory distress syndrome on veno-venous ECMO[J]. Ann Intensive Care, 2020, 10(1):12. DOI: 10.1186/s13613-020-0633-5.
[62]RieraJ, PérezP, CortésJ, et al. Effect of high-flow nasal cannula and body position on end-expiratory lung volume: a cohort study using electrical impedance tomography[J]. Respir Care, 2013, 58(4):589-596. DOI: 10.4187/respcare.02086.
[63]CorleyA, CaruanaLR, BarnettAG, et al. Oxygen delivery through high-flow nasal cannulae increase end-expiratory lung volume and reduce respiratory rate in post-cardiac surgical patients[J]. Br J Anaesth, 2011, 107(6):998-1004. DOI: 10.1093/bja/aer265.
[64]MauriT, AlbanL, TurriniC, et al. Optimum support by high-flow nasal cannula in acute hypoxemic respiratory failure: effects of increasing flow rates[J]. Intensive Care Med, 2017, 43(10):1453-1463. DOI: 10.1007/s00134-017-4890-1.
[65]BasileMC, MauriT, SpinelliE, et al. Nasal high flow higher than 60 L/min in patients with acute hypoxemic respiratory failure: a physiological study[J]. Crit Care, 2020, 24(1):654. DOI: 10.1186/s13054-020-03344-0.
[66]LeeDH, KimEY, SeoGJ, et al. Global and regional ventilation during high flow nasal cannula in patients with hypoxia[J]. Acute Crit Care, 2018, 33(1):7-15. DOI: 10.4266/acc.2017.00507.
[67]ZhangR, HeH, YunL, et al. Effect of postextubation high-flow nasal cannula therapy on lung recruitment and overdistension in high-risk patient[J]. Crit Care, 2020, 24(1):82. DOI: 10.1186/s13054-020-2809-7.
[68]MatsudaW. Is the effect of a high-flow nasal cannula after extubation evaluated by electrical impedance tomography applicable to clinical practice?[J]. Crit Care, 2020, 24(1):184. DOI: 10.1186/s13054-020-02899-2.
[69]EimerC, FreierK, WeilerN, et al. The effect of physical therapy on regional lung function in critically ill patients[J]. Front Physiol, 2021, 12:749542. DOI: 10.3389/fphys.2021.749542.
[70]YuanS, ChiY, LongY, et al. Effect of position change from the bed to a wheelchair on the regional ventilation distribution assessed by electrical impedance tomography in patients with respiratory failure[J]. Front Med (Lausanne), 2021, 8:744958. DOI: 10.3389/fmed.2021.744958.
[71]TaubeC, HolzO, MückeM, et al. Airway response to inhaled hypertonic saline in patients with moderate to severe chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2001, 164(10Pt 1):1810-1815. DOI: 10.1164/ajrccm.164.10.2104024.
[72]AkhavanS, HashemianSM. The role of electrical impedance tomography for monitoring during bronchoscopy: a case report[J]. J Crit Care, 2018, 48:311-313. DOI: 10.1016/j.jcrc.2018.09.028.
[73]中国病理生理危重病学会呼吸治疗学组. 重症患者气道廓清技术专家共识[J/CD].中华重症医学电子杂志(网络版), 2020, 6(3):272-282. DOI: 10.3877/cma.j.issn.2096-1537.2020.03.007.
[74]FranchineauG, ChommelouxJ, Pineton de ChambrunM, et al. Electrical impedance tomography monitoring of bronchoalveolar lavage in patients with acute respiratory distress syndrome[J]. Crit Care Med, 2021. DOI: 10.1097/CCM.0000000000005302.
[75]LonghiniF, BruniA, GarofaloE, et al. Chest physiotherapy improves lung aeration in hypersecretive critically ill patients: a pilot randomized physiological study[J]. Crit Care, 2020, 24(1):479. DOI: 10.1186/s13054-020-03198-6.
[76]GrasselliG, TonettiT, ProttiA, et al. Pathophysiology of COVID-19-associated acute respiratory distress syndrome: a multicentre prospective observational study[J]. Lancet Respir Med, 2020, 8(12):1201-1208. DOI: 10.1016/S2213-2600(20)30370-2.
[77]SantamarinaMG, BoisierD, ContrerasR, et al. COVID-19: a hypothesis regarding the ventilation-perfusion mismatch[J]. Crit Care, 2020, 24(1):395. DOI: 10.1186/s13054-020-03125-9.
[78]PatelBV, ArachchillageDJ, RidgeCA, et al. Pulmonary angiopathy in severe COVID-19: physiologic, imaging, and hematologic observations[J]. Am J Respir Crit Care Med, 2020, 202(5):690-699. DOI: 10.1164/rccm.202004-1412OC.
[79]GattinoniL, ChiumelloD, CaironiP, et al. COVID-19 pneumonia: different respiratory treatments for different phenotypes?[J]. Intensive Care Med, 2020, 46(6):1099-1102. DOI: 10.1007/s00134-020-06033-2.
[80]CobesN, GuernouM, LussatoD, et al. Ventilation/perfusion SPECT/CT findings in different lung lesions associated with COVID-19: a case series[J]. Eur J Nucl Med Mol Imaging, 2020, 47(10):2453-2460. DOI: 10.1007/s00259-020-04920-w.
[81]LangM, SomA, MendozaDP, et al. Hypoxaemia related to COVID-19: vascular and perfusion abnormalities on dual-energy CT[J]. Lancet Infect Dis, 2020, 20(12):1365-1366. DOI: 10.1016/S1473-3099(20)30367-4.
[82]MauriT, SpinelliE, ScottiE, et al. Potential for lung recruitment and ventilation-perfusion mismatch in patients with the acute respiratory distress syndrome from coronavirus disease 2019[J]. Crit Care Med, 2020, 48(8):1129-1134. DOI: 10.1097/CCM.0000000000004386.
[83]RauseoM, MirabellaL, LaforgiaD, et al. A pilot study on electrical impedance tomography during CPAP trial in patients with severe acute respiratory syndrome coronavirus 2 pneumonia: the bright side of non-invasive ventilation[J]. Front Physiol, 2021, 12:728243. DOI: 10.3389/fphys.2021.728243.
[84]FuY, ZouR, WangS, et al. Monitoring bronchoalveolar lavage with electrical impedance tomography: first experience in a patient with COVID-19[J]. Physiol Meas, 2020, 41(8):085008. DOI: 10.1088/1361-6579/abab1b.
[85]Safaee FakhrB, Araujo MoraisCC, et al. Bedside monitoring of lung perfusion by electrical impedance tomography in the time of COVID-19[J]. Br J Anaesth, 2020, 125(5):e434-e436. DOI: 10.1016/j.bja.2020.08.001.
[86]PerierF, TuffetS, MaraffiT, et al. Effect of positive end-expiratory pressure and proning on ventilation and perfusion in COVID-19 acute respiratory distress syndrome[J]. Am J Respir Crit Care Med, 2020, 202(12):1713-1717. DOI: 10.1164/rccm.202008-3058LE.
[87]ZarantonelloF, AndreattaG, SellaN, et al. Prone position and lung ventilation and perfusion matching in acute respiratory failure due to COVID-19[J]. Am J Respir Crit Care Med, 2020, 202(2):278-279. DOI: 10.1164/rccm.202003-0775IM.
[88]TomasinoS, SassanelliR, MarescalcoC, et al. Electrical impedance tomography and prone position during ventilation in COVID-19 pneumonia: case reports and a brief literature review[J]. Semin Cardiothorac Vasc Anesth, 2020, 24(4):287-292. DOI: 10.1177/1089253220958912.
[89]ChiumelloD, Sferrazza PapaGF, ArtigasA, et al. ERS statement on chest imaging in acute respiratory failure[J]. Eur Respir J, 2019, 54(3).DOI: 10.1183/13993003.00435-2019.
[90]VictorinoJA, BorgesJB, OkamotoVN, et al. Imbalances in regional lung ventilation: a validation study on electrical impedance tomography[J]. Am J Respir Crit Care Med, 2004, 169(7):791-800. DOI: 10.1164/rccm.200301-133OC.
[91]ReinartzSD, ImhoffM, TolbaR, et al. EIT monitors valid and robust regional ventilation distribution in pathologic ventilation states in porcine study using differential DualEnergy-CT (ΔDECT)[J]. Sci Rep, 2019, 9(1):9796. DOI: 10.1038/s41598-019-45251-7.
[92]RichardJC, PouzotC, GrosA, et al. Electrical impedance tomography compared to positron emission tomography for the measurement of regional lung ventilation: an experimental study[J]. Crit Care, 2009, 13(3):R82. DOI: 10.1186/cc7900.
[93]BecherT, BußmeyerM, LautenschlägerI, et al. Characteristic pattern of pleural effusion in electrical impedance tomography images of critically ill patients[J]. Br J Anaesth, 2018, 120(6):1219-1228. DOI: 10.1016/j.bja.2018.02.030.
[94]LichtensteinDA, MezièreGA. Relevance of lung ultrasound in the diagnosis of acute respiratory failure: the BLUE protocol[J]. Chest, 2008, 134(1):117-125. DOI: 10.1378/chest.07-2800.
[95]中国重症超声研究组, 尹万红, 王小亭, 等. 重症超声临床应用技术规范[J].中华内科杂志, 2018, 57(6):397-417. DOI: 10.3760/cma.j.issn.0578-1426.2018.06.004.
[96]BachmannMC, MoraisC, BugedoG, et al. Electrical impedance tomography in acute respiratory distress syndrome[J]. Crit Care, 2018, 22(1):263. DOI: 10.1186/s13054-018-2195-6.
[97]GirrbachF, LandeckT, SchneiderD, et al. Detection of posttraumatic pneumothorax using electrical impedance tomography-An observer-blinded study in pigs with blunt chest trauma[J]. PLoS One, 2020, 15(1):e0227518. DOI: 10.1371/journal.pone.0227518.
[98]MiedemaM, FrerichsI, de JonghFH, et al. Pneumothorax in a preterm infant monitored by electrical impedance tomography: a case report[J]. Neonatology, 2011, 99(1):10-13. DOI: 10.1159/000292626.
[99]MoraisCC, De Santis SantiagoRR. Monitoring of pneumothorax appearance with electrical impedance tomography during recruitment maneuvers[J]. Am J Respir Crit Care Med, 2017, 195(8):1070-1073. DOI: 10.1164/rccm.201609-1780LE.
[100]HeH, ChiY, LongY, et al. Three broad classifications of acute respiratory failure etiologies based on regional ventilation and perfusion by electrical impedance tomography: a hypothesis-generating study[J]. Ann Intensive Care, 2021, 11(1):134. DOI: 10.1186/s13613-021-00921-6.
[101]HeH, ChiY, LongY, et al. Influence of overdistension/recruitment induced by high positive end-expiratory pressure on ventilation-perfusion matching assessed by electrical impedance tomography with saline bolus[J]. Crit Care, 2020, 24(1):586. DOI: 10.1186/s13054-020-03301-x.
[102]SpinelliE, KircherM, StenderB, et al. Unmatched ventilation and perfusion measured by electrical impedance tomography predicts the outcome of ARDS[J]. Crit Care, 2021, 25(1):192. DOI: 10.1186/s13054-021-03615-4.
[103]FrerichsI, HinzJ, HerrmannP, et al. Regional lung perfusion as determined by electrical impedance tomography in comparison with electron beam CT imaging[J]. IEEE Trans Med Imaging, 2002, 21(6):646-652. DOI: 10.1109/TMI.2002.800585.
[104]BorgesJB, Suarez-SipmannF, BohmSH, et al. Regional lung perfusion estimated by electrical impedance tomography in a piglet model of lung collapse[J]. J Appl Physiol (1985), 2012, 112(1):225-236. DOI: 10.1152/japplphysiol.01090.2010
[105]ReiniusH, BorgesJB, FredénF, et al. Real-time ventilation and perfusion distributions by electrical impedance tomography during one-lung ventilation with capnothorax[J]. Acta Anaesthesiol Scand, 2015, 59(3):354-368. DOI: 10.1111/aas.12455.
[106]HentzeB, MudersT, LuepschenH, et al. Regional lung ventilation and perfusion by electrical impedance tomography compared to single-photon emission computed tomography[J]. Physiol Meas, 2018, 39(6):065004. DOI: 10.1088/1361-6579/aac7ae.
[107]BluthT, KissT, KircherM, et al. Measurement of relative lung perfusion with electrical impedance and positron emission tomography: an experimental comparative study in pigs[J]. Br J Anaesth, 2019, 123(2):246-254. DOI: 10.1016/j.bja.2019.04.056.
[108]HeH, ChiY, LongY, et al. Bedside evaluation of pulmonary embolism by saline contrast electrical impedance tomography method: a prospective observational study[J]. Am J Respir Crit Care Med, 2020, 202(10):1464-1468. DOI: 10.1164/rccm.202005-1780LE.
[109]GrassiLG, SantiagoR, FlorioG, et al. Bedside evaluation of pulmonary embolism by electrical impedance tomography[J]. Anesthesiology, 2020, 132(4):896. DOI: 10.1097/ALN.0000000000003059.
[110]YuanS, HeH, LongY, et al. Rapid dynamic bedside assessment of pulmonary perfusion defect by electrical impedance tomography in a patient with acute massive pulmonary embolism[J]. Pulm Circ, 2021, 11(1):2045894020984043. DOI: 10.1177/2045894020984043.
[111]HeH, LongY, FrerichsI, et al. Detection of acute pulmonary embolism by electrical impedance tomography and saline bolus injection[J]. Am J Respir Crit Care Med, 2020, 202(6):881-882. DOI: 10.1164/rccm.202003-0554IM.
[112]CostaEL, ChavesCN, GomesS, et al. Real-time detection of pneumothorax using electrical impedance tomography[J]. Crit Care Med, 2008, 36(4):1230-1238. DOI: 10.1097/CCM.0b013e31816a0380.
[113]KallioM, RahtuM, van KaamAH, et al. Electrical impedance tomography reveals pathophysiology of neonatal pneumothorax during NAVA[J]. Clin Case Rep, 2020, 8(8):1574-1578. DOI: 10.1002/ccr3.2944.
[114]PreisC, LuepschenH, LeonhardtS, et al. Experimental case report: development of a pneumothorax monitored by electrical impedance tomography[J]. Clin Physiol Funct Imaging, 2009, 29(3):159-162. DOI: 10.1111/j.1475-097X.2008.00855.x.
[115]MiedemaM, AdlerA, McCallKE, et al. Electrical impedance tomography identifies a distinct change in regional phase angle delay pattern in ventilation filling immediately prior to a spontaneous pneumothorax[J]. J Appl Physiol (1985), 2019, 127(3):707-712. DOI: 10.1152/japplphysiol.00973.2018.
[116]WangY, ZhongM. Bedside evaluation of pulmonary embolism by saline contrast-enhanced electrical impedance tomography: considerations for future research[J]. Am J Respir Crit Care Med, 2021, 203(3):394-395. DOI: 10.1164/rccm.202009-3640LE.
[117]HeH, LongY, ChiY, et al. Reply to Wang and Zhong: bedside evaluation of pulmonary embolism by saline contrast-enhanced electrical impedance tomography: considerations for future research[J]. Am J Respir Crit Care Med, 2021, 203(3):395-397. DOI: 10.1164/rccm.202010-3768LE.
[118]BorgesJB, AlcalaGC, MlčekM. A step forward towards a bedside and timely monitoring of regional ventilation/perfusion matching[J]. Am J Respir Crit Care Med, 2020, 202(10):1342-1344. DOI: 10.1164/rccm.202007-2896ED.
引用本文:中国卫生信息与健康医疗大数据学会重症医学分会标准委员会, 北京肿瘤学会重症医学专业委员会, 中国重症肺电阻抗工作组. 肺电阻抗成像技术在重症呼吸管理中的临床应用中国专家共识 [J] . 中华医学杂志, 2022, 102(9) : 615-628. DOI: 10.3760/cma.j.cn112137-20211201-02680.
通信作者:隆云,中国医学科学院 北京协和医学院 北京协和医院 疑难重症及罕见病国家重点实验室 重症医学科,北京 100730.
本文转载自订阅号「中华医学杂志」
原链接戳:标准与规范 | 肺电阻抗成像技术在重症呼吸管理中的临床应用中国专家共识


