
开篇语
全中国近四个月的新冠之战取得重大阶段性胜利。在大家继续防控不松懈和隔离调整之际,呼吸人已经开始了对新冠疫情过去和未来的思考。新冠疾病的出现对于呼吸系统疾病意味着什么?新冠救治过程中有哪些探索和体会?呼吸人在此次疫情中的特殊位置和重要作用是怎样的?新冠给未来的呼吸学科发展将带来哪些挑战和变化……?《呼吸界》从今天起推出系列报道「新冠新启示」。通过专访在此次新冠之战中发挥主要作用的呼吸学科领军、各省市新冠救治专家组负责人、赴湖北医疗队队员以及PCCM学员……等,让每一位呼吸人分享他们的亲身经历和宝贵经验,共同思考和感悟呼吸人的特殊使命和呼吸学科未来的发展之策。在此也特别期待,无论您在任何地区和岗位,直接或间接参与了抗疫之战,请把您的经验和体会分享出来,您的点滴体会都是弥足珍贵的。(《呼吸界》投稿邮箱:editorhuxijie@163.com)
在一线抗疫的两个多月,我先后在武汉东西湖方舱医院和武汉同济医院中法新城院区参与轻症、危重症患者的诊治。从方舱医院到重症病房,我见到了从只有一些上呼吸道感染症状的轻症患者,到只能用上ECMO方能堪堪维持氧合与通气的「大白肺」危重症患者,COVID-19临床症状、影像、受累器官、进展速度、严重程度的多样性……这种感官上的过度、认识上的转变,对我个人而言是一次次巨大强烈的冲击。通过这段工作历程,使我对已有病毒性肺炎的认识得到了加深,也思考了COVID-19的一些独特之处。所以,今天想分享一个病例给大家,针对在COVID-19治疗中尚无定论的激素应用和机械通气策略进行一些探讨。
病毒性肺炎中的抗生素应用:入院前已多日不发热,入院后第二天又出现发热,且白细胞升高,我们考虑在她在病毒感染的基础上还合并了细菌感染

图:为重症患者做床旁超声
这是1例老年重症COVID-19病例,患者是一名60岁女性,她是地地道道的湖北武汉人。2020年2月4日,这名患者因「间断发热12天」入院。询问病史时我们发现,她既往有胸腔积液、糖尿病及右手骨折史。入院前的12天左右出现发热、干咳、呼吸困难,伴腹泻、恶心、呕吐、纳差、头痛、头晕、肌肉酸痛、乏力等症状。入院前5天的胸部CT显示她的双肺有弥漫的磨玻璃影,沿胸膜下及支气管血管束周围分布。入院2天前,患者通过查咽拭子SARS-CoV-2核酸阳性被确诊为COVID-19患者,开始口服奥司他韦及莫西沙星治疗。
这位老年患者入院时体温保持在36.8℃,并无发热,脉搏84次/分,血压122/70mmHg,呼吸频率22次/分,储氧面罩15L/min时指尖氧饱和度SpO2 92%,血常规也大致正常。当时我们采用的是病毒性肺炎的基础治疗即抗病毒治疗。考虑到对新型冠状病毒确实有效的抗病毒药物现仍不确切,包括瑞德西韦等药物在内的多项临床研究当时正在开展之中,尚无定论,也鉴于患者COVID-19诊断明确,我们应用了洛匹那韦利托那韦抗病毒治疗,丙种球蛋白静点增强免疫,输注恢复期血浆200ml,希望能通过被动免疫的方式使患者获得特异性抗体,帮助患者的机体清除病原体。然而,就在患者入院后第二天就出现了发热,血常规示白细胞及中性粒细胞升高。我们考虑到患者的病程已近2周,有可能是在病毒感染的基础上合并了细菌感染,按照社区感染予头孢曲松联合阿奇霉素经验性抗细菌治疗并覆盖非典型病原体,同时给予祛痰治疗。
这些特点均提示她可能从激素治疗中获益,我们在患者入院6天起开始用激素……可患者还是从I型呼吸衰竭进展为II型呼吸衰竭,当时情况危急

图:与护士一起为ECMO俯卧位患者摆体位、整理管路
患者刚入院时,应用储氧面罩吸氧15L/min,呼吸频率20-25次/分,血气分析提示I型呼吸衰竭。入院后刚开始我们对她应用的是经鼻高流量吸氧,流量50L/min,吸氧浓度0.8-1.0,氧合指数60-80mmHg,呼吸频率25-35次/分。后来改为无创呼吸机辅助通气,S/T模式,IPAP 14cmH2O,EPAP 8cmH2O,FiO2 0.9,Vt 600-700ml,MV 22L/min,应用正压通气后,患者氧合指数稍有改善,约90mmHg。这是一位存在呼吸衰竭的危重症患者,入院时血沉、C反应蛋白、铁蛋白、IL-2R及IL-6等炎症指标即明显升高,并且胸部CT十分符合机化性肺炎改变,这些特点均提示她可能从激素治疗中获益。因此,在患者入院后的第6天,我们开始对她用激素治疗,给予了甲强龙40mg每日两次(甲强龙1.3mg/kg/d)静点的抗炎治疗。
当患者入院1周时,这个节点我的印象非常深刻,她的情况很不好,血常规示白细胞、中性粒细胞明显升高,降钙素原轻微升高,考虑当时已经加用了激素,并且病毒感染后易合并二重感染,不排除有继发细菌、真菌感染,于是我们立即停用头孢曲松及阿奇霉素,升级为亚胺培南西司他丁联合伏立康唑抗感染治疗。此时,患者的呼吸频率已增加至40次/分左右,呈胸腹矛盾呼吸,血气分析由最初的I型呼吸衰竭进展为II型呼吸衰竭,情况危急。这个节点对我们的考验很大,患者感染、呼吸衰竭都在进展中,且应用无创机械通气的条件下呼吸驱动强,气压伤风险高,如果不积极干预,恐怕会有生命危险。因此,我们立即对她进行了气管插管,予以有创机械通气,初始为PCV模式,PC 16cmH2O,PEEP 12cmH2O,FiO2 0.9,RR 25bpm,气管插管期间予镇痛、镇静治疗。
通过一系列的治疗以后,患者的低氧血症和呼吸性酸中毒逐渐得到了改善,氧合指数上升至160-200mmHg,呼吸支持力度逐渐下调至PSV模式,PS 10cmH2O,PEEP 8cmH2O,FiO2 0.45,且神志清楚,咳痰能力较好。插管4天后,患者终于能通过自主呼吸试验,我们都很开心,对她拔除气管插管,序贯经鼻高流量吸氧,患者的氧合指数得到继续改善。
激素从减量到停用是一个逐渐递减的过程,在仔细观察中谨慎调整……治疗过程中同时注意血栓形成、凝血因子及血小板的消耗,及时给予抗凝治疗

图:为患者更换ECMO管路
在治疗过程中,还有一个最大的疑问是用上激素之后如何停用?从减量到停用,是一个逐渐递减的过程,监测氧合、影像学改变,在仔细观察中小心谨慎地做调整,同时还要注意动态评估免疫状态,如监测淋巴细胞总数及淋巴细胞亚群,密切观察有无应用激素的不良反应,如继发感染、消化道出血、血压血糖升高等。我们给患者应用甲强龙40mg每日两次10天后,患者的淋巴细胞明显减少,结合当时患者已脱机拔管、氧合改善,因此将激素逐渐减量至甲强龙40mg每日一次静点6天。待患者感染指标逐渐好转,病原学方面,痰细菌、真菌涂片及培养均阴性,呼吸道合胞病毒、腺病毒、甲型流感病毒、乙型流感病毒、副流感病毒、嗜肺军团菌IgM抗体均阴性。先后将抗细菌药物降阶梯至哌拉西林舒巴坦、头孢曲松,两周后停用伏立康唑。患者入院后第11天、12天,我们对其连续复查咽拭子SARS-CoV-2核酸两次均阴性,停用洛匹那韦利托那韦,应用洛匹那韦利托那韦抗病毒治疗10天,期间患者无显著不良反应,呈持续好转趋势。这时再调整激素,逐渐减量,泼尼松30mg每日一次口服5天、泼尼松20mg每日一次口服6天、泼尼松15mg每日一次口服3天,直至最后停用。
患者刚入院时的凝血显示为凝血酶原时间、活化的部分凝血酶原时间大致正常,纤维蛋白原略升高,D-二聚体明显升高达19.43μg/mL,入院1周后,纤维蛋白原明显下降,血小板在正常范围内呈下降趋势。我们也在其他多位危重症患者中遇到了这种情况。此时,我们考虑她存在血栓形成、凝血因子及血小板的消耗,因此给予了低分子肝素预防性抗凝。住院期间,患者曾有谷丙转氨酶、谷草转氨酶、γ-谷氨酰基转移酶升高,低蛋白血症,也曾出现低钾血症、低钠血症,我们同时给予她肠内营养、补充白蛋白、保肝、抑酸、补钙、降糖、调节肠道菌群等对症支持治疗,最终取得了较好的治疗效果。患者未再发热,呼吸困难逐渐减轻,应用鼻导管吸氧3L/min时指尖氧饱和度可达98%以上,感染指标恢复正常,炎性因子逐渐下降,肝脏、心脏、凝血、内环境等多系统功能逐渐恢复正常,复查胸部CT示双肺磨玻璃影、胸膜下斑片影较前吸收,双肺胸膜下可见牵拉支扩、胸膜下线等纤维化征象。以下是患者的CT对比图:
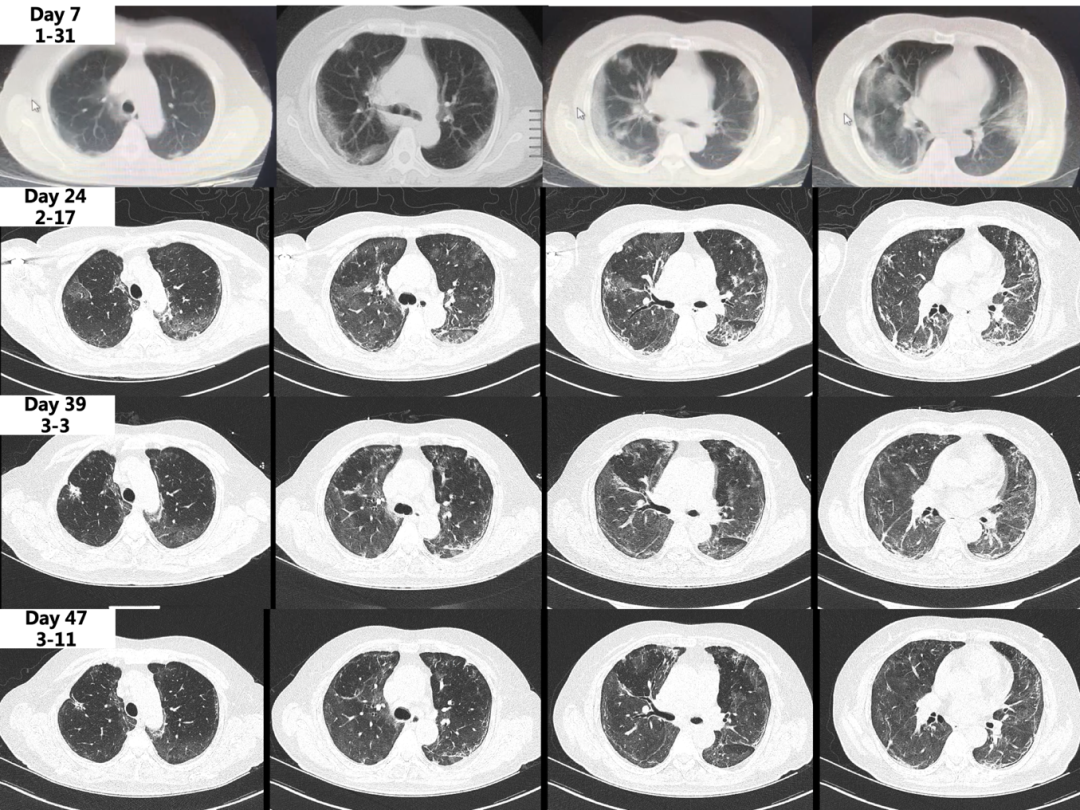
图:患者CT对比
合并慢性基础疾病的老年人群是重型新型冠状病毒肺炎的好发人群,对此部分患者的综合管理对于改善其预后至关重要
从这个案例我得到的启示和思考是,合并慢性基础疾病的老年人群是重型新型冠状病毒肺炎的好发人群,对此部分患者的综合管理和积极干预对于改善其预后至关重要。这是一例患有糖尿病的老年女性,入院时她就存在I型呼吸衰竭,诊断为重型新型冠状病毒肺炎,后续病情进展为危重型,需要有创机械通气。由于慢性基础疾病造成相应脏器代偿能力差、对缺血缺氧更加敏感,对此部分患者的综合管理对于改善其预后至关重要,包括抗病毒治疗、抗继发感染、抗炎、呼吸支持、预防性抗凝、增加免疫力、营养支持、脏器功能保护、控制血压血糖、维持水电解质平衡等等。除抗病毒治疗这一基础治疗外,激素和呼吸支持是其中尤为重要的两个方面。
激素在肺炎特别是病毒性肺炎的治疗中是否应用、如何应用一直是一个有争议的问题。在中国的一项纳入2141例甲型H1N1流感肺炎患者的研究[1]中,低至中等剂量的激素(甲泼尼龙25-150mg/天或等量其他种类激素)可降低氧合指数低于300mmHg患者的病死率。在一项纳入401例SARS患者的回顾性研究[2]中,合理应用激素可降低危重症患者的病死率、缩短其住院时间,且并不引起继发感染及其他并发症。一项系统回顾[3]显示,激素可降低重症社区获得性肺炎患者的病死率并减少机械通气的使用。一项Meta分析[4]发现,延长的甲泼尼龙治疗(≥7天)可加速ARDS病变的吸收,缩短患者恢复至无需呼吸支持的时间并减少此过程中的死亡和住院期间死亡,且不增加感染风险。与COVID-19相似,SARS患者存在多种炎症因子升高,在应用激素治疗5-8天后,IL-8、单核细胞趋化蛋白-1、IFN-γ诱导性蛋白-10等炎症因子明显下降[5]。然而,激素的应用,特别是大剂量、长疗程的应用,可能会导致继发感染、消化道出血、血压及血糖难以控制、骨质疏松甚至股骨头坏死、水电解质紊乱等并发症。在一项纳入478例甲型H7N9流感患者的多中心、回顾性研究中,激素治疗是甲流病毒排毒时间延长的危险因素 [6]。
综上,应用激素的获益在于改善重症患者氧合、抑制炎症反应、加速肺部病变吸收、减少机械通气的使用,有望降低病死率,弊端在于延长病毒排毒时间、继发感染及其他激素相关并发症。我们应该注意到充分权衡激素在病毒性肺炎治疗中的利与弊,谨慎使用激素这把双刃剑。如需应用激素治疗,则应在危重症、病情快速进展的患者中尽早使用,以最大程度地缓解病情进展,并减少不良反应。
中国的COVID-19诊疗方案[7]中,推荐对于氧合进行性恶化、影像学进展迅速、机体炎症反应过度激活状态的患者,酌情短期内使用糖皮质激素,建议剂量不超过相当于甲泼尼龙1-2mg/kg/d。根据专家共识[8],在重症COVID-19患者中激素可短期应用(≤7天)低至中等剂量(甲泼尼龙≤0.5-1mg/kg/d或等量其他种类激素)。
根据我们团队的经验,在危重症、炎症指标明显升高、氧合持续恶化、影像学快速进展、临床及影像提示继发机化性肺炎的COVID-19患者中,应用甲泼尼龙1-2mg/kg/d的初始剂量,密切监测有无激素相关不良反应,后续根据临床、氧合、影像逐渐减量,治疗的有效性及安全性均较为满意。
在本案例中,该患者在应用激素的第3天出现血常规中白细胞、中性粒细胞骤升这一继发感染征象,时间间隔短,因此我们认为,继发感染由激素应用导致的可能性不大,在应用激素过程中本例患者也并未生其他明显的不良反应,激素的用量和疗程相对安全。在新型冠状病毒肺炎中,激素是否会延长排毒时间?是否可切实改善重症患者氧合?是否能减轻遗留的肺间质纤维化?激素的用量和疗程到底应该如何把握?这些问题,都有待今后开展大规模的随机对照研究或队列研究来回答。
在早期应用无创机械通气效果欠佳后应及时进行气管插管,氧合得到改善及时脱机拔管
有创机械通气的时机是重症新型冠状病毒肺炎患者救治中另一个非常需要注意的问题。根据我们的经验,不能因为患者氧合可由经鼻高流量维持,或担心插管后发生呼吸机相关性肺炎、气压伤就延迟插管,在患者因长时间缺血缺氧发生呼吸肌疲劳、脏器功能不全后,氧合实在难以维持时才进行气管插管,插管的风险更高,后续的脏器功能维护更加困难。如本例患者,在入院后9天持续氧合指数<100mmHg,呼吸频率逐渐加快,血气分析由初始的过度通气逐渐变为高碳酸血症,均提示呼吸肌疲劳、呼吸功能失代偿、死腔通气增加,因此,我们在早期应用无创机械通气效果欠佳后及时地进行了气管插管,插管后患者氧合逐渐改善,在4天后及时脱机拔管。短期的有创机械通气可有效降低氧耗、改善氧合、缓解呼吸肌疲劳,又可减少呼吸机相关性肺炎、气压伤等并发症的发生。另一方面,在严格防护的前提下,气管插管对于医护人员也是相对安全的,根据我们团队对于病房物表及环境的检测,在有气溶胶产生的操作时,空气样本的SARS-CoV-2核酸检测是阴性结果。
根据COVID-19患者存在肺水肿、透明膜形成这些提示早期ARDS的病理改变,在危重症患者中应给予及时及恰当的激素联合机械通气,以延缓ARDS的进展[9]。本例危重症患者在入院后早期应用抗病毒、激素抗炎及机械通气治疗等综合治疗,治疗效果好,肺部病变吸收明显,且无治疗相关并发症发生,或可为同类患者的治疗提供参考。
综合的治疗方案、积极全面的脏器支持,显得尤为重要,特别是对于合并基础疾病的老年重症患者。新型冠状病毒肺炎诊治领域仍有许多未知,需要我们不断总结经验教训,积极开展临床与基础研究,完善对这一新发传染病的认知。

图:中日医院驰援武汉的PCCM fellow合影
「这次疫情对我来说像一次『总考核』。可以说,没有PCCM专培项目,我是不可能沉着应对在疫情一线每天身边发生着的一切。」这是刚刚从武汉凯旋正在隔离的中日医院呼吸中心张帅的由衷感慨。2017年底,张帅进入PCCM专培项目,经历了呼吸与危重症医学科普通病房、ICU以及呼吸中心诊察部轮转,先后担任病房与ICU住院总医师。这两年半的培训,得以让她对呼吸与危重症医学的临床思维、规范化诊疗的理念在潜移默化中形成并强化,能让她所学的知识与技能经得起这场疫情的考验,同时也是对心理素质的一种试炼。然而,这次疫情不仅仅是对个人的一场总考,它是对我们所有PCCM fellow的巨大考验……
参考文献
[1] Li H, Yang SG, Gu L, et al. Effect of low-to- moderate-dose corticosteroids on mortality of hospitalized adolescents and adults with influenza A(H1N1) pdm09 viral pneumonia. Influenza Other Respir Viruses 2017; 11: 345–54.
[2] Chen RC, Tang XP, Tan SY, et al. Treatment of severe acute respiratory syndrome with glucosteroids: the Guangzhou experience. Chest 2006; 129: 1441–52.
[3] Siemieniuk RAC, Meade MO, Alonso-Coello P, et al. Corticosteroid therapy for patients hospitalized with community-acquired pneumonia: a systematic review and meta- analysis. Ann Intern Med 2015; 163: 519.
[4] Meduri GU, Bridges L, Shih MC, Marik PE, Siemieniuk RAC, Kocak M. Prolonged glucocorticoid treatment is associated with improved ARDS outcomes: analysis of individual patients' data from four randomized trials and trial-level meta-analysis of the updated literature. Intensive Care Med. 2016;42(5):829-840.
[5] Lam CW, Chan MH, Wong CK. Severe acute respiratory syndrome: clinical and laboratory manifestations. Clin Biochem Rev. 2004;25(2):121-32.
[6] Wang Y, Guo Q, Yan Z, et al, CAP-China Network. Factors associated with prolonged viral shedding in patients with Avian Influenza A(H7N9) Virus Infection. J Infect Dis. 2018; 217 (11), 1708-1717.
[7] 国家卫生健康委. 新型冠状病毒肺炎诊疗方案(试行第七版).
[8] Zhao JP, Hu Y, Du RH, et al. Expert consensus on the use of corticosteroid in patients with 2019-nCoV pneumonia (in Chinese). Zhonghua Jie He He Hu Xi Za Zhi 2020; 43: E007.
[9] Xu Z, Shi L, Wang Y, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med. 2020;8(4):420-422.
作者介绍

张帅
医学博士,2015年毕业于首都医科大学,中日友好医院呼吸与危重症医学科医师,PCCM fellow。主持国家自然科学基金青年科学基金项目一项,以第一作者发表SCI论文6篇,核心期刊论文多篇。


