摘要
本文报道1例中年男性患者,主因「间断咳嗽、咳痰、痰中带血1年」就诊。患者血清自身抗体阴性。病程初期于外院查胸部CT可见右肺中叶结节伴空洞形成,行手术切除病灶,术后病理诊断炎性假瘤,未予治疗后症状再发,复查胸部CT新见右肺上叶斑片实变影,上级医院会诊手术病理见血管炎改变,考虑诊断肉芽肿性多血管炎,加用激素治疗后病情仍逐渐进展,北京协和医院会诊病理诊断肺放线菌病,经抗感染治疗后病灶吸收。本患者的诊治过程加深了临床医师及病理科医师对感染与血管炎关系的理解。
患者男,54岁,因「间断咳嗽、咳痰、痰中带血1年」于2018年11月就诊于北京协和医院。患者2017年9月起无明显诱因出现间断咳嗽、咳痰,痰中带血,无发热,胸部CT平扫示右肺中叶结节伴空洞形成,内部可见液气平,病灶周围渗出影(图1,2):
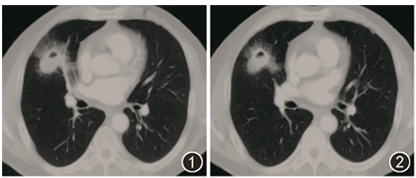
图1,2 胸部CT(2017-9-7):右肺中叶结节伴空洞形成
于外院行电视辅助胸腔镜下右肺中叶切除术,术后病理回报:肺组织急慢性炎,间质纤维组织增生,局部呈机化性肺炎样改变,伴脓肿形成。考虑「炎性假瘤」,术后未治疗。2017年12月患者症状再发,血痰逐渐加重,于2018年5月复查胸部CT平扫示:右肺上叶新发斑片实变影(图3,4)。
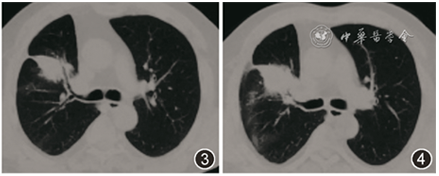
图3,4 胸部CT(2018-5):右肺上叶新发斑片实变影,伴术后改变
至上级医院行病理会诊,病理回报:支气管黏膜慢性炎伴机化性肺炎及脓肿形成,可见血管炎改变。当地医院考虑诊断「肉芽肿性多血管炎(granulomatosis with polyangiitis,GPA)」,2018年9月起给予甲泼尼龙45 mg(1次/d)口服治疗。治疗2个月后患者症状未见改善,体重下降明显(由80 kg降至65 kg),复查胸部CT示右肺上叶病灶未见明显吸收,且较前扩大(图5,6),为进一步诊治就诊我院。无吸烟史。既往史、婚育史及家族史无特殊。
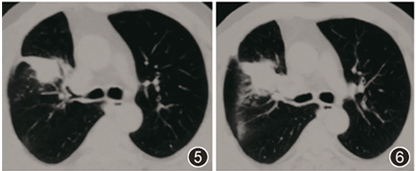
图5,6 胸部CT(2018-11):激素治疗2个月后,右上肺斑片影未见明显吸收缩小,局部有增大
体检:体温36 ℃,脉率86次/min,呼吸频率16次/min,血压130/70 mmHg(1 mmHg=0.133 kPa),右胸侧面可见3处陈旧性Trocar瘢痕,愈合良好。无皮疹,颈部淋巴结未触及肿大。双肺呼吸音清,未闻及干湿性啰音及胸膜摩擦音,心律齐,未闻及杂音,腹平软,无压痛及反跳痛,肝脾肋下未及,脊柱四肢未见异常。
实验室检查:血常规、尿常规未见明显异常。抗核抗体、抗中性粒细胞胞质抗体(ANCA)阴性,ESR、超敏C反应蛋白未见明显异常。
会诊外院病理:可见肺组织呈弥漫性肺组织炎(图7),肺泡腔内大量巨噬细胞集聚,可见慢性炎症细胞及少量含铁血黄素细胞,部分可见肺泡内机化,肺泡Ⅱ型上皮细胞增生,肺泡间隔增宽,胶原沉积,慢性炎症细胞浸润,间质纤维组织增生,血管内膜增厚;部分病变中心退变坏死及脓肿形成,其周边为炎性肉芽组织,与病变相邻之肌性血管内膜增厚、慢性炎症细胞浸润(图8,9),部分管腔闭塞;胸膜及小叶间胸膜纤维性增厚、血管充血;慢性淋巴结炎,淋巴结反应性增生。
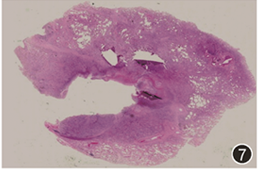
图7 手术切除肺组织标本HE染色可见肺组织慢性炎,部分病变肺组织坏死 低倍放大
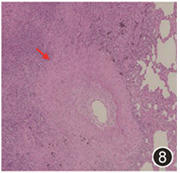
图8 病灶部位肺组织HE染色可见慢性炎,可见血管炎(红色箭头)HE 中倍放大
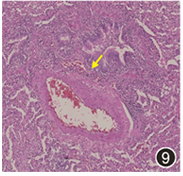
图9 远离病灶肺组织HE染色可见慢性炎,未见血管炎(黄色箭头)HE 中倍放大
考虑病变为感染,不排除特殊感染。特殊染色:抗酸/弱抗酸染色(-),弹性血管(+),六胺银(-),过碘酸雪夫染色(细胞内可见红染颗粒)。经细菌室会诊,加做革兰染色及弱抗酸染色:可见中量、有分枝革兰阳性杆菌,弱抗酸染色阴性(图10),考虑肺放线菌病。
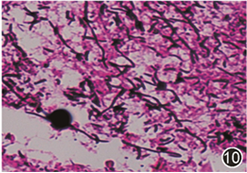
图10 病变处革兰染色阳性,可见丝状菌 高倍放大
最终诊断:肺放线菌病
给予左氧氟沙星(0.5 g,1次/d)口服治疗,同时停用糖皮质激素。患者治疗后咳嗽、咳痰、咯血明显缓解,6个月后复查胸部CT可见肺内病灶明显吸收,停左氧氟沙星,续贯磺胺甲噁唑/甲氧苄啶(2 # ,2次/d),2019年10月复查胸部CT示肺内病变吸收,伴轻度支气管扩张(图11,12),停药随访至今未复发。
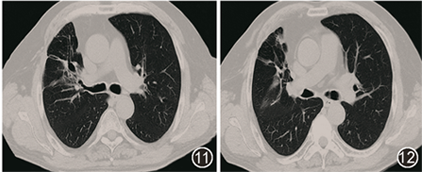
图11,12 胸部CT(2019-10):抗感染治疗1年后,肺内病变基本吸收
讨论
张婷(呼吸科):本病例特点:(1)中年男性,既往体健,慢性病程;(2)主要临床表现为咳嗽、痰中带血,近2个月症状加重、体重下降明显;(3)体检未见阳性体征;(4)实验室检查:血常规、尿常规、自身抗体、炎症指标均未见明显异常;(5)胸部CT:初期示右肺中叶结节伴空洞形成,行手术切除病灶,8个月后右肺上叶新发斑片实变影;(6)外院手术病理曾诊断炎性假瘤,未予治疗后症状再发,上级医院会诊手术病理见血管炎改变,考虑诊断GPA,加用激素治疗后病情仍逐渐进展,我院会诊病理诊断肺放线菌病,经抗感染治疗后病灶吸收。
彭敏(呼吸科): 肺部结节和空洞性病变涉及多种病因,以12周为界分为急性/亚急性和慢性病程,急性/亚急性空洞形成多与急性感染有关,常见病原体包括细菌(如金黄色葡萄球菌、肺炎链球菌、肺炎克雷伯菌、奴卡菌、铜绿假单胞菌)及真菌(如新型隐球菌、粗球孢子菌、毛霉、曲霉)。慢性结节和空洞形成则与多种病因有关,包括多种慢性感染(如结核分枝杆菌、非结核分枝杆菌、曲霉、荚膜组织胞浆菌、肺吸虫、人乳头瘤病毒等)、恶性肿瘤(原发性肺癌及肺转移癌)及自身免疫性疾病(如肉芽肿性多血管炎、类风湿性关节炎)。临床医生应结合患者的临床表现、实验室指标、影像学特点,甚至组织病理学结果进行详尽地分析和鉴别 [1] 。
施举红(呼吸科):GPA是一种以肉芽肿性炎症和坏死性血管炎为主要特征的,主要累及上呼吸道、下呼吸道以及肾脏的系统性自身免疫性疾病。临床可表现为鼻窦炎、中耳炎、肾小球肾炎、气道肺实质受累等多脏器病变,约90%的患者血清ANCA阳性。肺部影像学中,40%~70%的患者可出现单侧或双侧肺内结节,其他25%~50%的结节可伴有空洞形成,其他影像学改变还包括支气管扩张、支气管管壁增厚、实变及磨玻璃影等 [2]。其组织病理学表现为肉芽肿性炎,嗜碱性、地图状坏死和血管炎三联征。本例患者中年男性,无长期吸烟史,临床表现为痰中带血,肺内可见结节/空洞样病变,不能除外为GPA,但患者缺乏耳鼻喉、鼻窦、肾脏、皮肤等多脏器受累表现,且血清ANCA阴性,炎症指标正常,经激素治疗后病情仍有所进展,临床需考虑其他诊断可能。值得注意的是,GPA需要与慢性感染性疾病相鉴别,特别是慢性肉芽肿性感染性疾病,包括分枝杆菌感染、侵袭性真菌病(如毛霉、曲霉、组织胞浆菌感染等)均可引起肺内及全身多系统受累 [3, 4, 5],二者在临床特征上可能难以区分。考虑到针对GPA治疗的免疫抑制药物对于感染性疾病可能造成的严重后果,鉴别GPA与感染性疾病非常必要。影像学上,感染性疾病肺内病灶位置较固定,可伴有周围支气管壁增厚,而GPA肺内病灶可表现为游走性。二者在病理表现上可能存在差异:(1)感染仅会引起炎症区域内的血管炎症,在未受累的肺组织区域内若出现血管炎则更支持为系统性血管炎;(2)感染引起的组织坏死中心多呈嗜酸性而外周呈现淋巴细胞碎裂性浸润即嗜碱性改变,但在GPA中,坏死组织中心由于大量中性粒细胞脓肿聚集而在H&E染色中呈现蓝色,结核感染所致的干酪样坏死性肉芽肿亦是重要提示;(3)对组织进行特殊染色如革兰染色、抗酸/弱抗酸染色、六胺银染色等可以对感染性疾病进行更准确地识别,提高病原体的检出率 [6]。因此对于无全身多系统受累、ANCA阴性、病理表现为肉芽肿性病变及非坏死性血管炎的疑似GPA患者,应通过详细的病原学检查除外感染性疾病,并综合患者临床、影像、病理等信息做出诊断。
郑文洁(免疫科):血管炎是一组以血管壁炎症及坏死为主要病理改变的疾病。临床上系统性血管炎可分为原发性和继发性,原发性血管炎是指不合并另一种已经明确的疾病的系统性血管炎,继发性血管炎是指血管炎继发于另一确诊的疾病,如感染、肿瘤、结缔组织病、药物等 [7]。及时识别、去除诱因对于制定治疗方案、改善整体预后有着重要意义。继发性血管炎的感染性病因包括乙型和丙型肝炎病毒(HBV和HCV)、细小病毒B19、人类免疫缺陷病毒、水痘带状疱疹病毒、立克次体、螺旋体、细菌、真菌和寄生虫等。目前已被证实的包括乙肝病毒相关结节性多动脉炎、丙肝病毒相关冷球蛋白血症性血管炎,此外一些动物模型发现金黄色葡萄球菌可能与GPA的发病与复发有关 [8],结核分枝杆菌和肺炎克雷伯菌可能与大动脉炎有关,感染继发血管炎的机制包括以下方面:(1)病原体如分枝杆菌、真菌、巨细胞病毒、单纯疱疹病毒、立克次体直接侵袭血管内皮细胞造成损伤;(2)体液免疫机制:针对病原微生物抗原的免疫复合物沉积于血管壁内及管周导致血管损伤;(3)细胞免疫机制:自身反应性淋巴细胞的激活及多种细胞因子的释放,以及单核巨噬细胞的激活,进一步造成组织损伤及肉芽肿形成;(4)多种因素包括病原体本身、免疫复合物、自身抗体导致的免疫调节异常及血管内皮功能异常 [9]。对于明确感染继发的系统性血管炎,目前的治疗方案尚无指南明确,有学者认为,针对细菌、真菌或寄生虫继发的血管炎,治疗应以抗感染治疗为主,很少需要加用糖皮质激素;在病毒继发的血管炎中,对于单纯使用抗病毒药物或血浆置换不能恢复的患者,及初始病情严重的患者需考虑加用免疫抑制治疗 [10]。
许文兵(呼吸科):某些亚急性或慢性感染性疾病可以高度模拟原发性系统性血管炎,特别是某些伴有ANCA阳性的感染性疾病,如亚急性心内膜炎 [11]、结核分枝杆菌感染等 [12],病原体以链球菌属及葡萄球菌属最为常见,其他如结核分枝杆菌、军团菌、侵袭性曲霉病、丙型肝炎病毒、人类免疫缺陷病毒等均可引起ANCA弱阳性 [13]。其产生机制主要与中性粒细胞胞外陷阱的形成、多克隆B淋巴细胞活化产生自身抗体、血管内皮细胞激活表面表达胞浆酶有关。ANCA阳性的感染性疾病可以以发热、关节痛、肌痛、体重下降为首发表现,可伴有以血尿、蛋白尿为主的肾脏受累及以紫癜为主的皮肤受累,与血管炎临床表现十分相似,区别可能在于ANCA相关血管炎患者年龄较大,除肾脏以外较常累及耳鼻喉、肺脏、神经系统等。结合患者病史及临床表现,在严格或联合检测ANCA的前提下进行详细的病原学筛查至关重要,包括血培养、可疑感染灶局部培养和病原体特异性抗体检测。有学者认为,这些感染性疾病可能是感染继发血管炎的一个发展阶段,随着有效的抗感染治疗ANCA可逐步转阴,若病原体未能及时清除造成慢性感染,持续产生的ANCA等自身抗体可最终导致典型的ANCA相关血管炎病理损害 [14]。
冯瑞娥(病理科):病理是诊断的金标准,但对病理的解读不清也可能造成误诊。本患者病理曾提示血管内膜增厚、慢性炎症细胞浸润,外院病理回报「可见血管炎改变」。见到血管炎不能直接与临床所说系统性血管炎关联起来,事实上,任何感染导致的组织炎症反应均可能累及感染病灶周围的血管,即表现为血管壁炎症细胞浸润、内膜增厚等血管炎表现,但是结合患者临床表现以及病理中远离病灶部位的血管不受累这一特点可以加以鉴别 [6]。在毛霉感染患者的病理中,常见的病理表现包括地图状、凝固性坏死及化脓性肉芽肿形成,约62.5%可见真菌性血管炎表现,此外,菌丝还可侵犯血管壁或侵入血管内导致血管栓塞 [15]。因此病理中的血管炎除了提示可能的系统性血管炎疾病(无论原发或继发),更可以是一种常见的炎症改变,应结合患者全身多系统受累情况、自身抗体水平、病原学送检、影像学表现综合解读,此外,当临床按照原发性系统性血管炎进行正规治疗而病情持续进展恶化更是需要重新审视诊断的重要提示。
王瑶(检验科):肺放线菌病是由放线菌感染引起的一种肺内慢性化脓性疾病,由于发病率较低,临床认识不充分,存在较高的误诊率。口腔卫生不佳、有创操作、酗酒、存在肺部基础疾病(如慢阻肺、支气管扩张等)是肺放线菌病的高危因素。患者临床多表现为发热、咳嗽、咯血、胸痛等非特异性症状。胸部CT主要表现为肺内结节、局灶肺实变、团块影,部分病灶内含低密度的液化灶。肺放线菌病的确诊依赖于微生物学或病理学检测,特征性的「硫磺颗粒」有一定提示意义,在下呼吸道分泌物涂片或肺活检组织内找到放线菌即可诊断。放线菌生长时间较长,一般厌氧培养3~7 d后阳性,很多放线菌对厌氧条件要求不高,在5%~10% CO2环境延长培养也可生长,若临床高度疑似建议延长培养时间至21 d,可提高其检出率 [16]。本例患者否认发病前曾有洗牙、拔牙等口腔操作病史,体检未见明显牙体缺损、口腔黏膜创面、扁桃体肥大,病理学以局部坏死、脓肿形成、肉芽肿性炎症及病灶周围血管炎性改变为主,未见典型「硫磺颗粒」,但组织病理经细菌室会诊可见革兰阳性杆菌,有分支,弱抗酸染色可见蓝色、杆状菌体,为弱抗酸染色阴性,可与奴卡菌这一弱抗酸染色阳性菌鉴别,因此从形态学角度考虑为放线菌,建议采集新鲜组织进行细菌培养进一步确认,也可对外院石蜡包埋组织测序进一步鉴定。
施举红(呼吸科):本例给临床医师的启示,血管炎分为原发性和继发性,其中感染性疾病与原发性系统性血管炎应进行全面的鉴别。对于局限在肺内、ANCA阴性、病理为非坏死性血管炎的患者,诊断系统性血管炎应谨慎。对于病理有脓肿形成或肉芽肿性坏死的病变,应加做特殊染色除外感染性病变。传统的显微镜镜检、血清学实验、抗原抗体检测和新兴的二代测序技术均可用于病原体的诊断。
参考文献(略)
作者:孙忻 张婷 彭敏 王瑶 冯瑞娥 施举红
单位:中国医学科学院北京协和医学院北京协和医院呼吸与危重症医学科;中国医学科学院北京协和医学院北京协和医院检验科;中国医学科学院北京协和医学院北京协和医院病理科
本文转载自订阅号「中华结核和呼吸杂志」
原链接戳:【临床病例(理)讨论】痰中带血伴肺内结节和空洞性病变
引用本文: 孙忻, 张婷, 彭敏, 等. 痰中带血伴肺内结节和空洞性病变 [J] . 中华结核和呼吸杂志, 2022, 45(2) : 191-194. DOI: 10.3760/cma.j.cn112147-20210429-00298.


