
一、疫情前后社区获得性肺炎(CAP)病原谱的变迁
1、呼吸道感染症状及病因
致病微生物侵入呼吸道并进行繁殖导致的疾病称为呼吸道感染。根据其部位分为上呼吸道感染和下呼吸道感染。
文献报道上呼吸道感染的病原体70~80%是病毒性的;细菌性病原体占20-25%。
下呼吸道感染的症状包括肺炎、支气管炎和支气管扩张等,主要由细菌、支原体、衣原体、军团菌、病毒等感染引起。CAP的细菌主要包括流感嗜血杆菌、肺炎链球菌以及卡他莫拉菌等,最近几年来,肺炎克雷伯菌的感染比例在逐渐增加。
2、呼吸道感染常见病原体
呼吸道感染的常见病原体分为病毒、细菌、真菌、支原体、衣原体等(图1)。
病毒类病原分为RNA病毒和DNA病毒。与DNA病毒检测不同,RNA病毒进行PCR检测先经过逆转录成cDNA,再进行PCR检测。
RNA病毒包括流感病毒(A/B)、副流感病毒、呼吸道合胞病毒、冠状病毒等。流感病毒一直是我们关注的焦点,呼吸道合胞病毒更易引起婴幼儿,儿童,老年人群的感染。像SARS和SARS-CoV-2(COVID-19)对全球的政治和经济都造成了严重影响的冠状病毒,不可小觑。普通冠状病毒包括229E,NL63,OC43与HKU1,是普通感冒的主要病原微生物。引起的感染症状轻,健康人对其具有一定的抵抗力,往往不会受到特别关注。当然,严重的感染普通冠状病毒也会造成死亡。2022年我曾见有2例患者,伴有肥胖和糖尿病的患者(65岁以上),因感染普通冠状病毒去世。mNGS技术和多重PCR技术的应用,使我们对冠状病毒的理解更加深刻。
DNA病毒包括腺病毒、巨细胞病毒、EB病毒等。腺病毒可引起重症感染,也有在健康人群中检出腺病毒的情况。巨细胞病毒和EB病毒在婴幼儿时期感染。随着年龄增长和意外情况的发生,比如患者出现移植、血液性疾病、感染HIV以及肿瘤等情况,潜伏期/隐性感染的巨细胞病毒和EB病毒可能会「复燃」,从而引起非常严重的感染。肺移植科就非常关注巨细胞病毒引起的感染。
细菌类病原从形态上分为球菌和杆菌,依据革兰染色的特点又分为革兰阴性菌和阳性菌。
革兰阳性菌中的肺炎链球菌是引起CAP的重要病原,该菌难培养,因送样或保存不合理不及时容易死亡,检测阴性。肺炎链球菌可引起重症感染,患者使用抗生素后难以检出,因此,肺炎链球菌引起的CAP比例有被低估的趋势,采用分子生物学检测肺炎链球菌是不错的选择。肺炎克雷伯菌和流感嗜血杆菌的引起CAP的机会比较高。门诊患者铜绿假单胞菌感染可能更多见于支气管扩张和慢阻肺病(COPD)的患者。鲍曼不动杆菌引起的CAP非常罕见。上述这些细菌也可能会在正常人群定植,检出来未必意味着感染,特别是样本留取不合格的情况下。呼吸道样本涂片常有助于感染与定植的区分。
军团菌可以引起非常严重的感染,建议军团菌使用分子生物学检测方案,如PCR或多重PCR技术等,不提倡用抗体检测方法,培养也较为困难,耗时长,需要特殊的培养基。
真菌病原主要包括酵母菌、曲霉菌、毛霉菌等。
其他的非典型的病原包括肺炎支原体、肺炎衣原体、鹦鹉热衣原体以及立克次体等。值得注意的是鹦鹉热衣原体,实际上鹦鹉热衣原体近年来主要通过测序来诊断,临床中有一些分子生物学的试剂也可以检测鹦鹉热衣原体。随着分子生物学检测技术和宏基因组测序(mNGS)技术的广泛应用,我们发现自己实验室的鹦鹉热衣原体的感染率和检出率超过了肺炎衣原体,已经成为很重要的一类病原,鹦鹉热疾病可以引起严重的临床感染,患者进入ICU的比例也相当高。
此外,新的病原体还在不断地出现:如SARS病毒、高致病性禽流感、人感染H7N9禽流感、新型冠状病毒(SARS-CoV-2)等。

图 1 常见病原体分类
3、CAP患者病毒感染的研究
我国免疫功能正常成人获得病毒性肺炎的主要原因是流感病毒感染,其次是非流感病毒感染。
在我国免疫功能正常的成人CAP患者中流感与非流感病毒感染分别占比为63.5%、26.2%。对单种病毒感染患者的分析也证实,流感病毒感染是病毒性肺炎的主要原因,其次为腺病毒、呼吸道合胞病毒等非流感病毒感染(图2)[1]。
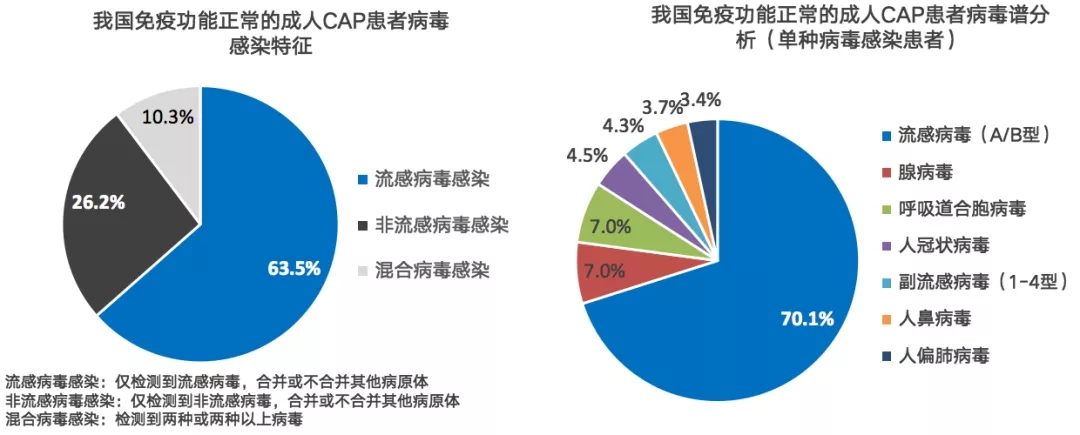
图 2 我国免疫功能正常的成人CAP患者病毒感染的研究
呼吸道病毒是CAP发病的重要原因
在过去20年,多种传染病的暴发凸显出病毒在CAP发病中的重要性,像SARS病毒、MERS病毒以及禽流感病毒等相继出现,未来还会有新的病毒不断涌现出来(图3)。
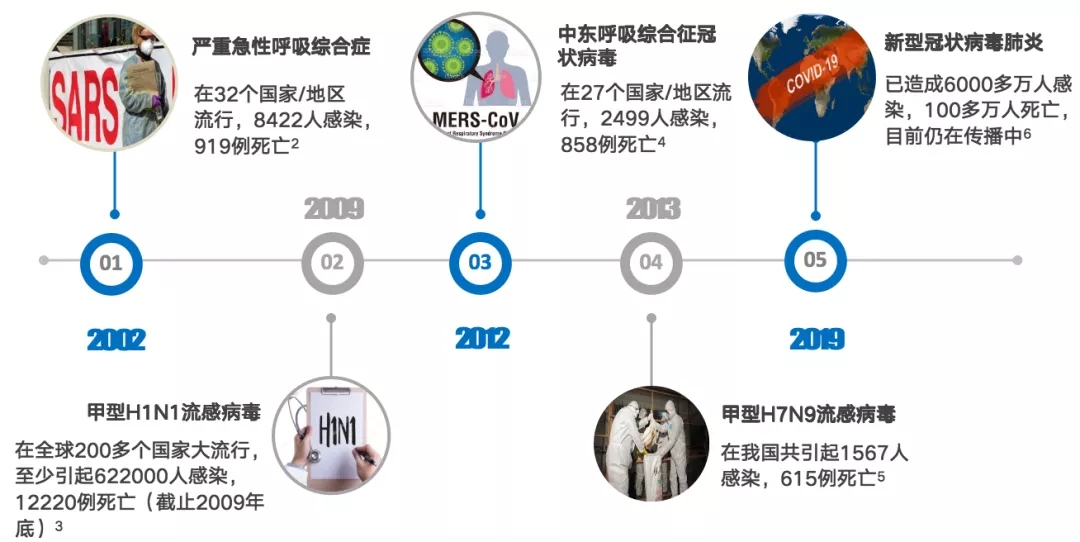
图 3 2002-2019年多种传染病的暴发[2-6]
4、疫情前后,CAP病原谱变化
疫情之前病原种类相对稳定
2021年中国疾控中心(CDC)发表了一项流行病学调查研究,调查了2015年9月-2018年8月北京19家医院的口咽拭子(TV)、鼻咽拭子(PV)、痰样本(SP)和支气管肺泡灌洗液(BALF)四种来源样品中病原种类的数量分布(图4)[7],分析了社区获得性肺炎(CAP)的病原学趋势。检测的病原谱几乎涵盖了所有CAP病原,包括细菌、病毒、真菌以及非典型病原体等。
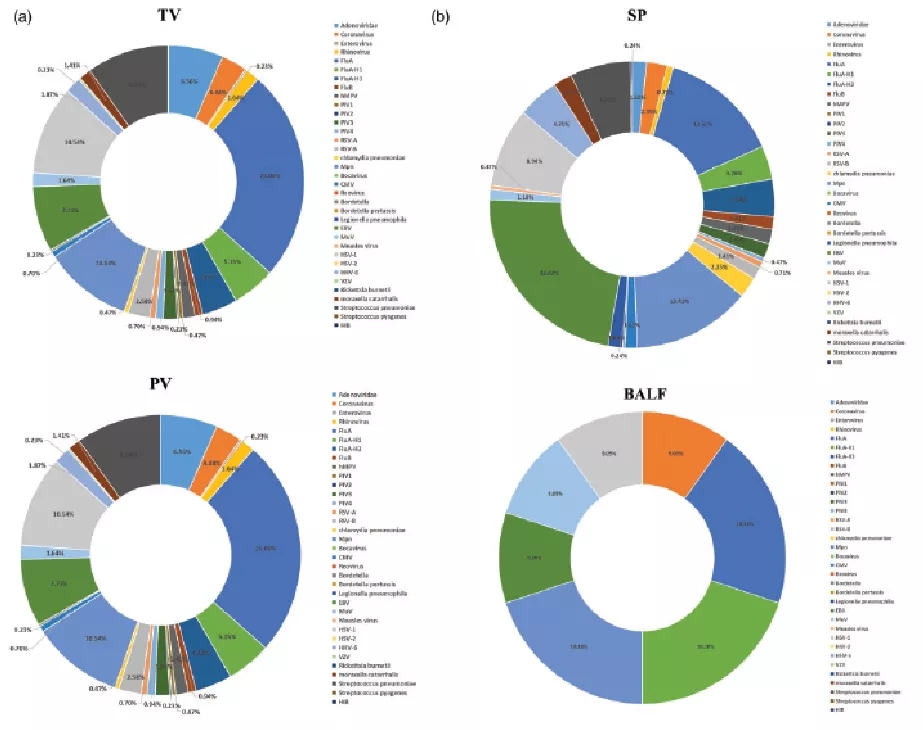
图 4 2015-2018年北京19家医院的口咽拭子、鼻咽拭子、痰样本和支气管肺泡灌洗液样本中病原分布
从口咽拭子样品的病原分布来看,腺病毒、冠状病毒(不包括分型)、鼻病毒、甲流、乙流、肺炎支原体等的感染概率较大(图5)。疫情之前,病原种类的分布情况相对比较稳定。
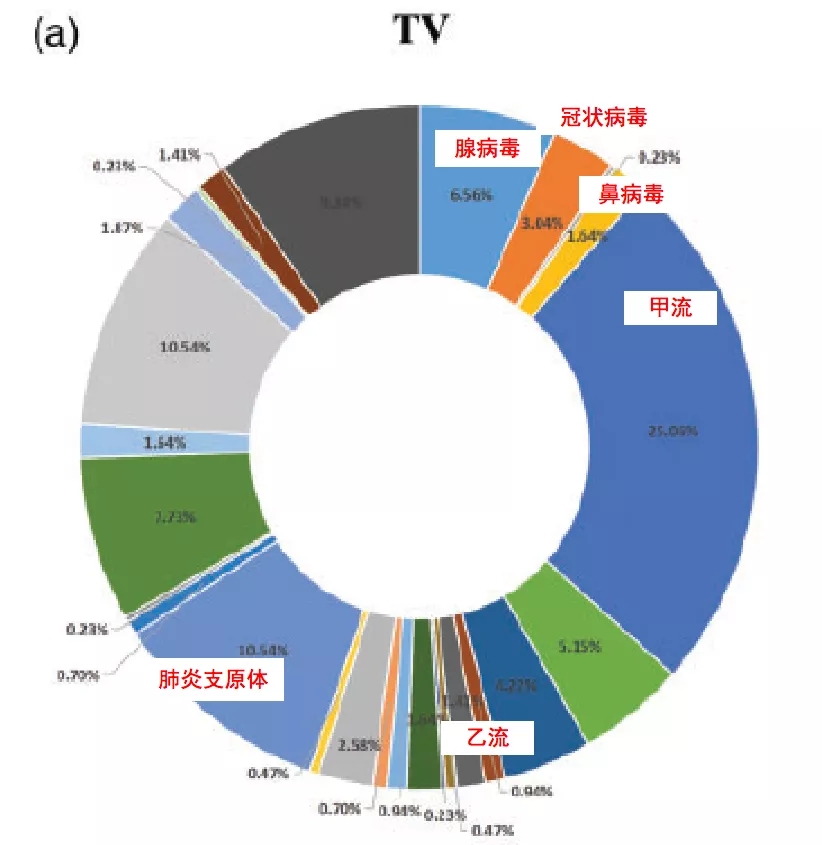
图 5 口咽拭子样本中病原分布
疫情之后CAP病原谱变迁
2020年,中国疾控中心发布的流感周报-南北方流调数据显示,疫情之后甲流和乙流的感染甚少,基本上已经销声匿迹(图6)[8]。
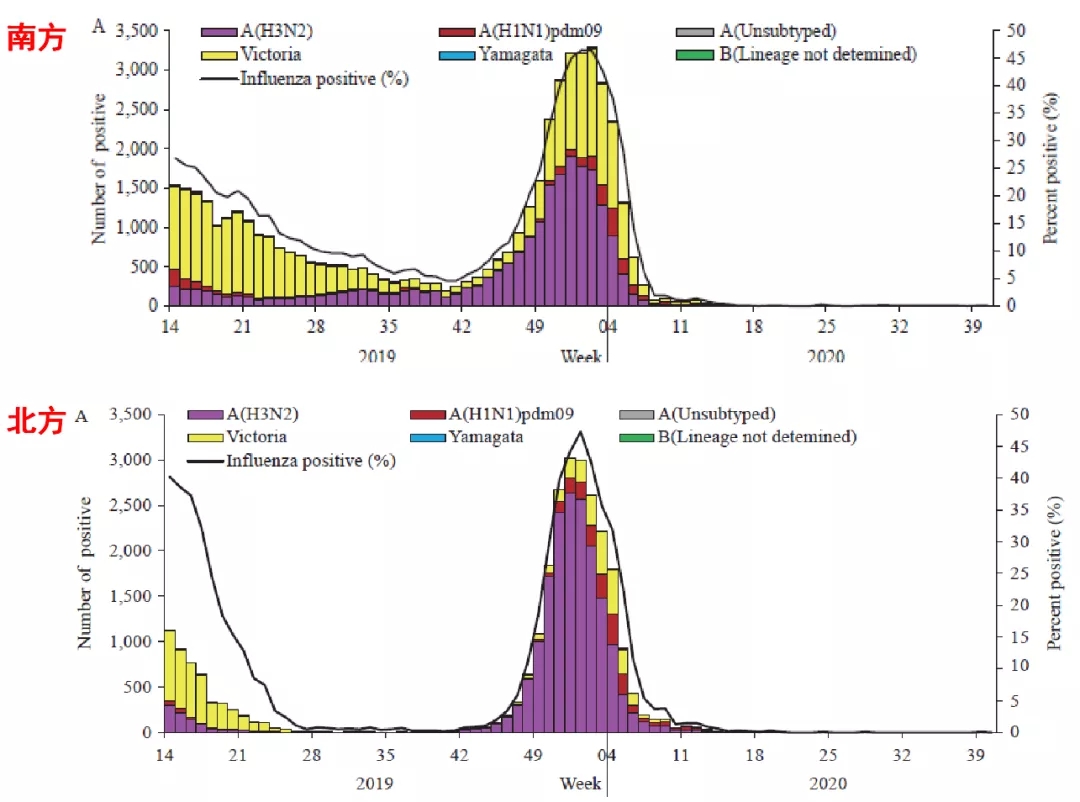
图 6 南方、北方流调数据
不同年度的南北方流感病毒阳性检测的曲线显示,2020~2021年,流感病毒基本处于基线水平(图7)[8]。其原因与我国采取的新冠肺炎疫情防控措施有关,例如戴口罩、勤洗手、减少接触等举措,对流感病毒的防控同样有效。但是从2021年11月份开始,乙流的感染病例不断检出,持续增加,从而出现新的增长趋势。同时呼吸道合胞病毒的检出率与去年同期相比也大为提高。
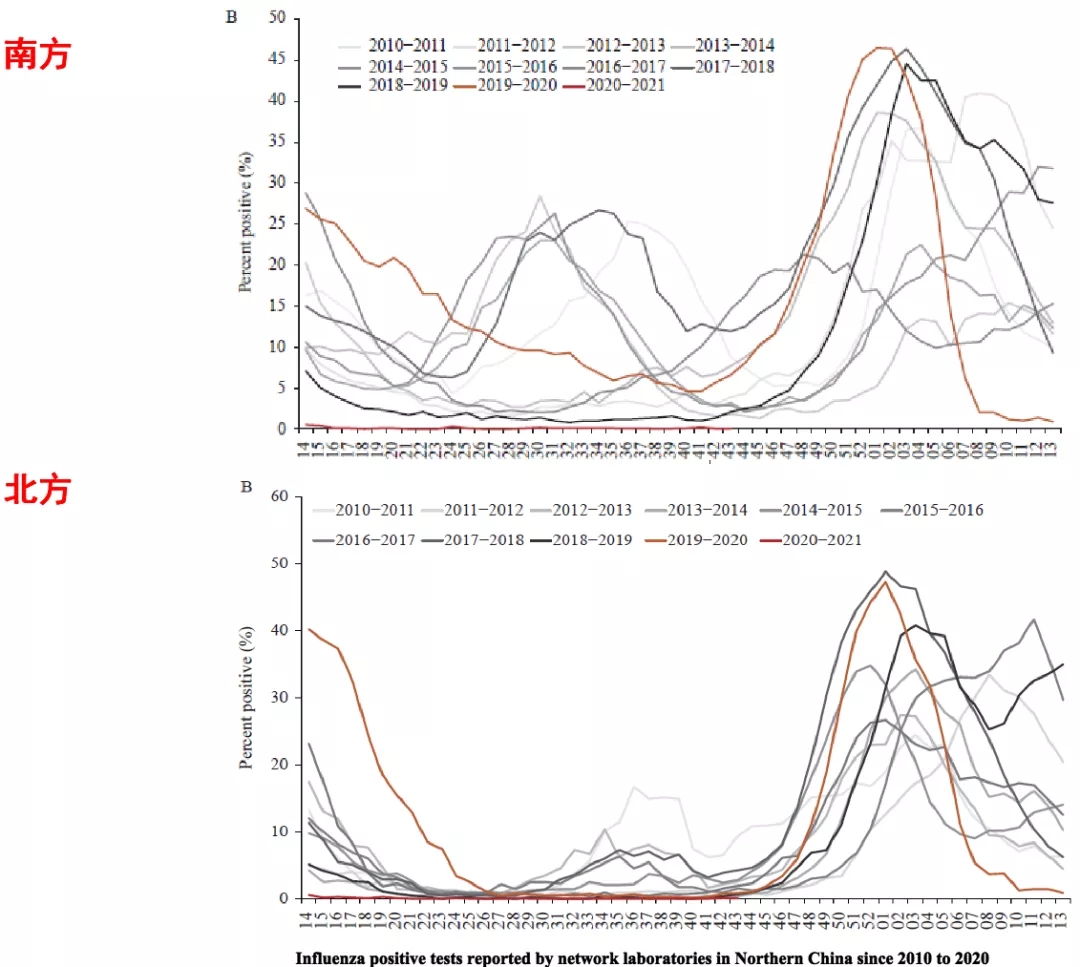
图 7 2010-2021年中国南北方实验室报告的流感阳性检测
2019年4月至2020年10月出现流感病原分布的情况显示,甲型H1N1病毒较少,甲型H3N2病毒和乙型Victoria系病毒较多(图8)[8]。
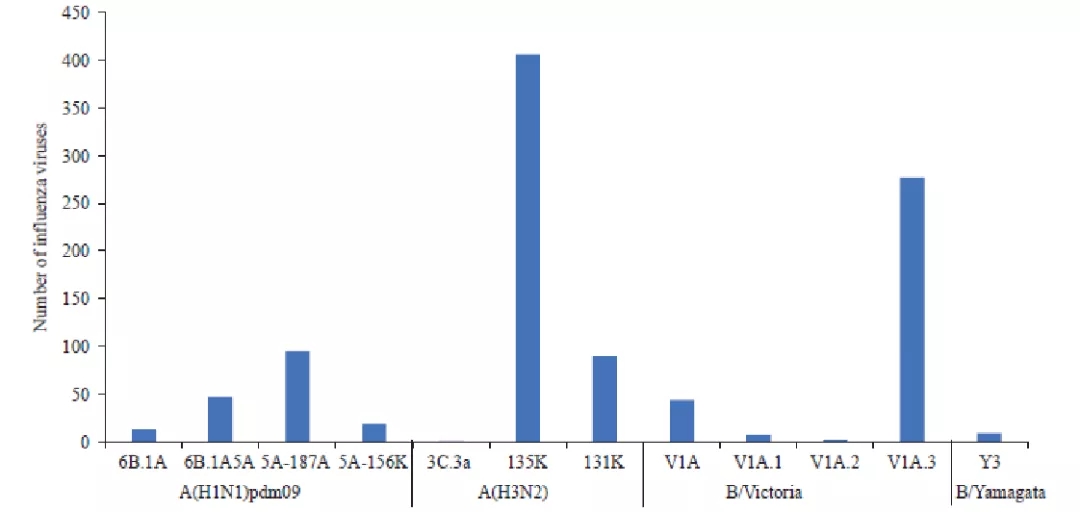
图 8 2019年4月至2020年10月中国大陆流感病原分布
国际与国内流感的变化趋势基本相同。2020年初,瑞士的流调研究显示,新型冠状病毒(SARS-CoV-2)和社区获得性呼吸道病毒(CARV)共感染率为1.8%[9]。这提示我们关注冠状病毒的同时,也不要忽视其他病毒的感染。
来自江苏省的早期流调研究显示,在新型冠状病毒检出的感染人群中,还能够检出鼻病毒、腺病毒、流感病毒、肺炎支原体、百日咳、偏肺病毒,这些病毒与新型冠状病毒存在一定的共感染率。
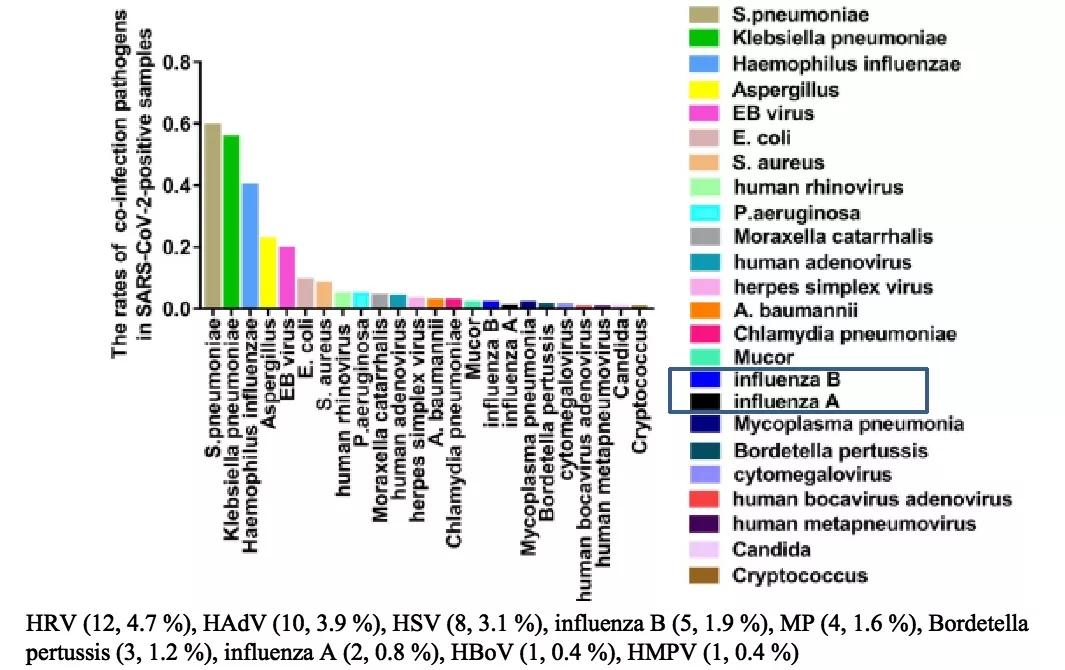
图 9 江苏省SARS-CoV-2合并呼吸道病毒病原体分布
在新冠疫情背景下,虽然SARS-CoV-2是大家关注的重点,但是中国CDC对流感病毒也特别的关注。
2021年5月,四川省出现小规模的禽流感病毒(H5N6)病例,共有5例患者(49~65岁)被诊断为H5N6,总体来说没有引起严重的后果(图10)。但是,令人警觉的是其中有3例患者死亡。
在每年流感季,即使新型肺炎疫情得到了有力的防控,我们也要其他流行病毒提高警惕。
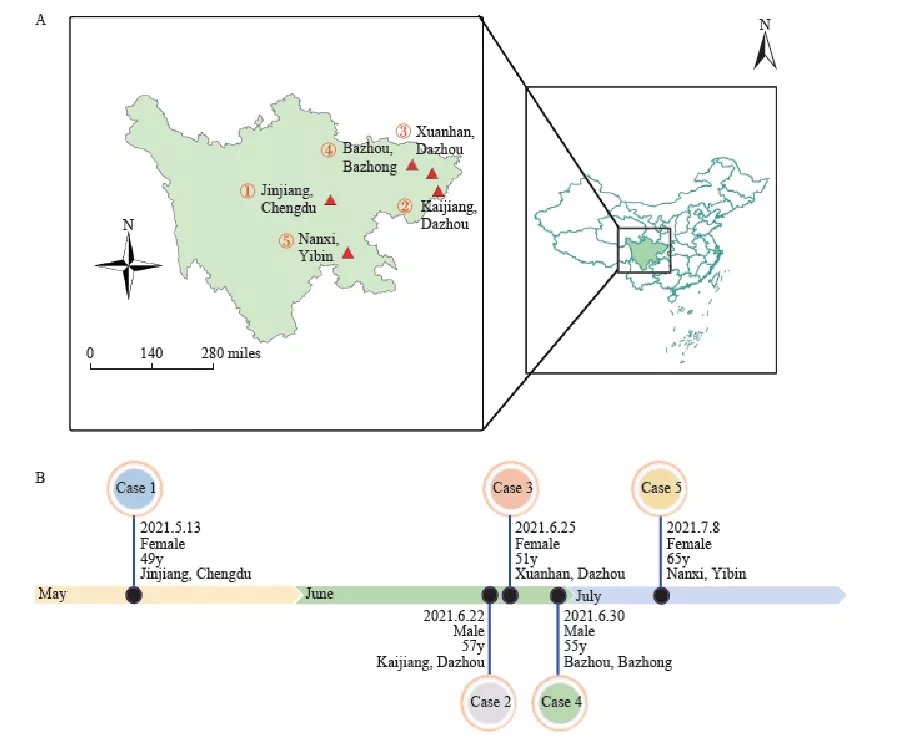
图 10 (A)人感染H5N6病毒地理分布, (B)人感染时间线和基本人口统计信息
为了显示甲型流感病毒具有不同的HA和NA配对,我国CDC专家发表的一篇文献,将目前已经在人或动物体内检测到的甲型流感病毒的亚型标黄,尚未检测出的用「X」表示(图11)。未来,某一「X」病毒也可能成为大规模的流行。
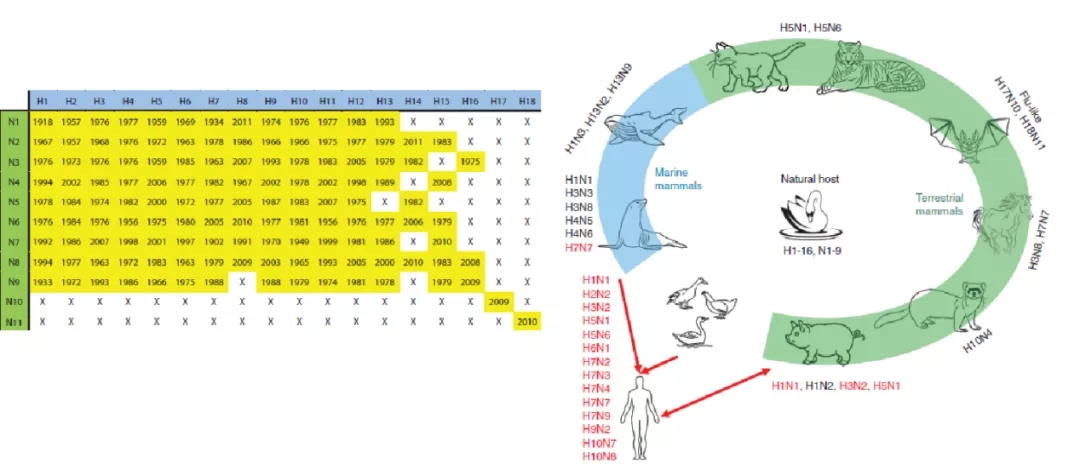
图 11 (左)甲型流感病毒亚型及其最早检测年份,(右)甲型流感病毒的自然宿主和哺乳动物宿主
二、实验室检测呼吸道病毒方法简介
1、明确目标病原
只要明确目标病原,临床抗感染治疗方能有的放矢,才能及时有效的治疗,还可以防止临床抗生素的滥用。不同的病原类型采取不同的治疗方案(图12)。
案例:中日友好医院曾经收入1例鹦鹉热衣原体阳性患者,该患者是一名孕妇,有严重的肺部感染,经ECMO、抗生素和抗病毒药物治疗效果一般。在明确病原是鹦鹉热衣原体后,给予对症治疗,用莫西沙星,替加环素,或阿奇霉素治疗,效果比较好。
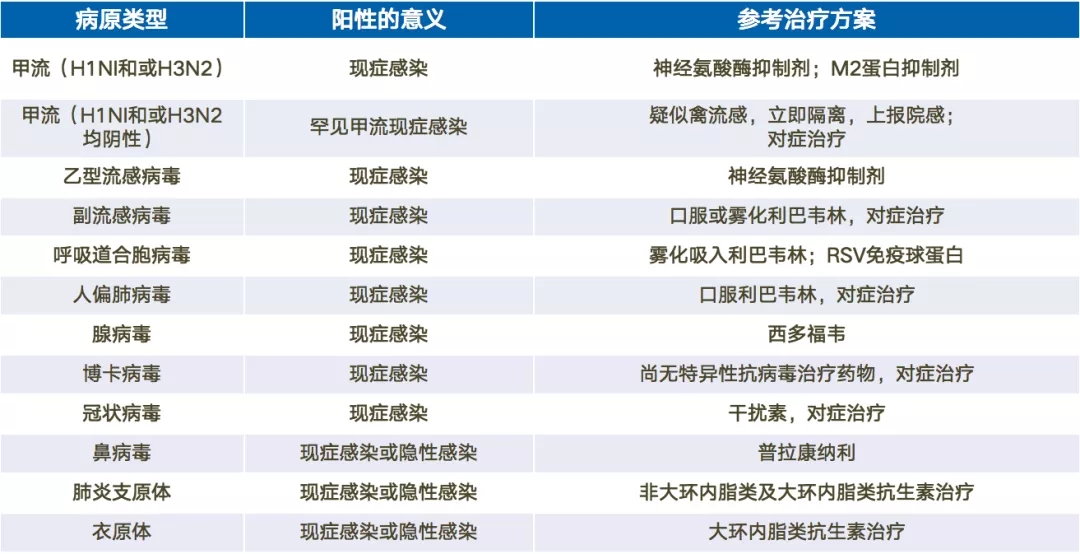
图 12 临床抗感染治疗方案[10-18]
2、呼吸道病原体流行病学情况
虽然呼吸道感染的病原体种类多,但是流行病学调查显示,呼吸道感染的常见的病原主要有甲、乙型流感病毒、呼吸道合胞病毒、腺病毒、肺炎支原体、肺炎链球菌、流感嗜血杆菌、卡他莫拉菌等,基本覆盖多数CAP病例,可以是核酸检测的重点靶标。
国内病原学诊断时应用宏基因组测序(mNGS)较多,因为国内在微生物检测的发展过程中缺少快速多重分子生物学靶向检测。国外尤其欧美国家对多重靶向检测的应用较多。
实际上,患者可能感染一种或多种病原,病原体可能存在共感染,因此,多重检测将是未来发展的趋势。若我们有一种针对多种(如大于20种)呼吸道病原且快速准确的检测手段,2小时内取得结果,随来随检,将会给临床治疗提供更多的帮助。
在临床工作中,快速发现目标方能抢占先机,争取赢面。在呼吸道感染诊疗中,及时发现病原体并进行干预可改善患者的结局。
3、病原体检测技术
随着科技的迅猛发展,病原体检测已从传统的病原体分离培养、到免疫学技术、再到血清学检查,最终迈向了分子检测时代。
①病原体分离培养
在过去几十年,病原微生物识别一直依赖于涂片与体外分离培养。但该方法所需时间长。部分病原体,如病毒及非典型细菌感染,培养存在操作难度大,假阴性率较高等问题,目前主要在科研中使用,临床中已经被分子生物学与抗原检测的方法所替代[19]。但是,像金黄色葡萄球菌或肺炎克雷伯菌、铜绿假单胞菌的抗生素治疗,还是需要培养的,培养可以提供药敏的结果。
②免疫学技术
病原体抗原检测用时短,操作简便,不需要复杂的操作仪器,是现在很多实验室呼吸道病毒检测的主流方法。该方法敏感性不高,特异性较好,常用于快速筛查[20]。例如2017年底北京暴发的甲型流感病毒,病原体抗原检测就体现了效率高、成本低的优势。
③血清学检查
血清学主要检测抗体,炎性标志物早期反映机体感染的状态,还可用于疾病进展及疗效的监测等,但其缺点是不用能用于感染病原体的诊断[21]。多数情况下,单次检测抗体对临床诊断没有多大价值,即使是IgM抗体阳性,对临床现症感染诊断的价值也很有限。
④分子检测
分子检测技术自上世纪80年代问世以来,逐渐应用于病原体诊断。该方法高效、便捷,检测敏感性、特异性高,在病原体检测中越来越受到重视[22]。
4、国内外指南推荐
美国CDC推荐的病毒诊断方法:抗原检测----快速;分子诊断----快速、早期、常规;病毒分离----培养困难;血清学检测抗体----不推荐使用[23]。
总体来说,国内和国外病原检测指南的基本理念相同。病毒的抗原和核酸检测可以用于早期诊断;抗体检测可以用于回顾性调查研究,但对病例的早期诊断意义不大。
在流行季,使用灵敏度和特异性较高的分子生物学检测方法对CAP感染的患者进行流感病毒等呼吸道病毒的快速检测是很有必要的,准确的诊断可以减少额外的测试和抗生素的使用[24]。实时定量PCR的敏感度和特异度较高,是流感病毒、禽流感病毒等呼吸道病毒感染快速诊断的首选方法,核酸检测可用于肺炎支原体、肺炎衣原体、军团菌感染的早期诊断[25]。
快速筛查时,则可选用抗原检测。
三、多重快速的分子生物学检测的价值
大多数情况下,建议采用分子检测手段,尤其是多重PCR病毒检测。
多重PCR病毒检测
国外非常依赖FilmArray快速多重PCR系统(图13),它可检测能够引起呼吸道感染、血流感染和胃肠道感染的各种病原体靶标以及抗生素耐药基因,对临床诊断很有帮助。

图 13 FilmArray快速多重PCR系统
当然,赛沛公司的甲型/乙型流感及呼吸道合胞病毒核酸联合检测试剂盒(Xpert Xpress Flu/RSV Assay)对临床呼吸道感染病原学诊断也很有帮助(图14)。

图 14 Xpert Xpress Flu/RSV Assay
多重PCR作为分子检测技术的代表,病原广谱覆盖,真正实现了高通量检测。
国内也有针对13项靶标检测的产品,目前商用的多重PCR试剂盒可涵盖引起呼吸道感染的常见病毒及非典型病原体,包括甲型/乙型流感病毒、呼吸道合胞病毒、腺病毒、鼻病毒、肺炎支原体和衣原体(可涵盖鹦鹉热衣原体与肺炎衣原体)。
近年来,国内的快速全自动分子检测的领域非常活跃,相信不久我们会有质佳价廉的国产产品用于临床。
宏基因组测序(mNGS)
传统病原学检测方法仍有临床无法满足的需求。对新型的流感病毒,通过传统的方法无法鉴别其病原体,可能造成像新型冠状病毒暴发的趋势,这时就要应用到宏基因组测序。
与国内文献对于宏基因组测序的技术大力提倡不同,国外的一些文献对于宏基因组测序用于临床持审慎的态度。2020年CHEST发表的一篇文献显示,与传统手段相比,宏基因组测序对真菌的检测无明显优势[26]。临床中,宏基因组测序对于结核检测的优势也是有限的。但是,如果微生物实验室不能为临床提供更有效服务时,临床医生首选宏基因组测序也是必然的趋势。
Nanopore测序技术
Nanopore测序技术(三代技术)是指单分子实时测序技术。主要优势:直接测序、快速、设备成本低。与前两代测序技术相比,其最大的特点就是测序过程无需进行PCR扩增,测序片段长。
靶向测序tNGS
t指targeted现在的技术可以在一个反应孔里加入数百种病原体引物,针对100~200种靶标进行扩增后测序,或加入捕获探针,捕捉目标病原核酸后测序,如此,排除人源及背景菌的干扰,只对我们所关注的病原进行靶向扩增和测序(图15)。
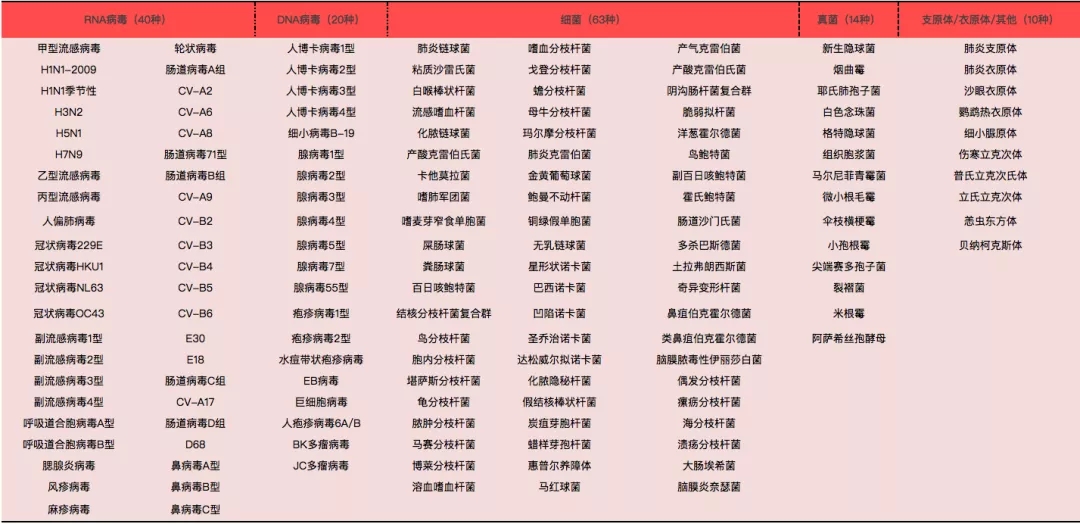
图 15 呼吸道多重病原体靶向测序153种
小结
疫情前后,CAP病原谱有所变迁。
呼吸道感染性病原学多重核酸检测具有重要临床意义:重症识别与预警;精准治疗降低医疗成本。
多重广谱快捷的分子诊断方案,为呼吸道感染性疾病精准化管理提供了坚实后盾。
mNGS技术,已经成为病原学手段的重要手段。正确的结果解读是利用好这一工具的关键。
参考文献 :
[1] Zhou F, Wang Y, Liu Y, et al. Disease severity and clinical outcomes of community-acquired pneumonia caused by non-influenza respiratory viruses in adults: a multicentre prospective registry study from the CAP-China Network[J]. European Respiratory Journal, 2019, 54(2): 1802406.
[2] Yang Y, Peng F, Wang R, et al. The deadly coronaviruses: The 2003 SARS pandemic and the 2020 novel coronavirus epidemic in China[J]. Journal of autoimmunity, 2020: 102434.
[3] Al Hajjar S, McIntosh K. The first influenza pandemic of the 21st century[J]. Annals of Saudi medicine, 2010, 30(1): 1-10.
[4] Memish Z A, Perlman S, Van Kerkhove M D, et al. Middle East respiratory syndrome[J]. The Lancet, 2020.
[5] Influenza at the human-animal interface. https://www.who.int/influenza/human animal interface/Influenza Summary IRA HA interface 02.03.2018.pdf?ua=1
[6] https://coronavirus.jhu.edu/map.html
[7] 2021 May 14;11(2). doi: 10.1177/20458940211011027
[8] 2021. CCDC Weekly / Vol. 2 / No. 44
[9] J Infect Dis 2020 09 14;222(8).
[10] Jain S, Williams D J, Arnold S R, et al. Community-acquired pneumonia requiring hospitalization among US children[J]. New England Journal of Medicine, 2015, 372(9): 835-845.
[11] Zhao M, Li G, Zhang D, et al. Clinical evaluation of a new single-tube multiplex reverse transcription PCR assay for simultaneous detection of 11 respiratory viruses, Mycoplasma pneumoniae and Chlamydia in hospitalized children with acute respiratory infections[J]. Diagnostic Microbiology and Infectious Disease, 2017, 88(2): 115-119.
[12] Krause J C, Panning M, Hengel H, et al. The role of multiplex PCR in respiratory tract infections in children[J]. Deutsches Ärzteblatt International, 2014, 111(38): 639.
[13] Abed Y, Boivin G. Treatment of respiratory virus infections[J]. Antiviral research, 2006, 70(2): 1-16.
[14] Kumar P, Srivastava M. Prophylactic and therapeutic approaches for human metapneumovirus[J]. Virusdisease, 2018, 29(4): 434-444.
[15] Kitanovski L, Kopriva S, Pokorn M, et al. Treatment of severe human metapneumovirus (hMPV) pneumonia in an immunocompromised child with oral ribavirin and IVIG[J]. Journal of pediatric hematology/oncology, 2013, 35(7): e311-e313.
[16] Peltola V, Söderlund-Venermo M, Jartti T. Human bocavirus infections[J]. The Pediatric infectious disease journal, 2013, 32(2): 178-179.
[17] Pyrc K, Berkhout B, van der Hoek L. Antiviral strategies against human coronaviruses[J]. Infectious Disorders-Drug Targets (Formerly Current Drug Targets-Infectious Disorders), 2007, 7(1): 59-66.
[18] 倪鑫. 儿童社区获得性肺炎诊疗规范 (2019 年版)[J]. 全科医学临床与教育, 2019 (9): 2.
[19] Das S, Dunbar S, Tang Y W. Laboratory diagnosis of respiratory tract infections in children–the state of the art[J]. Frontiers in microbiology, 2018, 9: 2478.
[20] Krause J C, Panning M, Hengel H, et al. The role of multiplex PCR in respiratory tract infections in children[J]. Deutsches Ärzteblatt International, 2014, 111(38): 639.
[21] 童永清, 赵志军, 徐万洲, 等. 急性呼吸道感染病原体的临床检验诊断路径[J]. 中华检验医学杂志, 2020, 43(7): 687-690.
[22] Yang S, Rothman R E. PCR-based diagnostics for infectious diseases: uses, limitations, and future applications in acute-care settings[J]. The Lancet infectious diseases, 2004, 4(6): 337-348.
[23] 卫计委颁布的《流行性感冒诊断与治疗指南(2011年版)》.
[24] 美国感染病协会(ISDA):CAP患儿的病毒诊断临床意义.
[25] 中国成人社区获得性肺炎诊断和治疗指南(2016年版).中华结核和呼吸杂志,2016年4月第39卷第4期: 253-279.
[26] CHEST (2020), doi:https://doi.org/10.1016/j.chest.2020.11.008.
[27] 2019 Jul;37(7):783-792. doi: 10.1038/s41587-019-0156-5.
本期直播嘉宾

鲁炳怀
中日医院,呼吸与危重症医学科临床微生物与感染实验室。主任医师,医学博士,北大医学部教授与硕士研究生导师。社会兼职:中华医学会检验分会微生物学组委员,中国医促会临床微生物与感染分会常委。研究方向:临床微生物与感染病原学诊断,耐药机制。主持多项国家级与省部级科研项目。发表SCI收录专业文章近30篇。
本文由《呼吸界》编辑 Asiya 整理,感谢鲁炳怀教授的审阅修改!
* 感谢赛沛(上海)商贸有限公司的大力支持!
本文完
直播导演:刘迪;排版:Jerry


