转眼间,新冠疫情已经在地球上肆虐两年了。
根据世界卫生组织(WHO)发布的数据,截至1月26日,全球确诊新冠病例超过3亿5200万,死亡病例超过560万[1] 。
随着2021年底Omicron突变株的出现,西方世界新发确诊病例屡创新高,越来越多的人开始相信:新冠可能会与人类共存。
既然如此,我们或许有必要深入认识一下新冠病毒。
它是第七种可以感染人体的冠状病毒!
回想2019年新冠疫情爆发之初,很快就有医生联想到了SARS,这不仅是因为患者的症状与SARS很像,还因为新冠与SARS长得也非常像,毕竟它们都属于冠状病毒。
冠状病毒因形得名,在电镜下,冠状病毒看起来非常像个皇冠。现在我们已经知道,冠状病毒属于单股正链RNA病毒,基因组大小约为26~32kb[2]。此外,在所有已知的RNA病毒中,冠状病毒的基因组是最大的[2]。
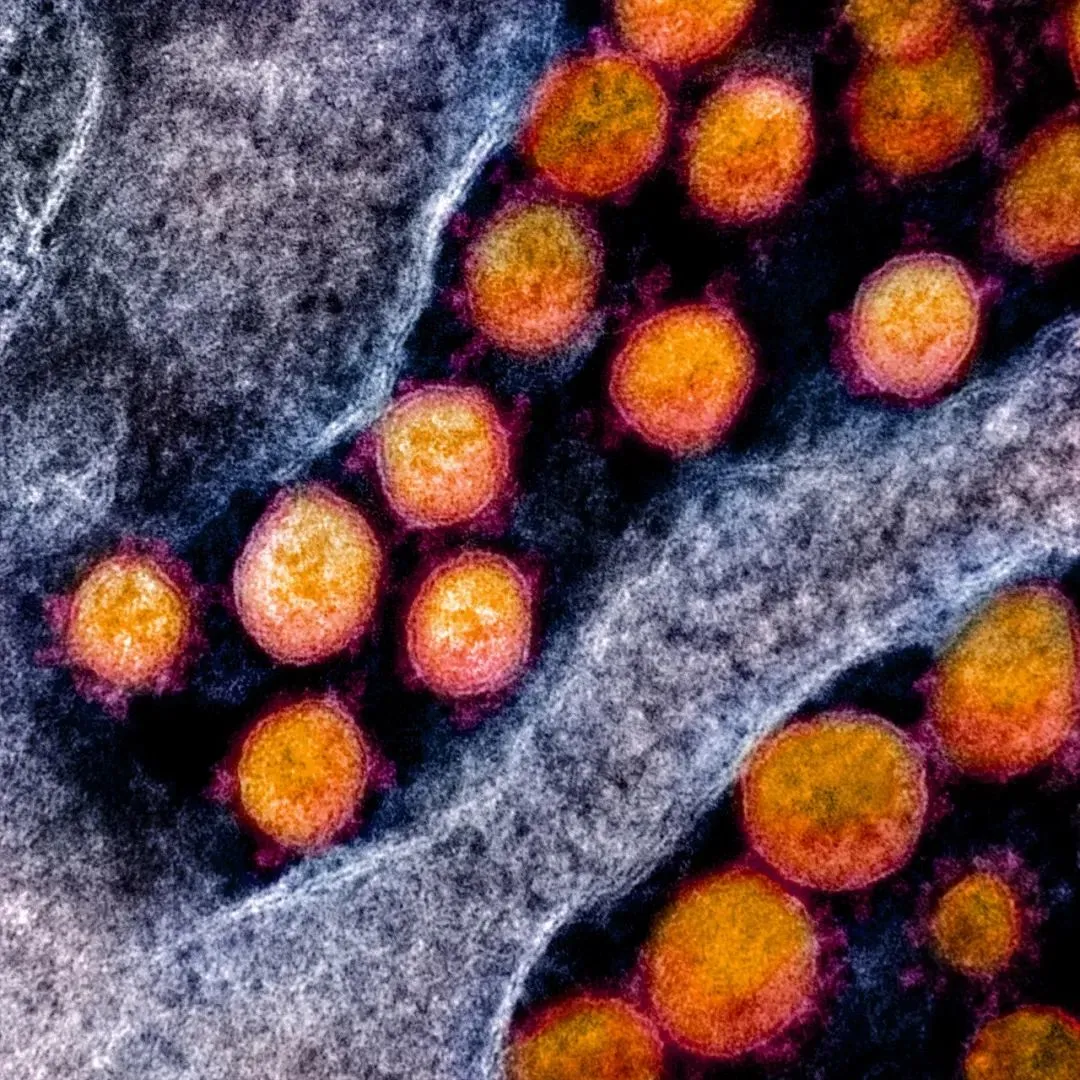
▲ 新冠病毒的电镜图片(图源:NIAID-RML)
其实冠状病毒的历史并不长,在1966年科学家才首次发现能感染人体的冠状病毒,它是从普通感冒患者的呼吸道中分离出来的HCoV-229E[2]。一年后,另一个研究团队又从普通感冒患者的呼吸道中分离出HCoV-OC43这个的冠状病毒[2]。
在二十世纪余下的三十多年里,没有能感染人体的新冠状病毒被发现,直到2002年SARS-CoV出现。对于SARS-CoV大家一定不陌生,它那9%的病死率[2],至今仍让人心有余悸,好在2003年,它就从人间销声匿迹了。
接下来是2004年发现的HCoV-NL63,以及2005年发现的HCoV-HKU1[2]。幸运的是,这两个冠状病毒与HCoV-229E和HCoV-OC43类似,都比较温和。据统计,每年大约10-30%的上呼吸道感染是这四个冠状病毒导致的,患者的症状一般较轻[3]。
2012年6月,一名60岁的沙特阿拉伯男性出现发热、咳嗽、咳痰、呼吸急促等症状,后因严重肺炎和多器官衰竭死亡。直到当年10月份,《新英格兰医学杂志》才发布这名男子死亡的真正原因——感染了一种新型的冠状病毒,也就是后来的MERS-CoV[4]。
与前面的五种冠状病毒相比,MERS-CoV是不折不扣的“大魔头”。据统计,截至2015年12月31日,全球确诊的MERS-CoV病例有1621例,死亡584例,病死率竟高达36%[2]。好在MERS-CoV没有在全球范围蔓延。
然而,与2019年底出现的新冠病毒(SARS-CoV-2)相比,MERS-CoV这个“大魔头”也相形见绌了。虽然新冠病毒感染的致死率远没有MERS-CoV高,但是新冠病毒导致的死亡人数,以及对人类社会的深远影响,是MERS-CoV远远不及的。
从名字上不难看出新冠病毒与SARS-CoV非常类似,实际上,在新冠病毒30kb的基因组中,有近80%与SARS-CoV同源[3]。从结构上看,新冠病毒与其他6种冠状病毒一样,病毒粒子由核衣壳(N)、膜(M)、包膜(E)和刺突(S)蛋白,以及病毒基因组组成[5]。
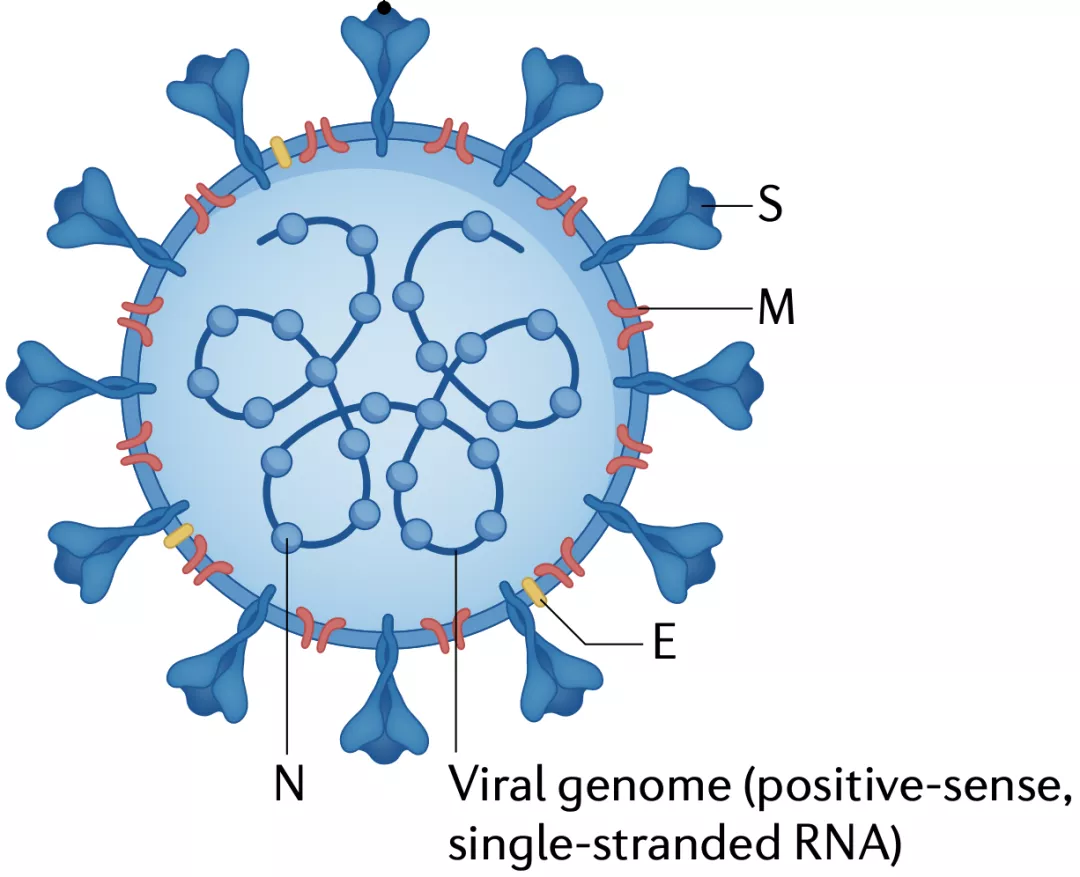
▲ 冠状病毒结构示意图[5]
不过,冠状病毒进入细胞的方式,却存在一定的差异。例如,新冠病毒、SARS-CoV和HCoV-NL63利用的是血管紧张素转化酶2(ACE2),HCoV-229E利用氨肽酶N(ANPEP),而MERS-CoV则是利用二肽基肽酶4(DPP4)进入细胞[6-9]。当然,没有这些受体,冠状病毒也可以进入细胞,只不过效率会大幅降低。
新冠病毒感染人体细胞的进程
众所周知,病毒感染细胞的过程可分为五步:吸附、释放遗传物质、复制增殖、组装和释放病毒粒子。其中第一步吸附是重中之重,也是疫苗和抗病毒药物的重要靶点之一。
在新冠疫情爆发伊始,我国科学家就率先发现,新冠病毒感染人体细胞取决于病毒S蛋白受体结合区域(RBD)与宿主细胞上ACE2的结合[7-9]。由此可见S蛋白和ACE2是病毒吸附成功的关键。
科学家已经发现,新冠病毒的S蛋白由两个非共价结合的亚基S1和S2组成,其中S1亚基与ACE2结合,S2亚基将新冠病毒锚定到膜上并介导病毒与细胞膜的融合。
具体过程大致是,S1亚基中的RBD与ACE2结合,导致S蛋白的构像发生变化,与此同时S2亚基暴露,人体细胞表面的跨膜丝氨酸蛋白酶2(TMPRSS2)切割S2亚基上的S2’位点,S2亚基中的融合肽(FP)露出,启动融合孔形成[5]。如此这般,新冠病毒就完成了吸附这一步。随后新冠病毒的遗传物质通过融合孔进入人体细胞,开启病毒的复制增殖、组装和释放等过程。
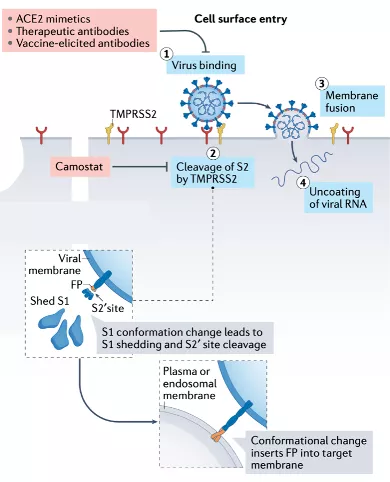
▲ 新冠病毒进入细胞的主要途径[5]
一旦新冠病毒成功进入人体细胞,并完成上述一系列过程,感染就真正开始了。
2020年3月20日,为了让新冠肺炎的诊治更规范,哈佛医学院布列根和妇女医院Mandeep R. Mehra和Hasan K. Siddiqi率先提出了一个新冠肺炎的临床分期系统[10]。
他们将新冠肺炎的病生理过程分成三个阶段:I期(轻度),早期感染;II期(中度),肺部受累;III期(严重),全身性过度炎症。接下来咱们就逐一认识这三个阶段。
先来说I期(轻度)——早期感染
在这个阶段,新冠病毒刚感染宿主,主要任务是在宿主体内繁殖并定居,且主要集中在呼吸系统。对于大多数人来说,这个阶段其实是个潜伏期,症状轻微且没有特异性,例如不适、发烧和干咳等[10,11]。
Mehra等人认为,在此阶段,如果使用有效的抗病毒疗法可能会减少症状持续时间,最大限度地减少传染性,并防止严重程度的进展。如果在这一阶段控制住病毒,患者的预后和恢复都会非常好[10,11]。
再来看II期(中度)——肺部受累
在这个阶段新冠病毒的增殖和肺部局部炎症是常态,患者会出现病毒性肺炎,伴有咳嗽、发烧,可能还缺氧。胸部X光或CT扫描能发现肺部出现双侧浸润或磨玻璃影。血液检查能发现淋巴细胞减少和转氨酶增多。此外,感染者的全身炎症标志物可能会升高,不过不是很明显。这一阶段的治疗主要包括支持性措施和抗病毒疗法[10,11]。
最后是III期(重度)——全身性过度炎症
这是新冠肺炎的最严重阶段,好在只有少数患者会进展到这个阶段。这个阶段,患者体内的辅助性、抑制性和调节性T细胞数量减少,IL-2、IL-6、IL-7、粒细胞集落刺激因子、巨噬细胞炎症蛋白1-α、肿瘤坏死因子-α、C反应蛋白、铁蛋白和D-二聚体等炎症细胞因子和生物标志物的水平显著升高。因此,这个阶段的患者最明显的特征是全身性过度炎症。这个阶段的治疗主要依赖于免疫调节药物[10,11]。
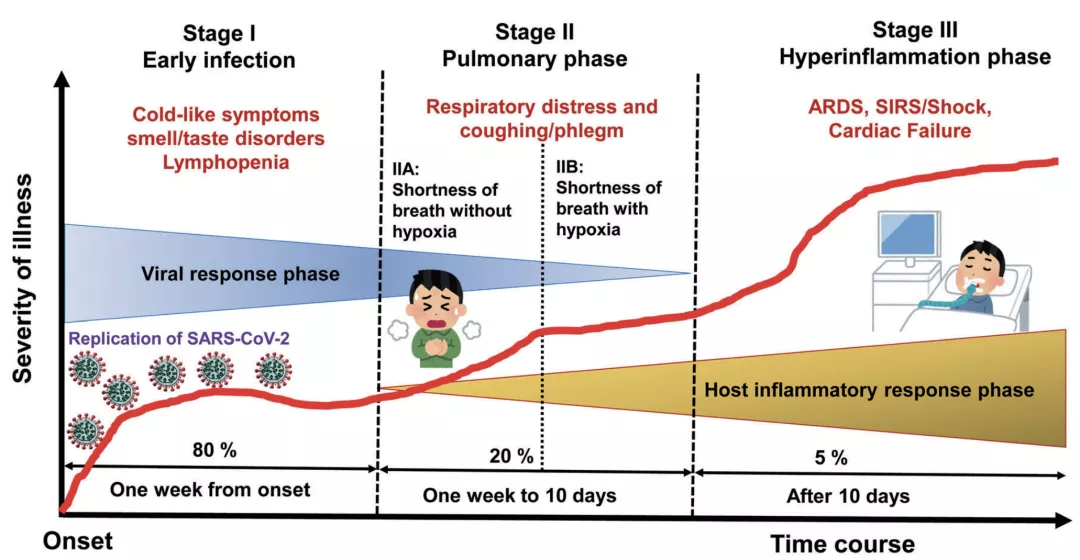
▲ 临床分期系统[11]
从Mehra等人划分的临床分期,以及他们对临床分期的解释不难看出,在新冠肺炎病生理处于I期和II期,也就是轻中度阶段,使用抗病毒疗法或能让感染者获得最大的益处。
实际上,大量的中和抗体临床研究已经证实,对于有症状、非住院、且有发展为重症风险因素的成年新冠患者,中和抗体能大幅度降低患者的住院及死亡风险[12-15]。其中,我国自主研发的安巴韦单抗/罗米司韦单抗组合,能将上述患者群体因疾病进展发生住院及死亡的风险降低80%(P<0.00001)[16]。
这些研究数据证实,早期抗病毒治疗确实能让患者获益。
人体免疫细胞是如何对抗新冠病毒的?
了解完新冠病毒感染的过程之后,大家应该也想知道人体免疫系统是如何应对新冠病毒的感染的。
我们都知道,人体的免疫反应有两类,一个是先天性免疫,一个是获得性免疫。最先响应新冠病毒感染的是先天性 免疫反应。
新冠病毒一旦感染人体细胞,就会被Toll样受体(TLR)3、7、8和9等模式识别受体,以及病毒感染感受器RIG-I和MDA5识别,继而激活I型干扰素(IFN)反应程序和IFN刺激的基因。而且TLR3还会促进NLRP3炎症小体的激活,诱导caspase-1依赖性裂解,以及关键促炎细胞因子白细胞介素1β(IL-1β)和IL-18的释放,进而引发gasdermin D介导的细胞焦亡[17]。如此一来,新冠病毒的增殖就因被感染细胞的死亡而被抑制。

▲ 先天免疫反应过程[17]
获得性免疫反应的速度也不慢。当新冠病毒进入细胞之后,病毒特异性蛋白就会被I类主要组织相容性复合体(MHC)蛋白呈递给细胞毒性T细胞。细胞毒性T细胞被激活后,开始分裂及克隆性扩张,并分化出病毒特异性效应和记忆T细胞[18]。病毒特异性效应T细胞能裂解病毒感染的细胞,阻止病毒的复制和增殖。
几乎在同一时间,树突状细胞和巨噬细胞等抗原呈递细胞会通过II类MHC将病毒肽呈递给CD4+T细胞,促使其分化成1型辅助性(Th1)T细胞等细胞。B细胞也可以直接识别病毒,并被病毒激活[18]。被激活的B细胞快速增殖,并开启体细胞超突变(SHM),其中编码中和抗体可变区的基因将会以远超其他细胞的速度开始突变,以进化出能合成与病毒抗原亲和力更强抗体的浆细胞(PC,抗体分泌细胞)。随后,辅助性T细胞会帮助筛选浆细胞,已实现中和抗体的亲和力成熟[19]。
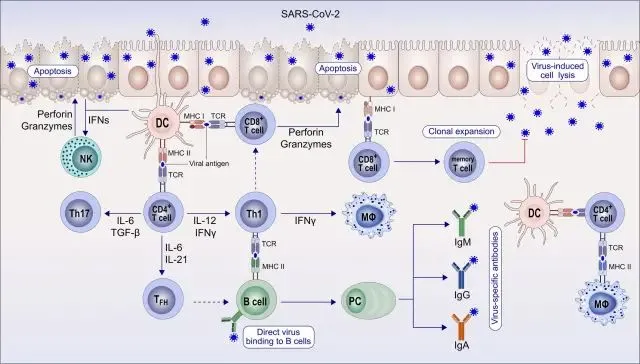
▲ 获得性免疫反应过程[18]
在获得性免疫反应中,值得一提的是B细胞的体细胞超突变(SHM)。在经历过数轮体细胞超突变之后,B细胞能合成数不清的中和抗体,不过这些中和抗体的中和活性并不相同,有些较强,有些较弱。
目前临床上使用的中和抗体基本都是从大量康复者血浆中和抗体中筛选出来的。例如,腾盛华创就从200多个人源特异性单克隆抗体[20]中筛选出一对与RBD结合能力强且互补的中和抗体,经过Fc段改造后得到了已经获批的安巴韦单抗/罗米司韦单抗。
新冠变异——逃避人体免疫系统的监视
俗话说,哪里有压迫,哪里就有反抗。既然人体免疫,以及中和抗体给新冠病毒施加了巨大的压力,它们也会变异。单链RNA的新冠病毒尤其会如此。
有研究表明,新冠病毒S蛋白进化的速度大约是流感病毒血凝素(HA)的10倍,这种进化速度那真是前所未有的[21] 。难怪新冠病毒在短短的两年之内就出现了那么多让人类紧张的新变种。
为了便于对新冠病毒新变种的监测和研究,WHO将它们分为三类:需关注的变异株(VOC)、需留意的变异株(VOI)和监测中的变异株(VUM)。
其中VOC对人类的威胁最大,截至目前,WHO一共认定了五个VOC,它们分别是:Alpha(B.1.1.7)、Beta(B.1.351)、Gamma(P.1)、Delta(B.1.617.2)和Omicron(B.1.1.529)[22]。每一个新的VOC诞生都取代上一个VOC,并导致一波大流行。
时至今日,S蛋白上出现30多个突变,且导致疫苗失效、部分中和抗体活性下降的Omicron[23],已经取代Delta成为西方流行毒株的主导者。
从近期的临床研究来看,Omicron突变株感染者的临床表现似乎更轻,住院率和死亡率降低[24,25]。有研究表明,这一方面可能与疫苗的接种有关[26];另一方面可能与TMPRSS2切割Omicron突变株刺突蛋白的能力下降有关[27]。不过,Omicron突变株的传播能力更强[28,29],高危人群面临的风险增加,如果短期出现大规模人群感染,仍可造成医疗挤兑,导致整体重症及死亡病例数量迅速增加。
▲ 新冠病毒的电镜图片(图源:NIAID-RML)
好消息是,在过去的一两个月里,科学家已经找到了至少三个应对Omicron变异株的方案。
第一个是疫苗加强针(第三针)。已经有研究发现,虽然两针新冠疫苗难以防范Omicron变异株,但是接种了mRNA疫苗[30]或灭活疫苗加强针[31]之后,接种者血清抗体对Omicron变异株的活性得到恢复,但仍低于野生株。
第二个应对方案是结合特定位点的中和抗体。虽然大部分中和抗体的活性都有所下降[23],但是已经有研究表明,结合S蛋白RBD位点IV的中和抗体(Sotrovimab和罗米司韦单抗)的活性,几乎不受Omicron变异株突变位点的影响[32]。这也是安巴韦单抗/罗米司韦单抗组合对Omicron变异株保持中和活性的原因之一。
第三个应对武器是小分子药物。已有多个实验室的研究表明,已经获得FDA批准获得紧急使用授权的三种小分子药物对所有当前的VOC活性保持不变[33,34]。
有了这“三板斧”,人类与新冠病毒之间的战争,也并非全无胜算。
总的来说,随着科学家对新冠病毒和新冠肺炎认知的加深,我们逐渐能摸清楚新冠病毒的弱点,最终大概率能找到克敌制胜的突破口。或许很快人类就可以与新冠病毒“和平共处”。
参考文献
[1].https://www.who.int/emergencies/diseases/novel-coronavirus-2019
[2].Su S, Wong G, Shi W, et al. Epidemiology, genetic recombination, and pathogenesis of coronaviruses[J]. Trends in microbiology, 2016, 24(6): 490-502.
[3].Yang H, Rao Z. Structural biology of SARS-CoV-2 and implications for therapeutic development[J]. Nature Reviews Microbiology, 2021, 19(11): 685-700.
[4].Zaki A M, Van Boheemen S, Bestebroer T M, et al. Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia[J]. New England Journal of Medicine, 2012, 367(19): 1814-1820.
[5].Jackson C B, Farzan M, Chen B, et al. Mechanisms of SARS-CoV-2 entry into cells[J]. Nature Reviews Molecular Cell Biology, 2022, 23(1): 3-20.
[6].Forni D, Cagliani R, Clerici M, Sironi M. Molecular Evolution of Human Coronavirus Genomes. Trends Microbiol. 2017;25(1):35-48. doi:10.1016/j.tim.2016.09.001
[7].Xu X, Chen P, Wang J, et al. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission[J]. Science China Life Sciences, 2020, 63(3): 457-460.
[8].Zhou P, Yang X L, Wang X G, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. nature, 2020, 579(7798): 270-273.
[9].Lan J, Ge J, Yu J, et al. Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor[J]. Nature, 2020, 581(7807): 215-220.
[10].Siddiqi H K, Mehra M R. COVID-19 illness in native and immunosuppressed states: A clinical–therapeutic staging proposal[J]. The journal of heart and lung transplantation, 2020, 39(5): 405.
[11].Hashimoto Y, Suzuki T, Hashimoto K. Mechanisms of action of fluvoxamine for COVID-19: a historical review[J]. Molecular Psychiatry, 2022: 1-10.
[12].Dougan M, Nirula A, Azizad M, et al. Bamlanivimab plus etesevimab in mild or moderate Covid-19[J]. New England Journal of Medicine, 2021, 385(15): 1382-1392.
[13]. Weinreich D M, Sivapalasingam S, Norton T, et al. REGEN-COV antibody combination and outcomes in outpatients with Covid-19[J]. New England Journal of Medicine, 2021.
[14].Gupta A, Gonzalez-Rojas Y, Juarez E, et al. Early Treatment for Covid-19 with SARS-CoV-2 Neutralizing Antibody Sotrovimab[J]. New England Journal of Medicine, 2021.
[15].https://www.gsk.com/en-gb/media/press-releases/gsk-and-vir-biotechnology-announce-continuing-progress-of-the-comet-clinical-development-programme-for-sotrovimab/
[16].https://newsfile.futunn.com/notice/2021/12/05/10041073-0.PDF
[17].Brodin P. Immune determinants of COVID-19 disease presentation and severity[J]. Nature Medicine, 2021, 27(1): 28-33.
[18].Azkur A K, Akdis M, Azkur D, et al. Immune response to SARS‐CoV‐2 and mechanisms of immunopathological changes in COVID‐19[J]. Allergy, 2020, 75(7): 1564-1581.
[19].Röltgen K, Boyd S D. Antibody and B cell responses to SARS-CoV-2 infection and vaccination[J]. Cell Host & Microbe, 2021, 29(7): 1063-1075.
[20].Ju B, Zhang Q, Ge J, et al. Human neutralizing antibodies elicited by SARS-CoV-2 infection[J]. Nature, 2020, 584(7819): 115-119.
[21].Yewdell J W. Antigenic drift: Understanding COVID-19[J]. Immunity, 2021, 54(12): 2681-2687.
[22].https://www.who.int/en/activities/tracking-SARS-CoV-2-variants
[23].Cao Y R, Wang J, Jian F, et al. B. 1.1. 529 escapes the majority of SARS-CoV-2 neutralizing antibodies of diverse epitopes[J]. BioRxiv, 2021.
[24].Maslo C, Friedland R, Toubkin M, et al. Characteristics and outcomes of hospitalized patients in South Africa during the COVID-19 Omicron wave compared with previous waves[J]. JAMA, 2021.
[25].Wolter N, Jassat W, Walaza S, et al. Early assessment of the clinical severity of the SARS-CoV-2 omicron variant in South Africa: a data linkage study[J]. The Lancet, 2022.
[26].Johnson A G. COVID-19 Incidence and Death Rates Among Unvaccinated and Fully Vaccinated Adults with and Without Booster Doses During Periods of Delta and Omicron Variant Emergence—25 US Jurisdictions, April 4–December 25, 2021[J]. MMWR. Morbidity and Mortality Weekly Report, 2022, 71.
[27].Shuai H, Chan J F W, Hu B, et al. Attenuated replication and pathogenicity of SARS-CoV-2 B. 1.1. 529 Omicron[J]. Nature, 2022: 1-1.
[28].Burki T K. Omicron variant and booster COVID-19 vaccines[J]. The Lancet Respiratory Medicine, 2021.
[29].Nishiura H, Ito K, Anzai A, et al. Relative reproduction number of SARS-CoV-2 Omicron (B. 1.1. 529) compared with Delta variant in South Africa[J]. Journal of clinical medicine, 2022, 11(1): 30.
[30].Dejnirattisai W, Huo J, Zhou D, et al. Omicron-B. 1.1. 529 leads to widespread escape from neutralizing antibody responses[J]. 2021.
[31].Yu X, Wei D, Xu W, et al. Reduced sensitivity of SARS-CoV-2 Omicron variant to booster-enhanced neutralization[J]. medRxiv, 2021: 2021.12. 17.21267961.
[32].Liu L, Iketani S, Guo Y, et al. Striking Antibody Evasion Manifested by the Omicron Variant of SARS-CoV-2[J]. nature, 2021.
[33].Vangeel L, De Jonghe S, Maes P, et al. Remdesivir, Molnupiravir and Nirmatrelvir remain active against SARS-CoV-2 Omicron and other variants of concern[J]. bioRxiv, 2021.
[34].Dabrowska A, Szczepanski A, Botwina P, et al. Efficacy of antiviral drugs against the omicron variant of SARS-CoV-2[J]. bioRxiv, 2021.


